Адъювантная лучевая терапия при раке молочной железы
В обзоре приведены данные исследований, демонстрирующие влияние различных факторов риска на выбор лучевой терапии при раке молочной железы T2N1M0. Следует рассмотреть возможность проведения лучевой терапии после радикальной мастэктомии при наличии как минимум двух из следующих факторов риска: возраст менее 40 лет, наличие позитивного или близкого (менее 1 мм) края резекции, экстранодальное распространение опухоли, низкая степень дифференцировки, лимфоваскулярная инвазия, люминальный В или трижды негативный подтип рака молочной железы.
В обзоре приведены данные исследований, демонстрирующие влияние различных факторов риска на выбор лучевой терапии при раке молочной железы T2N1M0. Следует рассмотреть возможность проведения лучевой терапии после радикальной мастэктомии при наличии как минимум двух из следующих факторов риска: возраст менее 40 лет, наличие позитивного или близкого (менее 1 мм) края резекции, экстранодальное распространение опухоли, низкая степень дифференцировки, лимфоваскулярная инвазия, люминальный В или трижды негативный подтип рака молочной железы.
От локального или локорегионарного рецидива рака молочной железы (РМЖ) не застрахованы ни радикально пролеченные больные с местнораспространенным процессом, прошедшие длительную комплексную терапию, ни пациентки с небольшими опухолями и достаточно благоприятным прогнозом. По данным разных авторов, частота развития изолированных рецидивов в области грудной стенки или сопровождающихся поражением зон регионарного лимфооттока у пациенток с инвазивным РМЖ стадий I–IIIA варьируется от 10 до 20% [1]. Такие больные заслуживают особого внимания, поскольку некоторым из них потребуется завершающая точка в виде послеоперационной лучевой терапии, направленной прежде всего на снижение риска рецидива и улучшение отдаленных результатов лечения. Несмотря на то что специалисты, занимающиеся данной проблемой, руководствуются рекомендациями крупных мировых сообществ, основанными на результатах большого количества исследований наивысшего уровня достоверности, в спорных ситуациях, к которым безусловно относится стадия T2N1M0 после радикальной мастэктомии, нередко звучат диаметрально противоположные мнения.
Показано ли облучение пациенткам с первичной опухолью размером менее 5 см и ограниченным количеством пораженных лимфоузлов (от одного до трех) после мастэктомии? Или такое лечение должны получать только больные с большим размером опухоли и более массивным метастатическим процессом в регионарных лимфоузлах? На какие факторы риска следует обращать более пристальное внимание при решении данного вопроса? Стоит ли в случае принятия положительного решения о лучевой терапии подвергать полномасштабному облучению все традиционно принятые зоны, или можно ограничиться отдельными? Специалисты достаточно часто задаются подобными вопросами.
На какие же факторы риска следует обращать особое внимание, принимая решение о назначении адъювантной лучевой терапии для снижения риска рецидива в области грудной стенки? Такие факторы риска, как размер первичной опухоли менее 5 см, мультифокальность и наличие внутрипротокового компонента, не ассоциированы с повышенным риском локального рецидива, равно как и количество пораженных лимфоузлов (один, два или три). Однако последний фактор неразрывно связан с таким показателем, как количество исследованных лимфоузлов. R.V. Iyer и соавт. показали, что в соответствии со статистической моделью для достижения 90% вероятности аккуратности стадирования и подтверждения статуса N1 у больной с Т1 и пораженными одним, двумя или тремя лимфоузлами необходимо исследовать восемь, 15 или 20 лимфоузлов соответственно [4]. Если количество пораженных лимфоузлов менее восьми, то при обнаружении одного метастатического лимфоузла риск N2 составит 13%, двух – 55%, трех – до 93%. В подобных ситуациях следует задуматься об облучении подмышечной области. Как показали результаты недавних исследований, в отсутствие лимфодиссекции эффективность облучения подмышечной зоны сопоставима с эффективностью операции. Процент осложнений такой же или меньше [5].
О повышенном риске рецидива в области грудной стенки можно говорить при наличии следующих клинических, патоморфологических и иммуногистохимических факторов:
Маловероятно, что в случае HER2-позитивных опухолей лучевая терапия эффективно предотвратит рецидив в отсутствие таргетной терапии трастузумабом. По крайней мере при люминальном В подтипе (в сочетании с экспрессией HER2-neu или без нее) показано облучение грудной стенки, а при трижды негативном раке – возможно, всех зон регионарных лимфоузлов.
Итак, в случае T2N1M0 после радикальной мастэктомии при наличии как минимум двух из указанных выше факторов риска (возраст менее 40 лет, наличие позитивного или близкого (менее 1 мм) края резекции, экстранодального распространения опухоли, низкой степени ее дифференцировки и лимфоваскулярной инвазии, а также при обнаружении люминального В или трижды негативного молекулярного подтипа рака молочной железы) следует облучить хотя бы грудную стенку для снижения риска локального рецидива. Вероятно, в большинстве клинических ситуаций этой областью можно ограничиться.
Лучевая терапия на зоны регионарного лимфооттока чревата усугублением частоты и выраженности лимфостаза, развитием пневмофиброзов и сердечно-сосудистых осложнений. Подобный риск повышается при использовании 2-D-конвенционального облучения с более проблематичной стыковкой полей. Учитывая такую небезобидность лучевой терапии на регионарные зоны, при раннем раке подход к ее назначению должен быть максимально индивидуальным и взвешенным.
По мнению экспертов NCCN, если решение о лучевой терапии при Т1–2N1 принято, следует проводить облучение грудной стенки и надключичной области. С этим сложно не согласиться, особенно когда имеют место выявленная неадекватная подмышечная лимфодиссекция при количестве удаленных лимфоузлов менее восьми (необходимо рассмотреть возможность облучения подмышечной области), выраженная лимфоваскулярная инвазия, а также трижды негативный РМЖ.
Для подтверждения последнего предположения можно обратиться к результатам двух недавних работ. J. Wang и соавт. оценивали эффективность лечения 681 больной ранним тройным негативным РМЖ стадий I–II после радикальной мастэктомии и адъювантной химиотерапии в зависимости от добавления лучевой терапии в полном объеме (грудная стенка и зоны регионарного лимфооттока) либо без таковой. Причем основное внимание уделялось показателям пятилетней безрецидивной и пятилетней общей выживаемости. Средний период наблюдения при этом составил 86,5 месяца. Оказалось, что адъювантная лучевая терапия позволяет увеличить показатели безрецидивной выживаемости до 88,3% (против 74,6% в отсутствие таковой) и общей выживаемости до 90,4% (против 78,7%) без существенного увеличения токсичности [10].
T.J. Whelan и соавт. в подгруппе больных (как правило, с T1–2N1) после радикальной резекции с отрицательными рецепторами эстрогенов и прогестерона при облучении молочной железы и всех зон регионарных лимфоузлов установили тенденцию к лучшей общей выживаемости по сравнению с теми, у кого облучению подвергалась только молочная железа (81,3 против 73,9%) [11].
Вопрос о включении в облучаемые зоны парастернальной области остается одним из наиболее дискутабельных, несмотря на то что за последние три года появились результаты рандомизированных исследований, в частности EORTC 22922 и MA20, а также метаанализ 2013 г. Ни в одном из них не выявлено явных преимуществ добавления парастернального поля. Вероятно, поэтому рекомендации St. Gallen – 2015 не содержат прямых указаний на необходимость облучения данной зоны.
Наиболее подходящим для нашей клинической ситуации представляется исследование французских авторов [12]. Из 1334 больных после радикальной мастэктомии, включенных в исследование, почти 90% имели Т1–2. Больных с N1 насчитывалось более половины. Пациентки были рандомизированы на группы в соответствии с возрастом, рецепторным статусом и лекарственным лечением. В контрольной группе облучали грудную стенку и надподключичную зону. В экспериментальной группе лучевая терапия проводилась дополнительно на парастернальные лимфоузлы. Анализ десятилетней общей выживаемости продемонстрировал статистически недостоверное преимущество – 3,3%. Причина скорее всего в том, что изначально авторы предполагали более значительный выигрыш – 10%. При этом анализ по подгруппам в зависимости от локализации опухоли (медиальный/центральный или латеральный квадрант), наличия или отсутствия пораженных подмышечных лимфоузлов (N1 или N0), проведения адъювантной химиотерапии либо отказа от нее также не выявил достоверных преимуществ включения в зону облучения парастернального поля. Между тем при наличии медиальной или центральной локализации и N1 проведение парастернального облучения приводило к более существенной разнице в показателях выживаемости как среди тех, кто получал адъювантную химиотерапию, так и среди тех, кому она не проводилась.
Таким образом, расширение зон послеоперационного облучения с захватом надподключичной области в большей степени показано пациенткам с трижды негативным РМЖ, особенно при условии неадекватного исследования подмышечных лимфоузлов (когда необходимо облучение подмышечной зоны), а также больным с выраженной лимфоваскулярной инвазией, даже при стадии T3N0M0, как рекомендуют специалисты Американского колледжа радиологии (American College of Radiology). При локализации опухоли во внутреннем или центральном квадранте молочной железы и поражении подмышечных лимфоузлов, особенно в сочетании с другими факторами риска, необходимо рассмотреть возможность облучения парастернальной области.
Рак грудных желез — коварное онкологическое заболевание, однако может быть диагностировано, в настоящее время, на ранних стадиях при размере опухоли с горошину. Лечение дает эффект при комплексном применении разных методик (химиотерапия, гормонотерапия, лучевая терапия, операция). Ознакомимся с химио- и лучевой терапией — одними из современных направлений.
Химиотерапия
Метод борьбы со злокачественными новообразованиями с использованием специальных медикаментов – химиопрепаратов. Их воздействие способствует устранению опухолевой ткани и замедлению размножения раковых клеток.

Химиотерапия при раке груди осуществляется по индивидуальной схеме, которую составляет лечащий доктор. Обычно лечение состоит из одного или нескольких курсов применения определенных комбинаций медикаментозных препаратов.
Рассмотрим, основные виды химиотерапии при раке молочной железы.
- Адъювантная химиотерапия при раке одной молочной железы или обеих. Назначается после хирургического вмешательства, с целью профилактики. В послеоперационном периоде, врачи-гистологи определяют биологический тип опухоли (люминальный А, люминальный В, люминальный C, с гиперэкспрессией HER2 (не люминальный), базальноподобный) с целью точного подбора лекарственных препаратов.
- Неоадъювантная химиотерапия при раке молочной железы. Основное назначение — приостановить и блокировать процесс развития злокачественных клеток в дооперационном периоде, тем самым добиться локального контроля над опухолью, уничтожить метастазы в регионарных лимфоузлах.
- Лечебная. Назначается с паллиативной целью, когда диагностируется, чаще всего, 4 стадия онкологического процесса — опухоль имеет большие размеры, с врастанием в окружающие ткани (местнораспространённая), определяется наличие отдаленных метастазов.
Схемы химиотерапии при раке молочной железы подбираются врачом — химиотерапевтом в зависимости от совокупности факторов и носят строго индивидуальный характер.
Курс химиотерапии при раке молочной железы необходим в следующих случаях:
- нужно уменьшить размеры новообразования, чтобы впоследствии удалить его хирургическим путем;
- нужно предупредить распространение метастазов;
- как дополнительное медикаментозное воздействие по отношению к лучевому или к хирургическому вмешательству;
- если диагностировано поражение регионарных (близлежащих) лимфоузлов.
Химиотерапия имеет ряд противопоказаний при раке молочной железы:
- аллергические реакции на введение препаратов;
- наличие печёночной или почечной недостаточности;
- выраженная сердечно-сосудистая недостаточность;
- беременность.
Химиотерапия рака молочной железы подбирается индивидуально, в зависимости от особенностей организма больной, распространённости опухоли, наличия отдалённых метастазов.
Чтобы максимально уменьшить последствия после лечения, необходима подготовка к химиотерапии.
- Пройти обследование для диагностики и лечения сопутствующих болезней.
- Избегать стрессовых ситуаций.
- Для укрепления иммунитета и для защиты слизистой оболочки органов лечащий врач может прописать прием медикаментов.
- Сбалансированное питание — главный этап при подготовке к химиотерапии. В рационе должны быть кисломолочные блюда, компоты из свежих или сухофруктов, натуральные соки, разнообразная зелень, овощи, мандарины, апельсины а также много белковой пищи. А вот ограничить следует употребление красного мяса, сахара, соли, минеральной воды, сладкой газированной, алкогольных напитков, рафинированных продуктов.
Рассмотрим, как проводится химиотерапия при раке. Лечение осуществляется циклами, а длительность полного курса определяется дозой, которая нужна организму. Количество курсов определяет только врач.
Препараты для проведения химиотерапии при раке молочной железы вводятся в организм так:
Доктор подробно рассказывает о том, какие возможны последствия химиотерапии при раке молочной железы. Часто развивается тошнота, рвота, снижаются показатели гемоглобина, количества тромбоцитов и выпадают волосы. Химиотерапия — это шанс вернуться к здоровой жизни, а осложнения пройдут, организм восстановится.
Таргетная (целенаправленная) химиотерапия
Одним из самых современных и дающих положительный результат методов является таргетная терапия при раке молочной железы, при которой происходит воздействие на молекулярно-генетическом уровне. Применяемые противоопухолевые препараты при раке молочной железы приостанавливают рост или вызывают самоуничтожение клеток рака. Однако, данное лечение возможно только после проведения генетического и иммуногистохимического исследования.
Показанием для назначения таргетной химиотерапии при раке молочной железы является наличие у опухоли HER2 положительных рецепторов, которые определяются после исследования ткани опухоли.
Таргетные препараты обладают невысокой токсичностью и очень эффективны, они не только продлевают жизнь, но и повышают её качество. Специалисты предполагают, что благодаря развитию молекулярной терапии в будущем злокачественная опухоль будет побеждена на любой стадии.

Наибольшее распространение в мировой практике лечения злокачественных новообразований молочной железы получил препарат трастузумаб (герцептин). Средство эффективно используется в лечении HER-2-позитивного рака груди, который имеет 2, 3 и 4 стадию. Трастузумаб можно принимать на протяжении неопределенного времени, особенно это актуально при метастатических формах.
Герцептин вводится в организм внутривенно капельно. Первая доза — в течение 90 мин., вторая и последующие – не менее 30 мин. В основном препарат назначается один раз в 7 — 20 дней.
Трастузумаб обладает менее выраженной токсичностью, по сравнению с другими химиопрепаратами.
Лучевая терапия
Лучевая терапия при раке молочной железы назначается специалистом — лучевым терапевтом, который на совместном консилиуме с хирургом-онкологом принимают решение о тактике лечения: как лучше воздействовать излучением — до оперативного вмешательства, после него или вместо операции (в последнем случае речь идет о неоперабельном раке).

Лучевая терапия при раке груди предполагает использование рентген-излучения большой энергии, которое создаётся с помощью лучевого ускорителя. Показатели лучевой нагрузки при лечении намного превышают цифры диагностических процедур. Во время сеанса разрушаются злокачественные клетки.
- При лечении IIIА, IIIВ, IIIС стадий (если нет результата от проведения химиотерапии), с последующим проведением оперативного лечения.
- Неоперабельный опухолевый процесс после завершения лекарственного лечения
или отказе от операции.
- Проводится при выявлении рака молочной железы на 0, I стадиях после выполнения органосохраняющих операций с целью снижения риска местного рецидива (повторного роста опухоли).
- При раке IIA, IIB стадии показано проведение лучевой терапии на зону удалённой опухоли и области регионарного метастазирования (прилежащие к ложу удалённой опухоли).
- При лечении IIIА, IIIВ, IIIС стадий в зону облучения должны попасть мягкие ткани передней грудной стенки, регионарные лимфоузлы.
Прямым запретом к проведению лучевой терапии являются заболевания и состояния:
- системная волчанка, склеродермия, дерматомиозит;
- сахарная болезнь, протекаемая в тяжелой форме;
- вынашивание беременности;
- анемия или истощение;
- ранее проведенная радиотерапия;
- сердечно-сосудистая недостаточность;
- тяжелое состояние пациентки;
- лихорадка;
- туберкулез в активной форме;
- инфаркт (недавно перенесенный);
- почечная или дыхательная недостаточность.
Последствия лучевой терапии при раке молочной железы бывают следующими:
- общая утомляемость;
- болевые ощущения в груди;
- дерматит;
- отечность железы;
- лучевые язвы.
Нажмите, чтобы увеличить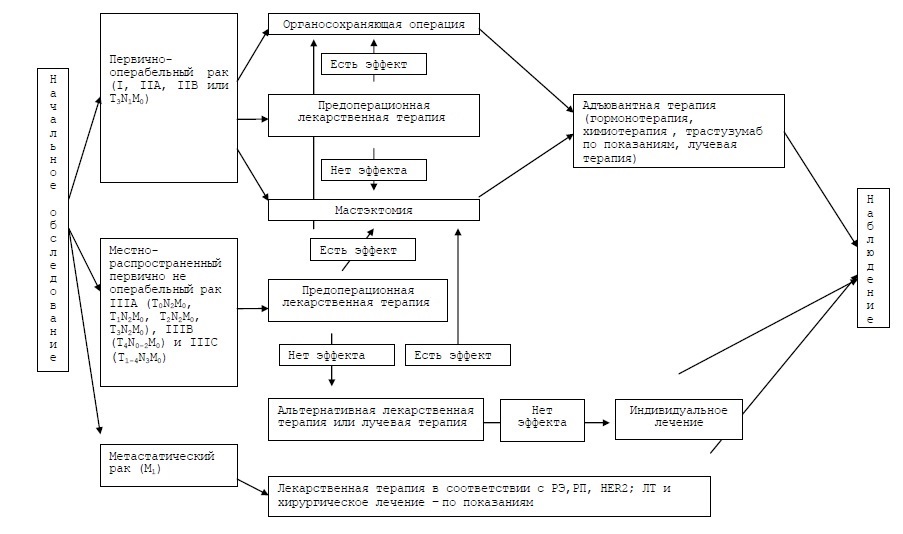
В заключение нужно сказать, что современная тактика лечения злокачественных новообразований молочной железы заключается в комплексном подходе: редко, когда применяется только один лечебный метод воздействия. Ведь именно в мультикомандном подходе (хирург, радиолог, химиотерапевт) возможно достигнуть оптимальных результатов лечения, добиться излечения и высокого качества жизни пациента.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Х имиотерапия и гормонотерапия играют существенную роль в комплексном лечении рака молочной железы практически при всех стадиях заболевания. Это объясняется особенностями данной опухоли – даже на ранних стадиях заболевания велик риск существования отдаленных микрометастазов, особенно при наличии факторов риска (поражении подмышечных лимфоузлов, отрицательных рецепторах эстрадиола и прогестерона, гиперэкспрессии Неr–2/neu и т.д.). Применение адъювантной химио– и гормонотерапии значительно улучшило результаты лечения операбельного рака молочной железы. При запущенном раке молочной железы химиотерапия и гормонотерапия являются основными методами лечения, позволяющими значительно продлить жизнь больного и улучшить ее качество. У 10–25% женщин с диссеминированным раком молочной железы возможно достижение полной регрессии опухоли с длительным безрецидивным периодом.
Адъювантная терапия
Адъювантная терапия рака молочной железы сегодня представляет собой систему стандартов, эффективность которых доказана в большом числе клинических исследований [1].
До настоящего времени остается четыре независимых прогностических фактора при резектабельном раке молочной железы: поражение регионарных лимфатических узлов, размер первичной опухоли, степень дифференцировки и содержание рецепторов к стероидным гормонам (к эстрогенам – РЭ и к прогестерону – РП).
Стандартами химиотерапии и эндокринной терапии являются: 4 цикла химиотерапии в режиме АЦ (адриамицин + циклофосфан) или АЦФ (адриамицин + циклофосфан + фторурацил) или 6 циклов химиотерапии по схеме ЦМФ (циклофосфан + метотрексат + фторурацил), а также тамоксифен 20 мг в день в течение 5 лет.
Первый фактор, положенный в основу назначения адъювантной терапии – поражение регионарных лимфатических узлов, разделяет всех больных на две группы.
Рак молочной железы без метастазов в регионарные лимфоузлы
Для назначения адъювантной терапии в этой группе необходимо определение групп повышенного риска. Граница для назначения адъювантной лекарственной терапии, что означает группу повышенного риска – снижение пятилетней выживаемости до 95% и менее (табл. 1).
Только в группе низкого риска пятилетняя выживаемость больных составляет более 95%. Во всех остальных группах проведение адъювантной лекарственной терапии улучшает результаты хирургического лечения.
Больным в пременопаузе с умеренным или высоким риском и положительным уровнем эстрогенных рецепторов показана химиотерапия с последующим назначением тамоксифена. При гормононезависимых опухолях показано назначение только химиотерапии.
Больным в постменопаузе с умеренным или высоким риском и положительным уровнем эстрогеновых рецепторов показан прием тамоксифена, а в группе высокого риска – комбинация химиотерапии с тамоксифеном. При отрицательном уровне рецепторов к эстрогенам показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена, а в группе высокого риска возможно дополнительное назначение химиотерапии. С уче– том возраста больных дополнительное назначение химиотерапии должно быть индивидуально обоснованным.
Рак молочной железы с метастазами в регионарные лимфоузлы
У всех больных раком молочной железы с метастазами в регионарные лимфатические узлы применение адъювантной лекарственной терапии улучшает результаты лечения.
При положительном уровне рецепторов к эстрогенам вне зависимости от менструальной функции показана комбинированная адъювантная терапия – химиотерапия и эндокринная терапия тамоксифеном.
При гормононезависимых опухолях показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена вне зависимости от уровня эстрогеновых рецепторов. Если уровень рецепторов к эстрогенам отрицательный, возможно дополнительное назначение химиотерапии. С учетом возраста больных дополнительное назначение химиотерапии должно быть индивидуальным.
При всей внешней простоте и схематичности назначения адъювантного лечения лишь методы, доказавшие свою эффективность в результате длительных клинических исследований, применяются для лечения больных. Оптимальная тактика адъювантной терапии постоянно совершенствуется. Совсем недавно химиотерапия рекомендовалась только больным в пременопаузе с метастазами в регионарные лимфатические узлы. В настоящее время только больным с низким риском и пожилым больным с положительными эстрогеновыми рецепторами не показано проведение химиотерапии.
При проведении адъювантной химиотерапии необходимо строго придерживаться оптимального режима (стандартных доз и интервалов между циклами). Неоправданные модификации режимов химиотерапии, несомненно, ухудшают результаты лечения.
Сегодня продолжаются исследования роли выключения функции яичников и рутинное применение данного метода адъювантного лечения нецелесообразно.
Появились данные об эффективности таксанов, как дополнительной химиотерапии к антрациклин–содержащим комбинациям у больных с неблагоприятным про– гнозом.
В связи с широкими исследованиями роли гиперэкспрессии рецептора Her2/neu наметились новые тенденции в оценке прогноза и лечения больных. Однако пока необходимо дополнительное число исследований для изменения практических рекомендаций.
Исследования по адъювантной терапии рака молочной железы интенсивно продолжаются, и можно надеяться, что в ближайшее время все больше и больше женщин будут излечиваться от рака молочной железы.
Неоадъювантная терапия
Неоадъювантная терапия – системное лечение, которое проводится до начала локального лечения (хирургического вмешательства или лучевой терапии).
Задачи неоадъювантной терапии:
- уменьшение размеров первичной опухоли и регионарных метастазов
- уменьшение объема оперативного вмешательства (радикальная резекция вместо радикальной мастэктомии)
- определение чувствительности опухоли к цитостатикам, выявление резистентных случаев с целью использования альтернативных режимов для адъювант– ной химиотерапии
- увеличение общей и безрецидивной выживаемости
- оценка новых режимов лечения по частоте полной клинической и морфологической ремиссии.
Стандартом неоадъювантной химиотерапии по результатам многоцентрового исследования NSABP B–18 признана схема АЦ, при применении которой объективный эффект составил 80%, полная морфологическая ремиссия отмечена у 15% больных.
Предполагалось, что раннее воздействие противоопухолевых лекарств на микрометастазы приведет к увеличению общей и безрецидивной выживаемости. Однако анализ 7 крупных рандомизированных исследований, в том числе NSABP B–18, включившего 1500 женщин с операбельным раком молочной железы, проведенный Wolff [2], не подтвердил эту гипотезу. Продолжительность жизни может быть увеличена только за счет рационального подхода к лечению – использования альтернативных режимов для адъювантной химиотерапии в случае низкой эффективности неоадъювантного лечения.
Продолжается поиск наиболее эффективного режима неоадъювантной химиотерапии. Особенно важным показателем является достижение полной морфологической регрессии опухоли, так как именно этот показатель статистически достоверно коррелирует с ростом общей выживаемости. С этой целью исследуются комбинации, включающие наиболее эффективные препараты, входящие в режимы неоадъювантной химиотерапии в последние годы – цисплатин, навельбин, таксаны. Некоторые авторы показали преимущество комбинаций антрациклинов и таксанов по сравнению со стандартным режимом АС. Разрабатываются новые режимы, включающие препараты, недавно вошедшие в практику химиотерапии, например, кселода и герцептин. Исследуются интенсивные режимы химиотерапии, однако пока не получено достоверных доказательств влияния интенсификации неоадъювантной химиотерапии на отдаленные результаты лечения.
Обсуждается количество курсов неоадъювантной химиотерапии. Признано, что эффект химиотерапии и частота полных регрессий опухоли зависят от количест– ва курсов лечения. Поэтому целесообразно проводить не менее 4 курсов, что безопасно для больных при условии регулярного контроля за динамикой заболевания.
У больных в менопаузе с положительными РЭ и/или РП применяется неоадъювантная гормонотерапия. Объективный эффект гормонотерапии достигает 50–70%. Для неоадъювантной гормонотерапии могут быть рекомендованы тамоксифен, анастразол, летрозол, экземестан.
Диссеминированный рак молочной железы
Для выбора метода лечения перед началом терапии необходимо оценить ряд прогностических факторов, определяющих возможный ответ заболевания на проводимое лечение. Длительный период, прошедший после лечения первичной опухоли до появления отдаленных метастазов, поражение только мягких тканей и костной системы или единичные отграниченные очаги в легких, медленный рост опухоли, удовлетворительное общее состояние больной, пожилой возраст и постменопауза, положительный уровень рецептов эстрадиола и/или прогестерона свидетельствуют о вероятно высокой чувствительности опухоли к гормонотерапии. В случае раннего появления отдаленных метастазов после лечения первичной опухоли, быстрого прогрессирования заболевания, молодого возраста больной, при множественных висцеральных метастазах, наличии лимфангоита кожи или легких лечение необходимо начинать с химиотерапии.
Эффективность гормонотерапии при положительном уровне РЭ и РП достигает 50–70%, снижается при положительных рецепторах одного вида (33%). При отрицательных РЭ и РП существует небольшой процент больных (5–10%), отвечающих на гормонотерапию. Традиционными препаратами, рекомендованными для первой линии гормонотерапии у больных в менопаузе, являются антиэстрогены – тамоксифен и торемифен. В настоящее время в I линии эндокринотерапии альтернативой тамоксифену являются антиароматазные препараты – анастрозол и летрозол. Во II линии эндокринотерапии больных раком молочной железы в менопаузе (при использовании тамоксифена в I линии) в настоящее время вместо прогестинов используются антиароматазные препараты (анастрозол, летрозол, экземестан). Применять прогестины во II линии гормонотерапии считается неэтичным.
У больных в пременопаузе гормонотерапию можно начинать с выключения функции яичников с помощью агониста гонадотропин–рилизинг гормона гипофиза – гозерелина (золадекса), а также хирургическим или лучевым методами.
Эффект гормонотерапии оценивается через 6–8 нед после начала лечения. Положительным ответом считается не только полная или частичная регрессия опухоли, но и длительная стабилизация заболевания (>=6 месяцев). Лечение продолжается до прогрессирования болезни. В случае быстрого прогрессирования болезни после гормонотерапии первой линии следует начать химиотерапию. При прогрессировании после длительного положительного эффекта на фоне первой линии гормонотерапии, а также кратковременной полной или частичной регрессии опухоли начинают гормонотерапию второй линии – ингибиторы (инактиваторы) ароматазы.
Третья линия гормонотерапии – прогестины – медроксипрогестерона ацетат (фарлутал, провера) и мегестрола ацетат (мегейс). Достаточно редко в наше время в III линии гормонотерапии используются андрогены и у женщин в постменопаузе – эстрогены.
Химиотерапия
Стандартами I линии химиотерапии рака молочной железы являются схемы: ЦМФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, метотрексат 40 мг/м 2 в/в дни 1,8, фторурацил 600 мг/м 2 в/в дни 1,8, интервал 4 нед), ЦАФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, доксорубицин 30 мг/м 2 в/в дни 1,8, фторурацил 500 мг/м 2 в/в дни 1, 8, интервал 4 недели), АЦФ (фторура– цил 500 мг/м 2 , доксорубицин 50 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), ЕЦФ (фторурацил 500 мг/м 2 , эпирубицин 100 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), АЦ (доксорубицин 60 мг/м 2 , циклофосфан 600 мг/м 2 каждые 3 нед).
Большинство исследователей отдают предпочтение антрациклиновым комбинациям, учитывая более высокий противоопухолевый эффект этих комбинаций по сравнению с ЦMФ. Комбинация ЦМФ чаще используется у пожилых больных, при противопоказаниях к применению антрациклинов.
Высокую эффективность показали комбинации антрациклинов и таксанов – АТ (доксорубицин 50–60 мг/м 2 , паклитаксел 175 мг/м 2 , интервал 3 нед), ЕД (эпирубицин 100 мг/м 2 , доцетаксел 75 мг/м 2 , интервал 3 нед).
Длительность химиотерапии обычно определяется ответом опухоли: после достижения максимального эффекта проводится дополнительно 2 курса ПХТ. Затем предпочтение может быть отдано наблюдению за больным до прогрессирования. При продолжении лечения до прогрессирования увеличивается время до прогресси– рования, однако общая выживаемость не меняется, при этом снижается качество жизни больных.
Ведется поиск эффективных комбинаций для первой линии лечения диссеминированного рака молочной железы, включающих новые препараты, в частности, капецитабин (кселода). Показано, что капецитабин имеет лечебную активность, сходную с ЦМФ.
У больных, имевших прогрессирование после химиотерапии антрациклинсодержащими комбинациями, стандартом дальнейшего лечения являются таксаны (паклитаксел 175 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед, доцетаксел 100 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед). В монотерапии у резистентных к антрациклинам больных объективный эффект составляет 41%. В последнее время все более популярным становится еженедельное введение таксанов, при этом увеличивается интенсивность лечения без увеличения токсичности. Эффективны комбинации таксанов с другими препаратами: навельбин 20 мг/м 2 в/в дни 1, 5-й + доцетаксел 75 мг/м 2 в/в со стандартной премедикацией день 1-й, интервал 3 нед; паклитаксел 175 мг/м 2 в/в со стандартной премедикацией день 1-й + фторурацил 1 г/м 2 /день в/в кап. 72–часовая инфузия дни 1, 2, 3-й, интервал 3 нед; кселода 1650 мг/м 2 дни 1–14 + паклитаксел 175 мг/м 2 (или доцетаксел 75 мг/м 2 )1 раз в 3 нед; гемцитабин 1 г/м 2 дни 1, 15-й + паклитаксел 135 мг/м 2 дни 1, 15-й, интервал 4 нед.
Для третьей и последующих линий лечения четких стандартов не разработано. Применяются комбинации препаратов, включающие навельбин, препараты платины (цисплатин, оксалиплатин), антиметаболиты (длительные инфузии фторурацила, гемцитабин, томудекс, кселода). Следует отметить высокую эффективность кселоды у больных во II (объективный ответ у 36% больных) и III (20%) линиях химиотерапии. Препарат может быть рекомендован, как альтернатива таксанам во II линии химиотерапии.
Некоторые режимы, эффективные во II–III линии лечения диссеминированного рака молочной железы: МММ – митомицин 8 мг/м 2 в/в день 1 + митоксантрон 8 мг/м 2 в/в день 1 + метотрексат 30 мг/м 2 в/в день 1; МЕП – митомицин 10 мг/м 2 в/в день 1 + цисплатин 40 мг/м 2 в/в дни 2, 7 + вепезид 100 мг/м 2 в/в дни 3 ,4, 5, интервал 4 нед; цисплатин 80 мг/м 2 в/в день 1 + кселода 2000 мг/м 2 внутрь ежедневно дни 1–14; навельбин 25 мг/м 2 в/в дни 1, 8 + митомицин 7 мг/м 2 в/в день 1, интервал 4 недели; навельбин 20 мг/м 2 в/в дни 1, 15 + цисплатин 80 мг/м 2 в/в день 1, интервал 4 нед; циклофосфан 600 мг/м 2 в/в день 1 + лейковорин 500 мг/м 2 в/в кап. в течение 2 часов + фторурацил 1,5 г/м 2 в/в постоянная 24–часовая инфузия, дни 1, 15, интервал 4 нед; навельбин 25 мг/м 2 в/в дни 1, 8 + томудекс 1 мг/м 2 в/в дни 1, 8, интервал 3 нед.
В 25–30% случаев в опухоли молочной железы отмечается гиперэкспрессия Неr–2/neu, коррелирующая с плохим прогнозом заболевания. У таких больных эф– фективен Герцептин – препарат принципиально нового механизма действия – рекомбинантные гуманизированные моноклональные антитела, связывающиеся с рецептором Неr–2/neu. Герцептин применяется еженедельно, первое введение – 4 мг/кг в/в, последующие – 2 мг/кг. Лечение продолжается до прогрессирования заболевания. Герцептин рекомендуется к применению у больных с гиперэкспрессией Неr–2/neu в комбинации с гормонотерапией и химиотерапией. Добавление герцептина к комбинации АС повысило частоту объективных эффектов с 42 до 60%. При резистентности к антрациклинам комбинация герцептина с таксолом была эффективна у 49% больных (при монотерапии таксолом эффект составил 17%). Изучаются комбинации герцептина с другими цитостатиками, например, с кселодой, навельбином [5].
1. Материалы шестой конференции по адъювантной терапии рака молочной железы, Сан–Галлен Швейцария, 1998 год.
2. A.C.Wolff, N.E. Davidson: Primary systemic therapy in operable breast cancer. J Clin Oncol 18:1558–1569, 2000.
3. C.А. Тюляндин: Химиотерапия диссеминированного рака молочной железы. Практическая онкология, 2, 2000.
Читайте также:

