Злокачественный рост в онтогенезе
Рост опухоли из самой себя. Опухоль растет за счет увеличения массы опухолевых клеток. Такой рост опухоли "из самой себя" возможен только после образования первичного опухолевого зачатка, который возникает путем превращения нормальной ткани в опухолевую. В пределах близких по происхождению тканей возможно вовлечение в рост опухолей и соседних нормальных клеток. Но в этих случаях такой рост (аппозиционный) наблюдается в периоде первоначального образования опухоли и не свойствен уже достаточно развившейся опухоли.
Неурегулированность роста. Опухоль растет тем быстрее, чем менее дифференцированы ее клеточные элементы, в большей или меньшей степени утратившие свои нормальные морфологические и функциональные свойства.
На бластоматозный рост оказывает влияние организм в целом, его регуляторные системы, обмен веществ, химические и физико-химические особенности того участка, в котором происходит опухолевый рост. Тем не менее по сравнению с другими видами тканевого роста опухоли характеризуются неурегулированностью роста, нарушением обычной структуры и функции пораженной ткани, а также нарушением регуляторных воздействий на нее со стороны всего организма.
Беспредельность роста. Опухоли характеризуются относительной беспредельностью роста или тенденцией к непрерывному прогрессирующему развитию. Это свойство следует понимать как потенциальную способность опухоли к росту без видимого предела. В случае отсутствия лечения (хирургического или лучистой энергией) опухоль растет до тех пор, пока жив организм, в котором она возникла. При злокачественных опухолях организм погибает раньше, чем опухоль достигнет больших размеров. В других случаях некоторые опухоли у человека, например фибромиомы матки, могут достигать веса 20 - 25 кг. Иногда встречается киста яичника весом 50 кг и более.
Питаясь за счет веществ, поступающих из окружающих тканей, опухоли являются паразитирующими образованиями, растущими за счет организма.
Доброкачественный и злокачественный рост. Опухолевый рост бывает двояким (рис. 63).
Одни опухоли растут более или менее изолированно, не прорастают в окружающие ткани, а лишь отодвигают их, что может вызывать нарушение функции от сдавления. Из окружающей ткани в опухоль проникают лишь нервы и питающие ее кровеносные сосуды. Такой тип роста - экспансивный рост - характеризует доброкачественные по течению опухоли, менее атипичные по строению, с менее выраженной анаплазией клеточных элементов, с меньшей потенцией роста и размножения. Для этих опухолей характерен медленный рост, иногда с длительными остановками, без переноса (метастазирования) клеток опухоли из первичного очага в другие органы. Доброкачественные опухоли растут, отодвигая окружающие их ткани, которые, уплотняясь, как бы образуют вокруг опухоли капсулу. Ткань доброкачественных опухолей обычно сохраняет специфические свойства тех тканевых элементов, из которых они произошли.
Доброкачественные опухоли бывают эпителиального и мезенхимального происхождения. К первым относятся, например, аденомы, папилломы, ко вторым - фибромы, липомы, хондромы.
Другой тип опухолевого роста - инфильтрирующий, злокачественный рост. Он характеризуется врастанием опухоли в окружающую ткань, совершающимся с разной быстротой и различной степенью разрушения (деструкции) окружающей ткани, причем граница между опухолью и нормальной тканью становится нечеткой. Злокачественные опухоли, как правило, дают метастазы, т. е., врастая в просвет кровеносных или лимфатических сосудов, клетки бластоматозной ткани переносятся в более отдаленные места, являясь зачатком нового опухолевого роста. Эпителиальная злокачественная опухоль - рак (cancer) - метастазирует преимущественно по лимфатическим сосудам (например, метастазы в подмышечные и надключичные лимфатические железы при раке молочной железы). Соединительнотканная по происхождению злокачественная опухоль - саркома (sarcoma) - метастазирует обычно по кровеносным сосудам, чаще всего по венам.
Метастазирование опухолей нередко зависит от направления сосудов. Так, злокачественные опухоли в желудке по току крови дают метастазы в печень, из легких - в мозг. Однако распространение метастазов и локализация их определяются также свойствами тех органов, куда попадают метастазы.
Вследствие инфильтрирующего роста полное вылущивание злокачественных опухолей или вырезывание их представляет большие затруднения, так как в тканях могут оставаться части опухоли, которые через некоторое время дают начало новому росту - рецидиву опухоли.
Злокачественные опухоли отличаются от доброкачественных и тем, что вызывают сильное нарушение обмена веществ и истощение организма (кахексия), нередко сопровождаются кровотечением (ввиду прорастания сосудов) и присоединением септической инфекции, а в ряде случаев поражают жизненно важные органы. Злокачественные опухоли неуклонно ведут организм к гибели.
Однако по клиническому течению не всегда удается четко разграничить указанные два типа опухолевого роста. Иногда доброкачественные опухоли (например, в мозгу) ведут к смерти, а инфильтрирующий рост еще не всегда определяет злокачественное течение опухоли, например при некоторых сосудистых опухолях - ангиомах, опухолях челюсти - эпулидах и др. Известны случаи, когда рост злокачественной опухоли длится годами. Изредка инфильтрирующий рост встречается и при доброкачественных опухолях, например при фибромах носоглоточного пространства.
Наблюдаются также переходы доброкачественных опухолей (например, некоторых видов аденом) в злокачественные с приобретением всех типичных свойств злокачественного роста.
Введение
- Предмет и задачи патофизиологии
- История развития патофизиологии
Общая патофизиология
- Общие вопросы патофизиологии
- Региональные типовые патологические процессы
- Типовые нарушения обмена веществ
- Иммунопатология
- Патофизиология тканевого роста
- Патофизиология экстремальных состояний
- Хронопатология
Частная патофизиология
- Патология крови и кроветворения
- Патология сердечнососудистой системы
- Патология системы дыхания
- Патология системы пищеварения
- Патология выделительной системы
- Патология эндокринной системы
- Патология нервной системы
- Инфекционный процесс
Вход в систему
Поделиться
Биологические особенности роста злокачественной опухоли
Совокупность характерных признаков, отличающих опухолевую ткань от нормальной и составляющих биологические особенности опухолевого роста, носит название атипизм. Различают следующие виды опухолевого атипизма.
Морфологический атипизм. Для злокачественных опухолей характерен как клеточный, так и тканевой атипизм. Первый заключается в необычной величине, форме и строении опухолевых клеток. При их разрастании отмечается омоложение клеток, возврат их структуры к наиболее примитивной, эмбриональной организации. Как правило, опухолевые клетки имеют значительно большую, нежели нормальная, величину и нетипичную для клеток данной ткани форму. Если, например, клетки кубического эпителия в норме выглядят на срезах квадратными, то клетки опухоли, развившейся из кубического эпителия, могут иметь круглую, овальную или неправильную форму. Ядра этих клеток огромные, уродливой формы, с изрезанными границами и неравномерно распределенным по нуклеоплазме хроматином; в них гораздо чаще, нежели в нормальных клетках, происходят митозы. Нередко встречаются многоядерные клетки. Количество хромосом в опухолевых клетках значительно увеличено (описаны случаи, когда их число превышало 500).
Явления клеточного атипизма могут быть выражены в опухолевой ткани в различной степени: в одних случаях они видны под световым микроскопом, в других для их обнаружения требуется электронный микроскоп, иногда морфологические изменения можно выявить лишь цитохимическими методами.
Кроме клеточного, у злокачественных опухолей отмечается также и тканевой атипизм, выражающийся в нарушении нормальных взаимоотношений паренхимы и стромы тканей. Например, в липосаркомах отмечается абсолютно бессистемное чередование жировой и соединительной ткани, в опухолях желез секреторная ткань может быть разбросана в виде островков, вне связи с другими аналогичными элементами.
Если морфологический атипизм опухоли выражен слабо, то опухоль по своему строению напоминает ту ткань, из которой развивается; такие опухоли носят название гомотипических или гомологических. Если же атипизм выражен сильно и нельзя точно сказать, из какой ткани развилась опухоль, то эту опухоль характеризуют как гетеротипическую или гетерологическую.
Метаболический атипизм. Наиболее ярким нарушением тканевого метаболизма в опухолях является то, что в них процессы анаэробного расщепления углеводов преобладают над процессами их аэробного превращения. Для нормальной ткани характерен эффект Пастера: кислород тормозит процессы анаэробного расщепления углеводов, что обусловлено тем, что аэробное окисление углеводов в 19 раз в энергетическом отношении выгоднее, чем анаэробное. Поэтому, если ткань имеет возможность окислять углеводы аэробным путем, то анаэробный путь блокируется. В опухолевой же ткани эффект Пастера отсутствует: анаэробное расщепление углеводов не только идет в присутствии кислорода, но и превалирует над аэробным. Этот тип обмена веществ характерен для эмбриональных клеток: в них также преобладает анаэробное расщепление углеводов, которое идет очень интенсивно, и высвобождающаяся энергия, как и в опухолях, расходуется на обеспечение пластических процессов. В связи с резким усилением анаэробного превращения углеводов в опухолевой ткани накапливается значительное количество молочной кислоты. что приводит к локальному ацидозу.
Поскольку в опухолях интенсивно идут пластические процессы, синтез белка в них преобладает над его распадом, в то время как в организме в целом отмечаются обратные соотношения: распад белка превалирует над его синтезом, и азотистый баланс организма в целом является отрицательным.
В организме, пораженном опухолевой болезнью, резко извращен и липидный обмен. Значительно повышается утилизация тканями свободных жирных кислот, а вследствие этого усиливается липолиз и больной худеет. Кроме того, интенсифицируется перекислое окисление липидов. Образующиеся при этом свободные радикалы повреждают мембраны, в том числе и мембраны эритроцитов, что приводит к их гемолизу, а следовательно, и к малокровию.
В опухолях нарушается и электролитный обмен: в частности, происходит обеднение опухолей кальцием и накопление в них калия.
Особое значение для опухоли имеет то, что в перерожденных клетках происходят глубокие нарушения в обмене некоторых биологически активных веществ, оказывающих прямое влияние на процессы клеточного деления. Речь идет о кейлонах.
Что касается роли нарушения обмена кейлонов в опухолевой ткани, то высказывается предположение о том, что бластомный рост в определенной степени связан с неправильной функцией системы кейлонов. Установлено, что при введении в организм, пораженный опухолью, экзогенных кейлонов рост опухоли тормозится. Поэтому было вполне естественным предположить, что, может быть, опухолевые клетки не продуцируют кейлоны. Однако оказалось, что в бластомных клетках кейлоны вырабатываются так же, как и в нормальных, но их содержание в опухолевых тканях значительно ниже, чем в нормальных, а в крови, оттекающей от опухоли, концентрация кейлонов очень высока. По-видимому, кейлоны слабее фиксируются в опухолевой клетке и более свободно выходят через измененные мембраны.
Поскольку действие кейлонов определяется целым рядом гормонов (например, эпителиальный кейлон проявляет свое действие только в комплексе с адреналином), ослабление их фиксации в опухолевой клетке можно связать и с изменением реакции опухолевых клеток на биологические регуляторы, которыми являются продукты желез внутренней секреции.
Кейлоны имеют высокую тканевую и не имеют видовой специфичности.
Проблема лечения опухолей введением экзогенных кейлонов наталкивается на то, что клетки продуцируют их в крайне малых концентрациях. Даже видовая неспецифичность кейлонов не дает возможности получения их в промышленных масштабах, а искусственный синтез кейлонов в тех же масштабах пока не налажен.
Иммунологический атипизм. Этот вид атипизма заключается в том, что в опухолях появляются белки, являющиеся носителями чуждой для организма генетической информации, то есть антигены. Подробнее иммунологический атипизм будет рассмотрен ниже в разделе, посвященном иммунологии опухолей и противоопухолевому иммунитету.
Метастазирование злокачественных опухолей. Особенностью злокачественных опухолей является их способность к метастазированию, то есть к отрыву от опухоли отдельных клеток и переносу их в другие органы с последующим развитием на месте их имплантации аналогичного новообразования.
Существуют три пути метастазирования опухолевых клеток:
1. Гематогенный - по кровеносным сосудам.
2. Лимфогенный - по лимфатическим сосудам.
3. Тканевой - непосредственно от одной соприкасающейся ткани к другой или по межтканевым пространствам.
Долгое время считали, что процесс метастазирования связан только с особенностями строения опухоли и не зависит от организма. Отрыв бластомных клеток и их перемещение по одному из трех указанных выше путей объясняли (и эти объяснения справедливы) следующими причинами. Во-первых, кровеносные и лимфатические сосуды, проходящие через опухоль, имеют одну важную особенность: в их стенку входят клетки опухолевой ткани, вследствие чего эти клетки легко попадают в кровоток и лимфоток. Во-вторых, вследствие ослабления сцепления между опухолевыми клетками они легко отрываются от опухоли. В-третьих, большинство опухолей имеет довольно рыхлую строму, что также облегчает отрыв клеток.
Причины трансформации метастазов в опухоли пока еще недостаточно изучены. На современном этапе развития онкологии еще нельзя сказать, что должно произойти в ткани, чтобы она стала готовой к превращению метастаза в опухоль. По-видимому, здесь играют роль реактивные свойства тканей, связанные с их местными иммунными особенностями. Кроме того, в организме есть ряд тканей и жидкостей. не пропускающих через себя метастазы, как, например, гематоэнцефалический барьер. Поэтому опухоли центральной нервной системы метастазируют только в ее пределах, а опухоли других органов редко метастазируют в мозг (кроме уже упоминавшегося рака легкого).
Раковая кахексия. Важной особенностью, свойственной ряду злокачественных опухолей, является развитие у больного злокачественной опухолью кахексии, то есть состояния крайнего истощения. Поскольку чаще всего кахексию вызывает опухоль эпителиальной ткани, то есть рак, ее обыкновенно называют раковой кахексией.
Механизмы развития кахексии в основном сводятся к следующему.
Затем были получены данные, которые дали возможность связать развитие раковой кахексии с глубокими изменениями метаболизма опухолевой ткани, оказывающими влияние на обмен веществ организма в целом. Эти особенности можно свести к следующим основным положениям.
3. Опухоли успешно конкурируют с нормальными тканями за целый ряд витаминов, поглощая их значительно интенсивнее. Таким образом, ткани организма обедняются витаминами, что отрицательно сказывается на процессах белкового синтеза, коферментами которого многие витамины являются.
4. Аналогичная ситуация возникает и в отношении глюкозы, которая в опухоли (прежде всего вследствие интенсификации процессов ее анаэробного расщепления) с аномально высокой скоростью метаболизируется до молочной кислоты. В результате этого концентрация глюкозы в опухолевой ткани падает практически до нулевого уровня, и глюкоза начинает из организма насасываться в опухоль, как в вакуум, а другие ткани лишаются главного энергетического субстрата. Может также развиться гипогликемия. При массивных опухолях, массой 1-10 кг, развивается глубокая прогрессирующая гипогликемия, для предупреждения которой приходится ежедневно вводить больным большие количества глюкозы. Все это ведет к нарушению протекания в тканях процессов белкового синтеза, требующего для себя значительного количества энергии.
5. Организм включает все возможные механизмы для предотвращения возникновения гипогликемии, в частности, резко активируется глюконеогенез, в процессе которого глюкоза синтезируется из аминокислот. Бурт и Лoypu показали, что при искусственной блокаде процессов глюконеогенеза в организме с опухолью уже через час после начала этой блокады развивается глубочайшая, несовместимая с жизнью гипогликемия. Однако защитный в отношении синтеза глюкозы глюконеогенез приводит к уменьшению количества аминокислот и усилению нарушений процессов белкового синтеза.
Поистине отчаянные усилия организма нормализовать нарушенный опухолью углеводный обмен приводят к глубоким изменениям биоэнергетических процессов. В условиях нарастающей гипогликемии начинает функционировать цикл Кори, в процессе которого происходит образование глюкозы из пирувата и лактата. Этот цикл чрезвычайно расточителен в энергетическом отношении. Для образования в нем одной молекулы глюкозы затрачивается шесть молекул АТФ, а при анаэробном распаде одной молекулы глюкозы (а в опухоли превалирует именно этот путь утилизации глюкозы) образуется всего две молекулы АТФ. Таким образом, снижая уровень гипогликемии, цикл Кори приводит к возникновению энергетического дефицита и в этом плане не только не выгоден для организма, но даже ухудшает его энергетическую ситуацию. Нехватка энергии сразу же сказывается на процессах белкового синтеза, что усиливает состояние кахексии.
Злокачественный рост в онтогенезе
начиная от стадии оплодотворенной яйцеклетки и до окончани жизненного цикла
Удлинение периода внутриутробного развития Удлинение продолжительности периода детства и отсрочка полового созревания Выделение особого периода, переходного от половой зрелости к пожилому возрасту (климакс) Увеличение общей продолжительности жизни
Продолжительность детства - 6 месяцев
Продолжительность детства – 6-12 лет
Краниокаудальный – на 1 году, чередование удлинения конечностей (максимум – к 10-11 годам) и туловища (в фазе завершения пубертатного спурта)
Пифагор (VI в. до н.э.)
Гиппократ (IV-V в. до н.э.)
Выделял 10 семилетних циклов в постнатальном онтогенезе
Выделял 4 периода человеческой жизни: до 20 лет – весна, 20-40 – лето, 40-60 – осень, 60-80 - зима
Количество клеток у 7-недельного зародыша составляет 1,3*10^9, у новорожденного – 2*10^12. В данном случае рост максимален на ранних стадиях внутриутробного развития, к концу этого периода он замедляется в связи с ограниченными размерами матки. Далее, интенсивность ростовых процессов резко возрастает после рождения.
прорезывания постоянных зубов (кроме М3). Начало полового созревания, усиленного роста тела в длину, в первую очередь у женщин. Переход от наглядно-образного к словесно-логическому мышлению, осознание места в системе общественных отношений, развитие внимания и произвольной памяти
интенсивного полового созревания; характерен пубертатный скачок роста. Бурные морфофункциональные сдвиги, затрагивающие все основные системы организма. В психологическом плане в пубертасе происходит интенсивное интеллектуальное развитие (самоанализ, самовоспитание), сочетающееся с личностной и эмоциональной нестабильностью. Характерна более высокая половая идентификация
роста и формирования организма. Период стабилизации личности и самоопределения. Формирование мировоззрения.
1. Препубертатный период (adrenarche). Начинается в среднем в 6-7 лет у женщин и в 7-8 лет у мужчин. 2. Пубертатный период (gonadarche) (время наступления – спустя 3-4 года после адренархе)
adrenales – надпочечники Созревает андрогенная зона коры надпочечников, возрастает уровень секреции ДЭА (дегидроэпиандростерон), ДЭА-сульфата и 17-КС в целом. Надпочечниковые андрогены вызывают интенсификацию роста, стимулируют скелетное и начальное половое созревание (особенно у женщин)
В этот период созревает система репродуктивного гомеостаза (гипоталамус-гипофиз-гонады)
Гипоталамус - отдел промежуточного мозга, расположенный ниже таламуса
Снижение чувствительности центров гипоталамуса к тормозному действию половых гормонов Повышение чувствительности гонад к гонадотропным гормонам гипофиза
(РФ) – пептидных гипоталамических гормонов, поступающих через портальную систему гипофиза в его переднюю долю и стимулирующих выделение гонадотропных гормонов
гормон (ФСГ) Лютропин, лютеинезирующи гормон (ЛГ) Гормон, стимулирующий интерстициальные клетки (ГСИК) (у мужчин) Повышение уровня гонадотропинов ведет к увеличению секреции гормонов гонад – андрогенов (тестостерона) и эстрогенов (эстрадиола)
Андрогены и эстрогены
изменяется: увеличивается примерно с 13 лет, но даже к 17 не достигаются дефинитивные значения. У женщин, помимо тонической секреции гонадотропинов, существует еще и циклическая, обусловливающая наступление овуляции
Развитию первичных и вторичных половых признаков Увеличению размеров тела Изменениям в пропорциях и составе тела – в частности, андрогены стимулируют развитие мышечного компонента и усиливают андроморфную, а эстрогены - гинекоморфную тенденцию в топографию подкожного жироотложения Формированию полового поведения
Перекресты ростовых кривых
У женщин спурт наблюдается в среднем в 11-13, у мужчин – в 13-15 лет
СТГ – действует опосредованно, через соматомедины печени. Повышение СТГ примерно на 1 год предшествует спурту. В начале пубертаса действует синергично с тестостероном , а затем – как антагонист Кортизол – важнейший глюкокортикоидный гормон человека. В ряде эффектов - антагонист тестостерона и СТГ. Тормозит синтез белка в костной и мышечной тканях Инсулин – универсальный анаболический гормон. Регулирует белковый и жировой обмен. Возможно, играет роль в инициации пубертаса и т.д.
интеллектуальное развитие (самоанализ, самовоспитание), сочетающееся с личностной и эмоциональной нестабильностью. ЭЭГ
Внутренние (эндогенные) факторы
Внешние (экзогенные) факторы
rmz - rdz 1 - rdz
rmz и rdz – коэффициенты корреляции для пар моно- и дизигот соответственно. Привести некоторые значения
Половые гормоны Тироксин и трийодтиронин СТГ АКТГ Инсулин Глюкагон Эндорфины Простагландины Холин-, адрен, серотонин-, пептидергические нейромедиаторы и т.д.
Синдром Шерешевского-Тернера (Х0) Синдром Кляйнфельтера Синдром Дауна
Характер питания, качество медицинского обслуживания, уровень образования и социальный статус родителей, образ жизни и тд. Степень благоприятности психологической среды
уровню ростовой кривой при устранении влияния фактора задержки роста
Биологический возраст индивида определяется как достигнутый уровень морфофункционального созревания организма. В любой популяции есть индивиды, по своему биологическому развитию соответствующие некоему среднему варианту (их около 50%), а также отклоняющиеся в сторону ускоренного или замедленного его темпа
Комплексность Связь с хронологическим возрастом Тождество дефинитивного статуса Ведущее значение показателя на данном этапе онтогенеза, его скоррелированность с другими критериями биологического возраста (например, гипоталамо-гипофизарно-гонадная система в пубертасе) Качественная однородность изучаемой группы
Критерии половой зрелости
Применим лишь на определенных этапах онтогенеза (6 месяцев – 2 года и 5-6 – 13-14 лет)
I1i2m1cm2 – молочная генерация
M1i1i2p1p2cm2m3 – постоянная генерация
перипубертатном периоде (примерно от 7-8 до 17-18 лет)
Последовательность появления признаков полового развития:
G-развитие гениталий c-пуб.Набухание сосков p-лобковое обволошение ax-обволошение подмышек l-ломка голоса волосы на лице волосы на груди
Расширение таза округление бедер ma-развитие грудных желез P ax me-менструация
Показатели основного, углеводного и липидного обмена Гормональные индексы Показатели функционирования сердечно-сосудистой и дыхательной систем (ЭКГ, систолическое АД, ЖЕЛ, частота дыханий и т.д.) Показатели крови и мочи (число эритроцитов, уровень гемоглобина, креатинин Состояние опорно-двигательного аппарата (например, динамометрия кисти)
В качестве критериев биологического возраста применяются: показатели величины и плотности расположения нейронов, длина аксонов, степень миелинизации, активность АХЭ (ацетилхолинэстераза), содержание ДНК; при старении – липофусцин (пигмент белковой природы) в перикарионах нейронов, сенильные бляшки (островки повреждения коры мозга) в нейропиле, атрофия дендритного дерева, уменьшение размеров и потеря нейронов
Есть данные о возрастных изменениях темперамента, определяющихся анатомическим и физиологическим созреванием нейроэндокринной системы Интеллектуальные тесты
Увеличение длины тела детей и подростков Более раннее наступление пубертатного спурта и менархе (у девочек) Ускорение развития по показателям силы мышц, состояния сердечно-сосудистой системы, двигательной активности Более раннее формирование речевых функций, зрительных, слуховых и эмоциональных реакций Возможно, и более быстрое интеллектуальное развитие
Помимо интенсификации темпов развитие включает:
Удлинение репродуктивного периода Общее увеличение продолжительности жизни Макросомия, укрупнение размеров тела на всех этапах Неравномерность роста и развития, функциональные расстройства
Изменение рациона Колебания солнечной активности Эффект гетерозиса как результат метисации Прогресс медицины Урбанизация (как следствие – нейроэндокринная стимуляция) Систематическая иммунизация и т.д.
характеризующийся постепенностью, разновременностью и неуклонным прогрессированием, ведущий к понижению адаптационных возможностей индивида и в конечном итоге определяющий продолжительность жизни
Уменьшение роста, изменения состава тела Снижение амплитуды движений грудной клетки Уменьшение количества сальных желез, толщины эпидермиса Уменьшение массы мозга, падение работоспособности нервных клеток Снижение гормонообразования в ряде эндокринных желез и т.д.
Теория развертывания компенсаторно-старческих процессов В.В. Фролькиса; например, падение синтеза гормонов компенсируется повышением чувствительности клеток к их действию В условиях гибели одних клеточных элементов усиление функции других
По Фролькису нет идеальной нормы для всех возрастов, в каждом возрасте можно выделить свою норму, в т.ч. для старческого периода онтогенеза
Долгожительство – период, наступающий с возраста 90 лет. Центры долгожительства – Северный Кавказ и Закавказье, Якутия, некоторые районы Южной и Центральной Америки, Индии, Пакистана, США и др. По некоторым данным, среди лиц старше 75 лет возрастает относительная частота I (0) группы крови
Или с места в карьер, или медленно и поэтапно. Рост злокачественной опухоли влияет на прогноз: особенности прогрессирования карциномы у каждого пациента индивидуальны.
Бесформенно-инвазивно
Рост злокачественной опухоли
Еще полгода-год назад при проведении обследования ничего не было, и вдруг – новообразование достаточно больших размеров. Откуда? Как? Неужели в прошлый раз пропустили-профукали?
Стремительный или быстрый рост злокачественной опухоли всегда прогностически неблагоприятен. Медленное формирование карциномы более благоприятный вариант, потому что можно выявить рак на ранних стадиях. Выделяют 3 варианта роста опухоли:
- Экспансивный;
- Аппозиционный;
- Инвазивный (инфильтративный).
Коварство Карциномы в непредсказуемости. Первично образовавшиеся мутантные клетки могут долго прятаться, чтобы потом начать стремительно размножаться, превратившись за короткий промежуток времени в опухоль больших размеров. Или злокачественное новообразование может неторопливо и размеренно расти, увеличиваясь в размерах медленными темпами.
Для злокачественных новообразований не совсем типичный вариант (чаще встречается при доброкачественных опухолях). Экспансивный вид роста характеризуется:
- Не прорастание, а отодвигание и раздвигание тканей (опухоль словно протискивается через толпу, не пытаясь навредить окружающим);
- Вокруг новообразования формируется капсула (словно толпа отгораживается от Карциномы);
- Растет неспешно-медленно (как при очень замедленной съемке, увеличение первичного очага растягивается на годы и десятилетия).
Экспансивный рост злокачественной опухоли встречается редко. Прогностически это вариант всегда благоприятен: и выявить можно рано, и своевременно проведенный комплекс лечебных мероприятий обеспечит выживание.
Сравнительно редко и не совсем типично для рака, но вполне реальный вариант развития событий в первичном онкологическом очаге. Аппозиционный рост – это медленное врастание в соседние ткани, когда здоровые клетки становятся раковыми (не разрушитель и убийца, а рекрутер-вербовщик, неутомимо работающий в толпе и пополняющий армию Карциномы за счет нормальных клеточных структур).
Типичный вариант для большинства раков. И практически всегда прогностически неблагоприятный. Инвазия – это:
- Врастание в ткани и разрушение клеток (словно безжалостный убийца напал на беззащитную толпу);
- Никаких границ и капсул (Карцинома нападает сразу во все стороны, а у толпы нет ни времени, ни возможностей для возведения защитных редутов);
- Очень быстрый рост опухоли (стремительно и неумолимо, как при быстрой перемотке кадров).
Чаще всего именно так – никто не ожидал-не предполагал, а Карцинома уже тут. Инвазивный рост злокачественной опухоли является самым распространенным вариантом прогрессирования болезни. Впрочем, даже при этом варианте можно поймать начальные формы онкологии, если помнить об онкологической настороженности и регулярно проводить скрининг на рак.
На протяжении всего XX века ученые пытались сформулировать, какие конкретные признаки отличают опухолевые клетки и ткани от их нормальных предшественников. Прогресс в данной области, представляющей основу для разработки направлений противоопухолевой терапии, затруднялся биологическим разнообразием проявления новообразований. Тем не менее к настоящему времени удалось выделить и классифицировать несколько четких, подкрепленных молекулярногенетическими данными тенденций. Наиболее ясное обобщение этих признаков представлено в работе основоположников молекулярной онкологии D. Hanahan и R. Weinberg, появившейся на страницах журнала Cell (? 1 за 2000 г.). По мнению авторов, все или почти все опухоли характеризуются несколькими неотъемлемыми чертами.
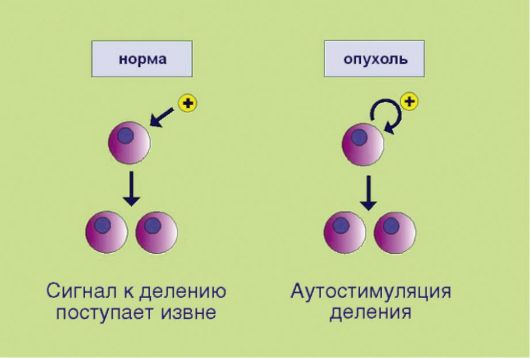
Рис. 5.1.Аутостимуляция пролиферативного сигнала
1. Самодостаточность в отношении сигналов пролиферации, связанная e аутопродукцией факторов роста, соответствующих рецепторов или других компонентов сигнального промитотического каскада(рис. 5.1). Существенно, что нормальная клетка никогда не делится сама по себе; для запуска пролиферативной программы необходим сигнал извне, доставляемый эндокринной системой (гормоны), паракринными механизмами (тканевые факторы роста), или через синаптические окончания нейронов (нейротрофика). Таким образом, увеличение количества клеток в норме происходит лишь в том случае, если многоклеточный организм-хозяин продуцирует сигналы к наращиванию клеточной массы. Трансформированная клетка продуцирует подобные сигналы сама для себя, вне зависимости от потребностей организма, что и приводит к безостановочному делению опухолевого клона.
2. Потеря чувствительности к сигналам, сдерживающим процесс пролиферации, обусловленная инактивацией супрессорных (антимитотических) белков (рис. 5.2). Клоны, обладающие аномальной способностью к аутостимуляции пролиферативного каскада, могут возникать в организме достаточно часто, что связано с постоянным мутационным процессом в клетках организма. Однако все многоклеточные представители живой природы выработали в процессе эволюции несколько уровней защитных систем, препятствующих несанкционированному накоплению клеток. В случае появления клеток со способностью к аутокринной стимуляции деления организмхозяин продуцирует сдерживающие сигналы, доставляемые к клеткам
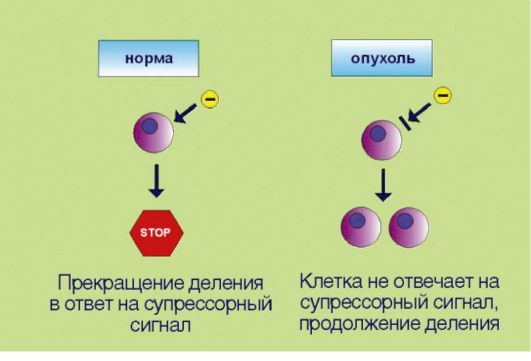
Рис. 5.2.Потеря чувствительности к сигналам, прекращающим клеточное деление
в виде гуморальных факторов и направленные на прекращение пролиферации. Трансформированные клетки в отличие от нормальных утратили способность к восприятию таких сигналов. Подобная нечувствительность к супрессорным воздействиям может происходить в результате утраты соответствующих мембранных рецепторов или других компонентов сигнальных каскадов, участвующих в проведении экстрацеллюлярного сигнала к клеточному ядру.
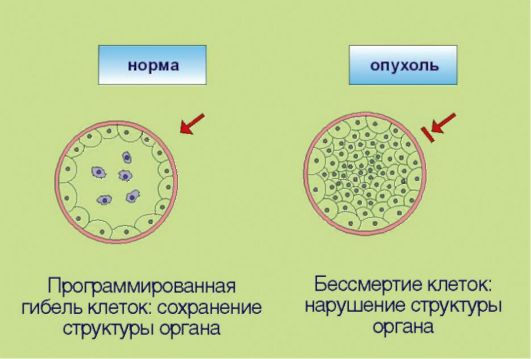
Рис. 5.3.Иммортализация (бессмертие)
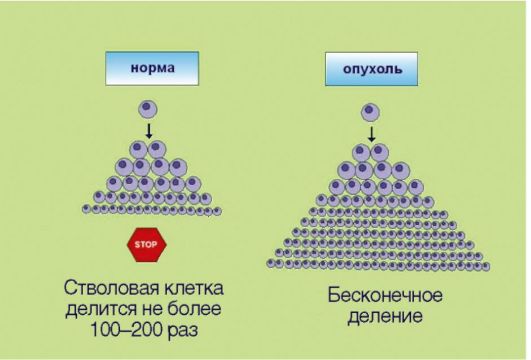
Рис. 5.4.Неограниченный репликативный потенциал (бесконечное деление)
репликативного потенциала делящихся клеток. В 1961-1962 гг. американский ученый L. НауШек установил, что нормальные клетки могут делиться не более 100-150 раз, после чего весь клон (т.е. исходная клетка и ее потомки, обладающие соответственно меньшим резервом возможных делений) утрачивает возможность к самовоспроизведению. Этот феномен, зачастую называемый лимитом Хэйфлика, по крайней мере отчасти лежит в основе биологических механизмов старения: установлено, что репликативный потенциал клеток уменьшается с возрастом индивидуума. Более того, преодоление лимита Хэйфлика является необходимым условием злокачественной трансформации; демонстрацией этого свойства является тот факт, что в лабораторных условиях только опухолевые клетки могут подвергаться многолетнему культивированию, в то время как долгосрочные культуры нормальных клеток получить не удается. Неограниченный репликативный потенциал опухолевых клеток принято объяснять активацией фермента теломеразы, которая компенсирует наблюдаемое в ходе клеточного деления физиологическое укорочение концевых участков хромосом. Теломераза, по-видимому, является одной из самых перспективных молекулярных мишеней для противоопухолевой терапии.
5. Стимуляция процессов ангиогенеза в опухоли, вызванная экспрессией трансформированными клетками ангиогенных факторов и направленная на удовлетворение повышенных потребностей быстроделящихся неопластичес-
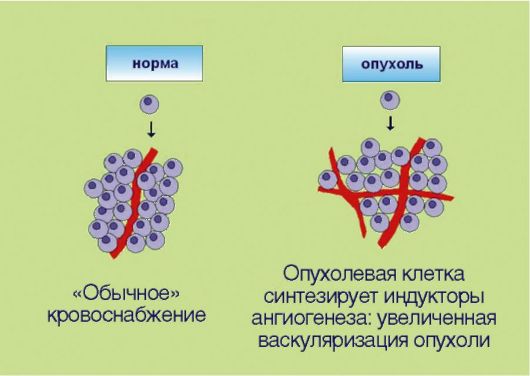
Рис. 5.5. Индукция ангиогенеза
ких компонентов в оксигенации (рис. 5.5). Длительное время опухолевым клеткам приписывалась полная самодостаточность. Предполагалось, что трансформированный клон пролиферирует сам по себе, а все остальные элементы опухоли - строма, сосуды, фибробласты - являются лишь пассивными вспомогательными компонентами. Изменение этих представлений связано с именем выдающегося американского ученого J. Folkman, который совмещал повседневную работу врачахирурга с основополагающими, фундаментальными исследованиями в области экспериментальной онкологии. J. Folkman предположил и экспериментально доказал, что опухолевые клетки могут сформировать клинически распознаваемое новообразование лишь в том случае, если они продуцируют факторы неоангиогенеза. Таким образом, формирование сосудистой сети опухоли происходит не само по себе, а за счет активных, управляемых трансформированными клетками биологических процессов. К настоящему времени идентифицированы десятки факторов, провоцирующих или, наоборот, ингибирующих ангиогенез. Примечательно, что разработка антиангиогенных препаратов считается одним из самых перспективных направлений в онкологии. Дело в том, что во взрослом организме практически не происходит формирования новых сосудов (исключение составляют посттравматическая регенерация тканей и некоторые процессы, связанные с репродуктивным циклом у женщин). Предполагается, что антиангиогенные препараты должны обладать прекрасным
терапевтическим индексом, т.е. эффективно тормозить рост опухолевой массы без каких-либо побочных воздействий на организм.
6. Способность к инвазии и метастазированию, ассоциированная с продукцией опухолью гистолитических ферментов (протеаз), а также факторов, угнетающих локальный иммунитет (рис. 5.6). Эта особенность злокачественной трансформации почти всегда упоминается как ключевой компонент опухолевого роста. Внимание к инвазии и метастазированию связано с клинической значимостью данных процессов: именно они компрометируют результаты хирургического лечения рака и приводят к летальному исходу у онкологических больных. В контексте сказанного отметим, что ни один из перечисленных признаков опухолевого роста не является достаточным для клинической манифестации онкологического процесса. В частности, процесс метастазирования нетрансформированных клеток характерен для заболевания женской репродуктивной системы - эндометриоза, которое никоим образом не является онкологической патологией.
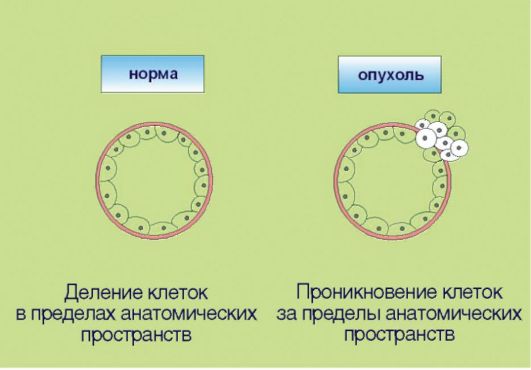
Рис. 5.6.Инвазия и метастазирование
7. Геномная нестабильность, опосредованная инактивацией систем репарации ДНК и нарушениями в молекулярном контроле клеточного цикла (рис. 5.7). Для опухолевой клетки характерно ускоренное накопление мутаций, что по крайней мере отчасти связано со снижением эффективности процессов репарации ДНК. Подобная особенность приводит к чрезвычайной биологической пластичности новообразований, которые способны быстро приспосабливаться
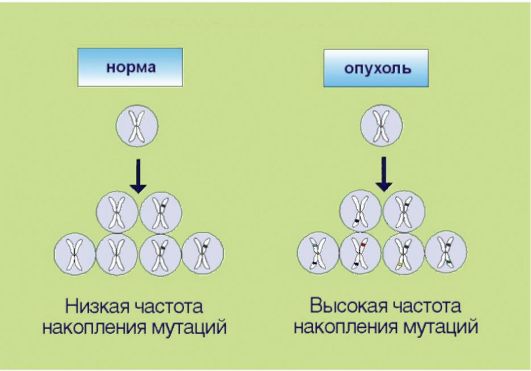
Рис. 5.7.Геномная нестабильность
8. Перестройка стромальных компонентов, создающая более благоприятные условия для эволюции злокачественного клона (рис. 5.8). Длительное время предполагалось, что элементы стромы образуют лишь пассивный каркас для размножающихся опухолевых клеток. В последние годы установлено, что подобное утверждение далеко от истины. Многочисленные факты свидетельствуют о том, что стромальные компоненты опухолей заметно отличаются от таковых в нормальных тканях; некоторые исследователи даже настаивают
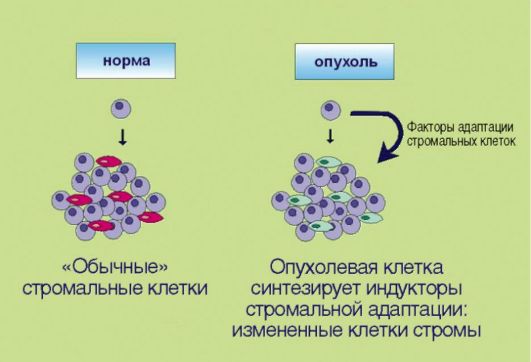
Рис. 5.8.Адаптация стромальных клеток к особенностям опухолевого роста
на том, что фибробласты, инфильтрирующие эпителиальные новообразования, содержат соматические мутации, отличные от таковых в опухолевых клетках и необходимые для жизнедеятельности злокачественного новообразования. Продемонстрированы многочисленные случаи симбиоза трансформированных клеток и окружающих их фибробластов. В частности, независимость малигнизированного эпителия от внешних пролиферативных сигналов может обеспечиваться не аутокринной стимуляцией как таковой, а секрецией факторов роста фибробластами, населяющими опухоль. В свою очередь, эпителиальные клетки секретируют целый спектр биологически активных веществ, регулирующих адаптацию стромальных элементов к потребностям опухолевого роста.
Дата добавления: 2015-07-24 ; просмотров: 1971 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Читайте также:

