Злокачественные опухоли развиваются de novo
Рассматривая судьбу промежуточных стадий (нодозные пролнфераты, доброкачественные опухоли, рак in situ), L. Foulds указывает на следующие возможности длительное существование без всяких изменений, простой рост без озлокачествления, регрессия и озлокачествление. По его мнению, озлокачествление доброкачественной опухоли — наиболее редкий вариант ее эволюции, чаще же всего реализуются 3 другие из перечисленных возможностей. То, что любая доброкачественная опухоль может в принципе озлокачествляться, вряд ли подлежит сомнению, но практическое значение этого, безусловно справедливого положения, невелико. Папилломы кожи озлокачествляются столь редко, что практические действия по отношению к ним предпринимаются или но косметическим соображениям или при локализации их в местах, где они подвергаются постоянной травме. С другой стороны, папилломы мочевого пузыря — это потенциально злокачественные опухоли с очень высокой вероятностью озлокачествления.
По понятным причинам лучше всего изучена судьба морфологически доброкачественных опухолей кожи человека кожный рог, старческая кератома имеют значительно более высокую потенцию к озлокачествлеиию, чем, например, папиллома, себорейная бородавка, кератоакантома.
Практические вмешательства в этих случаях производят, опять же исходя из предшествующего опыта, а не из представлений о свойствах опухолей вообще Несмотря на длительную историю онкологии н онкоморфологии, накопление эмпирического материала связано с большими трудностями.
Рак толстой кишки возникает, таким образом, сразу как таковой de novo, минуя стадии диффузной и очаговой гиперплазии и стадию аденоматозного полипа. К такому же выводу К. М. Пожарисский пришел и на основании изучения клинического материала Л. М. Шабад считает, что развитие рака толстой кишки через стадию карциномы in situ является как раз доказательством его представлений о стадийности канцерогенеза, поскольку карцинома in situ, по его мнению, это предрак, а не рак Л. Л. Капуллер и соавт. (1980) дают иную картину развития рака толстой кишки. По их данным, основанным на изучении большого статистического материала, железистые полипы переходят в железисто-ворсинчатые, а последние в ворсинчатые, обладающие высокой потенцией к озлокачествлению. Диаметр первых — не превышает 1 см, вторые — в половине случаев имеют диаметр 2—3 см, а все ворсинчатые — превышают в размере 1 см.
При семейном полипозе они отметили признаки озлокачествлеиия в 17% случаев начальных полипов, в 46% — железистых и 82% — железисто-ворсинчатых. По данным V A Gilbersten (1974), озлокачествление аденоматозных полипов происходит редко (по-видимому, менее 1%), но поскольку встречаются они часто, развивающиеся из них злокачественные опухоли составляют значительную часть всех раков толстой кишки. В эксперименте на мышах было установлено, что рак толстой кишки может развиваться из нескольких источников более 80% всех обнаруженных новообразований представляли собой аденоматозные полипы, пятая часть которых подвергалась малигнизации — именно они и были главным источником развития рака; самостоятельными формами полипов были гиперпластические и ворсинчатые, они обладали высокой потенцией к озлокачествлению, но встречались редко; наконец, отдельной формой опухолевого поражения был эндофитный рак, развивающийся через стадию дисплазни, карциномы in situ, ио минуя стадию полипа; все названные варианты развивались на фоне гиперплазии слизистой оболочки.
Имеется ли в данном случае развитие злокачественной опухоли действительно de novo, т. е. в гистологически совершенно неизмененной ткани, без всяких морфологических предстадии — доказать (по крайней мере в отношении эпителиальных опухолей) чрезвычайно трудно не только у человека, но и в эксперименте. Примером развития злокачественной опухоли de novo, быть может, является вызываемая у крыс нитроза минами мезенхимиая опухоль почки она начинается с диффузного разрастания недифференцированных опухолевых клеток, которые лишь позже начинают обнаруживать признаки дифференцировки в те или иные мезенхимные компоненты. Если при экспериментальном изучении эпителиальных опухолей их морфологически доброкачественные предстадии в виде нодозных пролифератов, доброкачественных опухолей, диспластических изменений в эпителии проследить не представляет труда, особенно в таких органах, как кожа и мочевой пузырь (японские исследователи, например, описали последовательность стадий в развитии рака мочевого пузыря, в точности соответствующую тому, что ранее было описано Л. М. Шабадом для опухолей кожи, S Fukushima и соавт (1984)), то в отношении сарком столь ясной картины нет. Экспериментальным саркомам, как правило, не предшествуют морфологические стадии, которые можно было бы обозначить как фиброма, лейомиома, а описания изменений, называемых предсаркомами, не кажутся достаточно убедительными.
У человека роль доброкачественных соединительнотканных опухолей как источника развития сарком установить еще труднее, в первую очередь вследствие, по-видимому, относительной редкости последних (примерно Vio числа эпителиальных опухолей). Известно, что лейо-миомы матки — довольно частое заболевание; считают, что менее 1% их озлокачествляется, ио вследствие их высокой частоты, саркомы матки, развившиеся из лейомиом, составляют примерно половину всех сарком этого органа.
МОРФОГЕНЕЗ ОПУХОЛЕЙ
Разбирая морфогенез опухолей, необходимо остановиться на четырех вопросах: 1) возникает ли опухоль без каких-либо предшествующих изменений сразу, "с места в карьер" — de novo — или же стадийно? 2) в случае стадийного развития опухоли, какова сущность этих стадий, в том числе и процесса метастазирования? 3) развивается ли неоплазма из одной трансформированной клетки, и тогда все опухолевые клетки относятся к одному клону, или же опухолевому росту предшествует трансформация многих клеток? 4) каково взаимодействие опухоли и организма-опу-холеносителя?
На первые два вопроса о развитии опухолей de novo или стадийно отвечают две теории — скачкообразной и стадийной трансформации.
Теория скачкообразной трансформации.В соответствии с этой теорией H.Ribbert, M.Borst, B.Fischer (1914) опухоль может развиться без предшествующих изменений тканей, о чем свидетельствуют данные экспериментального вирусного канцерогенеза, а также разнообразные клинические наблюдения. Теоретически возможность скачкообразного развития опухоли подтверждается существованием одноступенчатой модели вирусного канцерогенеза. В подавляющем же большинстве экспериментальных моделей опухолей речь идет о многоступенчатом развитии опухолей (см. лекцию 20 "Опухолевый рост").
Теория стадийной трансформациипри опухолевом росте была разработана отечественным онкологом-экспериментатором Л.М.Шабадом (1968), который одним из первых высказывался о решающем значении мутации соматических клеток в происхождении злокачественных опухолей. В 60-х годах, изучая экспериментальный канцерогенез в различных органах, он предложил выделять четыре стадии в морфогенезе злокачественных опухолей, три из которых относятся к предопухолевым процессам: 1) очаговая гиперплазия; 2) диффузная гиперплазия; 3) доброкачественная опухоль; 4) злокачественная опухоль.
В настоящее время расшифрованы и уточнены следующие стадии морфогенеза злокачественных опухолей:
▲ стадия предопухоли — гиперплазии и предопухолевой дисплазии;
▲ стадия неинвазивной опухоли (рак на месте); а стадия инвазивного роста опухоли;
Вопрос о взаимоотношении доброкачественных и злокачественных опухолей решается неоднозначно. Бесспорно, существуют доброкачественные опухоли, которые могут трансформироваться в злокачественные. Примером могут служить аденоматозные полипы, аденомы и папилломы, в которых развиваются фокусы малигнизации и рак. Но есть также доброкачественные опухоли, практически никогда не трансформирующиеся в злокачественные аналоги.
Предопухолевая дисплазия. Развитию большинства злокачественных опухолей предшествуют предопухолевые процессы, что наиболее детально изучено в группе эпителиальных опухолей и опухолей системы крови и лимфоидной ткани. В первом случае речь идет о предраке, во втором — о предлейкозе и предлимфоме. К предопухолевым процессам в настоящее время относят диспластические процессы, которые характеризуются развитием изменений как в паренхиматозных, так и стромальных элементах. Основными морфологическими критериями диспластических процессов считают появление признаков клеточного атипизма в паренхиме органа при сохранной структуре ткани. В строме очагов дисплазии регистрируются изменения состава экстрацеллюлярного матрикса, появление клеточного инфильтрата, фибробластическая реакция и др. При дисплазии эпителия обнаруживаются полиморфные эпителиальные клетки с гиперхромными ядрами и фигурами митозов не только в базальных отделах, утолщается базальная мембрана, накапливаются коллагены определенных типов и появляются лимфоидные инфильтраты. В случае предлейкоза увеличивается процент бластных клеток до 9. Помимо стереотипных проявлений дисплазии как пред опухолевого процесса, в разных органах и тканях имеются и свои специфические черты, о чем будет сказано в соответствующих лекциях в частном курсе патологической анатомии.
В большинстве органов диспластический процесс развивается при наличии пролиферации клеточных элементов на фоне предшествующей гиперплазии в связи с хроническим воспалением и дисрегенерацией. Однако в ряде случаев дисплазия сочетается с атрофией ткани, как это бывает при атрофическом гастрите с перестройкой эпителия, а также при циррозе печени. Сочетание дисплазии и атрофии не случайно, так как и тот, и другой процессы имеют общие генетические механизмы, в которых участвует ряд клеточных онкогенов, ген-супрессор р53 и др. В одних ситуациях активация данных генов приводит к апоптозу и атрофии без или в сочетании с дисплазией, в других — к пролиферации также без или в сочетании с дисплазией.
На стадии дисплазии методами иммуногистохимии и молекулярной биологии регистрируются перестройки в работе онкопро-теинов, факторов роста, интегриновых рецепторов и адгезивных молекул. Причем генетические перестройки могут значительно опережать морфологические изменения и служить ранними признаками предопухолевых изменений.
Стадия неинвазивной опухоли. Прогрессирова-ние дисплазии связывают с дополнительными воздействиями, ведущими к последующим генетическим перестройкам и злокачественной трансформации. В результате возникает малигнизированная клетка, которая некоторое время делится, формируя узел (клон) из себе подобных клеток, питаясь за счет диффузии питательных веществ из тканевой жидкости прилежащих нормальных тканей и не прорастая в них. На данной стадии опухолевый узел не имеет еще своих сосудов. Причина этого неизвестна. Вероятно, малая масса опухоли обусловливает недостаточную продукцию факторов, стимулирующих ангиогенез и стромообразо-вание в опухоли. Однако, по нашему мнению, представляется более верной точка зрения об отсутствии в неинвазивной опухоли определенных генных перестроек, которые необходимы для осуществления инвазивного роста.
В случае рака стадия роста опухоли "самой в себе" без разрушения базальной мембраны и без образования стромы и сосудов называется стадией рака на месте — cancer in situ, и выделяется в самостоятельную морфогенетическую стадию. Длительность течения данной стадии может достигать 10 лет и более.
Стадия инвазивной опухоли. Она характеризуйся появлением инфильтрирующего роста. В опухоли появляется развитая сосудистая сеть, строма, выраженная в различной степени, границы с прилежащей неопухолевой тканью отсутству- 1От за счет прорастания в нее опухолевых клеток.
Инвазия опухоли протекает в три фазы и обеспечивается определенными генетическими перестройками. Первая фаза инвазии опухоли характеризуется ослаблением контактов между клетками, о чем свидетельствуют уменьшение количества меж. клеточных контактов, снижение концентрации некоторых адгезивных молекул из семейства CD44 и др. и, наоборот, усиления экспрессии других, обеспечивающих мобильность опухолевых клеток и их контакт с экстрацеллюлярным матриксом. На клеточной поверхности снижается концентрация ионов кальция, что приводит к повышению отрицательного заряда опухолевых клеток. Усиливается экспрессия интегриновых рецепторов, обеспечивающих прикрепление клетки к компонентам экстрацеллюлярного матрикса — ламинину, фибронектину, коллагенам. Во второй фазе опухолевая клетка секретирует протеолитические ферменты и их активаторы, которые обеспечивают деградацию экстрацеллюлярного матрикса, освобождая тем самым опухоли путь для инвазии. В то же время продукты деградации фибронектина и ламинина являются хемоаттрактантами для опухолевых клеток, которые мигрируют в зону деградации в третьей фазе инвазии, а затем процесс повторяется снова.
Стадия метастазирования. Это заключительная стадия морфогенеза опухоли, сопровождающаяся определенными гено- и фенотипическими перестройками опухоли. Процесс метастазирования связан с распространением опухолевых клеток из первичной опухоли в другие органы по лимфатическим, кровеносным сосудам, периневрально, имплантационно, что легло в основу выделения видов метастазирования.
Процесс метастазирования объясняется с помощью теории метастатического каскада,в соответствии с которой опухолевая клетка претерпевает цепь (каскад) перестроек, обеспечивающих распространение в отдаленные органы. В процессе метастазирования опухолевая клетка должна обладать определенными качествами, позволяющими ей проникать в прилежащие ткани и просветы сосудов (мелких вен и лимфатических сосудов); отделяться от опухолевого пласта в ток крови (лимфы) в виде отдельных клеток или небольших групп клеток; сохранять жизнеспособность после контакта в токе крови (лимфы) со специфическими и неспецифическими факторами иммунной защиты; мигрировать в венулы (лимфатические сосуды) и прекрепляться к их эндотелию в определенных органах; осуществлять инвазию микрососудов и расти на новом месте в новом окружении.
Метастатический каскад условно может быть разделен на четыре этапа:
▲ формирование метастатического опухолевого субклона;
▲ инвазия в просвет сосуда;
▲ циркуляция опухолевого эмбола в кровотоке (лимфотоке);
▲оседание на новом месте с формированием вторичной опухоли (рис. 5).
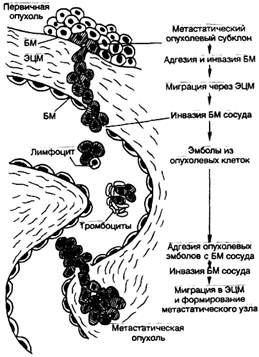
Рис. 5. Метастатический каскад [Cotran R.S., Robins L.S., 1989]. БМ — базальная мембрана; ЭЦМ — экстрацеллюлярный матрикс.
Процесс метастазирования начинается с появления метастатического субклона опухолевых клеток с измененной плазмолеммой, в результате чего клетки теряют межклеточные контакты и приобретают способность к передвижению. Затем опухолевые клетки мигрируют через экстрацеллюлярный матрикс, прикрепляясь интегриновыми рецепторами к ламинину, фибронектину, коллагеновым молекулам базальной мембраны сосуда, осуществляют ее протеолиз за счет выделения коллагеназ, катепсина, эластазы, гликозаминогидролазы, плазмина и др. Это позволяет опухолевым клеткам инвазировать базальную мембрану сосуда, прикрепляться к его эндотелию, а затем, изменяя свои адгезивные свойства (супрессия адгезивных молекул семейства САМ), отделяться как от опухолевого пласта, так и от эндотелия сосуда, "а следующем этапе формируются опухолевые эмболы, которые могут состоять только из опухолевых клеток или же из опухолевых клеток в сочетании с тромбоцитами и лимфоцитами. Фибриновое покрытие таких эмболов может защищать опухолевые клетки от элиминации клетками иммунной системы и действия неспецифических факторов защиты. На заключительном этапе опухолевые клетки взаимодействуют с эндотелием венул за счет "homing''-рецепторов и молекул семейства CD44, происходит прикрепление и протеолиз базальной мембраны, инвазия в периваскулярную ткань и рост вторичной опухоли.
Опухоль может развиваться двумя путями:
без предшествующих изменений (de novo);
путем стадийных трансформаций.
Для злокачественных опухолей эпителиального происхождения выделяют стадии:
неинвазивной опухоли (ракin situ);
метастазирования. Допускается возможность развития злокачественной опухолиde novo, без предшествующих предопухолевых изменений.
Для других злокачественных опухолей (из неэпителиальных тканей) стадийность сходна, но еще недостаточно хорошо изучена. Для доброкачественных опухолей выделяют стадию предопухоли и опухоли.
Предопухолевые процессылучше всего изучены в группе эпителиальных опухолей, где они называются предраком. Выделяютпредраковые состояния(заболевания, приведшие к развитию рака) ипредраковые изменения. К предраковым заболеваниям относят: хронический бронхит, лейкоплакию шейки матки, хронический атрофический гастрит, анемию Аддисона–Бирмера, наследственный полипоз толстой кишки и др. Предраковые изменения проявляются дистрофией, атрофией, гиперплазией, метаплазией идисплазией. Наибольшее значение среди них в настоящее время придают дисплазии.
В онкологии существует понятие облигатного и факультативного предрака. Чаще всего имеет место факультативный предрак, при этом возможность возникновения рака составляет 20–30%. При облигатном предраковом процессе риск развития рака превышает 40%.
Стадия неинвазивной опухоли. Причины трансформации дисплазии в рак остаются неясными, однако высокая митотическая активность клеток при дисплазии III степени несомненно увеличивает вероятность мутаций и появления клеток с реактивацией генетических программ репликации, в норме находящихся в репрессированном состоянии. В результате возникает малигнизи-рованная клетка, которая некоторое время делится, формируя клон из подобных клеток, которые питаются за счет диффузии питательных веществ и кислорода из тканевой жидкости и прилежащих нормальных тканей и не прорастая в них. На этой стадии, называемой ракin situилинеинвазивныйрак, опухолевый узел еще не имеет своих сосудов. Эта стадия в редких случаях протекает несколько лет, обычно она быстро сменяется стадией инвазии.
Стадия инвазиии механизмы инвазивного роста. Стадия инвазии опухоли характеризуется появлением инвазивного, т.е., инфильтрирующего роста. В опухоли появляются развитая сосудистая сеть, строма, выраженная в различной степени, границы с прилежащей неопухолевой тканью отсутствуют за счет прорастания в нее опухолевых клеток.
Инвазия опухоли протекает в три фазыи обеспечивается определенными генетическими перестройками.
Процесс метастазирования объясняется с помощью теории метастатического каскада, который условно может быть разделен на четыре этапа:
1) формирование метастатического опухолевого субклона и внедрение его в русло распространения;
2) транспортировка опухолевых клеток, по типу эмболии, по кровеносным и лимфатическим сосудам;
3) имплантация — задержка этих клеток в сосудах разного калибра и приживление их в местах остановки (вторичный опухолевый зачаток);
4) рост имплантированных клеток в новом месте с формированием метастатических узлов.
Лимфогенные (наиболее характерно для рака).
Гематогенные (наиболее характерно для сарком, часто в органах, бедных лимфатическими сосудами):
а) первичные, когда опухолевые клетки непосредственно попадают в кровяное русло;
б) вторичные, когда опухолевые клетки попадают в лимфоузлы, а затем — в ток крови.
Имплантационные (например, карциноматоз брюшины при раке желудка, раке яичника; по мягким мозговым оболочкам при злокачественных опухолях головного мозга).
Ликворогенные (характерно для опухолей ЦНС).
Кроме того, можно, в зависимости от топографии первичной опухоли, выделить три типа метастазов:
1-й тип — первичная опухоль и ее метастазы находятся в пределах одного и того же органа или ткани;
2-й тип — первичная опухоль в одном органе, метастазы — в другом, но в пределах одной системы;
3-й тип — когда первичная опухоль в одном органе, метастазы — в другом, но в разных системах.
Таким образом, цепь последовательных изменений тканей в процессе морфогенеза опухоли (на примере рака) представляется следующим образом: неравномерная диффузная гиперплазия клеток→очаговые пролифераты, включая очаги метаплазии →доброкачественные опухоли→дисплазия I степени→дисплазия II степени(интраэпителиальная неоплазия низкой степени) →дисплазия III степени→прединвазивный рак(ракin situ, интраэпителиальная неоплазия высокой степени) →инвазивный рак. Обязательное прохождение всех этапов при формировании злокачественной опухоли не является обязательным, практически любое промежуточное звено (чаще — доброкачественной опухоли) может выпадать.
Опухоли построены из паренхимы и стромы. Паренхима опухоли— это собственно опухолевые клетки, образовавшиеся в результате злокачественной трансформации клетки-предшественницы и ее клональной пролиферации. Структурные изменения (атипия) затрагивают все компоненты опухолевой клетки — ядро, цитоплазму, мембраны, органеллы и цитоскелет.
Строма опухоли, так же как и строма нормальной ткани, в основном выполняет трофическую, модулирующую и опорную функции и состоит из волокон и клеток (нормальных фибробластов, лимфоцитов и пр.) с сосудами и нервными волокнами. Таким образом, в опухолях могут соседствовать и взаимодействовать опухолевые и нормальные клетки.
В зависимости от развитости стромы опухоли подразделяют на органоидныеигистиоидные.
В органоидныхопухолях имеются паренхима и развитая строма. В зависимости от десмопластических свойств опухоли строма может быть выражена слабо (например, в медуллярном раке) или преобладать (например, при такой форме рака, как скирр).
В гистиоидныхопухолях доминирует паренхима, строма практически отсутствует, так как представлена лишь тонкостенными сосудами капиллярного типа, необходимыми для питания. В опухолях соединительной ткани стромой принято называть также экстрацеллюлярный матрикс с коллагеновыми волокнами.
В зависимости от степени дифференцировки опухоли различаюттри видаее роста:экспансивный,аппозиционный,инфильтрирующий(инвазивный).
Приэкспансивном(центральном) росте опухоль растет, отодвигая и раздвигая окружающие ткани. Паренхиматозные элементы окружающей опухоль ткани атрофируются, развивается коллапс стромы, и опухоль окружается как бы капсулой (псевдокапсула). Экспансивный рост опухоли медленный, он характерен для зрелых, доброкачественных опухолей. Однако некоторые злокачественные опухоли (рак почки, рак щитовидной железы, фибросаркома и др.) также могут долгое время расти экспансивно.
Аппозиционныйрост опухоли происходит за счет неопластической трансформации нормальных клеток, окружающих опухоль, в опухолевые, что наблюдается в так называемом опухолевом поле.
Приинфильтрирующем(инвазивном) росте клетки опухоли врастают в окружающие ткани и разрушают их (деструирующий рост). Инвазия обычно происходит в направлении наименьшего сопротивления по межтканевым щелям, по ходу нервных волокон, кровеносных и лимфатических сосудов. Границы опухоли при инфильтрирующем ее росте четко не определяются, гораздо шире видимых ее границ, поэтому при ее удалении возможны рецидивы.
Инфильтрирующий рост опухоли быстрый, он характерен для незрелых, злокачественных опухолей.
Макроскопически опухоль может расти в виде узла, язвы, инфильтрата, кисты.
По отношению к просвету полого органа рост опухоли может быть эндофитнымилиэкзофитным.
Эндофитный рост— инфильтрирующий рост опухоли в толщу стенки полого органа, а также наружу по отношению к его внешней поверхности, прорастая окружающие ткани. При этом опухоль со стороны слизистой оболочки (например, желудка, мочевого пузыря, бронха, кишки) может быть почти незаметна, а на разрезе стенки видно, что она проросла опухолью. Иногда большая часть опухоли находится снаружи в виде узла разной величины (экзоорганный рост).
Экзофитный рост — экспансивный рост опухоли в просвет полого органа. Опухоль при этом может соединяться со стенкой как тонкой ножкой (наиболее характерно для доброкачественных опухолей), так и располагаться на широком основании (более характерно для злокачественных опухолей).
В зависимости от числа очагов возникновения опухоли говорят об уницентрическом(один очаг) имультичентрическом(множественные очаги) росте.
Отдельно выделяют так называемые местнодеструирующие опухоли, которые имеют признаки инфильтрирующего роста и склонность к рецидивам, при этом ониникогда(или крайне редко)не метастазируют(например, базальноклеточный рак, ранее называвшийся базалиомой).
Классификация опухолей базируется на основе следующих основных критериев: степени зрелости (доброкачественные и злокачественные), гистогенетической и цитогенетической принадлежности (по тканевому и клеточному источнику развития), степени дифференцировки (для злокачественных опухолей).
Традиционная и самая распространенная клинико-морфологическая классификацияподразделяет все новообразования на два важнейших класса — доброкачественные и злокачественные.
Доброкачественные опухоли, их свойства:
растут экспансивно, раздвигая и сдавливая окружающие ткани;
как правило, четко отграничены и могут иметь фиброзную капсулу (псевдокапсулу);
в полых и трубчатых органах характеризуются экзофитным типом роста (растут в просвет);
почти всегда растут медленно;
редко возникают рецидивы и отсутствуют метастазы;
обладают тканевым атипизмом, меньший полиморфизм клеток опухолевой паренхимы;
характеризуются митотической активностью опухолевой паренхимы, редко выходящей за пределы соответствующей нормы;
вторичные изменения — склероз, гиалиноз, кальциноз.
Злокачественные опухоли, их свойства:
обладают инвазивным (инфильтрирующим) ростом с прорастанием окружающих тканей и их разрушением;
в полых и трубчатых органах характеризуются как экзофитным, так и эндофитным типом роста;
почти всегда растут быстро;
часто дают рецидивы, метастазируют;
обладают тканевым атипизмом, а также атипизмом и полиморфизмом клеток опухолевой паренхимы (отличиями этих клеток от нормальных аналогов и отличиями между собой по расположению, величине, форме и степени окраски), меньшая степень зрелости;
часто характеризуются повышенной митотической активностью опухолевой паренхимы и наличием вторичных изменений — зон некроза, ослизнения, кровоизлияний.
Классификация опухолей по гистогенезу
Эпителиальные опухоли без специфической локализации (органонеспецифические).
Опухоли экзо- и эндокринных желез, а также эпителиальных покровов (органоспецифические).
Мезенхимальные опухоли (мягкотканные и опухоли костей и суставов).
Опухоли меланинпродуцирующей ткани.
Опухоли центральной и периферической нервной системы, оболочек головного и спинного мозга (нейро-эктодермальные и менингососудистые).
Опухоли кроветворной (гемопоэтической) и лимфоидной ткани.
Гистогенез опухоли устанавливается с помощью морфологического изучения строения и сравнения клеток опухоли с различными этапами онтогенетического развития клеток органа и ткани, в котором развилась данная опухоль. В опухолях из низкодифференцированных клеток, потерявших сходство с клетками исходной ткани и органа, установить гистогенез очень трудно, и иногда невозможно. Поэтому существуют еще опухоли неустановленного гистогенеза (недифференцированные), хотя число таких опухолей уменьшается благодаря использованию новых методов исследования.
Важным в клиническом и прогностическом отношении является гистологическая градация злокачественных новообразований по степени дифференцировки паренхимы.
высокодифференцированные опухоли: обладают паренхимой, которая по строению и функции ближе всего к своему нормальному аналогу. Клеточный атипизм и полиморфизм в них, как правило, выражены слабо. Склонность к росту, инвазии и метастазированию не достигает максимального уровня;
умереннодифференцированные опухоли: указанные показатели выражены сильнее, степень злокачественности выше;
низкодифференцированные опухоли: признаки, перечисленные выше, выражены особенно сильно, что реализуется в более значительных злокачественных потенциях.
Опухоли с более низкой степенью дифференцировки прогностически менее благоприятны.
Основные принципы классификации опухолей положены в основу Международной Онкологической Классификации Болезней (МКБ-О), которая пересматривается ВОЗ каждые несколько лет. Кроме того, периодически ВОЗ выпускает пересмотренные международной группой экспертов гистологические классификации опухолей.
Стадированиебольшинствазлокачественных опухолей(за исключением лимфом и некоторых других опухолей)осуществляют по международной системеTNM. В этой системе буквой Т (tumor) обозначают протяженность (распространенность) местной инвазии в зоне основного, первичного опухолевого узла и на прилежащие ткани, буквойN(nodes) — поражение метастазами регионарных лимфатических узлов, буквойM(metastases) — наличие отдаленных, главным образом, гематогенных метастазов. Каждая локализация злокачественных новообразований имеет свою конкретизацию по системеTNM. При этом используется два критерия распространенности опухолевого заболевания — клиническое (TNM) и патогистологическое (постхирургическое —pTNM). Первый из них основывается на данных клинического исследования, проведенного до лечения, второй учитывает сведения, полученные при исследовании операционного препарата, и дополняет или исправляет первый.
Стадии онкологического заболевания, обозначаемые как I,II,III,IVрекомендуется использовать лишь дополнительно, по мере необходимости.
Далеко не всегда, особенно на ранних стадиях развития, опухоль проявляет себя клинически. По мере роста опухоли появляется определенная симптоматика, которую можно разделить на несколько групп.
1. Местное воздействие первичного опухолевого узла.
А. Сдавление опухолью окружающих тканей, сосудов и соседних органов с нарушением их функции, например, нарушение оттока секрета желез, нарушения крово- и лимфообращения.
Б. При экзофитном типе роста опухоли в полом органе — стеноз (сужение) и обструкция (закрытие) просвета с нарушением продвижения содержимого.
В. При инвазивном типе роста — деструктивные изменения тканей, которые могут привести к развитию кровотечения (врастание в стенку и аррозия сосудов), перфорации полого органа, формирование свищевых ходов и т.д.
2. Нарушение гемостаза.
A. Повышение свертываемости крови (из-за неустойчивого кровотока и повреждения эндотелиальной выстилки). Характерный синдром — илеофеморальный тромбоз.
Б. Риск развития тромбоэмболий.
B. Развитие хронического ДВС-синдрома (особенно в терминальной стадии развития онкологического заболевания) с тенденцией к спонтанным кровоизлияниям вследствие истощения компонентов коагуляции.
4. Системные неметастатические воздействия (обменные, эндокринные и иммунные нарушения).
A. Железодефицитная анемия.
Б. Анорексия (отсутствие аппетита и частично связанная с этим потеря массы тела) и раковая кахексия.
Г. Паранеопластические синдромы.
К паранеопластическим синдромам относят.
Гиперкальциемию из-за остеолиза, вызванного метастатическим, реже первичным поражением костей, например при миеломе, и выработкой какой-либо некостной опухолью гуморальных субстанций, приводящих к поступлению кальция в кровь (например, паратгормона при раке лёгкого).
Эндокринопатии. Встречаетсясиндром Иценко–Кушинга(при опухолях передней доли гипофиза, раке лёгкого, толстой кишки, эндометрия),гиперкальциемияиостеопорозпри опухолях паращитовидных желёз, раке лёгкого. Гиперпродукция гастрина при некоторых опухолях поджелудочной железы и двенадцатиперстной кишки (гастриномах) приводит к развитиюсиндрома Золлингера–Эллисона(гипертрофия и множественные эрозии и язвы слизистой оболочки желудка и двенадцатиперстной кишки с развитием желудочно-кишечных кровотечений).
Иммунопатологические процессы с иммунокомплекс-ными, антительными и цитотоксическими механизмами развития, приводящие к развитию васкулитов, нейропатий, миопатий и дерматопатий (дерматомиозит).
Иногда к паранеопластическим синдромам относят анемию, гиперкоагуляцию, кахексию, лихорадку. Если их учитывать, то паранеопластические синдромы встречаются более, чем у половины больных со злокачественными опухолями.
Паранеопластические синдромы часто бывают первыми клиническими симптомами опухоли и поэтому имеют важное диагностическое значение.
Вторичные изменения в опухоляхпредставлены очагами некроза и кровоизлияний, воспалением, ослизнением, склерозом, отложением солей кальция (петрификация), разрастанием костных структур (оссификация), формированием кист.
Иногда эти изменения происходят в связи с применением лучевой терапии и химиотерапии и являются признаком терапевтического патоморфоза, поэтому при направлении биоптата или удаленной опухоли в патологоанатомическое отделение обязательно указывают проводимое лечение.
Читайте также:

