Взаимодействия циклобутана с хлором
Циклоалканы (циклопарафины, нафтены) - циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда - CnH2n.
Названия циклоалканов формируются путем добавления приставки "цикло-" к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.
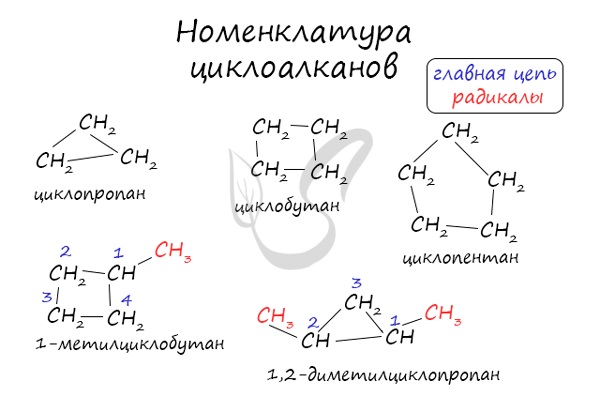
Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации.
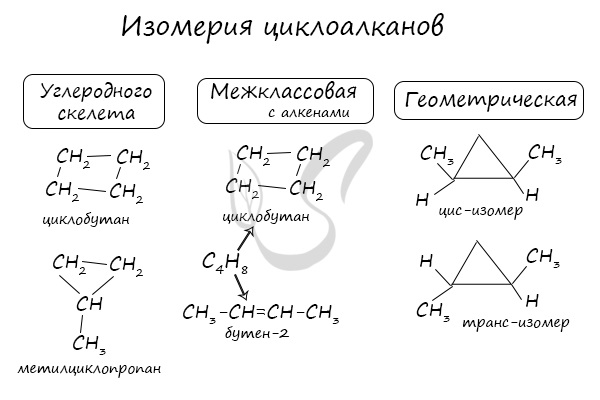
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
В промышленности циклоалканы получают несколькими способами:
-
Из ароматических углеводородов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.

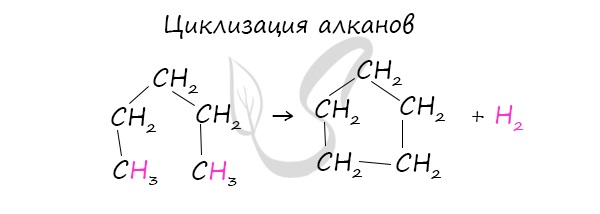
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
-
Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)

Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
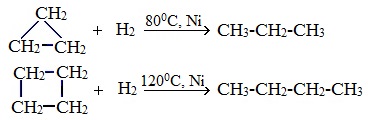
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования.

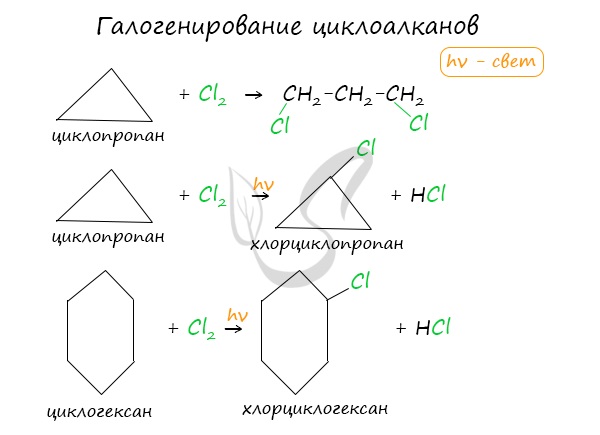
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
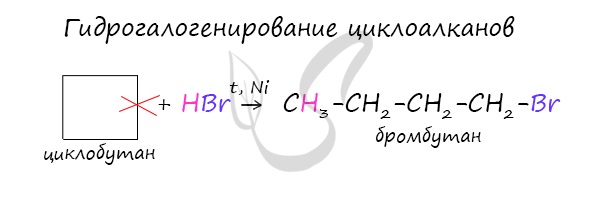
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов - гомологи бензола.

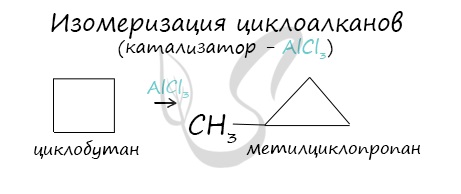
В ходе нагревания с катализатором - AlCl3 циклоалканы образуют изомеры.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
Реакция присоединения характерна для циклопропана, цикл которого неустойчив и легко рвется.
Межклассовыми изомерами циклоалканов являются алкены.
Тип гибридизации атомов углерода у циклоалканов (как и у алканов) - sp 3 .
В результате гидрирования бензола можно получить циклогексан.
Циклогексан не вступает в реакцию присоединения, этой прочный устойчивый цикл.
Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
Общая формула циклоалканов CnH2n, где n≥3.
Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения.
1. Реакции присоединения к циклоалканам
| Чем меньше цикл и чем больше угловое напряжение в цикле, тем легче протекают реакции присоединения. Способность вступать в реакции присоединения уменьшается в ряду: циклопропан > циклобутан > циклопентан. |
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана.
Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:


Циклопентан присоединяет водород в жестких условиях:

Бромирование протекает более медленно и избирательно.
Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют.
Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
| Например. Циклопропан присоединяет бром с образованием 1,3-дибромпропана: |

Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
| Например, циклопропан присоединяет йодоводород. |

| Присоединение галогеноводородов к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и др.) происходит по правилу Марковникова. |
| Например, при присоединении бромоводорода к метилциклопропану преимущественно образуется 2-бромбутан |

2. Реакции замещения
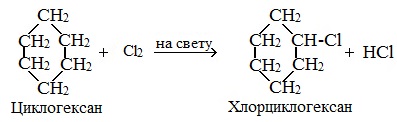
Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
| Например, при хлорировании циклопентана на свету или при нагревании образуется хлорциклопентан |

При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:

При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
| Например, нитрование циклопентана. |

При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода.
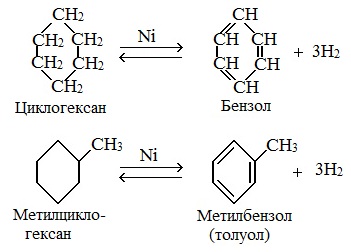
Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
| Например, бензол образуется при дегидрировании циклогексана. |

| Например, при отщеплении водорода от метилциклогексана образуется толуол. |

3. Окисление циклоалканов
Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
| Например, горение циклопентана. |
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:

Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.
Циклоалканы
Свойства циклоалканов в зависимости от размера цикла имеют свои особенности, и поэтому целесообразно рассматривать их для каждого цикла отдельно. Строение циклических соединений изучалось еще в прошлом веке, и были попытки найти закономерности, объясняющие своеобразие реакционной способности каждого цикла. Адольфом фон Байером была предложена теория напряжений валентных углов, согласно которой молекула тем стабильнее, чем ближе значения валентных углов к нормальному. Эта теория объясняла, почему циклопропан мало устойчив, но она не смогла объяснить высокую устойчивость циклогексана, потому что исходила из представлений о плоской геометрии циклов. Действительно, в циклопропане валентный угол соответствует углу в равностороннем треугольнике (60°), тогда как нормальный валентный угол sp 3 -С-атома равен 109,5°. Это означает, что циклопропановое кольцо испытывает большое напряжение и стремится раскрыться, поэтому циклопропан ведет себя в некоторых реакциях как алкен.
Структурные измерения и квантово-химические расчеты молекулы циклопропана дают следующие геометрические параметры:
Объяснение строения циклопропана в свете этих данных заставляет предположить, что связи в кольце образованы гибридными орбиталями с вкладом s-характера лишь 17% против 25% при гибридизации sp 3 (об этом можно судить, например, по величине энергии ионизации: циклопропан 10,5 эВ, пропан 11,7 эВ, пропен 9,7 эВ). Внешние орбитали имеют 33% s-вклада (т.е. ближе к sp 2 -гибридизации).
Сравнение величин теплот сгорания ряда циклоалканов в расчете на одну метиленовую группу показывает, что циклопропан является самым богатым энергией циклоалканом (38,5 кДж/моль). За точку отсчета принят циклогексан (0 кДж/моль).
Циклопропан проявляет химические свойства как алканов, так и непредельных соединений. Гидрирование, взаимодействие с бромо- и хлороводором в воде, бромом при нагревании и на свету приводит к раскрытию цикла.
Напротив, при действии хлора на свету он, аналогично алканам, подвергается замещению – хлорированию.
Циклобутан, как и другие циклоалканы с циклом больше трехчленного, имеет неплоское кольцо. Оно представляет собой геометрическую фигуру с перегибом по линии соединяющей противоположные углеродные атомы, что обусловлено внутримолекулярным отталкиванием атомов водорода. Поэтому монозамещенные циклобутаны существуют в двух конформациях, которые, однако, легко переходят друг в друга и не могут быть разделены.
Кольцо циклобутана более устойчиво к действию многих реагентов, чем кольцо циклопропана. Для него более характерными являются реакции замещения, однако каталитическое гидрирование приводит к раскрытию кольца.
Молекула циклопентана образует правильный пятиугольник с внутренним углом 105°, близким по величине к валентному углу тетраэдрического атома углерода. Однако, вследствие внутримолекулярного отталкивания атомов водорода, происходит искажение плоскости молекулы.
Циклопентан проявляет свойства, характерные для алканов и реакции раскрытия цикла для него нехарактерны. Повышенный интерес вызывает циклопентадиен. Он является активным субстратом в реакциях диенового синтеза, при хранении обратимо димеризуется с образованием эндо- и экзо-аддуктов Дильса-Альдера. При перегонке оба димера превращаются в исходный циклопентадиен с примесью полимерных продуктов.
Если бы молекула циклогексана была плоской, как предполагал А. ф. Байер, то в ней наблюдалось бы значительное напряжение валентных углов (120° против 109,5°). Сейчас известно, что циклогексан неплоский, четыре атома углерода находятся в одной плоскости, а два выходят из нее. Возможны три пространственные конформации циклогексана: кресло – С-атомы расположены по разные стороны плоскости, ванна – по одну. Из-за внутримолекулярного отталкивания атомов водорода более выгодна форма кресла (на 29,3 кДж/моль). Промежуточное положение занимает конформация, которую называют твист-формой – это искаженная ванна, она на 6,3 кДж/моль выгоднее ванны.
Кресло Ванна Твист
Когда молекула циклогексана находится в конформации кресла, атомы водорода в ней можно различить на экваториальные (ориентированные ближе к плоскости кольца) и аксиальные.
Однако, в химическом отношении все атомы водорода равноценны, т.к. конформации быстро переходят друг в друга. Реакционная способность циклогексана аналогично алканам и для него характерны реакции свободнорадикального замещения: хлорирование, нитрование по М. Коновалову. Однако в отличие от циклопропана и циклобутана каталитическое гидрирование требует жестких условий
Из всех циклоалканов циклогексан имеет самое устойчивое кольцо: величина теплоты сгорания в расчете на одну метиленовую группу, равная 659 кДж/моль, принята за нулевую при сравнении с другими циклоалканами.
При пропускании циклогексана или его алкилзамещенных через никелевый или платиновый катализатор при 200 °С происходит дегидрирование кольца и его превращение в ароматическую систему. Эта реакция, однако, препаративного значения не имеет, т.к. производные бензола зачастую доступнее производных циклогексана с теми же заместителями.
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость.
Трех- и четырехчленные циклы (малые циклы), являются насыщенными, но, несмотря на это резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp 3 -гибридизованному атому углерода.
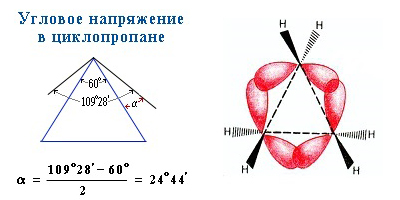
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
В циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
1. Гидрирование
Циклопропан, циклобутан довольно легко присоединяют водород, образуя соответствующие нормальные алканы.
2. Галогенирование
Малые циклы (С3 — С4) способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном). С алкенами реакция идет при комнатной температуре, для циклоалканов необходимо нагревание.
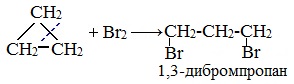
3. Гидрогалогенирование
В реакцию присоединения с галогеноводородами опять де вступают только малые циклы при нагревании.

Присоединение к гомологам циклопропана происходит по правилу Марковникова.
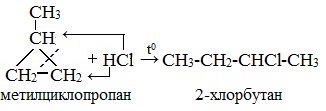
1. Галогенирование
2. Нитрование

1. Дегидрирование
Эти соединения, подобно алканам, вступают в реакции дегидрирования.
Дегидрирования циклогексана (реакция Зелинского-Казанского) и его алкильных производных.
1. Реакция горения
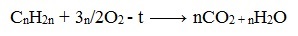
2. Окисление в присутствии катализатора.
При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота.
Сравнение свойств
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла.
Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.
Важнейшей особенностью, отличающей алициклические соединения от алифатических соединений является наличие цикла.
Циклоалканы сильно отличаются между собой по устойчивости цикла: наименее устойчивы трехчленные и наиболее устойчивы пяти- и шестичленные циклы.
Реакции гидрирования и дегидрирования
При каталитическом гидрировании трех-, четырех- и пятичленные циклы разрываются с образованием алканов. Особенно легко идет эта реакция в случае циклопропана и его гомологов. Пятичленный цикл разрывается только при высоких температурах.


(циклопентан) + H2 –– 300º C , Pd CH3–CH2–CH2–CH2–CH3(пентан)
Соединения с шестичленными циклами при нагревании с катализаторами гидрирования дегидрируются и превращаются в ароматические углеводороды:

Реакции галогенирования
Реакции циклоалканов с галогенами происходят в различных направлениях в зависимости от величины цикла и природы галогена.
Галогенирование циклопропана
Реакция взаимодействия циклопропана с бромом сопровождаются разрывом циклов и присоединением атомов брома:
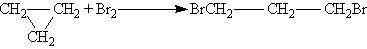
При взаимодействии циклопропана с хлором происходит реакция замещения:

Галогенирование циклобутана
Большая устойчивость циклобутана по сравнению с циклопропаном проявляется в том, что он присоединяет бром труднее – лишь при повышенных температурах:

+ Br2 → BrCH2-CH2-CH2-CH2Br
Хлор при взаимодействии с циклобутаном вступает в реакцию замещения:
CH2 – CH2 CH2 – CH-Cl CH2 - CH
| | + Cl2 → | | → | ||
CH2 – CH2 CH2 – CH2 - HCl CH2 - CH
Галогенирование циклопентана и циклогексана
При взаимодействии циклопентана и циклогексана с галогенами реакция не сопровождается разрывом цикла, а приводит к реакциям замещения:

Реакции гидрогалогенирования
Циклопропан и его гомологи реагируют с галогеноводородами с разрывом цикла:

При взаимодействии гомологов цикропропана с галогеноводородами реакция протекает по правилу Марковникова:

Циклобутан присоединяет HBrаналогично циклопропану, но только при нагревании.
Циклопентан, циклогексан и высшие цилкоалканы с галогеноводородами не реагируют.
Взаимодействие с кислотами
Взаимодействие с серной кислотой
Циклопропановый цикл раскрывается при взаимодействии с серной кислотой с образованием н-пропилсульфата:
∕ \ + H2SO4 → CH3 – CH2 – CH2 – OSO3H
Взаимодействие с трифторуксусной кислотой
Циклопропановый цикл раскрывается при взаимодействии с сильными карбоновыми кислотами. С гомологами циклопропана реакция протекает в соответствии и правилом Марковникова:
∕ \ + CF3-COOH → CH3 – CH2 – CH – OCOCF3
R - HC – CH2 |
Циклобутан взаимодействует с кислотами аналогично, но труднее, чем циклопропан.
Циклопентан, циклогексан и высшие циклоалканы кислотами не расщепляются.
Окисление циклоалканов
Циклоалканы довольно стойки к действию окислителей. Однако, при повышенных температурах, под действием сильных окислителей (KMnO4,K2Cr2O7) происходит разрыв цикла с образованием двухосновных кислот с тем же числом атомов углерода в молекуле:

Перегруппировки циклоалканов
Для циклоалканов и их производных характерны реакции сужения и расширения циклов. Эти реакции являются каталитическими и протекают в присутствии кислот Льюиса:
Перегруппировки, приводящие к сужению цикла


AlCl3
Перегруппировки, приводящие к расширению цикла


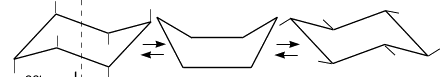
ось симметрии II III I
Двенадцать связей C–H, которые имеются у циклогексана в конформации "кресла", делятся на два типа. Шесть связейнаправлены радиально от кольца к периферии молекулы и называются экваториальными связями (e- связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a- связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз)."
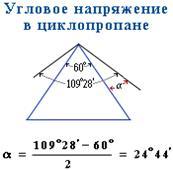
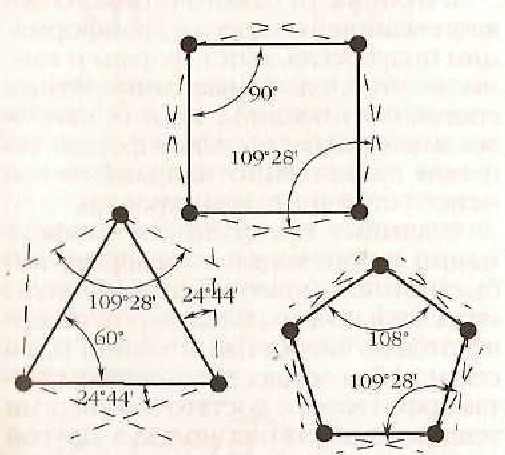

Аналогично можно рассчитать отклонения валентных углов и для других циклов:
Отклонения валентных углов
Разница между теплотой сгорания на группу СН2 данного цикла и ненапряженного циклогексана (кДж/моль)
вычисленные по Байеру
фактические
0 (как у гексана)
Циклы с С12 и более
Согласно полученным расчетам по Байеру, напряжение циклов уменьшается от трехчленного (наиболее напряженного и менее устойчивого) к пятичленному, а затем вновь возрастает. Исходя из этого Байер сделал вывод, что наиболее устойчивым должен быть циклопентан, затем циклогексан, а остальные циклы должны быть значительно менее устойчивыми.
Однако теория Байера оказалась в противоречии со многими экспериментальными данными.
Было установлено, что шестичленный цикл прочнее пятичленного; не наблюдается увеличения напряжения и в циклах с большим числом атомов углерода.
Несостоятельность теории Байера заключалась в том, что он считал все циклы плоскими, а угловое напряжение рассматривал как единственный фактор, определяющий устойчивость циклов.
В настоящее время установлено, что:
все циклы, за исключением трехчленного, не имеют плоскостного строения;
в циклических соединениях существуют следующие типы напряжений, повышающие внутреннюю энергию циклов:
Напряжение угловое (ангулярное) или байеровское напряжение.
Этот тип напряжения обусловлен отклонением валентных углов от нормального валентного угла (109 0 28 ).
Напряжение заслонения или торсионное напряжение.
Этот тип напряжения, связанный с конформационным состоянием молекул, обусловлен отклонением атомов или групп атомов от наиболее выгодной заторможенной конформации.
Напряжение Ван-дер-Ваальса.
Этот тип напряжения возникает в результате взаимного отталкивания атомов или групп атомов, находящихся у соседних атомов углерода, связанных σ-связью.
Напряжение трансаннулярное (напряжение Прелога).
Этот тип напряжения возникает в результате взаимодействия атомов или групп атомов, расположенных не у соседних, а у отдаленных друг от друга атомов углерода цикла. Например, в циклах, содержащих 8-12 атомов углерода.
Естественно, что все указанные типы напряжений приводят к увеличению внутренней энергии системы. Поэтому любое алициклическое соединение стремится принять такую пространственную конфигурацию, при которой число всех этих типов напряжений было бы наименьшим, т.е. чтобы внутренняя энергия системы была минимальной.
Экспериментальная количественная оценка степени напряженности (устойчивости) циклических систем была сделана на основе исследований теплот сгорания, являющихся мерой внутренней энергии соответствующих циклоалканов.
Результаты этих исследований показали, что теплота сгорания в расчете на одну группу СН2 является наименьшей для циклогексана и не отличается от таковой в углеводородах нормального строения. Это свидетельствует об отсутствии напряжения в шестичленном цикле.
Если напряжение в этом цикле принять за нуль, то наибольший избыток энергии в расчете на одну группу СН2 по сравнению с циклогексаном имеют циклопропан (38,5 кДж/моль) и циклобутан (27,4 кДж/моль), что свидетельствует о наличии в этих циклах больших напряжений.
Небольшое напряжение имеется в циклопентане (5,4 кДж/моль), циклогептане (3,7 кДж/моль) и в циклах , содержащих С8 – С11 (4,2-5,8 кДж/моль).
Макроциклы с числом атомов углерода С12 и более приближаются по своей устойчивости к циклогексану (0-1,7 кДж/моль).
Читайте также:

