Взаимодействие н бутана с хлором протекает
Взаимодействие н-бутана с хлором протекает
2) через образование свободных радикалов
3) с преимущественным образованием 1-хлорбутана
4) с образованием нескольких монохлорпроизводных
6) на свету или при нагревании
Ответ запишите цифрами без пробелов
Алканы- это предельные углеводороды, для них характерны реакции радикального замещения (с образованием свободных радикалов) , протекающие на свету или нагревании. Если алкан имеет разветвленное строение, то замещение происходит у третичных или вторичных и в последнюю очередь у первичных атомов углерода. При хлорировании алканов линейного строения образуются несколько монохлорпроизводных. Поэтому ответ: 2,4,6
у бутана же всего 4 атома углерода в скелете, то есть с какой бы стороны не присоединился первый хлор это всё равно будет 2-хлорбутан
(CH3-CHCl-CH2-CH3 и CH3-CH2-CHCl-CH3 это ведь одно и то же вещество только прочитанное с другого конца.) а вот 5 ответ по моему правильный ведь реакция идет по радикальному механизму соответственно должен ременно образоваться свободный радикал.
Будет получаться и 2-хлорбутан, и 1-хлорбутан.
Под номером 5 представлена частица с положительным зарядом - катион, а не радикал.
полностью согласен с гостем, правильный ответ 256, и если вы говорите что это катион а не радикал то объясните пожалуйста как вы понимаете слово радикал, и как ещё его можно изобразить, если не как в 5 варианте ответа, до того как он присоединился к чему либо? со всем уважением, но вы в данном случае не правы, но это моё субъективное мнение, и если вы мне толково объясните в чем наша ошибка, буду вам искренне благодарен.)))
Например, радикал изопропил изображается так:
В данном задании (взаимодействие бутана с хлором) реакция идет именно через образование радикалов.
Через образование указанного в пункте 5 катиона происходит, например, реакция бутена-2 с хлороводородом
Так что, правильный ответ 246
Взаимодействие толуола с бромом на свету протекает
1) с разрывом π-связей в молекуле толуола
2) через образование свободных радикалов
3) как реакция присоединения
4) как реакция замещения
6) по ионному механизму
Ответ запишите цифрами без пробелов
Толуол- представитель голомологического ряда аренов (ароматических углеводородов). В случае гомологов бензола при действии хлора на свету или при нагревании происходит реакция хлорирования на свету радикального замещения (образование свободных радикалов) в БОКОВОЙ цепи. Поэтому правильный ответ: 2,4,5
Этан может вступать в реакции
Этан это алкан. Для предельных углеводородов характерны реакции замещения, дегидрирования, горения, разложения, изомеризации, крекинга. В этане 2 атома углерода, поэтому реакции изомеризации и крекинга отсутствуют.
По ионному механизму протекают реакции, уравнения которых:
По ионному механизму идут реакции присоединения полярных молекул: HCl, HBr, H2O
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:

Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:

Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, п ри дегидрировании этана образуются этилен или ацетилен:  |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:

Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана .
При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ:

Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:

- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.

4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Представленный материал поможет учителю закрепить одну из сложнейших тем "Механизмы реакций в органическом химии". Содержит ответы
1. Взаимодействие этилена и бромоводорода протекает
1) с промежуточным образованием частицы 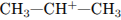
2) без катализатора
3) с разрывом 
-связи в молекуле этилена
4) с образованием дибромэтана
5) с образованием бромэтана
2. Взаимодействие пропена и бромоводорода протекает
1) с промежуточным образованием частицы 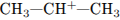
2) по правилу В.В. Марковникова
3) с разрывом 
-связи в молекуле пропена
4) с образованием дибромпропана
5) в присутствии катализатора
3. Реакция пропена с водой
1) – это реакция замещения
2) требует участия катализатора
3) протекает с образованием двух продуктов — основного и побочного
4) протекает с участием свободных радикалов
5) приводит к разрыву 
-связи углерод-углерод
6) приводит к разрыву 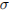
-связи углерод-углерод
4. Для этина характерна(-о)
1) реакция этерификации
2) наличие двойной связи в молекуле
3) реакция изомеризации
4) взаимодействие с 
5) реакция гидрирования
6) реакция тримеризации
5. Взаимодействие н-бутана с хлором протекает
1) с образованием нескольких монохлорпроизводных
2) через образование свободных радикалов
3) с преимущественным образованием 1-хлорбутана
4) на свету или при нагревании
5)с промежуточным образованием частицы 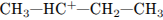
6) с разрывом связей 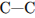
в молекуле бутана
6. Установите соответствие протекающей между взаимодействующими веществами и механизмом протекания реакции:
А) 2-хлорбутан с аммиаком 1) радикальное замещение
Б) хлорэтан с водным раствором 2) радикальное присоединение
гидроксида натрия 3) нуклеофильное замещение
В) полимеризация изопрена (2-метилбутен-1) 4) нуклеофильное присоединение
Г) пропин с водой 5)электрофильное присоединение
Д) этаналь с метанолом 6)электрофильное замещение

1. Взаимодействие н-бутана с хлором протекает
1) с разрывом связей 
в молекуле бутана
2) через образование свободных радикалов
3) с преимущественным образованием 1-хлорбутана
4) с образованием нескольких монохлорпроизводных
5) с промежуточным образованием частицы 
6) на свету или при нагревании
2. Взаимодействие толуола с бромом на свету протекает
1) с разрывом р-связей в молекуле толуола
2) через образование свободных радикалов
3) как реакция присоединения
4) как реакция замещения
5) с промежуточным образованием частицы 
6) по ионному механизму
3. Этан может вступать в реакции
4. По ионному механизму протекают реакции, уравнения которых:
1) 
2) 
3) 


4) 
5) 
6) 
5. Для циклогексана справедливы утверждения:
1) при нагревании с катализатором образует толуол
2) реакция гидрирования протекает довольно легко
3) взаимодействует с бромом
4) все атомы углерода находятся в состоянии sp3-гибридизации
5) является изомером гексана
6) не растворяется в воде
6. Для бутина-1 справедливы утверждения:
1) молекула содержит одну сигма-связь
2) вступает в реакции галогенирования
3) обесцвечивает раствор перманганата калия
4) все атомы углерода находятся в состоянии sр2-гибридизации
5) является изомером бутадиена-1,3
6) при гидратации в присутствии солей ртути (II) образует бутанол-1
7. Взаимодействие пропена и хлороводорода протекает
1) по цепному радикальному механизму
2) с промежуточным образованием частицы 
3) без катализатора
4) с разрывом пи - связи в молекуле пропена
5) с образованием дихлорпропана
6) с преимущественным образованием 1-хлорпропана
8. Для этена характерна(-о):
1) sр-гибридизация атомов углерода
2) наличие двойной связи в молекуле
3) реакция гидрогалогенирования
4) взаимодействие с аммиачным раствором 
5) реакция изомеризации
6) взаимодействие с раствором 
9. И для ацетилена, и для толуола характерна(-о):
1) взаимодействие с бромоводородом
2) sp2-гибридизация атомов углерода в молекуле
3) взаимодействие с кислородом
4) взаимодействие с хлором
5) наличие 
- и 
-связей в молекулах
6) высокая растворимость в воде
10. По радикальному механизму протекают реакции
1) 
2) 
3) 
4) 
5) 
6) 
11. Взаимодействие пропена и бромоводорода
1) протекает по правилу ковникова
2) приводит к образованию дибромпропана
3) относится к реакциям присоединения
4) не сопровождается разрывом 
-связи
5) осуществляется по ионному механизму
6) приводит к образованию 2,2-дибромпропана
12. Для бутина-1 справедливы утверждения:
1) молекула содержит две 
-связи
2) реагирует с аммиачным раствором оксида серебра
3) взаимодействует с раствором перманганата калия
4) все атомы углерода находятся в состоянии sp-гибридизации
5) не является изомером дивинила
6) при гидратации в присутствии солей ртути (II) образует бутаналь
13. Ацетилен будет реагировать с каждым из веществ, указанных в ряду:
1) 
2) 
3) 
4) 
5) 
6) 
14. Толуол реагирует с
4) азотной кислотой
15. Для метилциклопентана справедливы утверждения:
1) является изомером гексана
2) может вступать в реакцию галогенирования на свету
3) может вступать в реакцию полимеризации
4) является изомером гексена-2
5) все атомы находятся в состоянии sp3-гибридизации
6) обесцвечивает водный раствор перманганата калия
16. Реакция хлорирования метана протекает
1) с образованием хлорид-ионов
2) в несколько стадий
3) с образованием различных хлорпроизводных
4) при условии яркого освещения в начале реакции
5) на никелевом катализаторе
6) в соответствии с правилом ковникова
17. Для метилциклогексана справедливы утверждения:
1) при нагревании с катализатором образует толуол
2) способен к реакциям дегидрирования
3) взаимодействует с хлором
4) все атомы углерода находятся в состоянии 
-гибридизации
5) является изомером гексана
6) не окисляется кислородом
18. Реакция бромирования метана протекает
1) по радикальному механизму
2) в одну стадию
3) с образованием различных бромпроизводных
4) в темноте и без нагревания
5) с выделением теплоты
6) в соответствии с правилом ковникова
19. Углеводороды ряда этилена будут реагировать с каждым из веществ, указанных в ряду:
1) 
2) 
3) 
4) 
5) 
6) 
20. Бутан может вступать в реакции
21. Взаимодействие этилена с водой протекает
1) по цепному свободнорадикальному механизму
2) без катализатора
3) с промежуточным образованием частицы 
4) с разрывом 
-связи в молекуле этилена
5) с образованием этанола
6) с преимущественным образованием этиленгликоля
22. Взаимодействие пропена и бромоводорода
1) протекает по правилу ковникова
2) приводит к образованию 2-бромпропана
3) относится к реакциям замещения
4) не сопровождается разрывом 
-связи
5) осуществляется по ионному механизму
6) приводит к образованию 2,2-дибромпропана
23. Для циклогексана справедливы утверждения:
1) при нагревании с катализатором образует толуол
2) реакция гидрирования протекает довольно легко
3) взаимодействует с бромом
4) все атомы углерода находятся в состоянии sp3-гибридизации
5) является изомером гексана
6) молекула не является плоской
24. Реакция хлорирования этана протекает
1) по радикальному механизму
2) в одну стадию
3) с образованием различных хлорпроизводных
4) в темноте и без нагревания
5) с выделением теплоты
6) без изменения степеней окисления атомов углерода
25. Взаимодействие этилена и бромоводорода протекает
1) по цепному радикальному механизму
2) с промежуточным образованием частицы 
3) без катализатора
4) с разрывом 
-связи в молекуле этилена
5) с образованием дибромэтана
6) с образованием бромэтана
26. И для ацетилена, и для толуола характерна(-о):
1) реакция полимеризации
2) sp2-гибридизация атомов углерода в молекуле
3) окисление перманганатом калия
4) реакция галогенирования
5) наличие 
- и 
-связей в молекулах
6) высокая растворимость в воде
27. Реакция хлорирования метана протекает
1) по ионному механизму
2) в несколько стадий
3) с образованием различных хлорпроизводных
4) при условии яркого освещения в начале реакции
5) с поглощением энергии
6) в соответствии с правилом ковникова
28. Для бутина-1 справедливы утверждения:
1) молекула содержит одну 
-связь
2) способен к реакции гидрирования
3) взаимодействует с бромной водой
4) все атомы углерода находятся в состоянии sр2-гибридизации
5) является изомером дивинила
6) при гидратации в присутствии солей ртути (II) образует бутаналь
29. Для циклопентана справедливы утверждения:
1) является газообразным веществом
2) не вступает в реакцию разложения
3) взаимодействует с хлором
4) является изомером пентена-1
5) все атомы находятся в состоянии sp2-гибридизации
6) не растворим в воде
30. Взаимодействие пропена и бромоводорода протекает
1) по цепному радикальному механизму
2) с промежуточным образованием частицы 
3) по правилу ковникова
4) с разрывом 
-связи в молекуле пропена
5) с образованием дибромпропана
6) в присутствии катализатора
31. Бутан может вступать в реакции с
1) азотной кислотой
4) гидроксидом натрия
32. Взаимодействие пропена и хлороводорода
1) протекает по правилу ковникова
2) приводит к образованию 2-хлорпропана
3) относится к реакциям обмена
4) не сопровождается разрывом 
-связи
5) сопровождается образованием частицы 
6) приводит к образованию 1,2-дихлорпропана
33. Взаимодействие пропена и хлороводорода протекает
1) по цепному радикальному механизму
2) с промежуточным образованием частицы 
3) без катализатора
4) с разрывом 
-связи в молекуле пропена
5) с образованием дихлорпропана
6) с преимущественным образованием 1-хлорпропана
Читайте также:

