Взаимодействие марганцовки с хлором
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 - амфотерные, +6, +7 - кислотные.

Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 - пиролюзит
- MnO(OH) - бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 - браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
-
Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.

При нагревании марганец вытесняет водород из воды.
Реакции с кислотами
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.

Соединения марганца II
Для соединений марганца II характерны основные свойства. Оксид марганца II может быть получен разложением карбоната марганца, либо восстановлением оксида марганца IV до оксида марганца II.
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца II.
Соединения марганца II на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца IV.
Оксид и гидроксид марганца II проявляют основные свойства. При реакции с кислотами дает соответствующие соли.

Соли марганца II получается при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца IV проявляют амфотерный характер. Оксид марганца IV можно получить разложением нитрата марганца II.

В реакциях с щелочами марганец переходит в СО +6, в кислой среде - принимает СО +2.

Соединения марганца VI - MnO3, H2MnO4 - неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли - манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Соединения марганца VII - неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 - проявляют кислотные свойства. Соли марганцовой кислоты - перманганаты.
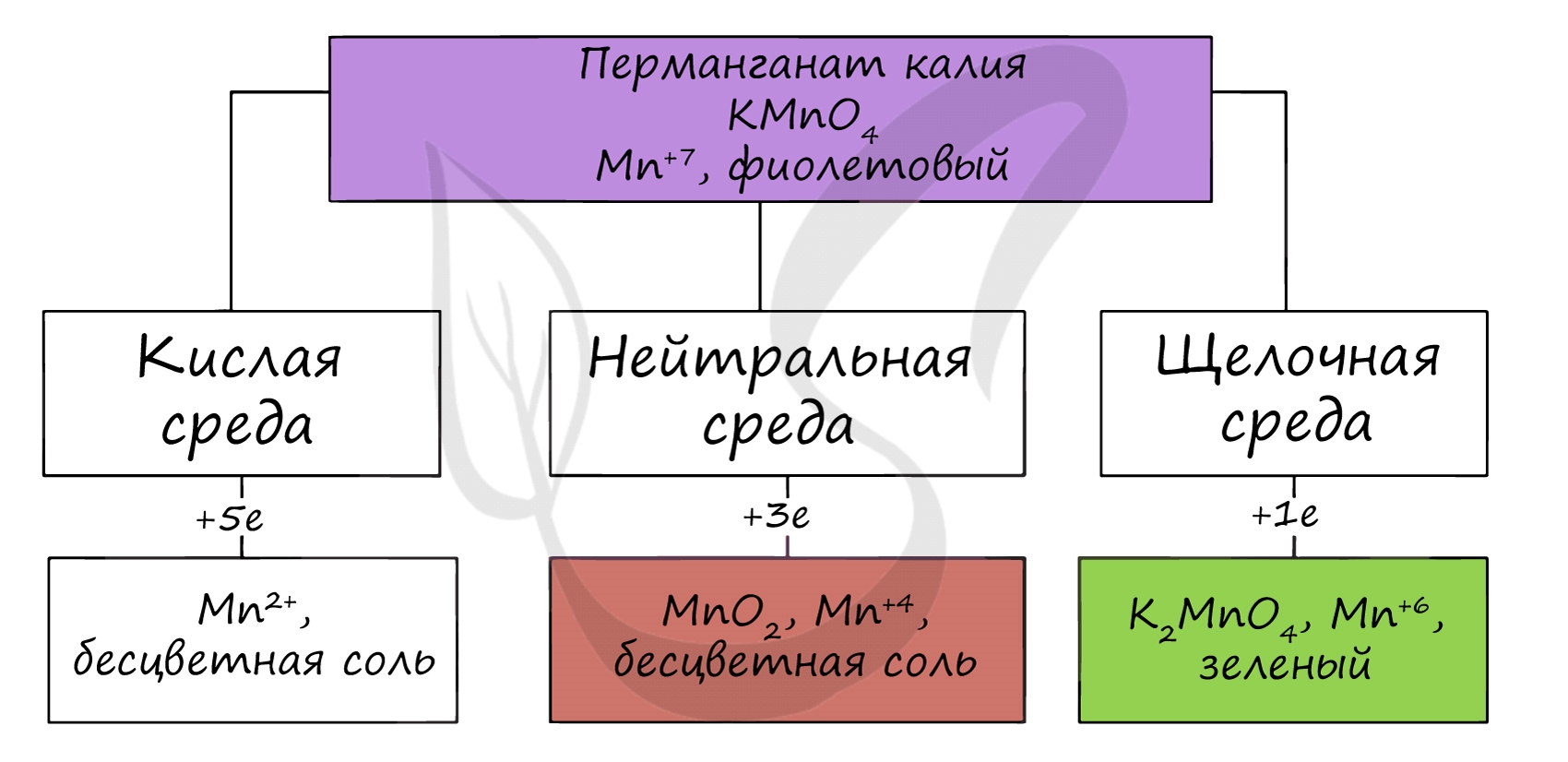
В различных средах - кислотной, нейтральной и щелочной - марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца VII получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца VII (кислотного оксида) в щелочи образуются соли марганцовой кислоты - перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца II.
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту - марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.

При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) - Mn 2+ , в щелочной - Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke - зубец. С древнейших времен известен сплав меди с цинком - латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS - цинковая обманка, сфалерит
- ZnO - цинкит
- ZnCO3 - симсонит, цинковый шпат
- 2ZnO*SiO2*H2O - гемиморфит

Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
-
Реакции с неметаллами (и аммиаком :)
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Реакции с кислотами
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка II
Эти соединения обладают амфотерными свойствами. Оксид цинка II можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка II проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка II может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка II получается в ходе реакций между растворимыми солями цинка и щелочами.

Гидроксид цинка II обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.

-
Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Реакции с кислотами
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.

С органическими веществами
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра - аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Марганец — элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Аr]Зd 5 4s 2 ; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
Шкала степеней окисления марганца:
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl). Соединения Мn ‖‖ — оксид и гидроксид — проявляют основные свойства, соединения Мn ‖‖‖ и Мn IV — амфотерные свойства, для соединений Мn VI и Мn VII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе — четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Мn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
Mn→(O2, до450 o C) MnO2 →( O2, до 800 o C) Mn2O3
Mn→MnO+( Mn II Mn2 II )O4 “окалина “ ( O2, выше 800 o C)
Mn+Cl2→MnCl2 , (200 o C) Mn+S→ MnS (до1580 o C)
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н2SO4 вытесняет водород:
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Получение марганца в промышленности — восстановление пиролюзита МnO2 или гаусманита (Мn II Mn II I )O4 коксом или алюминием:
3(Мn II Mn III )O4 + 8Аl = 9Мn + 4А12O3(700-900 °С)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца (П), например:
Промышленно важен сплав с железом — ферромарганец (> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) МnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Уравнения важнейших реакций:
В природе самое распространенное соединение марганца — минерал пиролюзит
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением О2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO4 2- . Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
Получение: сплавление МnO2 с сильными окислителями (KNO3, КClO3).
Перманганат калия КМnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону МnO4), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до Мn II , в нейтральной среде – до Mn IV в сильнощелочной среде — до Мn VI

Качественная реакция на ион МnO4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
МnO4 — + 8Н + + 5Fе 2+ = Мn 2+ + 5Fе 3+ + 4Н2O
Что такое марганец?
Марганец – элемент таблицы Менделеева . Принадлежит VII группе. Расположен в четвертом периоде между хромом и железом. Имеет 25-й атомный номер. Формула марганца [Ar] 3d 5 4s 2 .

Был открыт в 1774 году. Атом марганца весит 54,938045. Содержит изотоп 55Mn, а природный марганец состоит полностью из него. Степень окисления металла колеблется от 2 до 7. Электроотрицательность Mn — 1,55. Переходный материал.
Соединения марганец 2 образуют оксид и диоксид. Проявляют основные свойства элемента. Образования марганец 3 и марганец 4 отличаются амфотерными свойствами. В комбинациях металла 6 и 7 лидируют свойства кислоты марганца. Элемент № 25 образует многочисленные виды солей и различные бинарные соединения.
Добыча марганца ведется повсеместно как в России, так и в ближнем зарубежье. На Украине существует особый Марганец – город, расположенный на многочисленных образованиях марганцевой руды.
Описание и свойства марганца
Серебристо-белый цвет с легким серым налетом выделяет марганец. Состав элемента имеет примесь углерода, которая дает ему серебристо-белый цвет. Он превосходит железо по твердости и хрупкости. В виде мелких абразивов пирофорен.

При взаимодействии с воздушной средой происходит окисление марганца. Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца.
Плотность — 7200 кг/м3, t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.

При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород. При соединении марганца с кислородом образуется оксид марганца. Выделяют семь его групп:
Оксид марганца (II). Монооксид. Не взаимодействует с водой. Легко окисляется, образуя хрупкую корку. При нагревании с водородом и металлами активной группы восстанавливается до марганца. Имеет зеленый и серо-зеленый цвет кристаллов. Полупроводник.
Оксид марганца (II,III). Кристаллы коричневого – черного цвета Mn3O4. Парамагнетик. В естественной среде встречается как минерал гаусманит.
Оксид марганца (II,IV). Соединение неорганического характера Mn5O8. Может рассматриваться как ортоманганит марганца. Не растворяется в H2O.

Оксид марганца (III).Кристаллы коричневого – черного цвета Mn2O3. Не вступают в реакцию с водой. Встречается в природной среде в минералах браунит, курнакит и биксбиит.
Оксид марганца (IV) или диоксид марганца MnO2. Нерастворимый в воде порошок темно-коричневого оттенка. Устойчивое образование марганца. Содержится в минерале пиролюзит. Поглощает хлор и соли тяжелых металлов.
Оксид марганца (VI) . Темно-красный аморфный элемент. Вступает в реакцию с водой. Полностью разлагается при нагревании. Щелочные реакции образуют солевые отложения.
Оксид марганца (VII). Маслянистая зеленовато-бурая жидкость Mn2O7. Сильный окислитель. При контакте с горючими смесями, мгновенно воспламеняет их. Может взорваться от толчка, резкой и яркой вспышки света, взаимодействия с органическими компонентами. При взаимодействии с Н2O образует марганцовую кислоту.

Соли марганца являются катализаторами окислительных процессов, происходящих с участием кислорода. Они применяются в сиккативах. Льняное масло с добавлением такого сиккатива именуется олифой.
Применение марганца
Mn широко используют в черной металлургии. Добавляют сплав железо марганец (ферромарганец). Доля марганца в нем равна 70-80%, углерода 0,5-7 %, остальная часть приходится на железо и посторонние примеси. Элемент №25 в сталеплавлении соединяет кислород и серу.
Используются смеси хром — марганец, вольфрам -марганец, кремний-марганец. В производстве стали марганцу альтернативной замены нет.
Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец. Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %.
В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал характеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.

Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец. Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых кристаллов . Растворяется в водной среде, окрашивая её в фиолетовый цвет.
Является сильным окислителем. Антисептик, обладает противомикробными свойствами. Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета.
При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием.
Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.

Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, меди и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани.
Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность. Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Минералы, незаменимые для человека, такие как кальций, магний, марганец, медь, калий, железо добавляют в витаминно-минеральные комплексы для устранения витаминного дефицита.
Также микроэлементы цинк, марганец и железо играют огромную роль в жизни растений. Входят в состав фосфорных и минеральных удобрений.
Цена марганца
Металлический марганец содержит до 95 % чистого марганца. Его применяют в сталелитейной металлургической промышленности. Удаляет из стали ненужные примеси и наделяет её легирующими качествами.
Ферромарганец используется для раскисления сплава во время процесса плавления, путем удаления из него кислорода. Связывает частицы серы между собой, улучшая качественные характеристики стали. Марганец упрочняет материал, делает его более износостойким.
Применяют металл при создании шаровых мельниц, землеройных и камнедробильных машин, броневых элементов. Из сплава мангадин изготавливают реостаты. Элемент № 25 добавляют в бронзу и латунь .

Большой процент диоксида марганца потребляется для создания гальванических элементов. Сплав с добавлением Mn задействуется в тонком органическом и промышленном синтезе. Соединения MnO2 и KMnO4 выступают окислителями.
Марганец – вещество незаменимое в черной металлургии. Уникален по своим физическим и химическим характеристикам. Марганец купить можно в специализированных торговых точках. Пять килограмм металла стоит порядка 150 рублей, а тонна, в зависимости вида соединения, стоит около 100-200 тысяч рублей.
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Марганец.Металлический марганец реагирует с кислотами, образуя соли марганца(II):
В различных соединениях марганец проявляет степени окисления 2+, 4+, 6+ и 7+. Чем выше степень окисления, тем более ковалентный характер имеют соответствующие соединения. С возрастанием степени окисления марганца увеличивается также кислотность его оксидов.
При нагревании марганец взаимодействует с кислородом, галогенами, углеродом, бором, кремнием, серой. При взаимодействии марганца с кислородом образуются смешанные оксиды:
Диспергированный марганец при нагревании реагирует с водой:
Одной из особенностей марганца является способность поглощать кислород.
Марганец пассивируется в обычных условиях концентрированными кислотами окислителями, хотя при нагревании реакция идет:
При взаимодействии с разбавленными кислотами выделяется водород:
На самом деле в растворе существует аквакомплекс [Mn(H2O)6]Cl2.
Марганец взаимодействует со щелочами в присутствие окислителя:
Оксид марганца (II).Оксид марганца (II) можно получить восстановление оксида марганца (IV):
Этот оксид обладает основными свойствами. Так, он не реагирует с водой, а при взаимодействии с кислотами образуются соли марганца (II):
Гидроксид марганца (II).При взаимодействии солей марганца (II) со щелочами выпадает белый, нерастворимый осадок Mn(OH)2:
При взаимодействии с киcлотами от дает соли марганца (II):
При стоянии на воздухе гидроксид марганца (II) переходит в оксогидроксид, который далее окисляется до оксида марганца (IV):
Аналогичная реакция протекает с сульфидом марганца MnS, но с выпадением осадка серы.
Соли марганца (II).Марганец (II) при взаимодействии с сильными окислителями переходит в различные степени окисления в зависимости от реакции среды:
что можно проиллюстрировать следующими примерами:
К трудно растворимым солям марганца (II) относятся фторид, карбонат и фосфат.
Оксид марганца (IV).Наиболее важным соединением марганца(IV) является его оксид MnO2. Это соединение коричнево-черного цвета не растворяется в воде. Оксид марганца (IV) — сильный окислитель, который, например, окисляет концентрированную соляную кислоту до хлора:
Эта реакция часто используется для получения хлора в лаборатории.
Этот оксид обладает амфотерными свойствами, равно как и оксогидроксид MnO(OH)2 и гидроксид Mn(OH)4 марганца (IV):
Манганат калия.Соединения марганца (VI) малоустойчивы, однако наиболее известное соединение — манганат калия K2MnО4 — устойчив в щелочной среде. Он образуется при восстановлении перманганата калия в щелочной среде, например:
Вообще для Mn 6+ характерны следующие продукты окислительно-восстановительных реакций:
Перманганат калия.Высшую степень окисления 7+ марганец имеет в кислотном оксиде Мn2О7 и перманганате калия КмnO4. Последнее вещество — кристаллы фиолетового цвета, хорошо растворимые в воде.
Перманганат калия — сильнейший окислитель. В кислой среде он восстанавливается до ионов Мn 2+ :
в щелочнойсреде — до К2МnO4 (см. выше), а в нейтральнойсреде — до MnO2:
| | | следующая лекция ==> |
| Хром образует три оксида: СrО, Сr2O3 и СrO3 | | |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет

Марганец – это неизменный спутник железа в воде скважин. Как правило, он встречается железосодержащей воде, источником которой являются водоемы, речные, морские, подземные воды.
Как марганец поступает в воду?
Природный марганец поступает в поверхностные воды в процессе выщелачивания минералов, включающих марганец (манганитов, пиролюзитов и прочих), а также в результате разложения растений и водных организмов. В водоемы соединения марганца попадают со сточными водами предприятий химической промышленности и металлургических заводов. Содержание марганца в речных водах колеблется в пределах 1-160 мкг/куб.дм, в морских водах – до 2 мкг/куб.дм, в подземных водах – от сотен до тысяч мкг/куб.дм.
В природных водах миграция марганца проистекает в разных формах: комплексных соединений с сульфатами и бикарбонатами, коллоидной, ионной – в поверхностных водах осуществляется переход в высоковалентные оксиды, выпадающие в осадок, комплексных соединений с органическими веществами (органическими кислотами, аминами, гумусовыми веществами и аминокислотами), сорбированных соединений - марганецсодержащих взвесей минералов, вымытых водами.
Баланс и формы содержания марганца в воде определяют температурой, содержанием кислорода, pH, поглощением, выделением его водными организмами и подземными стоками.
Для марганца свойственны сезонные колебания концентрации. Существует множество факторов, влияющих на уровень свободного марганца в растворе – присутствие фотосинтезирующих организмов, связь озер и рек с водохранилищами, разложение биомассы (мертвые растения и организмы), аэробные условия.
Чем опасен марганец?
О повышенных концентрациях марганца в воде свидетельствуют черные пятна и разводы на бытовых приборах и сантехнике. Марганец крайне токсичный элемент, оказывающий губительное воздействие на нервную и кровеносную системы. Избыток металла может проникать в почки, железы внутренней секреции, тонкий кишечник, кости, головной мозг и провоцировать нарушение работы эндокринной системы, поджелудочной железы, а также увеличивать риски развития онкологических заболеваний и болезни Паркинсона. Клиническое проявление хронического отравления марганцем может иметь легочную и неврологическую формы.
При воздействии на нервную систему различают три стадии заболевания:
- Для первой стадии характерно преобладание функциональных нарушений нервной системы, выражающихся в повышенной утомляемости, сонливости, наличии парестезии и постепенного снижения силы в конечностях, симптомах вегетативной дистонии, повышенного слюнотечения и потливости. В ходе объективного обследования могут быть выявлены мышечная гипотония, легкая гипомимия (ослабление выразительных движений лицевой мускулатуры), оживление сухожильных рефлексов, периферические вегетативные нарушения, гипестезия дистального типа. Типичным для этой стадии интоксикации считается изменения психической деятельности: сужение круга интересов, снижение активности, скудость жалоб, ослабление ассоциативных процессов, снижение памяти и критики к болезни. Вслед за изменениями психики, как правило, наблюдаются очаговые неврологические симптомы интоксикации, но в виду снижения критики больных к собственному состоянию такие изменения зачастую своевременно не диагностируются. При продолжении контакта с повышенными концентрациями марганца признаки интоксикации могут нарастать, и процесс рискует приобрести необратимый органический характер.
- Для второй стадии характерно нарастание симптомов токсической энцефалопатии, таких как мнестико-интеллектуальный дефект, выраженный астенический синдром, сонливость, апатия, неврологические признаки экстрапирамидной недостаточности: брадикинезия, гипомимия, мышечная дистония с повышением тонуса отдельных групп мышц, про- и ретропульсия. Усугубляются признаки полиневрита, слабость, парастезии конечностей. Также наблюдается угнетение функции надпочечников, гонад и других эндокринных желез. Даже прекращение контакта с марганцем не останавливает развитие этого процесса, который прогрессирует еще в течение нескольких лет. На этой стадии полное восстановление здоровья в большинстве случаев не наблюдается.
- Для третьей стадии интоксикации, так называемого марганцевого паркинсонизма, показательны грубые расстройства двигательной сферы: дизартрия, маскообразность лица, монотонная речь, нарушение письма значительная гипокинезия, спастико-паретическая походка, грубые про- и ретропульсии, парез стоп. Наблюдается повышение тонуса мышц по экстрапирамидному типу, в подавляющем большинстве случаев в ногах. Иногда отмечается гипотония или дистония мышц, полиневритический тип гипестезии. Также характерные различные расстройства психики: больные благодушны, эйфоричны или апатичны. Снижена или отсутствует критика к собственной болезни, могут иметь место насильственные эмоции (смех или плач). Мнестико-интеллектуальный дефект выражен в значительной степени (затруднение в определении времени, забывчивость, ухудшение социальной, в том числе профессиональной, деятельности).
В виду возможности наступления таких тяжелых последствий важно своевременно выявить наличие избытка марганца в воде, которую человек принимает в пищу и использует для принятия водных процедур, чистки зубов и т.д.
Предельно-допустимые концентрации марганца

Согласно данным Всемирной организации здравоохранения с 1998 года определены нормы предельно-допустимого содержания марганца в водопроводной воде. Эта цифра составляет 0.05 мг/л. В то время как в США показатели достигают 0.5 мг/л. В соответствии с российскими санитарными нормами уровень предельно-допустимого содержания марганца в воде хозяйственно-питьевого назначения не должен превышать 0,1 мг/л.
Избыточное содержание марганца снижает органолептические свойства воды. Уровень содержания выше 0.1 мг/л провоцирует появление нежелательного привкуса воды и появление пятен на санитарно- технических изделиях. Накапливаясь в водопроводных трубах, марганец провоцирует появление черного осадка и, как следствие, мутной воды.
Методы устранения марганца
Если наличие железа в воде, как правило, подразумевает и наличие марганца, то сам марганец может содержаться в воде и при отсутствии в ней избытка железа. При этом он не меняет вкус, цвет и запах воды. В отдельных случаях, при соприкосновении марганца с чем-либо, остаются черные или коричневые следы даже при условии его минимальных концентраций в воде (в количестве 0.05 мг/л).
В воде, добываемой из подземных скважин и естественных водоемов, марганец находится в двухвалентной форме. Это частично растворимая форма, которая выпадает в осадок исключительно при условии сильного нагревания раствора. Для осуществления очистки воды от марганца нужно перевести ионы марганца в трех-, или четырехвалентную форму. В ней марганец образует соли кислот, гидроксиды, нерастворимые оксиды (в зависимости от того реагента, с помощью которого производится осаждение марганца после окисления).
В общей сложности процессы очистки воды заключаются в окислении двухвалентного марганца до трех-, четырехвалентного. После этого происходит реакция четырехвалентного марганца с кислородом или другим веществом, с которым образуется нерастворимый осадок. А осадок уже фильтруется механическим способом.
Аэрация с последующей фильтрацией
Аэрация в процессе очистке воды от марганца осуществляется аналогично безреагентному обезжелезиванию воды: применяется вакуумно-эжекционный аппарат, с помощью которого воду насыщают кислородом, способным окислять марганец до необходимой валентности, а далее фильтруют с помощью механических фильтров (песка и прочих).

Такой способ очистки воды считается наиболее экономичным. Однако применять его во всех случаях невозможно, потому как для осуществления реакции окисления марганца кислородом воздуха требуется соблюсти некоторые условия.
Данный метод очистки актуален при перманганатной окисляемости исходной воды до 9.5 мг/л. Обязательным является присутствие в воде двухвалентного железа. В процессе его окисления образуется гидроксид железа, который адсорбирует двухвалентный марганец и каталитически его окисляет. Соотношение концентраций [Fe2+] / [Mn2+] должно быть не менее 7/1.
Каталитическое окисление
В процессе очистки воды от марганца активно применяются каталитические процессы. С помощью насоса дозатора на поверхности фильтрующего материала образуется слой гидроксида четырехвалентного марганца, способного окислить двухвалентный оксид марганца до трехвалентной формы. Трехвалентная форма оксида окисляется растворенным кислородом воздуха до нерастворимой формы, при условии высоких концентраций в том числе.
Обратный осмос
Для удаления марганца из воды используют такие методы как очистка воды обратным осмосом и введение реагентов окислителей. Этот метод применяется при чрезвычайно высокой концентрации содержания марганца в исходной воде. В качестве реагента используют сильные окислители: хлор, его диоксид, гипохлорит натрия и озон.
Деманганация перманганатом калия
Данный метод применяется как для подземных, так и для поверхностных вод. Введение в воду перманганата калия провоцирует окисление растворенного марганца с образованием малорастворимого оксида марганца в соответствии со следующим уравнением:
3 Mn2+ + 2 KMnO4 + 2 H2O = 5 MnO2↓ + 4 H+ (1)
Осажденный оксид марганца (в виде хлопьев) отличается высокой развитой удельной поверхностью, приблизительно 300 кв.м на 1 г осадка. Это свидетельствует о его высоких сорбционных свойствах. Данный осадок является отличным катализатором, так как при его наличии возможна деманганация при показателе pH 8.5. Для избавления от 1 мг двухвалентного марганца потребуется 1.92 м перманганата калия. Такая пропорция предполагает окисление 97% двухвалентного марганца.
Следующим этапом очистки воды является введение коагулянта для выведения продуктов окисления и элементов, присутствующих в воде в виде взвеси. Вода после коагуляции фильтруется с использованием песчаного наполнителя. Кроме того может применяться ультрафильтрующее оборудование.
Введение реагентов-окислителей
Скорость окисления марганца озоном, гипохлоритом натрия, хлором, диоксидом хлора зависит от показателя pH. При добавлении хлора или гипохлорита натрия полная окислительная реакция наблюдается при pH от 8.0-8.5, при условии длительности взаимодействия между окислителем и водой 60-90 минут. Зачастую исходную воду необходимо подщелачивать. Такая необходимость возникает, когда в качестве окислителя используется кислород и pH не превышает 7.
Теоретически для окисления двухвалентного марганца до четырехвалентного необходимо использовать 1.3 мг реагента на 1 мг марганца. На практике дозы, как правило, выше.
Более эффективно применять диоксид хлора или озон. В таком случае окисление марганца займет 10-15 минут (при условии параметра pH равного 6.5-7.0). Согласно стехиометрии доля озона должна составлять 1.45 мг (или диоксида хлора 1.35 мг) на 1 мг двухвалентного марганца. Важно учитывать, что при озонировании озон будет разлагаться оксидами марганца, поэтому его пропорция должна быть большей, чем в теоретическом расчете.
Ионный обмен
Для очистки воды данным образом производится водородное или натриевое катионирование. В процессе очистки вода обрабатывается в двух слоях ионообменного материала с целью более эффективного удаления всех растворенных солей. Одновременно и последовательно используется катионообменная смола с ионами водорода H+, а также, анионообменная смола с ионами гидроксила OH-. Учитывая тот факт, что все растворимые в воде соли состоят из анионов и катионов, смесь смол в очищаемой воде заменяет их на ионы гидроксила OH- и водорода H+. В итоге, в результате химической реакции положительные и отрицательные ионы объединяются и образуют молекулы воды, то есть происходит процесс обессоливания воды.
При подборе многокомпонентной сложной комбинации ионообменных смол, эффективной и приемлемой для качества воды с большим пределом параметров, такой метод является наиболее перспективным в борьбе с марганцем и железом.
Дистилляция
Данный метод предполагает выпаривание воды с последующей концентрацией пара. Температура кипения молекул воды составляет 100 градусов Цельсия. У других веществ – другие температуры кипения. Благодаря этой разнице извлекается вода. То, что закипает при меньшей температуре, испаряется первым, то, что при большей испаряется после выкипания большей части воды. В результате получается вода без примесей. Однако, такая технология является довольно энергоемкой.
Читайте также:

