Взаимодействие анилина с хлором
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора.
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях: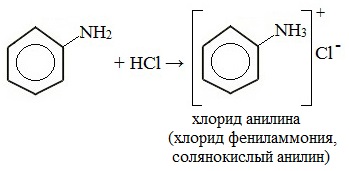
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
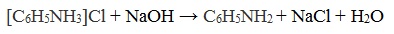
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
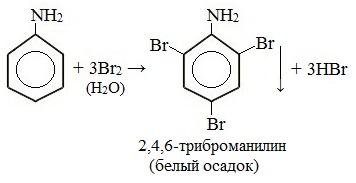
Качественная реакция на анилин!
2. Сульфирование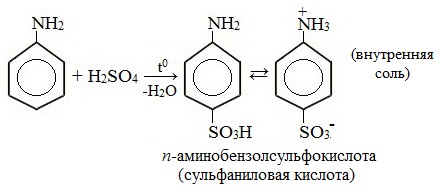
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.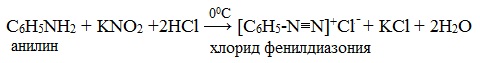
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
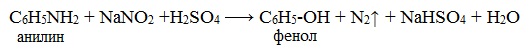
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Анилин (фениламин) C5H5NH2 – представитель класса ароматических аминов, в которых аминогруппа связана напрямую с бензольным кольцом.
Строение анилина.
Неподеленная пара атома азота реагирует с π-системой бензольного кольца. Взаимодействие можно представить так:

На атоме азота появляется частично положительный заряд, и основные свойства понижаются. А в бензольном кольце, наоборот, электронная плототность повышается, и наиболее сильно в орто- и пара- положениях:

Физические свойства анилина.
Анилин – бесцветная маслянистая жидкость, немного тяжелее воды, мало растворимы в воде, но хорошо – в этиловом спирте и в бензоле.
Получение анилина.
1. Основным способом получения анилина является процесс восстановления нитробензола. Для этого используют никелевый или медный катализатор при 250-350 °С:

В лаборатории используют восстановления цинка в кислой среде или алюминия в щелочной:


Химические свойства анилина.
Анилин является более слабым основанием, чем алифатические амины, т.к. электронная пара азота частично смещена в бензольное кольцо.
Анилин вступает в реакцию с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:

2. Анилин вступает в реакции электрофильного замещения в безольном кольце. Аминогруппа направляет замещение в орто- и пара- положения. Анилин легко бромируется, при этом выпадает белый осадок:

3. С концентрированной азотной кислотой анилин взаимодействует со взрывом. На время реакции можно защитить аминогруппу (превратить ее в амидную перед нитрованием), а после нитрования гидролизовать амид с образованием исходной аминогруппы:

3. При взаимодействии с азотистой кислотой образуются соли диазония:

4. Анилин легко подвергается окислению, темнее при хранении. Если на анилин действовать хлорной известью, то водный раствор анилин окрашивается в интенсивный фиолетовый цвет. Это реакция является качественной.
Применение анилина.
Анилин используют преимущественно для синтеза лекарственных средств и красителей:
История анилина началась в XIX веке. Сегодня продукция, изготовленная на его основе, прочно вошла в повседневный обиход. За это время учёные, эксперты производства всесторонне изучили свойства популярного реагента. Анилин (аминобензол, фениламин) является сильнодействующим ядом. Попадая в организм человека, он парализует систему доставки кислорода к тканям.
Давайте выясним, что такое анилин, историю его открытия, физические и химические свойства, где он сейчас применяется, какие симптомы указывают на острое и хроническое отравление им, о последствия интоксикации и мерах профилактики.
Что такое анилин
Это органическое соединение, которое относится к классу ароматических аминов. Впервые получил анилин немецкий химик Отто Унфердорбен в 1826 году, дав ему название кристаллин. Но на этом его история открытия не закончилась. На протяжении следующих 17 лет во время исследований разных учёных его получали ещё трижды.
- В 1834 г. немецкий химик-органик Фридлиб Фердинанд Рунгe выявил анилин в каменноугольной смоле, дав ему название кианол.
- В 1840 г. немецко-русский химик Юлий Фёдорович Фрицше получил это вещество путём нагревания индиго с раствором гидроксида калия, назвав его анилином.
- В 1842 г. русский химик-органик Николай Николаевич Зинин синтезировал анилин путём восстановления нитробензола действием сульфида аммония, назвав его бензидамом.
И лишь в 1843 г. немецкий химик-органик Август Вильгельм Гофман установил общность этих соединений, названных разными именами.
Способы получения
Основной способ синтеза анилина — восстановление нитробензола. Сегодня в качестве восстановителя обычно применяют водород. Это самый распространённый промышленный метод получения анилина.
Часть производственных процессов позволяет использовать в роли восстановителей другие вещества — металлы (железо, цинк, олово), соли (хлорид олова, сульфиды щелочных металлов), сероводород. Успешно применяются в производстве каталитический и электрохимический методы восстановления.
Физические и химические свойства
Формула анилина — C6H5NH2 содержит аминогруппу, поэтому вещество имеет второе название — фениламин. А также благодаря присутствию бензольной группы, он известен как аминобензол.
По своим физическим свойствам анилин — это бесцветная маслянистая жидкость, малорастворимая в воде. Имеет неприятный аммиачный запах. При горении образует яркое коптящее пламя. Температура кипения анилина составляет 184,4 °C. Это горючее вещество — при нагревании выше 70 °C могут образоваться взрывоопасные соединения. На воздухе анилин легко окисляется и приобретает красно-бурый цвет.
Благодаря химическим свойствам взаимодействует с сильными неорганическими кислотами (соляная, серная, фосфорная) и образует соли.
Применение
Анилин — это одно из первых органических соединений, полученных искусственным путём. Его открытие привело к созданию нескольких успешных отраслей.
Производственное использование анилина охватывает различные области — от получения ракетного топлива до изготовления крема для обуви.
Анилин и его соединения применяют в производстве:
- полиуретанов (конструкционные материалы, тепло- и звукоизоляция);
- ускорителей для вулканизации на основе натурального и синтетических каучуков (шины, резинотехнические изделия, резиновая обувь);
- красителей для тканей;
- эпоксидных полимеров;
- взрывчатых веществ;
- ингибиторов коррозии металлов;
- моторного топлива;
- смол, лаков.
Красители на основе анилина придают яркий цвет натуральным и синтетическим тканям, коже, шерсти, овчине. Однако существенным недостатком такого окрашивания является выгорание на солнце и низкая устойчивость к воздействию воды.
Анилин и его соединения являются сырьём для изготовления сложных промежуточных продуктов. Кроме основных областей применения, анилин используют при производстве гербицидов, пестицидов, фунгицидов, типографской краски, чернил, реактивов для фотографии, духов.
Анилин является сырьём для фармакологической промышленности. Лекарства, изготовленные с его применением, оказывают следующее действие:
- обезболивающее, жаропонижающее — анальгин, бутадион;
- антимикробное — этазол, сульфален, сульгин, сульфаниламид, бисептол;
- нейролептическое — аминазин, пропазин.
Производные анилина входят в состав медицинских красителей. Метиленовый синий оказывает антисептическое, анальгезирующее действие. Генцианвиолет применяется как антибактериальное, противоглистное, местное противовоспалительное средство. Фуксин используют для местного лечения гнойничковых и грибковых заболеваний кожи, себореи. Красители применяют в бактериологических исследованиях для окраски микроорганизмов.
Действие на организм человека
Анилин является сильным ядом, высокотоксичным для человека. Чаще всего интоксикация развивается при поступлении вещества через дыхательные пути, неповреждённую кожу и слизистые оболочки — ротовую полость, глаза. Небольшое количество может проникать через желудок.
Выводится вещество из организма в основном через почки. Оставшаяся часть выходит через дыхательные пути.
Анилин является гемотоксином, то есть наносящим вред крови человека. Механизм анилинового отравления состоит в образовании метгемоглобина, разрушении эритроцитов. Блокируется транспорт кислорода, что ведёт к поражению центральной нервной системы.
Кроме инактивации гемоглобина, токсичность анилина проявляется в развитии острой дыхательной, сердечно-сосудистой, почечной, печёночной недостаточности.
Накапливается анилин в печени и жировой ткани, создавая депо. Горячий душ, сауна, баня, приём алкоголя могут спровоцировать повторный выход токсина из депо в кровь, вызвав ухудшение состояния даже спустя две недели.
Отравление анилином
При кипении анилин образует пары, которые тяжелее воздуха. В производстве красителей, высока опасность отравления при соприкосновении с его растворами.
- непосредственный контакт с веществами в процессе их производства, хранения и применения;
- передозировка лекарственных препаратов;
- суицидальные попытки (нейролептиками);
- нарушения требований техники безопасности на производстве или в домашних условиях;
- аварии на промышленных объектах;
- загрязнение атмосферы ядовитыми парами, водоёмов стоками.
Отравление анилиновыми красителями может произойти в домашних условиях. Их используют для изменения цвета тканей, нанесения рисунков. Концентрация, состав красок рассчитаны на применение вне производственных объектов. Перед началом работы необходимо внимательно прочитать инструкцию. Соблюдение её пунктов обезопасит от случайной интоксикации.
Симптомы интоксикации лёгкой степени:

- жалобы на головную боль, слабость, недомогание, диспепсию в виде тошноты, рвоты;
- после приёма внутрь — боль в подложечной области;
- при осмотре выявляется синюшность губ, носогубного треугольника, ушных раковин, ногтей — акроцианоз.
Симптомы отравления средней степени:
- жалобы на сильную головную боль, тяжесть и болезненность в правом подреберье;
- изменения поведения — беспокойство, раздражительность, двигательное возбуждение;
- при осмотре — желтушность склер, выраженный акроцианоз;
- двигательные нарушения в виде неустойчивости при ходьбе;
- затруднение дыхания (одышка), усиленное отделение мокроты;
- учащение пульса.
Симптомы острого отравления анилином тяжёлой степени:
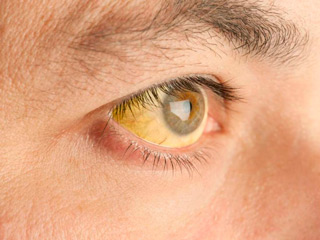
- синюшность кожного покрова, слизистых;
- желтушность кожи, склер;
- угнетение сознания до комы;
- развитие судорожного синдрома;
- одышка, учащение или урежение, патологический характер дыхательных движений (поверхностное, неритмичное);
- снижение артериального давления, учащение пульса, невозможность его определить на лучевой артерии;
- отсутствие мочеиспускания.
Синюшность при отравлении анилином имеет характерный оттенок. Его придаёт коричневый цвет метгемоглобина и красно-синеватый тон поражённого эритроцита. Кожа, губы приобретают сине-чёрный цвет.
На фоне нарастающей сердечно-сосудистой и дыхательной недостаточности наступает остановка кровообращения.

Клинические проявления хронической интоксикации анилином развиваются постепенно и являются неспецифичными по своему характеру. Человека беспокоят головные боли, слабость, быстрое утомление, расстройства сна. Близкие, коллеги отмечают его возросшую раздражительность, снижение внимания, памяти. У пострадавшего наблюдаются симптомы поражения желудочно-кишечного тракта, печени, почек.
Появляются шаткость походки, мышечные подёргивания. Характерны признаки расстройства зрительного аппарата — утомляемость глаз, светобоязнь, снижение остроты зрения. Возможно, образование сыпи на коже.
Симптомы не угрожают жизни, но при отсутствии лечения приводят к глубокой инвалидизации.
После прекращения вдыхания анилина или контакта с реагентами его содержащими, метгемоглобин в крови начинает распадаться. Восстанавливается транспорт кислорода к тканям, устраняется причина интоксикации.
При остром отравлении анилином, важна правильная последовательность оказания первой помощи. Её необходимо начинать с прекращения поступления яда в организм:
- устранить источник;
- проветрить помещение;
- снять загрязнённую одежду;
- если состояние пострадавшего позволяет — перенести его в безопасное место.
Мероприятия первой помощи при остром отравлении анилином:
При суицидальных попытках с использованием нейролептиков, содержащих анилин, промывание желудка можно проводить только в случае ясного сознания и удовлетворительного состояния. То есть, практически сразу после приёма препаратов. При их всасывании снижается артериальное давление, угнетается кашлевой рефлекс, сознание. Манипуляция может осложниться аспирацией желудочного содержимого (затекание в дыхательные пути), развитием острой сердечной и сосудистой недостаточности.
Диагностика отравления анилином проводится на основании сбора анамнеза, клинического обследования, результатов лабораторного и аппаратного исследования.
Кроме стандартных анализов, проверяют уровень фракции метгемоглобина (FMetHb) в сыворотке крови. Он присутствует в здоровом организме как продукт метаболизма, в количестве не более 1,0–1,5% от общего гемоглобина (Hb). При отравлениях симптомы появляются при значениях больше 3% FMetHb.

Принципы лечения острого отравления анилином, следующие:
- внутривенное введение антидота — метиленовый синий, аскорбиновая кислота, тиосульфат натрия;
- инфузионная терапия солевыми растворами;
- диуретики (мочегонные препараты);
- коррекция функции дыхания — в зависимости от показаний перевод на искусственную вентиляцию лёгких;
- методы эфферентной детоксикации — гемодиализ, гемосорбция;
- гипербарическая оксигенация для восстановления транспорта кислорода;
- мониторинг артериального давления, частоты сердечных сокращений, ЭКГ, температуры тела, диуреза, лабораторных анализов.
Интенсивная терапия проводится в условиях отделения анестезиологии-реанимации.
При подозрении на хроническое отравление анилином необходимо обратиться к врачу и пройти обследование. Анализы фракций гемоглобина доступны в амбулаторных условиях.
Последствия отравления
Интоксикация анилином опасна не только в острой, но и хронической форме. При длительном его воздействии на организм человека развиваются:
- осложнения со стороны центральной и периферической нервной системы, печени, почек, селезёнки, сердца, лёгких, желудочно-кишечного тракта;
- нарушения функций зрительного аппарата;
- дерматиты;
- анемия.
Канцерогенность анилина и его соединений для человека не доказана. Такие результаты получены только при исследованиях на лабораторных животных.
Симптомы анилиновой интоксикации неспецифичны. Избежать последствий хронического отравления поможет регулярное прохождение медицинских осмотров, предусмотренное федеральным законодательством.
Профилактика отравлений
Анилин относится к веществам II класса опасности — ГОСТ 12.1.005. Предельно допустимая концентрация (ПДК) в воздухе производственных помещений — 0,1 мг/м 3 .
Техника безопасности при работе с анилином предусматривает:

- использование средств индивидуальной защиты — костюма, перчаток, маски, очков;
- оборудование производственных помещений приточно-вытяжной вентиляцией;
- регулярное забор анализов воздуха в рабочих зонах;
- запрещение курения и питания в рабочих помещениях;
- соблюдение требований пожарной и взрывоопасности.
При сжигании анилина в воздух попадают токсичные или едкие пары — аммиак, оксиды азота, а также горючие пары, которые тоже могут вызвать отравление.
Работая в домашних условиях с анилиновыми красителями, необходимо следить за самочувствием. При появлении тревожных симптомов важно сразу же проветрить помещение или покинуть его.
Подводим итоги. Анилин — это органическое соединение, нашедшее применение в разных сферах промышленности. В лечебных дозах он входит в состав лекарственных препаратов. История использования анилина неразрывно связана с изучением признаков отравления этим сильнодействующим ядом. Чаще всего он попадает в организм через дыхательные пути. При своевременном прекращении контакта с токсином прогноз заболевания значительно улучшается. Избежать отравления можно, предприняв несложные меры безопасности.
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н + .
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой не взаимодействуют.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
2. Взаимодействие с азотистой кислотой
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Читайте также:

