Высокая митотическая активность опухоли что это

Лечение распространенных рецидивных и метастатических злокачественных опухолей остается одной из нерешенных проблем современной онкологии [4,5]. Причиной смерти таких больных, как правило, является прогрессирование опухолевого процесса в виде распространения и роста рецидивных и метастатических очагов. Основным методом лечения ЗНО был и остается хирургический компонент. Однако в тех случаях, когда вторичный опухолевый очаг невозможно или нецелесообразно удалить хирургическим путем, в онкологической практике применяют химиотерапевтическое лечение. Различные виды опухолей имеют различную степень чувствительности к цитостатическим препаратам [8]. Согласно современной классификации в зависимости от их чувствительности к противоопухолевой терапии различают три основных типа опухолей. Больных с такими опухолями, как лимфогранулематоз, семиномы, можно излечить при помощи химиотерапии. Другие опухоли не чувствительны к лечению цитостатиками (рак почки, рак щитовидной железы). Самая большая и самая распространенная группа опухолей обладает относительной чувствительностью к химиотерапевтическому лечению (рак молочной железы (РМЖ), меланомы кожи, колоректальный рак (КРР), саркомы мягкой ткани (СМТ), плоскоклеточный рак головы и шеи (ПРГШ)) [6]. Рецидивирование и метастазирование опухолей этого вида предопределяет неблагоприятный прогноз течения заболевания, и задачи вылечить больного, как правило, не ставится. Основная цель назначения лечения этих больных – продление жизни пациента. Срок дожития пациента является основным прогностическим фактором для пациентов с распространенным процессом. В свою очередь, срок дожития зависит от количества опухолевых очагов, их совокупной массы и их локализации. А также, по нашему мнению, в первую очередь, от скорости роста этих очагов.
Известно, что точка приложения любого из цитостатиков – пролиферативно-активная опухолевая клетка, находящаяся в процессе деления. Клетки опухоли, находящиеся в состоянии пролиферативного покоя, не чувствительны к цитостатикам. В свою очередь, опухолевый рост обусловлен увеличением числа клеток паренхимы вследствие их митотического деления. Одновременно с увеличением числа клеток в опухоли идут естественные процессы их убыли вследствие процессов некроза, апоптоза, миграции клеток в кроветворное и лимфатическое русло [1, 2, 3]. Совокупность всех этих процессов именуется фактором клеточных потерь (ФКП) [5]. Скорость роста опухолевых очагов определяется соотношением увеличения числа клеток (митотической активности опухоли (МАО)) и ФКП [7]. Чем быстрее скорость роста опухоли, тем быстрее опухолевый очаг достигнет величины, не совместимой с жизнедеятельностью организма. Медленно растущие опухоли будут определять более продолжительные сроки дожития пациентов с распространенным опухолевым процессом.
Мы определили две основные цели настоящей работы:
● определение влияния кинетических параметров роста рецидивных и метастатических опухолей на динамику прогрессирования онкологического заболевания.
● Оценка влияния, которое оказывает лечение цитостатиками на скорость роста рецидивных и метастатических опухолей.
К кинетическим параметрам в нашей работе были отнесены: митотическая активность опухоли (МАО), фактор клеточных потерь ФКП, а также скорость роста опухоли. Учитывая экспоненциальный характер роста опухолей за счет удвоения опухолевых клеток, скорость роста опухолей определялась как ВУО (время удвоения опухоли).
Для достижения указанных целей были поставлены следующие задачи:
1. Разработать математическую модель опухолевого роста, в которой бы учитывалось влияние структурных параметров на кинетику роста опухоли.
2. На основе указанной модели разработать компьютерную программу, позволяющую рассчитывать ФКП и скорость опухолевого роста для конкретных клинических случаев.
3. Исследовать кинетические свойства рецидивных и метастатических опухолей.
4. Оценить влияние кинетических параметров роста исследуемых опухолей на прогноз выживаемости.
5. Сопоставить кинетические параметры опухолей пациентов, получавших и не получавших химиотерапевтическое лечение.
Всего на базе Нижегородского областного онкологического диспансера было обследовано 130 пациентов с рецидивными и метастатическими опухолями различных локализаций, обладающих умеренной чувствительностью к химиотерапии. Было выбрано пять видов вторичных опухолей: саркомы мягких тканей (СМТ), колоректальный рак (КРР), меланомы кожи, рак молочной железы (РМЖ) и плоскоклеточный рак головы и шеи (ПРГШ). Информация о количественном соотношении больных в разных группах приведена в табл. 1. Каждому из исследуемых пациентов удалялись рецидивные или метастатические очаги (при технической невозможности или нецелесообразности их удаления бралась биопсия из нескольких участков очагов (преимущественно из их периферических отделов)). Проводилось морфометрическое исследование полученных гистологических препаратов. Определялись следующие структурные параметры опухолей: доля клеток паренхимы в состоянии митоза, доля клеток в интерфазе, доля клеток в состоянии пролиферативного покоя. Также определялись те доли объема, которые занимают в опухоли строма и некрозы. Прослежены результаты трехлетней выживаемости для вторичных опухолей пяти исследованных нами локализаций.
Распределение клинических наблюдений по локализациям первичных очагов и типу проведенного ранее лечения
Не получавшие химиотерапевтического лечения
В морфологической характеристике опухолевых клеток большую роль играют исследования митотического режима. Исчерпывающие сведения о митотическом режиме в нормальных клетках можно найти в фундаментальных работах И. А. Алова, а о митотическом режиме в опухолевых клетках—в работах И. А. Алова и И. А. Казанцевой.
Накопленные факты позволили определить следующие основные направления возможного использования исследования митотического режима в опухолях: 1) ранняя диагностика рака; 2) дифференциальная диагностика доброкачественных и злокачественных опухолей сходного гистогенеза; 3) разработка методов прогнозирования малигнизации предопухолевых процессов, 4) дифференциальная диагностика опухолей разного гистогенеза и уточнение гистогенетнческой принадлежности новообразования (первичного н метастатического), 5) оценка степени терапевтического повреждения опухоли.
Суммируя материалы, полученные И. А. Казанцевой, можно следующим образом охарактеризовать особенности митотического режима при гиперпластических и диспластических процессах и в опухолевых клетках.
Для многих нормальных эпителиальных тканей характерны умеренная митотическая активность, которая, однако, значительно выше в быстро обновляющихся тканях; примерно одинаковое количество клеток в стадии профазы и метафазы с преобладанием иногда первой; невысокая частота патологических митозов.
При фоновых процессах (умеренная дисплазня эпителия гортани и шейки матки, эпидермизация псевдоэрозий шейки матки, простая железисто-кистозная гиперплазия эндометрия и др. ) отмечают некоторое увеличение митотической активности, небольшое преобладание клеток в стадии метафазы, повышение количества патологических митозов, среди которых около 90% составляют колхициноподобные метафазы и отставание хромосом в метафазе.
При гиперпластических и диспластических процессах, которые могут рассматриваться как предраковые (тяжелая дисплазня шейки эпителия матки, атипическая гиперплазия эпителия гортани и др ), а также при некоторых доброкачественных опухолях может наблюдаться дальнейшее нарастание нарушений митотического режима, связанных с преобладанием метафаз, учащением числа патологических митозов и их разнообразие с появлением разновидностей, ведущих к анеуплоидин, расширение зоны, где встречаются делящиеся клетки.
Для клеток злокачественных опухолей характерно преобладание метафаз над другими стадиями митоза, резкое возрастание частоты патологических митозов, различная степень повышения митотической активности, нередко незначительная. Существуют опухоли, в которых митотическая активность ниже, чем в нормальных тканях. Мнение, что во всех опухолях клетки делятся чаше, чем в норме, неверно.
Нет, по-видимому, и прямой связи между митотической активностью и быстротой роста опухоли.
Обнаружение соответствующих нарушений митотического режима может быть дополнительным ранним диагностическим признаком наступившей малигнизации или иметь прогностическое значение при оценке предопухолевых процессов чем резче выражены нарушения митотического режима, тем неблагоприятнее прогноз.
Не исключено, что, возможно, имеют место некоторые различия в характере нарушения митотического режима в опухолях разного гистогенеза.
На основании изучения митотического режима может быть получена полезная информация для оценки степени повреждения опухолевых клеток при лучевом или лекарственном лечении новообразований. Например, снижение митотического индекса и нарастание так называемых комковатых митозов, являющихся разновидностью К-митозов и ведущих клетку к гибели, может служить одним из критериев терапевтического эффекта.
Исследование закономерностей митотического режима в новообразованиях имеет решающее значение для понимания механизмов, определяющих книети ку популяции опухолевых клеток, которая по многим параметрам оказывается весьма гетерогенной. Если рассматривать популяцию опухолевых клеток с точки зрения их деления, то следует отметить, что вышедшие из митотического цикла опухолевые клетки могут или вступить на путь диффереицировки, или вновь вступить в митоз и продолжать пролиферировать, или остаться в покоящемся состоянии. Таким образом, в популяции имеется 3 группы клеток, нахо дящихся во взаимосвязи друг с другом недифференцированные покоящиеся клетки, недифференцированные пролиферирующие клетки и дифференцирующиеся, но уже не пролифернрующие клетки.
Покоящиеся опухолевые клетки, как было показано О. И. Епифановой и соавт., сохраняют жизнеспособность и пролиферативный потенциал, они резистентны к химиотерапевтическим препаратам (цитостатикам, алкилирующим соединениям, антибиотикам), митотическим ингибиторам Сохраняя способность при каких-то условиях вновь вступать в митоз, эти клетки являются источником рецидивов, что делает их изучение крайне важным. Хотя существуют сведения о том, что в покоящихся опухолевых клетках ниже проницаемость плазматической мембраны, более резко конденсирован хроматин, возможно, в ДНК имеются участки, более прочно связанные с белком, повы шено обновление молекул, однако их практическая идентификация в опухоли пока еще невозможна, так как мы не знаем их особенностей нх обмена, ни их морфологических, гистохимических или ультраструктурных особенностей, ко торые позволили бы отличить их от других недифференцированных опухолевых клеток.
В связи с тем что недифференцированные пролиферирующие опухолевые клетки чувствительны к лучевому и химнотерапевтическому лечению, делают попытки перевести покоящиеся клетки в группу пролиферирующих путем гормональных воздействий или иных мероприятий.
Катаплазия на светооптическом уровне касается не только морфологии опухолевых клеток (их фенотипа), но еще в большей степени их морфогенетических потенций, что выражается в нарушении обычной тканевой и органной структуры новообразований. Органная и тканевая катаплазия, являющаяся, так же как инвазивный рост и метастазирование, наиболее характерным морфологическим признаком опухолевого роста, наряду с клеточной катаплазией составляют ту сумму признаков, которые позволяют на светооптическом уровне идентифицировать опухоль во всем многообразии ее строения.
Классические гистологические методы поэтому были и остаются основой морфологической диагностики новообразований человека, однако использование только их не дает возможности решать встающие перед онкологией новые задачи. Расширить методические возможности морфологической верификации новообразований можно с помощью таких современных способов исследования, как электронная микроскопия, гистохимия, иммуногистохимия. Анализ ультраструктурных, гистохимических, иммуногистохимических и биологических особенностей опухолевых клеток главным образом в плане диагностики и установления гистогенеза новообразований человека дан в последующих трех разделах.
Следует отметить, что медленнорастущие типы опухолей, как правило, обладают достаточно высокой митотической активностью. Например, рецидивный и метастатический колоректальный рак, рак молочной железы (см. табл. 4). Причина относительно медленного роста при высокой митотической активности — высокие показатели ФКП (см. табл. 4).
Быстрорастущие опухоли могут обладать как низкой (СМТ), так и высокой (меланомы) митотической активностью (см. табл. 4). Объединяют эти типы опухолей низкие клеточные потери.
Прогноз при рецидивных и метастатических опухолях, как правило, коррелирует со скоростью роста этих опухолей (рис. 4).

Рис. 4. Трехлетняя выживаемость пациентов со вторичными опухолями различных локализаций
Как и следовало ожидать, пациенты с медленнорастущими опухолями показывают лучшие результаты выживаемости. Медиана выживаемости пациентов с рецидивным и метастатическим РМЖ — 30,5 месяцев, КРР — 13,5 месяцев. Наихудшие результаты трехлетней выживаемости обнаружились у пациентов с рецидивными и метастатическими СМТ (медиана выживаемости 4 месяца), меланомами (медиана выживаемости 7,5 месяцев).
Мы провели сравнительный анализ кинетических параметров роста пациентов с различными видами вторичных опухолей, получавших и не получавших химиотерапию. В наибольшей степени лечение цитостатиками замедляет рост рецидивного и метастатического рака молочной железы. КЭХТ для этого вида опухолей 1,66. КЭХТ для вторичных очагов КРР составил 1,18. Химиотерапевтическое лечение практически не замедляло рост этого вида опухоли. Это утверждение в целом характерно и для рецидивных и метастатических меланом (КЭХТ 1,02) и СМТ (0,42). Для ПРГШ подобных исследований не проводилось ввиду отсутствия в этой группе пациентов, получавших химиотерапию.
Таким образом, удалось доказать наличие чувствительности к цитостатикам только для рецидивных и метастатических очагов РМЖ.
Влияние структуры опухолевых очагов на прогноз заболевания и чувствительность этих очагов к химиотерапии
Как уже отмечалось выше, по своей структуре опухоли состоят из паренхимы и стромы. Кроме того, в опухоли (как правило, ближе к центру очага) встречаются зоны некрозов.
В зависимости от выраженности стромального компонента мы разделили все опухолевые очаги на три группы (табл. 5):
- с низким содержанием стромы (доля стромы в опухоли менее 20%);
- с умеренным содержанием стромы (доля стромы в опухоли от 20,1 до 40%);
- с высоким содержанием стромы (доля стромы в опухоли выше 41%).
Кинетические свойства вторичных опухолей с различным содержанием стромального компонента
| Доля стромы в опухоли | Низкая (до 20%) | Умеренная (20,1–40%) | Высокая (выше 40%) |
| ВУО, сут | 26,01±4,35 | 25,77±4,62 | 15,77±3,71 |
| МАО, % | 8,54±0,85 | 5,81±0,49 | 3,66±0,35 |
| ФКП, % | 94,17±1,82 | 93,44±1,87 | 93,35±0,96 |
Средняя МАО снижается по мере увеличения стромального компонента в опухолевых очагах. Скорость роста опухоли значительно увеличивается у рецидивных и метастатических опухолей с высоким содержанием стромы (среднее ВУО снижается с 26,01±4,35 до 15,77±3,71 сут). Средние клеточные потери остаются практически неизменными (93–94%) вне зависимости от доли стромы в опухоли.
Наихудший прогноз в отношении продолжительности жизни — у опухолей с высоким содержанием стромы (медиана выживаемости 4 месяца, средняя продолжительность жизни 10,21±2,23 месяца). Медианы выживаемости больных с умеренным и низким содержанием стромы составили соответственно 14,5 и 9,5 месяца.
Максимальная эффективность химиотерапевтического лечения (КЭХТ 2,48) была отмечена для опухолей с высокой долей стромы. Высокая эффективность при лечении цитостатиками отмечалась также в группе опухолей с умеренным содержанием стромального компонента (КЭХТ 2,07). Рецидивные и метастатические опухоли с низкой долей стромы в объеме опухоли к лечению цитостатиками, по нашим данным, практически не чувствительны (КЭХТ 0,82).
Влияние кинетических параметров роста опухоли на прогноз заболевания и эффективность химиотерапии
Нами было проанализировано, какое влияние оказывают кинетические параметры опухоли (митотическая активность, ФКП и ВУО) на прогноз заболевания, а также на эффективность лечения цитостатиками.
В зависимости от доли митотически активных клеток опухоли все клинические случаи были разделены на три группы (табл. 6):
- с низкой митотической активностью — доля митотически активных клеток до 5%;
- с умеренной митотической активностью — доля митотически активных клеток от 5,1 до 10%;
- с высокой митотической активностью — доля митотически активных клеток выше 10%.
Прогноз и эффективность лечения цитостатиками рецидивных и метастатических опухолей с разной митотической активностью
| Показатель | Митотическая активность | ||
| Низкая (0–5%) | Умеренная (5,1–10%) | Высокая (выше 10%) | |
| КЭХТ (ВУОХТ/ВУОбезХТ) | 1,43 | 1,65 | 1,46 |
| Средняя продолжительность дожития (месяцы) | 14,67±1,71 | 13,71±1,84 | 14,23±2,54 |
| Медиана выживаемости (месяцы) | 11 | 10 | 10 |
Различия в эффективности химиотерапии, рассчитанные для каждой группы, не велики. Для опухолей c умеренной митотической активностью выявлены максимальные показатели КЭХТ (1,65). Для группы рецидивных и метастатических ЗНО с низкой митотической активностью опухоли и для группы опухолей с высокой митотической активностью опухоли КЭХТ оказался ниже.
Как видно из таблицы 6, такой показатель, как МАО, практически не влияет на выживаемость пациентов. На рисунке 5 ход кривых выживаемости пациентов с рецидивными и метастатическими ЗНО с различными уровнями митотической активности практически совпадает.
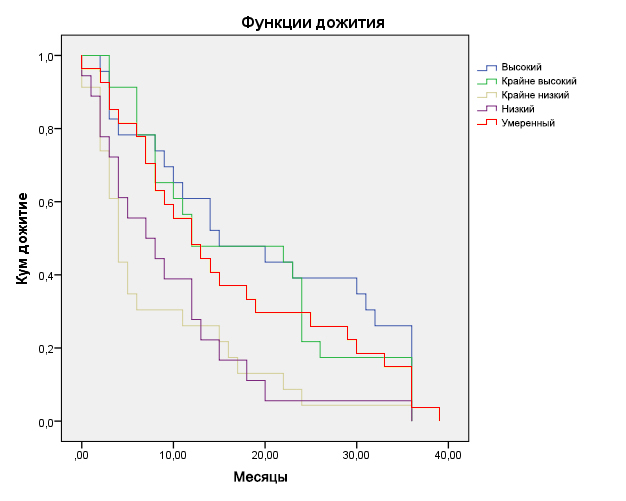
Рис. 5. Кривые выживаемости больных с рецидивными и метастатическими ЗНО с различной МАО
Была исследована также зависимость ВУО и КЭХТ от фактора клеточных потерь (ФКП). С этой целью проведена градация всего диапазона доли клеточных потерь на пять уровней (табл. 7):
- крайне низкие клеточные потери (ФКП до 90%);
- низкие клеточные потери (ФКП 90,1–95%);
- умеренные клеточные потери (ФКП 95,1–98%);
- высокие клеточные потери (ФКП 98,1–99%);
- крайне высокие клеточные потери (ФКП 99,1–99,99%).
Гистологическая дифференцировка рака молочной железы
Гистологическую градацию рака молочной железы (РМЖ) впервые ввел R.B. Greenough из Бостона, который в 1925 г. опубликовал анализ 73 случаев РМЖ.
Несмотря на то что прошло много времени и опубликовано большое количество работ о применении гистологической градации рака молочной железы, ничего существенного не добавлено в перечень морфологических критериев, которые определяют группы РМЖ, имеющие клиническое значение.
Работа R.B. Greenough актуальна и сегодня, он сформулировал прогностически значимые категории инвазивного рака молочной железы низкой, средней и высокой степени злокачественности.
Это деление базируется на 5 признаках:
1) тканевой (гистологической) организации опухоли, то есть способности образовывать дольки, протоки и железистоподобные структуры;
2) степени секреторной активности, которая подтверждается цитоплазматическими вакуолями, капельками муцина в просвете желез;
3) клеточной атипии, то есть единообразии или вариации размеров и формы клеток, соотношении размеров ядра и цитоплазмы;
4) наличии гиперхромных ядер;
5) наличии ядерной атипии и количества митотических фигур.
В соответствии с градациями по Greenough типы рака высокой степени злокачественности имеют клетки и ядра неправильной формы и различного размера, без секреторной функции, клетки расположены столбцами, отмечают гиперхроматоз ядер и большое количество атипичных митозов.
И наоборот, опухоли, состоящие из желез, построенных из единообразных по размеру и строению клеток без гиперхроматоза, с малым количеством митозов, следует относить к РМЖ низкой степени злокачественности.
По данным R.B. Greenough, после радикальной мастэктомии пациентки с раком низкой степени злокачественности были излечены в 68%, умеренной — в 33% случаев и нулевым был результат при высокой.
В 1928 г. Patey и Scarff из Лондона опубликовали анализ 50 случаев рака молочной железы. Они изучили корреляцию между гистологической градацией по Greenough, статусом лимфатических узлов и выживаемостью пациенток. Выявлено, что пациентки с раком низкой степени злокачественности после радикальной мастэктомии излечивались в 85%, средней степени — в 45% и высокой — в 23% случаев.
Кроме того, авторы отметили, что прогноз течения заболевания всегда хороший при отсутствии метастазов в лимфатических узлах, изъязвления опухоли и распространения ее на фасции независимо от гистологической степени злокачественности по Greenough.
Они также сделали заключение, что в случаях нераспространенного РМЖ более продолжительный период ремиссии, то есть период до появления метастазов или рецидивов после радикальной мастэктомии, у пациенток с опухолью низкой степени злокачественности по Greenough, а в случаях распространенного рака — более эффективна паллиативная терапия.
Последующая работа H.J.C. Bloom из Лондона, опубликованная в 1950 г., подтвердила выводы Patey и Scarff. В классическом труде Bloom-Richardson, опубликованном в 1957 г., окончательно сформулированы критерии гистологической градации РМЖ. В своей работе они проанализировали течение болезни 1409 пациенток, из которых 359 прожили более 15 лет.
Подобно R.B. Greenough, исследователи разделили рак молочной железы (РМЖ) на 3 категории, базируясь на трех показателях:
1) относительном количестве тубулярных структур;
2) наличии вариаций размеров клеток рака;
3) количестве гиперхромных ядер и фигур митоза.
Каждый из этих показателей авторы оценили в баллах (1, 2 или 3 балла). Суммируя количество баллов, получим возможные комбинации от 3 до 9. Наименьшее количество баллов соответствует наиболее низкой степени злокачественности рака молочной железы.
Авторы разделили шкалу злокачественности на три части: 3, 4 или 5 суммарных баллов — низкая степень злокачественности (grade 1); 6 или 7 суммарных баллов — средняя (grade 2); 8 или 9 — высокая (grade 3). Эта схема стала наиболее популярной в мире и называется схема градации РМЖ по Bloom-Richardson или технология Scarff-Bloom-Richardson, хотя должна была называться техникой градации по Greenough, в честь человека, впервые опубликовавшего эту градацию в 1925 г.
Bloom и Richardson установили, что 26% из 1409 исследованных случаев РМЖ имели 1-ю степень гистологической злокачественности, 45% — 2-ю, 29% — 3-ю. Результаты сравнения гистологических степеней злокачественности первичной опухоли и метастазов в аксиллярных лимфатических узлах показали, что в 82% степени совпадали.
В 12% случаев степень злокачественности была выше, а в 6% — ниже в метастазе, чем в первичной опухоли. Авторы выявили, что степень гистологической злокачественности, как и статус регионарных лимфатических узлов, дает независимую прогностическую информацию (табл. 2).
Таблица 2. Выживаемость пациенток с РМЖ в соответствии с градационной схемой Bloom-Richardson (исследованы 1409 пациенток). 
Bloom и Richardson пришли к выводу, что степень гистологической злокачественности рака молочной железы отражает предполагаемое клиническое течение заболевания и вероятность развития метастазов в дальнейшем, что стало в свое время очень прогрессивным учением.
Очевидно, что степень гистологической дифференцировки имеет корреляцию с темпами роста опухоли и соответственно показателями S-фазы митотического цикла (ЗН-тимидина, Ki67), показателями анеуплоидии, экспрессией С-егВ-2, рецепторов эстрогена и прогестерона.
Важность этого показателя очевидна, однако в ряде публикаций гистологическое стадирование подвергается жесткой критике из-за трудности, возникающей при его воспроизводимости. Отмечают, что процент расхождения в оценке гистологической дифференцировки иногда составляет 50-60%.
Однако когда критерии оценки гистологической степени злокачественности оценивают профессионально и тщательно, совпадение результатов этой оценки составляет 90%.
H.F. Frierson и соавторы прорецензировали патологоанатомические заключения 7 патологоанатомов, проводивших исследование 75 случаев инвазивного протокового РМЖ. Совпадение при оценке гистологической структуры составило 71%, тубулярных структур — 81%, полиморфизма ядер — 64%, митозов — 67%.
C.W. Elston рекомендует проводить двойное исслeдoвание. Это возможно при проведении исследования двумя патологами или одним патологом дважды на разных образцах.
Следующим недостатком предложенной Bloom и Richardson системы градаций РМЖ стало то, что большая часть пациентов относится к 2-й и 3-й степени градации. С .W. Elston, используя модифицированную систему гистологической градации Bloom и Richardson, исследовал рак молочной железы у 1831 пациентки с периодом наблюдения 16 лет и диагностировал 1-ю степень гистологической дифференцировки рака в 18%, 2-ю — в 34%, 3-ю — в 47% случаев.
Автором отмечена очень выраженная корреляция с клиническим прогнозом. У пациенток с раком 1-й степени злокачественности значительно лучшая выживаемость, чем со 2-й и 3-й степенью (р
План лечения составляют с учётом стадии опухолевого процесса, морфологической структуры опухоли, возраста больной, сопутствующих заболеваний, общего состояния пациентки. Применяют следующие методы лечения: хирургический, комбинированный (сочетание операции с лучевой или лекарственной терапией) и ком.
По данным многочисленных публикаций, этиология и патогенез РМЖ сложны и определяются сочетанием многих факторов. Гормональная регуляция функции молочных желез значительно сложнее, чем эндометрия. Помимо эстрогенов и прогесторона, развитие молочных желез в пубертатном периоде, их функция во время бер.
Гистологическую градацию рака молочной железы впервые ввел R.B. Greenough из Бостона, который в 1925 г. опубликовал анализ 73 случаев рака молочной железы. Несмотря на то что прошло много времени и опубликовано большое количество работ о применении гистологической градации рака молочной железы, ниче.
При анализе данных, получаемых с помощью ультразвукового исследования, целесообразно выделить ряд диагностических задач, решение которых позволит получить полный комплекс эхографических признаков рака молочной железы и метастатических лимфатических узлов, по которым в дальнейшем будет производиться .
Патологические процессы в молочной железе отличаются многообразными клиническими проявлениями, что норой создает серьезные дифференциально-диагностические трудности. Для гипеколога важнее всего заметить (не пропустить!) патологию молочных желез, что приведет в движение систему методов уточня.
Доброкачественные изменения молочных желез относятся к наиболее распространенным заболеваниям и включают различные по клиническим, морфологическим и этиологическим признакам процессы. Отличительной особенностью молочной железы является сложность четкой дифференцировки физиологических и патологически.
Рак молочной железы развивается из эпителия млечных протоков и альвеол. Патоморофологическая характеристика рака молочной железы включает такие параметры, как размер первичного очага, его локализацию в молочной железе, тип роста, морфологическое строение, степень дифференцировки, наличие регионарных.
ВАЖНО. По состоянию на 2020год, митотический индекс больше не влияет на стадирование T, но остается очень важным прогностическим фактором.
В статью коррективы не вносятся, так что просто имейте ввиду.
Так же, имейте пожалуйста ввиду, что вся инфа 2010г! Т.е. если само стадирование меланомы не изменилось с того времени, то данные по выживаемости конечно уже совсем другие, но раз идет ссылка на эти таблички, то нужно чтобы они тут были.
МИТОТИЧЕСКИЙ ИНДЕКС
И вот у нас случился такой диалог на днях (картинку я делать не стал, ибо она слишком длинная получится):
— Привет! Помнишь, у меня был вопрос про то, как митозы в полях зрения перевести в мм2? Кое что нашел. 1 mm2 corresponds to approximately four 400x fields in most, but not all, microscopes. Т.е., в большинстве микроскопов 1 мм2 = 4 полям зрения при 400-кратном увеличении (примерно). 10 полей зрения при 400Х получается примерно равным 2,5 мм2. Там еще и методика описана и много графиков.
Пересмотр системы стадирования меланомы и воздействие митотического индекса
Изменения в системе стадирования меланомы были опубликованы в 7-ом издании американского объединённого онкологического комитета (AJCC) в 2009 году и были осуществлены в январе 2010 г. Хотя изменений и не много, они имеют большое значение. [Последние критерии классификации по системе TNM и группы стадирования представлены в таблицах 1a и 1b, а коэффициенты выживаемости согласно стадии заболевания показаны на рисунке 1].
Основные моменты пересмотренной системы стадирования меланомы:
И толщина опухоли и изъязвление формально использовались с 2002 года для стадирования больных меланомой, основываясь на фактических данных. Позже клеточная пролиферация в первичной опухоли, отраженная митотическим индексом опухоли, появилась в качестве другого важного показателя выживаемости.
Митотический индекс первичной опухоли был введен в этом году как главный критерий стадирования меланомы и прогноза . Подробный анализ базы данных стадирования меланомы AJCC продемонстрировал значительную обратную корреляцию между митотическим индексом первичной опухоли (гистологически определяемый как число митоз/мм²) и выживаемостью (таблица 2).
Таким образом, митотический индекс первичной опухоли, как теперь признают, является важным независимым неблагоприятным прогностическим фактором выживаемости; число митоз/мм² увеличивается, выживаемость уменьшается .
Примечательно, что, хотя митотический индекс – это непрерывная переменная (как и толщина опухоли меланомы), никакие различимые пороги, которые очерчивают особенно увеличенный метастатический риск, не могут быть идентифицированы вне 1 митоз/мм². Напротив, когда не было определено никакой митотической активности — показательной для более медленно растущей первичной меланомы — прогноз был более благоприятным, чем для пациентов, у первичной опухоли которых был по крайней мере 1 митоз/мм². Это было особенно значительно в подгруппе пациентов с опухолью стадии T1.
Основываясь на этом анализе, митотический индекс первичной меланомы был включен в 7-ое издание руководства по стадированию рака AJCC как необходимый элемент для определения стадирования меланомы. Эти рекомендации были даны после рассмотрения статистической информации, включающей 4861 больных меланомой стадии T1 из обновленной базы данных стадирования меланомы AJCC, которая продемонстрировала, что митотический индекс был самым сильным показателем выживаемости для больных меланомой стадии T1, и наоборот, что уровень инвазии по Кларку больше не был статистически значимым, когда были включены митотический индекс и изъязвление.
Десятилетние коэффициенты выживаемости составили:
Тем не менее, стоит отметить, что недавно были представлены предварительные данные большой группы пациентов, демонстрирующие корреляцию между митотическим индексом и статусом сторожевого лимфатического узла среди пациентов со стадией меланомы T1.
Так как гистологические особенности первичной меланомы — толщина опухоли, митотический индекс и изъязвление — являются признаками прогноза и стадирования меланомы, начальная биопсия – это важный компонент и диагностирования и стадирования.
Эксцизионная биопсия всего клинически очевидного поражения с узким 1-2 мм краем смежной нормально появляющейся кожи, является предпочтительной техникой биопсии, когда предполагается меланома.( и единственно правильной в условиях РФ. Об этом уже писано переписано. прим. Дядя Вадик)
Инцизионная биопсия может быть приемлемой для поражений больших по размеру.
Глубокая бритвенная биопсия может быть достаточной, когда поражение плоское и риск подозрения на меланому не высок.
Система стадирования меланомы AJCC рекомендует проводить биопсию сторожевых лимфатических узлов как процедуру стадирования у больных, для кого информация будет полезна в планировании последующего лечения и последующих режимов.
Особенно процедуру следует рекомендовать (и обсуждать) пациентам, у которых меланома T2, T3 или T4 стадии и клинически невовлеченные региональные лимфатические узлы (клинические стадии IB и II), а так же для пациентов с меланомой стадии T1 и вторичными признаками, связанными с увеличенным риском для микрометастазов лимфатических узлов: изъязвление, митотический индекс ≥1/ мм², или IV уровень по Кларку, особенно когда первичная меланома превышает 0,7 мм по толщине.
Наконец, прогностическими факторами, включенными в систему стадирования меланомы, должны быть основные критерии стратификации и результаты, сообщающие о критериях клинических испытаний меланомы. Использование непротиворечивого множества критериев облегчит сообщение способов лечения меланомы и сравнимость клинических испытаний меланомы. Потенциально это также ускорит продвижение мультидисциплинарных подходов к лечению меланомы (об этом , кстати, говорил профессор Хаим Гутман на конференции по меланоме ).
А что у нас? А у нас все это до сих пор идет лесом, ибо «ну и чё вам это даст?«
В общем, этот пост прикрепляется справа в теоретической части.
З.Ы И еще, по моим наблюдениям, если в результатах гистологии что-то отсутствует, то и толщина обычно оказывается ВЕСЬМА приблизительная.
Читайте также:

