Всегда ли инновация это рак
Ученые нашли причину появления рака. Можно ли от него защититься?
Фото: Phanie / NCI-ARNOLD / Diomedia
Опасные сожители
Известно, что основными причинами рака являются курение, нездоровое питание, а также воздействие инфекционных агентов, включая вирусы, бактерии и паразитов. Инфекции стоят на третьем месте среди лидирующих факторов развития опухолей и отвечают за 10 процентов смертей от этой болезни. В то же время на поверхности и внутри человеческого тела обитают миллионы микроорганизмов, чей состав уникален для каждого человека и составляет его микробиом. Микробиом влияет на здоровье человека, защищает его, но при нарушениях может спровоцировать развитие целого ряда заболеваний, включая онкологические. Микробы отвечают за уязвимость к раку, его прогрессирование и восприимчивость к лечению.
Важную роль в защите от бактерий играет слизистая оболочка, выстилающая внутреннюю поверхность пищеварительных, дыхательных и других органов. Она содержит гликопротеины — соединения, пронизывающие мембраны клеток эпителия. Эти молекулы формируют защитный слой. Степень гликозилирования (то есть уровень гликопротеинов) слизистой оболочки определяет уровень невосприимчивости к инфекциям. Однако во время заражения происходят изменения в гликопротеинах, затрагивающие как ту часть (домен), что находится внутри клетки, так и наружную. Это может либо способствовать ликвидации микроба, либо привести к инфекции и воспалению.
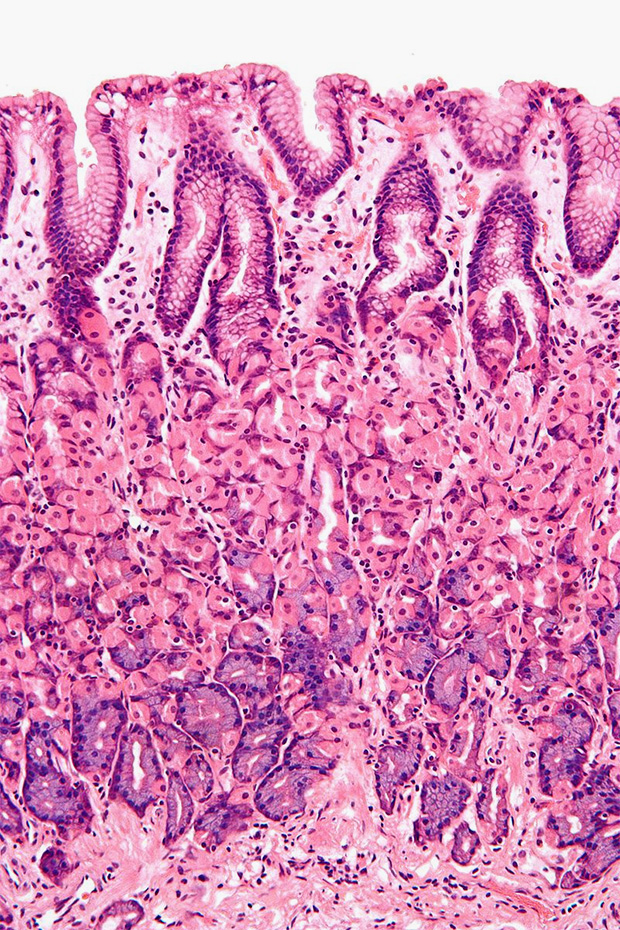
Слизистая оболочка и эпителиальная ткань
Защитник и враг
Когда наружная часть MUC1 связывается с бактерией, происходит отделение внутреннего домена. К нему присоединяются фосфорные остатки, что запускает целый ряд разных процессов: синтез провоспалительных факторов, адгезию (сцепление) эпителиальных клеток, их дифференциацию и программируемую клеточную смерть, называемую апоптозом.
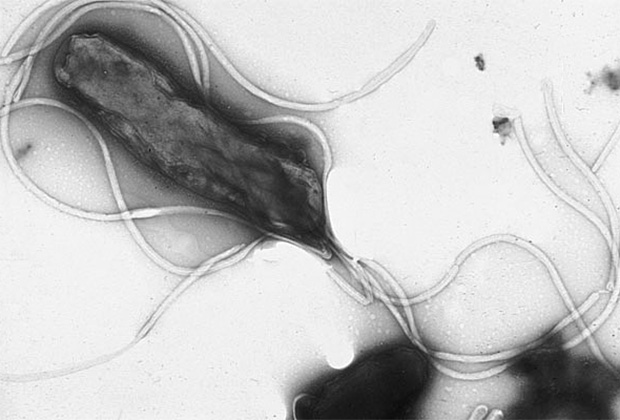
Пока бактерии не рассматриваются как основная причина раковых заболеваний в отличие от тех же вирусов. Лишь для нескольких бактерий показано, что они могут спровоцировать развитие злокачественных опухолей через провоцирование воспалительных процессов, выделение токсинов и других повреждающих ДНК метаболитов или нарушение сигнальных путей клеток. Известны две широко распространенные бактериальные инфекции, которые могут вызывать рак. Это Helicobacter pylori, связанная с раком желудка и лимфомой, и Salmonella typhi, связанная с карциномой желчного пузыря у тех, кто страдает от хронического тифа. Но могут быть и другие инфекции, повышающие риск.
Главные угрозы
Campylobacter jejuni — одна из самых частых причин инфекционных отравлений, возбудитель кампилобактериоза. Бактерия проникает через слизистый слой в эпителиальную ткань пищеварительного тракта, провоцируя гастроэнтерит. Когда микроорганизм связывается с MUC1, гликопротеин высвобождается вместе с микробом в слой слизи. Пока неизвестно, предотвращает ли это развитие рака. Сама бактерия попадает в организм человека через загрязненную пищу и воду. В группу риска входят дети, пожилые люди, пациенты с ослабленным иммунитетом. Методом профилактики является правильное приготовление пищи.
Клетка с вакуолями, содержащими муцины
Хроническая инфекция Helicobacter pylori приводит к язвам и раку. Показано, что муцины являются важным препятствием для бактерии. Однако внутриклеточный домен MUC1 при связывании с бактерией способен взаимодействовать с NF-kB — транскрипционным фактором, который отвечает за регулирование апоптоза и клеточного цикла. Нарушение регуляции данного сигнального пути приводит к воспалениям, аутоиммунным заболеваниям и развитию опухолей. Для профилактики инфекции специалисты рекомендуют соблюдать гигиену рук. Заражение происходит через контакт с загрязненными предметами и людьми — носителями инфекции.
Haemophilus influenzae вызывает инфекции дыхательных путей, в том числе пневмонию. При хронической обструктивной болезни легких (ХОБЛ) дыхательные пути часто колонизируются этой бактерией. Кроме того, ХОБЛ является одним из факторов риска рака легких. Показано, что взаимодействие микроба с MUC1 вызывает изменения в регуляции специфических рецепторов, которые, в свою очередь, участвуют в прогрессировании легочных аденокарцином.
Еще одним потенциальным виновником опухолей является кишечная палочка Escherichia coli, возбудитель заболеваний кишечника. При взаимодействии микроба с MUC1 возникает воспалительный процесс. Показано, что инфекции связаны с колоректальным раком и раком мочевого пузыря, но пока не совсем понятно, могут ли они быть онкогенным фактором.
Другие вредители
Среди онкогенных вирусов достаточно известны вирус Эпштейна-Барр (вирус герпеса) и вирус папилломы человека. Первый ассоциирован с крайне агрессивной назофарингеальной карциномой (рак носоглотки), лимфомой Ходжкина (рак лимфатической системы), лимфомой Беркитта, Т-клеточной лимфомой и раком желудка. Второй может вызвать рак шейки матки, а также опухоли на гениталиях, в заднем проходе, горле и голове. При отсутствии вируса рак шейки матки не развивается, то есть это заболевание четко связано с хронической инфекцией.
Опасность представляют и другие вирусы, в том числе возбудитель гриппа, однако при подобных инфекциях MUC1 эффективно защищает слизистую от патогена. Вирус гепатита часто становится причиной рака печени.
Что касается паразитов, то к онкологическим заболеваниям могут привести заражение кровяной шистосомой, которая проникает в организм человека через мочевыводящие пути. Червь провоцирует развитие плоскоклеточного рака мочевого пузыря, являясь второй ведущей причиной этого заболевания. Заражение обычно происходит в тропических регионах планеты при купании в естественных водоемах. Часто жертвами паразита становятся туристы и жители развивающихся стран с неблагополучной санитарной обстановкой. По подсчетам, во всем мире инфицировано более 207 миллионов человек.
Еще одним онкогенным паразитом является червь Opisthorchis viverrini, заражающий желчный пузырь и способствующий развитию холангиокарциномы. Этот тип опухолей редко встречается в западных странах, но распространен в Юго-Восточной Азии.
Как спастись
Некоторое время назад исследователи из Американского онкологического общества (ACS) пришли к выводу, что причиной половины случаев заболевания раком является нездоровый образ жизни. В целом внешние факторы среды отвечают за львиную долю онкологических заболеваний, неподконтрольными остаются лишь генетические факторы и просто случайные мутации в ДНК, на которые мы никак не можем повлиять.
Многие из воздействий можно исключить, другие — снизить до минимума. Среди этих мер обычно называют поддержание здорового веса, физические упражнения, отказ от курения и алкоголя, избегание длительного воздействия солнечных лучей и контакта с различными химическими загрязнителями. Однако теперь к этому можно добавить прививки (особенно, от ВИЧ и гепатита) и другие типы профилактики инфекционных и паразитарных заболеваний.








К сожалению, у меня не осталось фотографий, где я в самом начале болезни, когда еще не выпали волосы после химиотерапии. У меня украли ноутбук с жестким диском, где был фотоархив: прямо возле онкологического центра, где я проходила лечение, разбили стекло в машине и все вытащили. Кроме первой серии проекта, пропали все съемки за последние три года. Для меня это был удар. Тогда я постоянно думала, как бы не сломаться, как бы не опустить руки. Какое-то время я даже не фотографировала. . Фото: Алена Кочеткова

Борьба с онкологическими заболеваниями - одно из ключевых направлений нацпроекта "Здравоохранение", на него до 2024 года выделяется почти 1 трлн руб. За счет этих средств к 2024 году планируется снизить смертность от онкологических заболеваний в России на 8%. Достичь цели по снижению смертности сложно без внедрения в медицинскую практику передовых методов диагностики и разработки эффективных лекарственных средств. Здесь необходимы разработки инновационного бизнеса и значительные частные инвестиции. На примере РОСНАНО можно увидеть, каких реальных изменений в диагностике, лечении и фармакологии можно достичь, если поддерживать перспективные инновационные проекты в частном бизнесе.
Опорной инфраструктурой нацпроекта в части онкологии станут 420 центров амбулаторной онкологической помощи во всех регионах России, 160 региональных больниц для пациентов с онкологическими заболеваниями, оснащенных медицинским оборудованием, и 18 референс-центров для специализированных исследований. Обеспечить в них качественную диагностику и лечение смогут только специалисты, обученные передовым современным методам. Помимо инвестиционной поддержки, Группа РОСНАНО занимается подготовкой и переподготовкой кадров в онкологии, которые будут востребованы в строящихся медицинских учреждениях.
О наиболее важных инвестиционных и образовательных проектах РОСНАНО в борьбе с онкологией - в материале ТАСС.
Изотопы для диагностики и лечения
"Мы первыми в стране инициировали создание региональной сети центров ядерной медицины, которая занимается диагностикой в области онкологии", - отмечает председатель правления УК "РОСНАНО" Анатолий Чубайс.
РОСНАНО удалось осуществить трансфер в Россию передовых медицинских технологий диагностики и терапии онкологии. Компания "ПЭТ-Технолоджи", из которой РОСНАНО успешно вышло в 2018 году, создала первую в стране национальную сеть центров ядерной медицины - на сегодняшний день работают 14 диагностических центров ПЭТ/КТ-диагностики, где 90% высокоточных исследований проводятся бесплатно по полису ОМС. Метод ПЭТ/КТ сочетает в себе позитронно-эмиссионную и компьютерную томографию, что позволяет диагностировать рак на раннем этапе развития и назначить точное лечение. В рамках проекта действуют два производства радиофармпрепаратов - в Уфе и Ельце, которые оборудованы циклотронными комплексами, лабораториями синтеза радиофармпрепаратов, а также применяется терапевтическая установка радиохирургического лечения "Кибер-нож".

Биотех против рака
Другое важное технологическое направление инвестиций РОСНАНО в онкологии - клинические исследования, локализация зарубежных биотехнологических препаратов и разработка собственных. В Ленинградской области РОСНАНО открыло производственный комплекс "Фармсинтез", который выпускает препарат отечественной разработки для лечения опухолей головного мозга на основе гидразина сульфата. Препарат имеет паллиативное действие, нацелен на улучшение качества жизни онкобольных. Кроме того, компания работает в одном из самых многообещающих направлений в лечении онкологии - персонализированной CAR-T терапии (XCART). Планируется использование платформы XCART для разработки клеточной терапии для лечения В-клеточных неходжкинских лимфом. Также "Фармсинтез" выпускает онкопрепарат на основе молграмостима, сопровождающий химиотерапию.
На мощностях биофармацевтической компании "Нанолек" (создана при участии РОСНАНО, в 2019 году реализован выход) в Кировской области планируется развернуть совместный с Janssen (подразделение группы Johnson & Johnson) выпуск в России препарата с действующим веществом даратумумаб, применяемого в терапии множественной миеломы. Запуск лекарства ожидается в 2021 году, на российском рынке нет его аналогов. "Проект расширит доступ к современной и эффективной терапии для пациентов с трудноизлечимой формой рака - множественной миеломой", - говорит президент "Нанолек" Владимир Христенко.

Стартапы тестируют и реконструируют
Другая часть Группы РОСНАНО - инвестиционная сеть наноцентров Фонда инфраструктурных и образовательных программ - занимается созданием новых бизнесов. Среди почти 800 стартапов есть работающие над проблемой диагностики редких и онкологических заболеваний, а также помогающие онкобольным вернуться к нормальной жизни.
Важный проект наноцентров в области реконструктивной онкологии - TEN MedPrint (входит в группу компаний "ТехноСпарк"). Стартап проектирует и изготавливает индивидуальные эндопротезы под конкретного пациента в случаях, когда серийные медицинские изделия невозможно применить: при восстановлении формы челюсти и черепа, в том числе после онкологических удалений кости. В 2019 году было произведено более 500 индивидуализированных 3D-печатных имплантатов, из которых около 10% заказов пришлось на реконструктивную онкологию.
Стартап ульяновского наноцентра Ulnanotech "ТестГен" занимается производством и внедрением генетических тестов для определения рака простаты по моче. Онкомаркер ранее был недоступен в России, в то время как рак предстательной железы (РПЖ) - одно из самых распространенных злокачественных новообразований у мужчин старше 40 лет.

Компания Pepric из наноцентра "СИГМА.Новосибирск" разработала спектрометр для исследования проб крови и тканей с помощью измерения концентрации частиц методом электронного парамагнитного резонанса. Анализы, полученные данным методом, показывают точный и быстрый результат при низкой себестоимости.
Геномный центр ReadSense, входящий в группу компаний "ТехноСпарк", стал основной лабораторией российского проекта по изучению причин наследственных раков OncoBRCA. Специализированный банк данных формируется на основе уникальных клинических выборок, характеризуемых с использованием методов таргетного секвенирования. Полученные данные будут использованы для проведения эффективного скрининга наследственных онкологических заболеваний, выявления групп риска и совершенствования стратегии лечения.
Также Фонд инфраструктурных и образовательных программ участвует в международном проекте по созданию компактного протонного терапевтического комплекса для лечения онкологических заболеваний. Его разработкой занимаются компания "Протом" из г. Протвино Московской области и израильский партнер P-Cure. Проект призван сделать широкодоступной протонную терапию, ключевым преимуществом которой является возможность точечного воздействия непосредственно на опухоль с минимизацией негативного влияния на здоровые ткани. Завершаются испытания протонного комплекса, подана заявка в FDA.

Переподготовка онкологов
Фонд инфраструктурных и образовательных программ разработал 11 учебных программ, предназначенных для специалистов, профессиональная деятельность которых связана с диагностикой и лечением различных онкологических заболеваний. Всего к началу 2020 года обучение по ним завершили около 12 тысяч профессионалов.
Пять образовательных программ, сделанных при поддержке фонда, касаются высокотехнологичных методов ранней диагностики онкологических заболеваний - позитронно-эмиссионной и компьютерной томографии, использования омиксных данных, наномолекулярных методов диагностики меланомы, высокотехнологичных методов анализа клинических данных в области наследственных заболеваний, применения молекулярно-генетических маркеров для ранней диагностики рака предстательной железы. Передовым методам лечения посвящены четыре программы: в области онкологических заболеваний репродуктивной системы на основе таргетных препаратов, лучевой терапии, лазерных медицинских систем, методов локальной деструкции опухолей паренхиматозных органов. Две программы предполагали повышение квалификации специалистов, занятых одновременно диагностикой и лечением рака: в сфере ядерной медицины и флуоресцентной диагностики и фотодинамической терапии.
Программа по омиксным данным для врачей-онкологов, созданная при поддержке ФИОП, стала одной из наиболее востребованных на платформе, доступной через портал непрерывного медобразования Минздрава РФ. Отдельные модули программы были использованы практикующими врачами около пяти тысяч раз.
Анализ омиксных данных - так называют генетические, протеомные, липидомные и другие медицинские данные - позволяет реализовать персонализированный подход в лечении злокачественных образований. Одинаковые симптомы двух пациентов могут отражать разные пути развития заболевания и требовать различных терапевтических методов. Омиксные технологии дают возможность использовать в клинической диагностике комплексные данные и позволяют исследовать организм на самых разных уровнях - начиная с ДНК, - а также учитывать эффективность и побочные явления используемых пациентом лекарственных препаратов.
Николенко добавила, что за две недели после открытия доступа к ресурсу на портале непрерывного медобразования Минздрава РФ прошли обучение более 800 онкологов, причем каждый из них освоил в среднем по пять-шесть модулей.

Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела

С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

Что такое рак
Тезис, что рак — болезнь неизведанная, миф. Ученые давно выяснили механизмы появления болезни. Рак — это генетическое заболевание, что вовсе не означает, что оно наследственное. Он возникает в результате поломки генов, которая может случиться под воздействием различных факторов. Развитие рака — это последовательное накопление мутаций в клетке, которая постепенно приобретает свойства рака.
Какие гены повреждаются? Существуют три вида генов, поломка которых приводит к появлению опухоли в клетке. Прото-онкогены — это гены, кодирующие системы контроля и деления (отвечают за деление клетки), гены-супрессоры — это гены, которые кодируют системы восприятия сигналов от других клеток и тормозят рост и деление (отвечают за взаимоотношения между клетками), а также гены репарации — гены, которые кодируют белки, которые, в свою очередь, чинят ДНК. В процессе своей жизни человек сталкивается с факторами, которые повреждают гены, и если гены репарации работают хорошо в перманентном режиме, то они смогут устранить поломку. Часто, когда речь идет об опухолевых синдромах и высоком риске рака в молодом возрасте, это означает, что случилась поломка генов репарации. Сегодня известно порядка 50 генов (не только репарационных), поломка которых приводит к развитию опухолевого синдрома — резко увеличивает риск рака.
Если ген ломается, то поломка приводит к развитию опухоли. Опухолевая клетка перестает реагировать на сигналы и приобретает новые свойства, она начинает мутировать с высокой скоростью, и рано или поздно какие-то клетки приобретают новые свойства, которые позволяют ей стать еще более злокачественной, начать метастазировать. Так появляется метастатическая болезнь.

Лекция Ильи Фоминцева в Университете ИТМО
Стадий рака не существует
Считается, что первая стадия рака — это начальная стадия, из которой развиваются все последующие. В этой логике четвертая стадия является последней. Однако рак четвертой стадии и разросшийся рак первой стадии — это фактически два разных рака. Так, рак в четвертой стадии — это рак, у которого появились клоны клеток, способные метастазировать, получившие много новых свойств, которых не было в клетках на первой стадии. У этого рака новые свойства, другая генетика и биология. Теории постадийного развития рака противоречат биологические типы рака, которые рождаются сразу в четвертой стадии, существуют только в первой стадии или имеют только первую и четвертую стадии, минуя вторую и третью.
Несмотря на такое ошибочное представление, оно полезно с практической точки зрения. Биологические свойства опухоли проявляются в ее анатомическом распространении, а стадии учитывали именно его: врастает рак в мышцу или нет, дает метастазы или не дает. На этой основе можно было строить точный прогноз. Более того, до сих пор это самый удобный способ прогнозирования исхода болезни.
Рудольф Вирхов. Источник: syl.ru
Знание современной теории опухолевой прогрессии говорит о том, что максимальное удаление тканей вокруг опухоли за некоторыми пределами совершенно бессмысленно, ведь опухоль уже распространилась, просто не приобрела еще всех свойств. Впервые это выяснили Джош Фидлер и Бернард Фишер в конце XX века. В рамках исследования ученые выяснили, что удаление большего или меньшего количества тканей не влияет на отдаленную выживаемость человека. Также в исследовании было обнаружено, что нет необходимости удалять лимфоузлы — достаточно выяснить, поражены они или нет. Это исследование стало одним из ключевых в онкологии, за ним последовала серия других, которые расширяли и дополняли эту новую теорию, которая поворачивала все с ног на голову.
С 1950-х годов в онкологии наблюдается четкий тренд на уменьшение объемов хирургического вмешательства во всех видах рака. Сегодня молочную железу удаляют лишь тогда, когда опухоль занимает всю железу или опухоль имеет множество очагов в железе. В остальных случаях удаляют только опухоль и берут биопсию лимфоузлов, чтобы выяснить, имеет ли рак те свойства, которые позволяют ему вырасти в лимфоузлах. Процент органосохраняющих операций пока косвенно является показателем качества принятия решений в маммологических отделениях. К сожалению, в России многие онкологи до сих пор проводят операцию Холстеда.
Развитие рака — это стохастический процесс (вероятностный). Из первичной опухоли клетки распространяются везде: в кровоток, лимфоток и другие локации. Однако подавляющее большинство этих клеток не выживает, а те, которые выживают, не смогут дать вторичную опухоль. Если же среди триллионов клеток, которые отрываются от первичной опухоли и попадают в другие ткани, одна тысячная процента прикрепится к ткани, а из этого количества один процент окажется способным дать метастазы — этого хватит, чтобы убить человека.
Что приводит к генетическому повреждению клетки
Возраст своей цифрой, разумеется, не приводит к генетическому повреждению клеток, однако чем дольше живет человек, тем выше вероятность, что он встретится с фактором, который фатально повредит ген, поломка которого приводит к раку. Этот процесс можно ускорить, если контактировать с усиливающими мутацию веществами, например, с табаком. Если у человека есть мутации, которые приводят к раку легких сами по себе, поврежденный ген увеличивает вероятность рака легких. Если гены репарации не работают качественно, а человек курит, то он заболеет раком легких с практически стопроцентной вероятностью.
Похожая ситуация с алкоголем — химическим канцерогеном, который приводит к развитию рака (безопасных доз алкоголя не существует!). К генетическому повреждению клетки приводят и другие канцерогенные вещества. Одно из них, например, асбест — вещество, которое повышает риск рака легких у человека.
Хроническое воспаление приводит к развитию рака, так как при хронических воспалениях бесконечно происходит репарация тканей: клетки делятся в огромных количествах, и в зоне хронических воспалений рано или поздно возникнет ошибка при репликации ДНК. Несмотря на то, что ошибок всегда много, однажды ошибка рискует стать фатальной.
К генетическому повреждению клетки могут привести инфекционные агенты — бактерии или вирусы, которые напрямую повреждают ДНК или вызывают специфическое хроническое воспаление, которое приводит к повреждению ДНК. К числу вирусов, которые повреждают ДНК напрямую, относится вирус папилломы человека (ВПЧ). Этим вирусом рискует заразиться каждый, кто ведет половую жизнь. Однако высокий риск встречи человека с этим вирусом не гарантирует, что человек заболеет раком. Как правило, этот вирус сам элиминируется, также как и вирус гриппа, только медленнее. Именно поэтому лечение ВПЧ бессмысленно, как правило, он уходит сам. Однако не всегда. Бывают случаи (в возрасте старше 30 лет), когда ВПЧ остается в клетке и вызывает дисплазию (изменение клеток), что приводит в конечном итоге к раку (раку шейки матки, раку анального канала и другим видам).
К факторам риска относятся также ионизирующее излучение (напрямую повреждает гены), ультрафиолетовое излучение (однако оно, например, не вызывает рак молочной железы), диета (при приеме низкокачественной или испорченной продукции возникают хронические болезни ЖКТ, например, язва). Также существует доказанное влияние красного мяса и продуктов его переработки на риск возникновения колоректального рака (белое мясо и рыба не имеют влияния) — относительный прирост риска при регулярном употреблении красного мяса составляет 18 %.
Внешние гормоны могут резко повысить риск рака молочной железы, который во многом развивается именно под действием половых гормонов. Также ожирение и гиподинамия — один из мощнейших факторов риска рака многих локализаций. Сегодня все виды опухолей, которые связаны с ожирением и с ВПЧ, находятся в фазе роста заболеваемости, а те, которые связаны с курением и алкоголем, — в фазе снижения.
Важно помнить и о ложных факторах риска, которые НЕ влияют на развитие рака. Среди них электромагнитные поля, дезодоранты-антиперспиранты, заменители сахара, страх рака, стресс, хирургия, травма, неизбежность наследования (даже если есть мутация, это не означает, что она разовьется в рак).
Раннее выявление и скрининг
Раннее выявление — это выявление симптоматического рака, а скрининг — это выявление рака, у которого симптомов нет, а у самого человека нет никаких жалоб и оснований для обращения к врачу. Раннее выявление не равно излечению, а скрининг, хоть и прерывает естественную историю болезни и приводит к улучшению качества лечения, не гарантирует увеличения продолжительности жизни пациента.

Также результатом скрининга может стать прямой вред от обследования (инвазивного). Так, например, в ходе колоноскопии, которую проводят под общей анестезией, производится осмотр кишки эндоскопом. Даже у анестезии при этой процедуре могут быть осложнения вплоть до смертельного исхода, кроме того в ходе процедуры можно вызвать кровотечение кишки, остановку сердца или фатальную аритмию. Все перечисленное — лишь десятые процента случаев, однако для аудитории в сотни тысяч человек это смерти конкретных людей. Именно поэтому необходимо взвешивать пользу и вред от скрининга. Сегодня существуют четыре опухоли, для которых польза скрининга превышает вред: рак шейки матки, рак молочной железы, колоректальный рак и рак легких.
Читайте также:

