Все о химиотерапии при опухоли в животе
Одна из главных проблем, ухудшающих качество жизни человека с терминальной стадией онкологического заболевания, это асцит. При асците в брюшной полости скапливается жидкость, из-за чего возникает боль, пропадает аппетит, становится трудно дышать.
При онкологических заболеваниях асцит возникает на терминальной (последней) стадии из-за того, что многочисленные метастазы нарушают дренажные свойства вен и лимфатической системы. В результате жидкость скапливается в брюшной полости. Это может произойти при любом виде рака, который распространяется по брюшине: раке желудка, лёгкого, колоректальном раке, раке простаты, но наиболее характерно такое развитие заболевания для рака яичников.
Что такое внутрибрюшинная химиотерапия
Если воздействовать на метастазы, можно добиться уменьшения асцита.
Как обычно проводится химиотерапия?
Через подключичный катетер или иглу, введённую в периферическую вену, в организм поступает препарат, который должен бороться с раковыми клетками в какой-то конкретной части организма. Сейчас стало понятно, что в некоторых случаях гораздо эффективнее действовать непосредственно рядом с опухолью.
Если раковые клетки находятся в брюшной полости, то можно провести курс внутрибрюшинной химиотерапии. Это значит, что в брюшную полость вводится в несколько раз более концентрированная доза препарата, чем используется при обычной (системной) химиотерапии.
В некоторых случаях проводится гипертермическая химиотерапия, то есть с помощью препарата, нагретого до 41 °C.
Сейчас также стал использоваться новый метод — биотерапия опухолевых серозитов. Другими словами, введение в брюшную полость не химиопрепаратов, а белков интерлейкинов, которые помогают выработать более активный иммунный ответ на раковые клетки.
Раньше при асците не проводилось практически никакой терапии — делался только лапароцентез (жидкость убирали через прокол в брюшной стенке). Но сейчас установлено, что внутрибрюшинная химиотерапия способна справиться с этим состоянием.
После её применения асцит больше не развивается или откачка жидкости становится необходима гораздо реже: не раз в 5 дней, а раз в 15. То есть качество жизни заметно улучшается.
Однако этот вид лечения подойдёт не для каждого. Противопоказания к внутрибрюшинной химиотерапии — это нарушения работы почек, спаечный процесс в брюшной полости, перитонит, сепсис.
Установка порт-системы в брюшную полость
Если доктор понимает, что асцит возникнет снова и потребуется часто проводить лапароцентез, то врач установит перитонеальную порт-систему. Это небольшое устройство, которое помещается под кожу, в дальнейшем, сделав укол в него, можно удалять жидкость из брюшной полости и вводить химиопрепараты.
Введение химиопрепаратов в брюшную полость
Сначала в брюшной полости удаляются все видимые очаги онкологического заболевания, в конце операции врач может установить специальный порт.
Через некоторое время проводится лапароцентез, то есть из брюшной полости через прокол удаляется максимально возможное количество жидкости: одномоментно эвакуировать больше определённого объёма нельзя. При необходимости процедура повторяется.
Параллельно проводится заместительная терапия, то есть вводятся растворы с белком, чтобы компенсировать значительную потерю веществ, происходящую во время лапароцентеза.
Когда брюшная полость осушена, в нее вводятся химиопрепараты (цитостатики), которые через 6–12 часов в дальнейшем также удаляются. Чаще всего это блеомицин, цисплатин, митомицин или паклитаксел. Выбор зависит, как правило, от типа первичной опухоли.
Побочные эффекты при внутрибрюшной химиотерапии встречаются несколько чаще, чем при системной. Обычно это боль в животе, тошнота, рвота. Иногда могут возникнуть проблемы с катетером. Например, он может закупориться. Реже происходит повреждение кишечника. Особенности внутрибрюшинной химиотерапии
Первый курс внутрибрюшинной химиотерапии — самый сложный. Обычно к моменту проведения этой процедуры пациент проходит довольно много курсов изнуряющего лечения и операций, асцит также сильно ухудшает качество жизни.
В дальнейшем внутрибрюшинная химиотерапия должна проходить легче. В зависимости от тяжести состояния пациента врач определит, как долго нужно проводить этот вид лечения. Обычно оно не занимает больше 4 месяцев.
Гипертермическая (с применением горячего препарата) химиотерапия обычно проводится на завершающем этапе операции по удалению видимых опухолей. Эффективность гипертермической терапии, конечно, выше, но она на порядок более токсична, от неё больше осложнений. Препарат находится в брюшной полости час или два, после чего удаляется.
Внутрибрюшинная химиотерапия, в том числе гипертермическая, а также внутрибрюшинная биотерапия (с помощью интерлейкинов) — это современные методы с доказанной эффективностью, которые помогут значимо улучшить качество жизни.
- Брюшная полость и брюшина — что это такое?
- Виды рака брюшной полости
- Симптомы
- Осложнения
- Диагностика рака брюшной полости
- Лечение
- Прогноз и профилактика
Брюшная полость и брюшина — что это такое?
Брюшная полость — это пространство в животе, заполненное кишечником и другими внутренними органами. Сверху она ограничена диафрагмой, снизу — тазом, по бокам и спереди — мышцами брюшного пресса, сзади — позвоночником и поясничными мышцами.
Изнутри полость живота выстилает тонкая пленка из соединительной ткани — брюшина. Ее висцеральный листок, покрывает внутренние органы, париетальный — стенки брюшной полости. Между листками брюшины находится замкнутое щелевидное пространство, а в нем — минимальное количество жидкости, выполняющей функцию смазки и обеспечивающей свободное скольжение органов. В некоторых местах брюшина образует складки: брыжейки, на которых подвешены органы, сальники.
Внутренние органы могут быть расположены по отношению к брюшине по-разному:
- Интраперитонеально — покрыты брюшиной со всех сторон.
- Мезоперитонеально — покрыты частично.
- Ретроперитонеально (забрюшинно) — покрыты только с одной стороны.
Виды рака брюшной полости
Первичные опухоли брюшной полости встречаются редко. Они бывают разных типов: мезотелиальные, эпителиальные, гладкомышечные неопределенные. Особая разновидность злокачественных опухолей брюшины — псевдомиксома. Она развивается из клеток, которые продуцируют большое количество желеобразной жидкости. Чаще всего такие опухоли распространяются на брюшину из аппендикса.
Зачастую первичные злокачественные опухоли брюшной полости имеют строение и ведут себя, как рак яичников. Они вызывают сходные симптомы, и врачи применяют для борьбы с ними примерно одни и те же методы лечения.
Известно, что в целом вероятность развития первичного рака брюшной полости выше у женщин, чем у мужчин. Риски повышаются с возрастом. Есть связь между вероятностью развития заболевания и изменениями в генах BRCA1, BRCA2.
При разных типах рака на поздних стадиях опухолевые клетки отделяются от первичного новообразования, распространяются по организму и образуют новые очаги в различных органах, в том числе в брюшной полости. Этот процесс называется метастазированием. Чаще всего в брюшину метастазирует рак толстой и прямой кишки (в 15% случаев), желудка (в 50% случаев), яичника (в 60% случаев), поджелудочной железы. Иногда метастазы распространяются из органов, которые находятся за пределами брюшной полости: молочной железы, плевры (пленки из соединительной ткани, покрывающей легкие и выстилающей стенки грудной полости), легкого.

Симптомы
Зачастую в течение длительного времени симптомы при раке брюшной полости отсутствуют, поэтому нередко его диагностируют на поздних стадиях. Проявления патологии неспецифичны, их можно легко принять за признаки других заболеваний:
- Дискомфорт, спазмы, вздутие живота.
- Повышенное газообразование в кишечнике.
- Жидкий стул.
- Запоры.
- Тошнота.
- Снижение аппетита.
- Частые мочеиспускания.
- Одышка.
- Быстрый набор или потеря массы.
- Кровотечения из прямой кишки, у женщин — из влагалища.
Если канцероматоз брюшины возник в результате метастазирования злокачественной опухоли из другого органа, сильно ухудшается прогноз. Противоопухолевая терапия начинает работать хуже, потому что многие препараты плохо проникают через брюшину.
Осложнения
Главное осложнение данного заболевания — асцит. Этим термином называют состояние, при котором в животе скапливается жидкость. В норме между листками брюшины ежедневно вырабатывается и всасывается около 1,5 жидкости. При канцероматозе нарушается отток лимфы, и жидкость всасывается хуже. Она начинает скапливаться внутри живота.
Пока жидкости немного, больной не испытывает каких-либо симптомов. Затем начинают беспокоить тяжесть, тупые боли в нижней части живота. Затрудняется дыхание, возникает одышка. Из-за того что жидкость сдавливает органы, больной жалуется на отрыжку, тошноту, проблемы со стулом и мочеиспусканием. Живот увеличивается в размерах, может возникать пупочная грыжа. При выраженном асците развивается сердечная недостаточность, отеки.
Диагностика рака брюшной полости
Злокачественную опухоль помогают выявить следующие методы диагностики:
- Ультразвуковое исследование. Зачастую его назначают в первую очередь, как простой, доступный, безопасный и в то же время информативный метод диагностики.
- Компьютерная и магнитно-резонансная томография помогают оценить состояние брюшины и внутренних органов, выявить патологические образования, оценить степень распространения рака.
- ПЭТ-сканирование в настоящее время является золотым стандартом для поиска отдаленных метастазов.
- Биопсия — самый точный метод диагностики злокачественных опухолей. Врач может получить образец опухолевой ткани во время диагностической лапароскопии — процедуры, во время которой через проколы в брюшной стенке в живот вводят миниатюрную видеокамеру и специальные инструменты. Образец отправляют в лабораторию, проводят его гистологическое, цитологическое исследование, молекулярно-генетический анализ. Это помогает не только диагностировать рак, но и установить природу опухолевых клеток, разобраться, какими препаратами с ними лучше бороться.
- Рентгеноконтрастные исследования помогают оценить состояние пищеварительного тракта, выявить опухолевые очаги и другие патологии.
- Анализ на онкомаркер CA-125 (углеводный антиген 125). Уровень этого вещества повышается в крови при раке брюшины и яичников. Но для диагностики этих заболеваний данный анализ недостаточно точен. Как правило, его применяют для контроля течения рака и эффективности лечения.
- Женщины должны пройти осмотр у гинеколога.
Обычно врачи-онкологи устанавливают диагноз на основании таких признаков, как асцит, утолщение брюшины, появление на ней узелков, смещение, сдавление петель кишки, патологические изменения со стороны печени и складок брюшины — сальников.

Лечение
Выбор тактики лечения зависит от локализации, размеров, стадии злокачественной опухоли, количества узлов. Врач также должен учитывать общее состояние больного, его возраст, наличие сопутствующих заболеваний.
Зачастую при поражении брюшины опухолевых очагов очень много, многие из них мелкие, и полностью их удалить невозможно. Хирургическое лечение направлено на удаление как можно большего числа очагов, как правило, оно предшествует химиотерапии. Обычно удаляют матку, яичники, участки кишечника, — словом, всё, что поражено злокачественной опухолью. Если злокачественное новообразование вызывает кишечную непроходимость или другие осложнения, проводят паллиативные хирургические вмешательства.
Для того чтобы уничтожить опухолевые клетки при первичном раке в полости живота, применяют химиопрепараты, зачастую те же, что при раке яичников. Лекарства вводят внутривенно или в брюшную полость — такая химиотерапия называется интраперитонеальной (внутрибрюшинной).
С 2018 года врачи Европейской клиники практикуют инновационный метод лечения канцероматоза брюшины — гипертермическую интраперитонеальную химиотерапию (HIPEC). Суть ее заключается в том, что хирург удаляет все достаточно крупные опухолевые очаги, а затем промывает полость живота подогретым раствором химиопрепарата. Это помогает уничтожить максимальное количество опухолевых клеток и существенно продлить жизнь больного.
При асците наши доктора проводят лапароцентез (прокол в брюшной стенке и выведение жидкости), устанавливают перитонеальные катетеры для постоянного оттока, проводят хирургические вмешательства, которые препятствуют дальнейшему накоплению асцитической жидкости.
На поздних стадиях проводится паллиативное лечение, которое помогает уменьшить симптомы и продлить жизнь больного.

Прогноз и профилактика
Прогноз при первичном раке брюшины напрямую зависит от того, удалось ли удалить все опухолевые очаги во время хирургического вмешательства. К сожалению, зачастую заболевание диагностируют на поздней стадии, поэтому после лечения часто развиваются рецидивы. Обычно пациентам требуется более одного хирургического вмешательства, курса химиотерапии.
Канцероматоз брюшины при метастазах других типов рака резко ухудшает прогноз. Обычно продолжительность жизни таких больных измеряется месяцами. Но HIPEC может ее существенно продлить, до нескольких лет — в случае, если проведение такого лечения возможно у конкретного пациента.
Специальных мер профилактики данного заболевания не существует. Нужно в целом вести здоровый образ жизни, женщинам — регулярно проходить осмотры у гинеколога. Мера профилактики метастазов в брюшину — своевременная диагностика и лечение злокачественных опухолей.
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
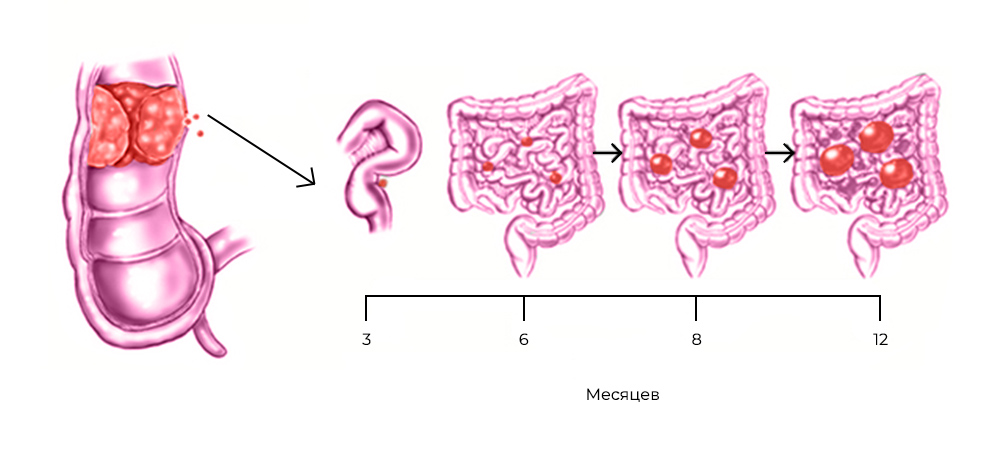
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
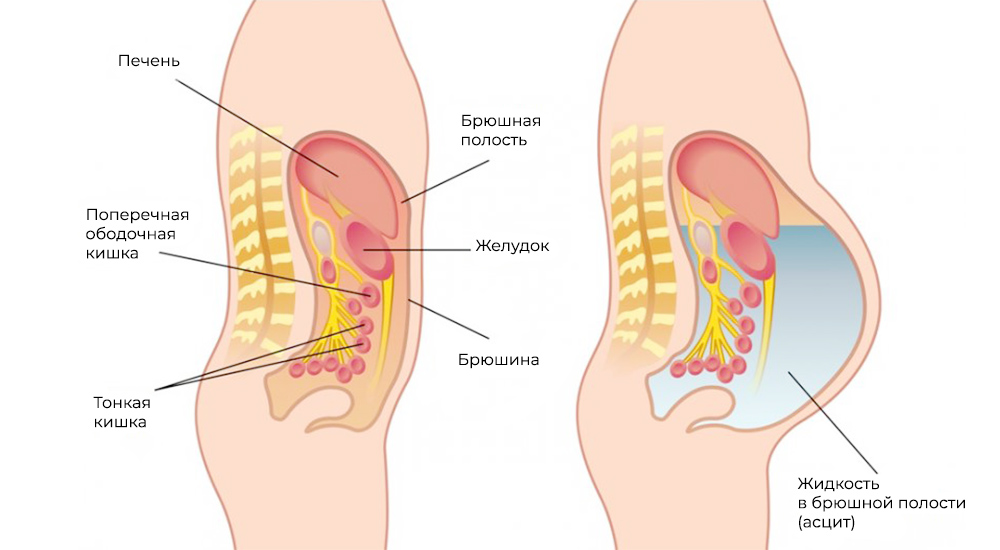
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
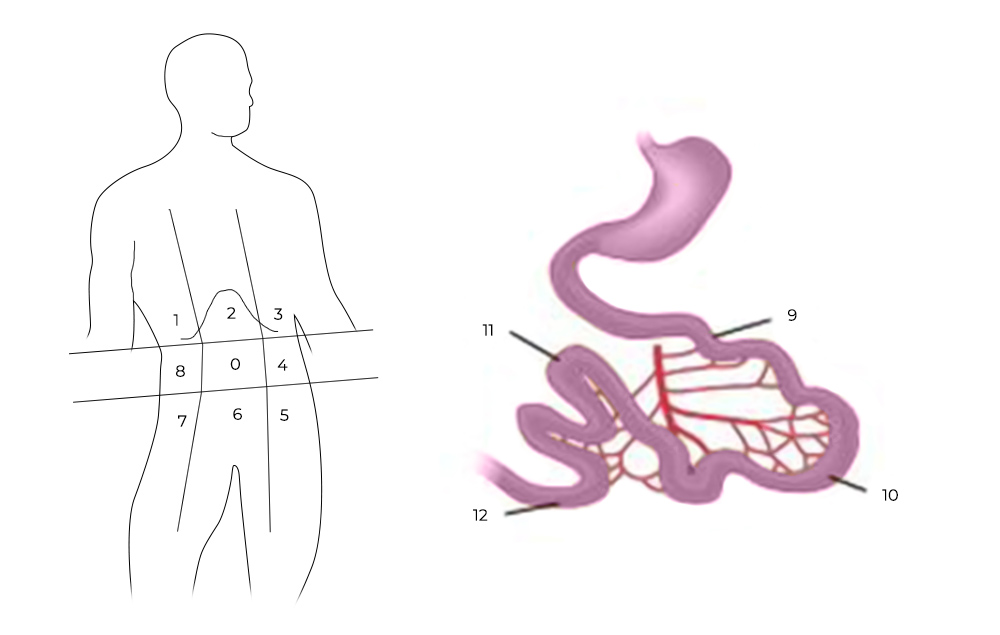
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
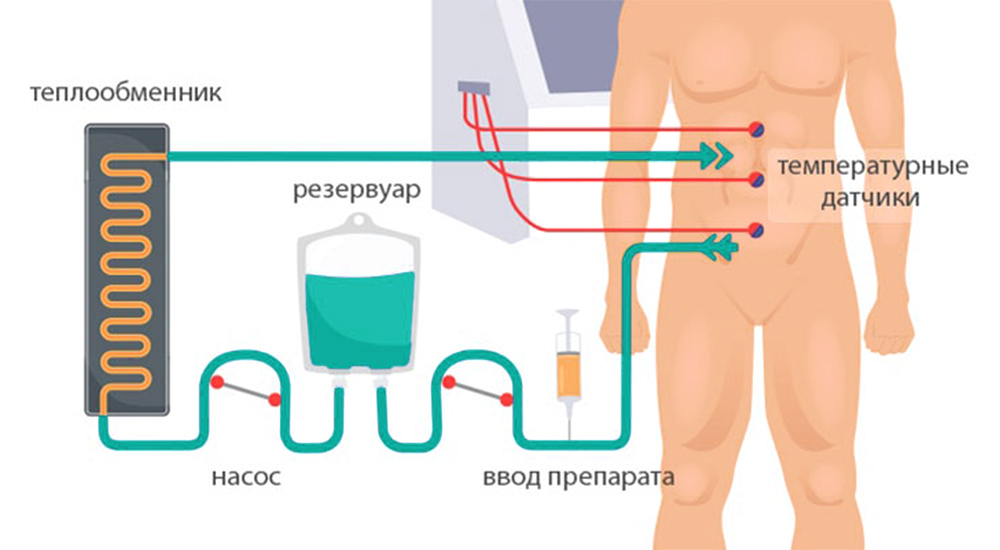
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
В последнее время в целях повышения эффективности химиотерапии опухолей брюшной полости внимание привлечено к внутрибрюшинному введению химиопрепаратов.
Данные позволили установить некоторые принципиальные особенности терапевтического действия внутрибрюшинно вводимых химиопрепаратов:
- 1) создание очень высоких концентраций противоопухолевых соединений в брюшной полости, позволяющее рассчитывать на успешное контактное ингибирование роста злокачественных клеток (за счет пенетрации)
- 2) общее, системное влияние химиопрепаратов на опухолевый процесс в брюшной полости после их попадания из полости рта в русло крови.
Л. О. Вигап (1985) констатировал- благоприятный результат лечения у 6 из 10 больных с опухолями брюшной полости. У 4 из них внутрибрюшинные поражения уменьшились в размерах более чем на 50%.Немногие, опубликованные к настоящему времени клинические работы, оставляют без ответа ряд вопросов, возникающих в связи с внутрибрюшинной химиотерапией.
Практически нет репрезентативных наблюдений, иллюстрирующих возможности внутриполостной химиотерапии при раке желудка, поджелудочной железы, печени, толстого кишечника, не отработаны схемы сочетаний различных препаратов, применение которых наиболее эффективно при той или иной локализации опухоли, недостаточно изучены осложнения при внутрибрюшинном введении противоопухолевых соединений. Интересны возможности сочетания системной и внутриполостной химиотерапии, разработка безопасного метода дренирования брюшной полости, особенно в случаях безасцитного течения опухолевого процесса.
На эти и другие, не прозвучавшие здесь вопросы, которые, вероятно, возникнут в ходе изучения проблемы, еще предстоит ответить в будущем.
Диагностика заболевания осуществлялась методами клинико-рентгенологического, радионуклидного и ультразвукового исследований. У 6 больных патологический процесс в брюшной полости верифицирован гистологическим исследованием ткани опухоли, у остальных — цитологическим анализом пунктата из нее. У всех пациентов был распространенный опухолевый процесс. В двух наблюдениях рака желудка и двух — рака толстого кишечника заболевание было осложнено асцитом.
Один курс полихимиотерапии получили 13 больных, трем больным проведено по два курса и трем — по три курса химиотерапии.Из противоопухолевых химиопрепаратов применяли фторурацил, платидиам, метотрексат, блеоцин, адриамицин, карминомицин, оливомицин. Лечение осуществлялось 3 или 4 химио-препаратами, вводимыми последовательно в течение 2—3 недель.
Основной была химиотерапия внутрибрюшинная , включающая 3 препарата: фторурацил, метотрексат и платидиам. В трех наблюдениях метотрексат был заменен блеоцином, в одном — адриамицином и еще в одном — карминомицином. Двое больных, помимо фторурацила, метотрексата и платидиама, получали: один больной — оливомицин, другой — карминомицин. Суммарная доза фторурацила коле-балась от 2000 до 5000 мг, метотрексата — от 60 до 200 мг, платидиама — от 50 до 250 мг, блеоцина — от 75 до 90 мг, карминомицина — от 40 до 50 мг. Доза оливомицина составила 90 мг, адриамицина —50 мг.
Непостоянная и умеренная болезненность наблюдалась при введении фторурацила, значительная — при инъекции противоопухолевых антибиотиков.
Введение ирригатора в брюшную полость при безасцитном течении бластоматозного процесса чревато возможностью повреждения внутренних органов. Проблему безопасного дренирования мы решаем, используя иглу Вериша, предназначенную для введения газа в брюшную полость. Под местным новокаиновым обезболиванием брюшная стенка пунктируется в левой подвздошной области. После удаления мандрена-предохранителя через просвет иглы в брюшную полость проводят пластиковый ирригатор с наружным диаметром 1 мм, насаженный на металлическую струну.
Последняя способствует прохождению пластиковой трубки через просвет иглы, так как без этой струны мягкость и сгибаемость трубки делают невозможным ее продвижение. Далее игла и струна последовательно удаляются. В свободный конец ирригатора вводят отрезок тонкой иглы с павильоном, который после введения химиопрепарата закрывается пробкой.Ирригатор фиксируют липким пластырем к коже живота.
При необходимости использования нескольких дренирующих трубок в разных точках передней брюшной стенки рекомендуется предварительно ввести через иглу Вериша в брюшную полость 2—3 литра кислорода, оттесняющего кишечник, обеспечивая тем самым безопасность и простоту введения ирригаторов.
Из 6 больных раком печени лечение оказалось эффективным у 4 больных. У 2 из них опухоль исходила из печеночных клеток, у двоих из клеток желчных ходов. В двух случаях безуспешного лечения опухоль имела гепатоцеллюлярное происхождение. В тех наблюдениях, когда результат химиотерапии позволял говорить о положительном терапевтическом эффекте (уменьшились размеры увеличенной печени и уровень билирубина, в брюшной полости прекращала накапливаться жидкость, улучшалось общее состояние), курс лечения повторялся через 1,5—2,0 месяца.
К этому времени у всех больных, поступивших для повторного курса, снова отмечались увеличение размеров печени и нарастание других клинических проявлений возобновившегося опухолевого роста. Эффективность повторного лечения была отмечена у одного больного после 2 курсов и еще у одного — после 3 курсов.
Из 5 больных, подвергнутых лечению по поводу рака желудка, благоприятный терапевтический эффект отмечен у двоих, течение процесса у которых осложнялось накоплением асцитической жидкости в брюшной полости. В одном из этих наблюдений проведено 3 курса полихимиотерапии, из которых 2 были успешными. Лечение остальных 3 пациентов прекращено досрочно из-за ухудшения общего состояния в процессе химиотерапии.
Лечение 4 больных раком толстого кишечника привело к благоприятному объективному результату в двух наблюдениях, осложненных накоплением асцитической жидкости.В группе, состоящей из двоих больных раком поджелудочной железы, одного больного раком желчного пузыря и одного больного с множественными метастазами в печень без выявленного первичного очага, уменьшение пальпируемой опухоли было отмечено у больного раком поджелудочной железы и у больного раком желчного пузыря.
Последнего пациента лечили дважды, но повторный курс химиотерапии ему не помог.Анализ непосредственных результатов внутрибрюшинной полихимиотерапии позволяет констатировать благоприятный терапевтический эффект у 10 больных из 19 (53%) подвергнутых лечению. В этих обнадеживающих наблюдениях имели место лишь частичное уменьшение опухоли и, в той или иной мере, купирование обусловливаемых ею осложнений.
Следует отметить, что в тех случаях, когда неопластический процесс осложнялся накоплением асцитической жидкости, ее рассасывание и в дальнейшем, при повторных курсах химиотерапии,— подавление асцитообразования происходили при незначительном или сомнительном уменьшении пальпируемой опухоли желудка или толстого кишечника. Эти наблюдения приводят к мысли о преобладании пенетрирующего действия введенных в брюшную полость химиопрепаратов по сравнению с системным влиянием на опухоль после попадания химиопрепаратов из брюшной полости в кровь.
Ремиссия продолжалась 1—3 месяца. При новообразованиях печени она была длительнее, чем при опухолях желудка и кишечника. У некоторых больных констатировали эффект после 2-го и 3-го лечебного курсов, но эффективность последующих курсов и продолжительность ремиссии между ними были меньше, чем после 1-го.
Помимо обычных побочных явлений, наблюдаемых при системной химиотерапии, внутрибрюшинное введение препаратов антрациклинового ряда вызывало клйнику перитонизма, ограничивая применение этих средств. Несмотря на тяжесть общего состояния пациентов, подвергавшихся лечению, умеренное угнетение гранулопоэза отметили только у троих больных, значительное (1,3-109/л) —у одного. Осложнения эти в дальнейшем были купированы медикаментозными средствами. Необходимо также отметить, что мы не наблюдали какие-либо осложнения при проведении дренажа в брюшинную полость и в связи с длительным его пребыванием в ней.
Подитоживая наш небольшой клинический опыт, необходимо отметить следующее.
- 1. Эффект внутриполостной химиотерапии отличается от наблюдаемого при системном введении химиопрепаратов высокой частотой благоприятных результатов (52%) и выраженной результативностью при асцитических формах бластоматозного процесса.
- 2. Опасность проведения дренажной трубки в брюшинную полость по используемой нами методике — минимальна
- 3. Не все имеющиеся в арсенале врача химиопрепараты можно вводить в брюшинную полость, поскольку после их введения развиваются явления перитонизма. Отсюда следует, что введенные в брюшную полость химиопрепараты обладают выраженным пенетрирующим действием, а потому существует проблема сочетания внутриполостной и системной химиотерапии.
Читайте также:

