Все кислоты и их соли с хлором формулы
15.1. Общая характеристика галогенов и халькогенов
Галогены ("рождающие соли") – элементы VIIA группы. К ним относятся фтор, хлор, бром и йод. В эту же группу входит и неустойчивый, а потому не встречающийся в природе астат. Иногда к этой группе относят и водород.
Халькогены ("рождающие медь") – элементы VIA группы. К ним относятся кислород, сера, селен, теллур и практически не встречающийся в природе полоний.
Из восьми существующих в природе атомов элементов этих двух групп наиболее распространены атомы кислорода (w = 49,5 %), за ним по распространенности следуют атомы хлора (w = 0,19 %), далее – серы (w = 0,048 %), затем – фтора (w = 0,028 %). Атомов остальных элементов в сотни и тысячи раз меньше. Кислород вы уже изучали в восьмом классе (гл. 10), из остальных элементов наиболее важными являются хлор и сера – с ними вы и познакомитесь в этой главе.
Орбитальные радиусы атомов галогенов и халькогенов невелики и лишь у четвертых атомов каждой группы приближаются к одному ангстрему. Это приводит к тому, что все эти элементы, представляют собой элементы, образующие неметаллы и только теллур и йод проявляют некоторые признаки амфотерности.
Общая валентная электронная формула галогенов – ns 2 np 5 , а халькогенов – ns 2 np 4 . Маленькие размеры атомов не позволяют им отдавать электроны, напротив, атомы этих элементов склонны их принимать, образуя однозарядные (у галогенов) и двухзарядные (у халькогенов) анионы. Соединяясь с небольшими атомами, атомы этих элементов образуют ковалентные связи. Семь валентных электронов дают возможность атомам галогенов (кроме фтора) образовывать до семи ковалентных связей, а шесть валентных электронов атомов халькогенов – до шести ковалентных связей.
В соединениях фтора – самого электроотрицательного элемента – возможна только одна степень окисления, а именно –I. У кислорода, как вы знаете, максимальная степень окисления +II. У атомов остальных элементов высшая степень окисления равна номеру группы.
Простые вещества элементов VIIA группы однотипны по строению. Они состоят из двухатомных молекул. При обычных условиях фтор и хлор – газы, бром – жидкость, а йод – твердое вещество. По химическим свойствам эти вещества сильные окислители. Из-за роста размеров атомов с увеличением порядкового номера их окислительная активность снижается.
Из простых веществ элементов VIA группы при обычных условиях газообразны только кислород и озон, состоящие из двухатомных и трехатомных молекул, соответственно; остальные – твердые вещества. Сера состоит из восьмиатомных циклических молекул S8, селен и теллур из полимерных молекул Sen и Ten. По своей окислительной активности халькогены уступают галогенам: сильным окислителем из них является только кислород, остальные же проявляют окислительные свойства в значительно меньшей степени.
Состав водородных соединений галогенов (НЭ) полностью отвечает общему правилу, а халькогены, кроме обычных водородных соединений состава H2Э, могут образовывать и более сложные водородные соединения состава Н2Эn цепочечного строения. В водных растворах и галогеноводороды, и остальные халькогеноводороды проявляют кислотные свойства. Их молекулы – частицы-кислоты. Из них сильными кислотами являются только HCl, HBr и HI.
Для галогенов образование оксидов нехарактерно, большинство из них неустойчиво, однако высшие оксиды состава Э2О7 известны для всех галогенов (кроме фтора, кислородные соединения которого не являются оксидами). Все оксиды галогенов – молекулярные вещества, по химическим свойствам – кислотные оксиды.
В соответствии со своими валентными возможностями халькогены образуют два ряда оксидов: ЭО2 и ЭО3. Все эти оксиды кислотные.
Гидроксиды галогенов и халькогенов представляют собой оксокислоты.
Хлор самый распространенный, а потому и важнейший из галогенов.
В земной коре хлор встречается в составе минералов: галита (каменной соли) NaCl, сильвина KCl, карналлита KCl·MgCl2·6H2O и многих других. Основной промышленный способ получения – электролиз хлоридов натрия или калия.
Простое вещество хлор – газ зеленоватого цвета с едким удушающим запахом. При –101 °С конденсируется в желто-зеленую жидкость. Хлор весьма ядовит, во время первой мировой войны его даже пытались использовать в качестве боевого отравляющего вещества.
Хлор – один из самых сильных окислителей. Он реагирует с большинством простых веществ (исключение: благородные газы, кислород, азот, графит, алмаз и некоторые другие). В результате образуются галогениды:
Cl2 + H2 = 2HCl (при нагревании или на свету);
5Cl2 + 2P = 2PCl5 (при сжигании в избытке хлора);
Cl2 + 2Na = 2NaCl (при комнатной температуре);
3Cl2 + 2Sb = 2SbCl3 (при комнатной температуре);
3Cl2 + 2Fe = 2FeCl3 (при нагревании).
Кроме того хлор может окислять и многие сложные вещества, например:
Cl2 + 2HBr = Br2 + 2HCl (в газовой фазе и в растворе);
Cl2 + 2HI = I2 + 2HCl (в газовой фазе и в растворе);
Cl2 + H2S = 2HCl + S (в растворе);
Cl2 + 2KBr = Br2 + 2KCl (в растворе);
Cl2 + 3H2O2 = 2HCl + 2H2O + O2 (в концентрированном растворе);
Cl2 + CO = CCl2O (в газовой фазе);
Cl2 + C2H4 = C2H4Cl2 (в газовой фазе).
В воде хлор частично растворяется (физически), а частично обратимо реагирует с ней (см. § 11.4 в). С холодным раствором гидроксида калия (и любой другой щелочи) аналогичная реакция протекает необратимо:
Cl2 + 2OH
= Cl
+ ClO
+ H2O.
В результате образуется раствор хлорида и гипохлорита калия. В случае реакции с гидроксидом кальция образуется смесь CaCl2 и Ca(ClO)2, называемая хлорной известью.
С горячими концентрированными растворами щелочей реакция протекает иначе:
3Cl2 + 6OH
= 5Cl
+ ClO3
+ 3H2O.
В случае реакции с KOH так получают хлорат калия, называемый бертолетовой солью.
Хлороводород – единственное водородное соединение хлора. Этот бесцветный газ с удушающим запахом хорошо растворим в воде (нацело реагирует с ней, образуя ионы оксония и хлорид-ионы (см. § 11.4). Его раствор в воде называют соляной или хлороводородной кислотой. Это один из важнейших продуктов химической технологии, так как расходуется соляная кислота во многих отраслях промышленности. Огромное значение она имеет и для человека, в частности потому, что содержится в желудочном соке, способствуя перевариванию пищи.
Хлороводород раньше получали в промышленности, сжигая хлор в водороде. В настоящее время потребность в соляной кислоте почти полностью удовлетворяется за счет использования хлороводорода, образующегося в качестве побочного продукта при хлорировании различных органических веществ, например, метана:
И лаборатории хлороводород получают из хлорида натрия, обрабатывая его концентрированной серной кислотой:
NaCl + H2SO4 = HCl + NaHSO4 (при комнатной температуре);
2NaCl + 2H2SO4 = 2HCl + Na2S2O7 + H2O (при нагревании).
Высший оксид хлора Cl2O7 – бесцветная маслянистая жидкость, молекулярное вещество, кислотный оксид. В результате реакции с водой образует хлорную кислоту HClO4, единственную оксокислоту хлора, существующую как индивидуальное вещество; остальные оксокислоты хлора известны только в водных растворах. Сведения об этих кислотах хлора приведены в таблице 35.
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее - оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным элементом.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к брому, и к йоду. Так например HBrO - бромноватистая кислота (соли гипобромиты), HIO - иодноватистая кислота (соли гипоиодиты).
HIO3 - иодноватая кислота (соли иодаты), HBrO3 - бромноватая кислота (соли броматы). По аналогии несложно составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
- Хлорноватистая кислота
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.

В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.

Хлористая кислота может быть получена из собственных солей - хлоритов, а также в реакции с оксидом хлора IV.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Самая сильная кислота в природе - хлорная кислота - может быть получение реакцией перхлората калия или натрия с концентрированной серной кислотой.

- Кислотные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная - к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
Разложение кислот и солей
И кислоты, и их соли разлагаются схожим образом.

KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Рис. 30. Сосуд для хранения летучих веществ с притертой пробкой и притертым колпаком.
Соляная кислота является сильным электролитом.
Соляная кислота — едкая жидкость, поэтому следует принимать меры предосторожности и при попадании на кожу или одежду немедленно смывать ее большим количеством воды и в дальнейшем нейтрализовать содой.
Соляная кислота обладает характерными свойствами кислот. Она изменяет окраску индикаторов, а также дает следующие реакции:
1) с металлами более активными, чем водород
Zn + 2НСl = ZnCl2 + H2
Zn0 + 2H + + 2Cl — = Zn 2+ + 2Cl — + H2↑
Zn0 + 2H + = Zn 2+ + H2
2) с основными окислами
MgO + 2HCl = MgCl2 + H2O
MgO + 2H + + 2Cl — = Mg 2+ + 2Сl — + H2O
MgO + 2H + = Mg 2+ + H2O
3) с растворимыми и нерастворимыми основаниями
NaOH + НСl = NaCl + H2O
Na + + ОН — + H + + Сl — = Na + + Cl — + H2O
Н + + OH — = H2O
Cu(OH)2 + 2НСl = CuCl2 + 2H2O
Сu(ОН)2 + 2Н + + 2Сl — = Cu 2+ + 2Сl — + 2H2O
Cu(OH)2 + 2H + = Cu 2+ + 2H2O
4) с солями
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
2Na + + CO 2 3 — + 2H + + 2Cl — = 2Na + + 2Cl — + H2O + CO2
2H + + CO 2 3 — = H2O + CO2
Особенно интересно взаимодействие соляной кислоты с растворимыми серебряными солями, например с нитратом серебра:
AgNO3 + НСl = AgCl + HNO,
Ag + + Cl — = AgCl
При этой реакции образуется белый творожистый осадок, нерастворимый в кислотах, но растворимый в аммиаке с образованием комплексного соединения.
Реакция с нитратом серебра является характерной качественной реакцией на соляную кислоту и ее соли.
С помощью этой реакции распознаются соляная кислота и ее соли.
Атом хлора в молекуле соляной кислоты, так же как и в молекуле хлористого водорода, находится в отрицательной степени окисления —1, поэтому в окислительно-восстановительных реакциях соляная кислота ведет себя как восстановитель.
Другие галогеноводородные кислоты весьма сходны с соляной кислотой. Некоторые особенности свойств имеются у плавиковой кислоты, которая в отличие от остальных кислот является слабым электролитом, так как фтор обладает высокой электроотрицательностью, небольшим (по сравнению с другими галогенами) радиусом атома и очень прочно удерживает около себя водород. Плавиковая кислота растворяет стекло. Главным компонентом стекла является двуокись кремния, которая реагирует с плавиковой кислотой, образуя четырехфтористый кремний:
4HF + SiO2 = SiF4 + 2H2O
Плавиковую кислоту никогда не хранят в стеклянной посуде. Ее хранят и перевозят либо в посуде, сделанной из парафина с воском (на парафин плавиковая кислота не действует), либо в каучуковых или эбонитовых сосудах.
Все остальные галогеноводородные кислоты являются сильными электролитами.
■ 27. Даны вода, поваренная соль, водород. Как, пользуясь этими веществами, можно получить соляную кислоту? Ответ подтвердите уравнениями реакций. (См. Ответ)
28. На 45 г поваренной соли подействовали 49 г серной кислоты. При этом получилось 12 г хлористого водорода. Можно ли из смеси, оставшейся в реакционном сосуде, получить еще хлористый водород, если ничего не прибавлять? Если да, то какой объем хлористого водорода может быть получен дополнительно?
29. Хлористый водород, полученный при действии концентрированной серной кислоты на 234 в поваренной соли, растворили в 354 г воды. Каковы процентная, молярная и нормальная концентрации этого раствора? (См. Ответ)
Галогеноводородные кислоты используются в разных областях народного хозяйства.
Применение соляной кислоты показано на схеме (рис. 31).
• Запишите в тетрадь области применения соляной кислоты.

Рис. 31. Применение соляной кислоты.
Соли галогеноводородных кислот
Соли галогеноводородных кислот — фториды, хлориды, бромиды и иодиды встречаются в природе в виде минералов.
Из хлоридов наибольшее значение имеет хлорид натрия, который встречается в природе как в виде каменной соли, образовавшейся на месте древних высохших соляных озер, так и в виде самосадочной соли, которая и в настоящее время осаждается в соляных озерах.
Поваренная соль кристаллизуется в виде кубических кристаллов, не имеет запаха, обладает соленым вкусом. Поваренная соль хорошо растворима в воде. С изменением температуры ее растворимость почти не меняется. Это имеет определенное значение при выделении поваренной соли из растворов других солей методом перекристаллизации.
О применении хлорида натрия можно судить по схеме, приведенной на, рис. 32.
• Запишите в тетрадь области применения поваренной соли.
Другая соль, широко распространенная в природе, — хлорид калия КСl. В природе он встречается в виде минерала сильвина КСl или сильвинита KCl-NaCl.
Хлорид калия применяется в сельском хозяйстве в качестве удобрения. До 1930 г. хлорид калия ввозился в нашу страну из-за границы. Благодаря исследованиям акад. Н. С. Курнакова около Соликамска найдено громадное месторождение хлорида калия.
Хлорид кальция СаСl2 — соль, содержащаяся в морской воде, но чаще всего получаемая искусственным путем. Интересным свойством хлорида кальция является его высокая гигроскопичность. Хлорид кальция энергично поглощает воду, поэтому его применяют в эксикаторах (рис. 33).

Рис. 32. Применение хлорида натрия.
Эксикатор служит для хранения веществ, которые необходимо предохранить от увлажнения парами воды, всегда присутствующими в воздухе. Это стеклянный сосуд, состоящий из двух частей, разделенных фарфоровой решеткой 3. В нижнюю часть сосуда 4 помещают хлористый кальций, концентрированную серную кислоту или другое вещество, энергично поглощающее воду. В верхнюю часть сосуда 1 на решетку 3 помещают чашку или тигель с высушиваемым веществом. Сверху эксикатор закрывают толстой стеклянной крышкой 2 с притертой поверхностью.
Хлористый кальций хорошо растворяется в воде. В твердом виде — вещество кристаллическое.
Хлорид бария ВаСl2 ядовит. Он широко применяется для борьбы с вредителями сельского хозяйства, а также в качестве реактива на серную кислоту и ее соли.
Хлорид серебра AgCl — творожистое белое вещество. Под действием света постепенно темнеет, разлагаясь с выделением металлического серебра.
Хлорид магния MgCl2—единственная соль, из которой в промышленности получают металлический магний.
Фторид натрия NaF довольно широко применяется в борьбе с грызунами и с некоторыми насекомыми-вредителями, а также для предохранения древесины от гниения. Фторидом натрия пропитывают шпалы, телеграфные столбы, строительные деревянные детали для удлинения срока их службы.
Плавиковый шпат, или флюорит, CaF, — наиболее распространенное соединение фтора, из которого получают все фтористые соединения и свободный фтор. Плавиковый шпат иногда встречается в виде правильных кристаллов с очень ценными оптическими свойствами. Из них изготовляют линзы, различные оптические приборы. Такие линзы приходится оберегать от толчков, так как они очень хрупкие.

Рис. 33. Эксикатор. 1-резервуар; 2 -притертая крышка; 3- фарфоровая решетка; 4 — хлорид кальция.
Из солей брома следует прежде всего отметить бромид магния MgBr2, который в природе сопровождает поваренную соль, а также хлорид калия. После извлечения поваренной соли из воды соляных озер в рассоле остается значительный процент бромида магния. Бромид магния встречается и в морской воде, но в очень небольших количествах, невыгодных для его промышленного получения.
Большое применение соли брома, главным образом бромиды натрия и калия, находят в медицине.
Бромиды сильно понижают возбудимость нервной системы. Но лечение бромистыми препаратами допустимо только при здоровых почках, иначе вследствие задержки выведения бромидов из организма может наступить отравление. Продолжительное лечение бромидами также не рекомендуется.
Бромид серебра AgBr обладает способностью легко разлагаться на свету с выделением металлического серебра в виде черной массы
2AgBr = 2Ag + Вr2.
Это свойство AgBr широко используется в фотографии.
Йодид серебра окрашен в желтый цвет, и, так же как хлорид и бромид серебра, он нерастворим в кислотах.
Реактивом на анионы Сl — , Br — , I — в кислотах и солях является катион Ag + , который даете этими анионами нерастворимые в воде и кислотах, по-разному окрашенные осадки: AgCl — белый, AgBr — желтоватый, быстро темнеющий, AgI — желтый. Анион F- таким образом открыть нельзя, так как AgF — соль растворимая.
• Выпишите в тетрадь формулы и названия всех приведенных в тексте солей галогенов, дайте им названия и постарайтесь возможно полнее перечислить, где они применяются.
■ 30. Каким образом из раствора иодида натрия можно удалить примесь свободного иода?
31. Йодкрахмальная бумага пропитана растворами крахмала и иодида калия. Почему при попадании в хлорную воду она синеет?
32. В пробирки налили растворы: в одну — хлорид натрия, в другую — бромид калия, в третью — иодид калия, в четвертую — фторид натрия. Как определить, в какой пробирке какая соль?
33. Соль, образовавшуюся при взаимодействии 20 г гидроксида магния и 20 л бромистого водорода, растворили в 40 мл воды. Какой процентной концентрации получился раствор. (См. Ответ)
Кислородные соединения галогенов
Среди кислородных соединений галогенов, в которых они проявляют положительные степени окисления, наиболее известны и получили наибольшее применение кислородные соединения хлора. Фтор не образует соединений, в которых он проявил бы положительную степень окисления, а бром и йод образуют, но практическое применение этих соединений значительно меньше.
Хлор может образовывать соединения не только с водородом и металлами, но и с кислородом. Правда, эти соединения никогда не образуются при непосредственном взаимодействии хлора с кислородом, но могут быть получены косвенным путем. В табл. 12 приведены окислы хлора, в которых он проявляет различные степени окисления.
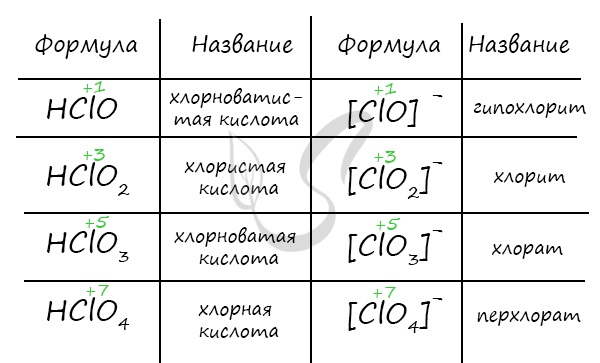
Кислородсодержащие кислоты хлора, НСlO4 – хлорная перхлораты НСlO3 – хлорноватая хлораты НСlO2 – хлористая хлориты НСlO – хлорноватистая гипохлориты
Кислородсодержащие кислоты (оксокислоты) хлора
В табл. 16.12 приведены систематические и традиционные названия кислородсодержащих кислот хлора и их солей. Чем выше степень окисления хлора в этих кислотах, тем выше их термическая устойчивость и силакислоты: 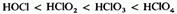
5 - сильные кислоты, причем 6 одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь частично диссоциируют в воде и
Таблица 16.12. Кислородсодержащие кислоты хлора и их анионы

существуют в водном растворе преимущественно в молекулярной форме. Среди кислородсодержащих кислот хлора только 7 удается выделить в свободном виде. Остальные кислоты существуют только в растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием егостепени окисления:
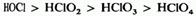
8 - особенно хорошие окислители. Например, кислый раствор 9:
1) окисляет ионы железа (II) до ионов железа (III):
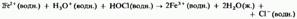
2) на солнечном свету разлагается с образованием кислорода:
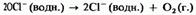
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат 10-ионы:
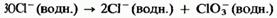
Соли кислородсодержащих кислот хлора
Эти соли обычно более устойчивы, чем сами кислоты. Исключением являются твердые соли хлораты (III), которые детонируют при нагревании и при соприкосновении с горючими материалами. В растворах окислительная способность кислородсодержащих солей хлора тем больше, чем больше в этих соляхстепень окисления хлора. Однако они не являются столь хорошими окислителями, как соответствующие кислоты. Натриевые и калиевые соли 11 имеют важное промышленное значение. Их производство и применения описаны в следующем разделе. Хлорат (V) калия обычно используют для лабораторного получения кислорода, в присутствии оксида 12 в качестве катализатора:
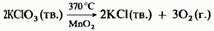
При нагревании этой соли до более низкой температуры в отсутствие катализатора происходит образование 13калия:
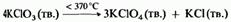
Иодат (V) калия 14 калия 15 сильные окислители, и в качестве окислителей они используются в количественном анализе.
Итак, повторим еще раз 1. Свойства галогенидов различных элементов при перемещении слева направо в пределах одного периода изменяются следующим образом: а) характер химической связи становится все более ковалентным и все менее ионным; б) водные растворы галогенидов становятся все более кислыми из-за гидролиза. 2. Свойства различных галогенидов одного и того же элемента при перемещении к нижней части VII группы изменяются следующим образом: а) характер химической связи галогенидов становится все более ковалентным: б) прочность связи в молекулах галогеноводородов уменьшается; в) кислотность галогеноводородных кислот уменьшается; г) легкость окисления галогеноводородов возрастает. 3. По мере возрастания степени окисления галогена происходят следующие изменения: а) термическая устойчивость его кислородсодержащих кислот возрастает; б) кислотность его кислородсодержащих кислот возрастает; в) окислительная способность его кислородсодержащих кислот уменьшается; г) окислительная способность солей его кислородсодержащих кислот возрастает. 4. Галогениды можно получать прямым синтезом из образующих их элементов. 5. Для получениигалогеноводородов может использоваться реакция вытеснения из галогенидной соли менее летучей кислотой. 6. Аномальные свойства соединений фтора: а) фторид серебра растворим в воде, а фторид кальция нерастворим; б) фтороводород имеет аномально высокие температуры плавления и кипения; в) водный раствор фтороводорода имеет низкую кислотность; г) фтор обнаруживает только одно устойчивое состояние окисления. Другие галогены обнаруживают множество состояний окисления, что объясняется промотированием их16 -электронов на легко доступные 17-орбитали, обладающие низков энергией.
31. Кислород. Получение и свойства кислорода. Аллотропия кислорода. Озон, его свойства. Озон в природе. Кислород-элемент с порядковым номером 8, его относительная атомная масса=15,999.Находится во втором периоде, в главной подгруппе 6 группы.
В большинстве своих соединений кислород имеет степень окисление -2.В пероксидах водорода и металлов(Н2О2, Na2O, CaO2 и др.)степень окисления кислорода -1.Существует единственное соединение, в котором кислород имеет положительную степень окисления +2-это фтроид кислорода OF2 (фтор-единственный элемент, ЭО которого больше ЭО кислорода, равной 3,5). Обычный кислород О2-газ без цвета и запаха, тяжелее воздуха. В воде малорастворим. Получение. Лабораторные методы получения О2 достаточно многочисленны. 1.Раздожение бертолетовой соли(хлората калия) при нагревании в присутствии оксида марганца(IV) в качестве катализатора: 2KClO3(t)(MnO2)=2KCl + 3O2↑
2.Термическое разложение перманганата калия: 2KMnO4(t)=K2MnO4 + MnO2 + O2↑
3.Термическое разложение нитратов щелочных металлов, например: 2NaNo3(t)=2NaNO2 + O2 4.Каталитическое разложение пероксида водорода: 2H2O2(MnO2)=2H2O + O2↑
5.Взаимодействие пероксидов щелочных металлов с углекислым газом: 2Na2O2 + 2CO2=2NaCO3 + O2↑ 6.Электролиз водных растворов щелочей или солей кислородосодержащих кислот. Сущность происходящих при этом процессов сводится к разложению воды под действием электрического тока: 2H2O(электролиз)=2H2↑ + O2↑
В промышленности кислород получают из воздуха. Химические свойства.
Кислород образует соединения со всеми химическими элементами, кроме легких инертных газов(He, ne, Ar),причем со всеми простыми веществами, кроме фтора, хлора, золота и платиновых металлов, он взаимодействует непосредственно. Во всех реакциях O2играет роль окислителя. При взаимодействии кислорода с простыми веществами -металлами и неметаллами- обычно образуются оксиды; например: 4Li+O2=2LiO2 4P+5O2(60 градусов)=2P2O5 Почти все реакции с участием O2 экзотермичны, за редким исключением; например: N2+O2=2NO-Q Кислород может существовать в виде двух аллотропных видоизменений: кислород О2 и озон О3. Аллотропия (от греч. allos — другой и tropos — образ, способ) связана либо с разным числом атомов в молекуле, либо со строением. При сравнении физических свойств кислорода и озона целесообразно вспомнить, что это газообразные вещества, различающиеся по плотности (озон в 1,5 раза тяжелее кислорода), температурам плавления и кипения. Озон лучше растворяется в воде. Кислород в нормальных условиях — газ, без цвета и запаха, озон — газ голубого цвета с характерным резким, но приятным запахом. Есть отличия и в химических свойствах.
Озон химически активнее кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами. Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании: 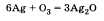
Но в то же время и озон и кислород реагируют с активными металлами, например с калием К. Получение озона происходит по следующему уравнению: 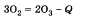
Реакция идет с поглощением энергии при прохождении электрического разряда через кислород, например во время грозы, при сверкании молнии. Обратная реакция происходит при обычных условиях, так как озон — неустойчивое вещество. В природе озон разрушается под действием газов, выбрасываемых в атмосферу, например фреонов, в процессе техногенной деятельности человека. Результатом является образование так называемых озоновых дыр, т. е. разрывов в тончайшем слое, состоящем из молекул озона.
Химические свойства: озон – сильный окислитель, он окисляет все металлы, в том числе золото – Au и платину – Pt (и металлы платиновой группы). Озон воздействует на блестящую серебряную пластинку, которая мгновенно покрывается черным пероксидом серебра – Аg2О2; бумага, смоченная скипидаром, воспламеняется, сернистые соединения металлов окисляются до солей серной кислоты; многие красящие вещества обесцвечиваются; разрушает органические вещества – при этом молекула озона отщепляет один атом кислорода, и озон превращается в обыкновенный кислород. Атакже большинство неметаллов, переводит низшие оксиды в высшие, а сульфиды их металлов – в их сульфаты: 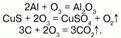
Йодид калия озон окисляет до молекулярного йода: 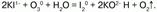
Но с пероксидом водорода Н2О2 озон выступает в качестве восстановителя: 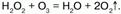
В химическом отношении молекулы озона неустойчивы – озон способен самопроизвольно распадаться на молекулярный кислород: 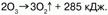
Нахождение в природе: в атмосфере озон образуется во время электрических разрядов. Применение: будучи сильным окислителем озон уничтожает различного рода бактерии, поэтому широко применяется в целях очищения воды и дезинфекции воздуха, используется как белящее средство.
32). Пероксид водорода, его строение и свойства.
Пероксид водорода H2O2 Молекула H2O2 неплоская, имеет строение H−O−O−H с σ-связью O−O на ребре и связями H-O на плоскостях двугранного угла:
На свету и под действием катализаторов (MnO2) легко разлагается (при нагревании - со взрывом): 2H2O2 = 2H2O + O2↑ Известны производные H2O2: Na2O2 - пероксид натрия BaO2 - пероксид бария Пероксиды при нагревании выделяют кислород: 2BaO2 = 2BaO + O2 реагируют с углекислым газом: 2Na2O2 + 2CO2 = 2 Na2CO3 + O2 (реакция используется для регенерации воздуха).
Пероксиды проявляют сильные окислительные свойства (O−I → O−II): 4H2O2 + PbS(т) = 4H2O + PbSO4↓ Na2O2(т) + 2H2SO4 + 2KI = 2H2O + I2↓ + Na2SO4 + K2SO4 и умеренные восстановительные свойства (O−I → O0): 2H2O2 + Ca(ClO)2 = CaCl2 + 2H2O + 2O2↑
5Na2O2(т) + 8H2SO4 + 2KMnO4 = 5O2↑ + 8H2O + 2MnSO4 + 5Na2SO4 + K2SO4 Получение H2O2: BaO2 + 2HCl(конц., хол.)= BaCl2 + H2O2 Пероксиды применяются как отбеливатели текстиля, бумаги, кож, жиров и минеральных масел, окислители ракетного топлива, реагенты в органическом синтезе, при осветлении картин старых мастеров (красочный слой, потемневший из-за перехода белил (гидроксокарбоната свинца в черный PbS) осветляют переводом в белый PbSO4). В промышлености пероксид водорода получают в основном электрохимическими методами, например, анодным окислением растворов серной кислоты или гидросульфата аммония с последующим гидролизом образующейся при этом пероксодвусерной кислоты H2S2O8. Происходящие при этом процессы можно выразить схемой: 2H2SO4 = H2S2O8 + 2H+ + 2e– ; H2S2O8 + 2H2O = 2H2SO4 + H2O2
В пероксиде водорода атомы водорода ковалентно связаны с атомами кислорода, между которыми также осуществляется простая связь. Строение пероксида водорода можно выразить следующей структурной формулой:H—O—O—H. Молекулы H2O2 обладают значительной полярностью, что является следствием их пространственной структуры. В молекуле пероксида водорода связи между атомами водорода и кислорода полярны (вследствие смещения общих электронов в сторону кислорода). Поэтому в водном растворе под влиянием полярных молекул воды пероксид водорода может отщеплять ионы водорода, т. е. он обладает кислотными свойствами. Пероксид водорода — очень слабая двухосновная кислота (K1 = 2,6•10–12); в водном растворе она распадается, хотя и в незначительной степени, на ионы: H2O2 H+ + HO2– Диссоциация второй ступени HO2– H+ + O22– практически не протекает. Она подавляется присутствием воды — вещества, диссоциирующего с образованием ионов водорода в большей степени, чем пероксид водорода. Однако при связывании ионов водорода (например, при введении в раствор щелочи) диссоциация по второй ступени происходит.
Читайте также:

