Внутрибрюшинная химиотерапия при раке яичника

Химиотерапия при раке яичников проводится практически всегда, но первым делом решается вопрос о возможности хирургического лечения.
Предполагается большая операция — с удалением не только обоих яичников, но и матки с трубами, и как фартук покрывающего органы брюшной полости, большого сальника. Вмешательство называется циторедуктивным, то есть с удалением всех обнаруженных опухолевых узлов, при невозможности полного удаления новообразования ограничиваются частичным, что значительно улучшает результат последующей химиотерапии.
Тактика лечения рака яичников
Рак яичников имеет несколько особенностей:
Вот на этой особенности и базируется хирургическая тактика с максимальной задачей — удалить всё злокачественное, когда это не удаётся, можно получить вполне хороший общий терапевтический результата, если останутся узелки размером менее сантиметра.
При самой минимальной стадии с низкой степенью злокачественности, когда женщина хочет сохранить возможность выносить и родить ребёнка, удаляется придаток с больным яичником и часть второго, резецируется сальник.
В каких ситуациях химиотерапия проводится до операции?
Циторедуктивная операция не выполняется при большой опухоли, неподвижной относительно внутренних стенок таза, что означает прорастание ракового конгломерата в кости. Операция невозможна технически, внутри таза находятся мочевой пузырь и прямая кишка, проходят крупные нервные стволы и магистральные сосуды, они тоже впаиваются в раковый узел, из которого их вычленить просто невозможно. В этой ситуации лечение начинают с химиотерапии, которую называют индукционной, после 2–3 курсов опухоль уменьшается и становится операбельной.
В каких случаях после операции не проводят химиотерапию?
Практически всегда после удаления рака яичников вне зависимости от того, остались ли в брюшной полости опухолевые узлы или всё было удалено, проводится химиотерапия. Исключение делается только при минимальном высокодифференцированном раке 1 стадии из несветлоклеточного типа клеток, то есть когда опухоль поражает один или оба яичника, но не вышла за его пределы и не проросла поверхностную капсулу, без признаков асцита. В медицинских документах такое положение обозначается как стадия 1А или 1В.
При более агрессивном варианте рака яичников со степенью злокачественности G2 или G3, а также при светлоклеточной форме при 1А и 1В стадий проводится 6 курсов химиотерапии.
При всех остальных стадиях всегда показана послеоперационная 6-курсовая химиотерапия, а если противоопухолевое лечение проводилось до хирургического вмешательства, то суммарное число курсов должно быть кратно шести.

Какие препараты используются при химиотерапии рака яичников?
Эффективны около десятка лекарственных препаратов, но в схемах первой линии используется шесть лекарств. В комбинацию вводят не более двух цитостатиков, как правило, это препарат таксанового ряда и производное платины.
Из таксанов предпочтение отдаётся паклитакселу, доцетаксел обладает чуть более выраженной токсичностью при чуть меньшей результативности и по факту применяется при непереносимости паклитаксела.
Паклитаксел может вводиться меньшими дозировками еженедельно или однократно в большей дозе, что не отражается на результате лечения, но переносимость малых доз лучше. Введение паклитаксела в течение нескольких дней курса в небольшой дозе называется метрономной химиотерапией, предполагается, что при таком способе клетки рака не вырабатывают устойчивости к лекарству, что не получило подтверждения в клинической практике.
Оба платиновых производных карбоплатин и цисплатин одинаково эффективны, но осложнения при химиотерапии вызывают разные. Карбоплатин негативно воздействует на клетки крови, цисплатин — на почечные канальцы, и оба лекарственных средства повреждают периферическую нервную систему. Длительность введения цисплатина втрое дольше, чем карбоплатина.
Стандарты предусматривают проведение ослабленным пациенткам или отягощённым хроническими заболеваниями монотерапии карбоплатином или комбинацией цисплатина с доксорубицином и циклофосфаном.
При малочувствительном к лекарствам муцинозном и светлоклеточном раке тоже используют цисплатин или оксалиплатин в сочетании с другими цитостатиками.
Сколько курсов химиотерапии назначают при раке яичников
Оптимальное число курсов всегда неизменно — шесть с интервалом в 3 недели.
Если химиотерапевтическое лечение проводилось до операции, то общее число должно быть кратно 6, в случае нарастающей после каждого курса регрессии опухоли можно довести и до 8 суммарных курсов.
Если при 4 стадии достигается регрессии или стабилизация процесса, то тоже ограничиваются шестью курсами с последующим наблюдением.
Применяются ли при заболевании таргетные препараты?
Пациенткам с 3 и 4 стадиями заболевания показано лечение таргетным препаратом бевацизумабом, ухудшающим кровоснабжение опухоли. Но при 3 стадии препарат вводится в схему только в случае неполной циторедукции, когда в брюшной полости остаются узлы более сантиметра, или вовсе не было операции. Бевацизумаб начинают вводить с 1–2 курса каждые 3 недели не меньше года или до появления признаков возобновления роста раковых узлов.
Обязателен бевацизумаб при рецидиве рака яичников, если он возник не во время использования таргетного препарата.
Когда полезно внутрибрюшинное введение химиопрепаратов?
При злокачественном процессе, сопровождающемся выработкой жидкости в брюшной полости, для улучшения состояния пациентки иногда требуется удаление избыточного асцита. Поскольку заболевание чувствительно к цитостатикам, после удаления асцита внутрь полости вводят химиопрепарат. Брюшная полость покрыта слизистой оболочкой, которая отлично всасывает лекарство, поэтому можно добиться быстрого результата.
В клинических исследованиях доказано, что внутрибрюшинное введение химиопрепаратов также эффективно, как и внутривенное. В стандарт послеоперационного лечения 3 стадии заболевания, когда остаточные опухоли не превышают сантиметрового размера, включено чередование внутрибрюшинного введения цисплатина и паклитаксела, причём последний вводится ещё и внутривенно в первый день каждого курса. Для такого многомесячного лечения во время циторедуктивной операции в брюшную полость устанавливается инфузионная порт-система.

Химиотерапия при рецидиве рака яичников
При возобновлении опухолевого роста, что регистрируется объективными методами исследования, например УЗИ, решается вопрос о проведении лекарственной терапии. Если при обследовании не находят новых узлов или увеличения размеров старых, а отмечается только двукратное увеличения уровня маркёра СА125, то пациентка просто наблюдается до появления признаков прогрессии заболевания.
- При развитии рецидива более чем через полгода после завершения последнего курса, в схему включается платиновый препарат и лекарство, не использовавшееся при первичном лечении.
- Если рецидив возник раньше полугода, опухоль считается устойчивой к платиновым производным, поэтому полезнее использовать лекарство, ранее не входившее в комбинацию.
- Если после завершения послеоперационной химиотерапии прошло более года, то эффект можно получить при использовании той же комбинации лекарств, что применялась раньше.
Разумеется, что во всех случаях рассматривается возможность оперативного лечения рецидивного процесса.
Химиотерапия рака яичников всегда сопровождается осложнениями, их можно уменьшить, если до начала лечения провести медикаментозную подготовку, а после завершения курса — реабилитационные мероприятия, и всё время осуществлять нутритивную поддержку — специальную диету, учитывающую исходное состояние, возможности тканей к восстановлению и сопротивляемости. В Европейской онкологической клинике решают все клинические и диагностические проблемы, потому что мы заинтересованы в хорошем результате не меньше наших пациентов.
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
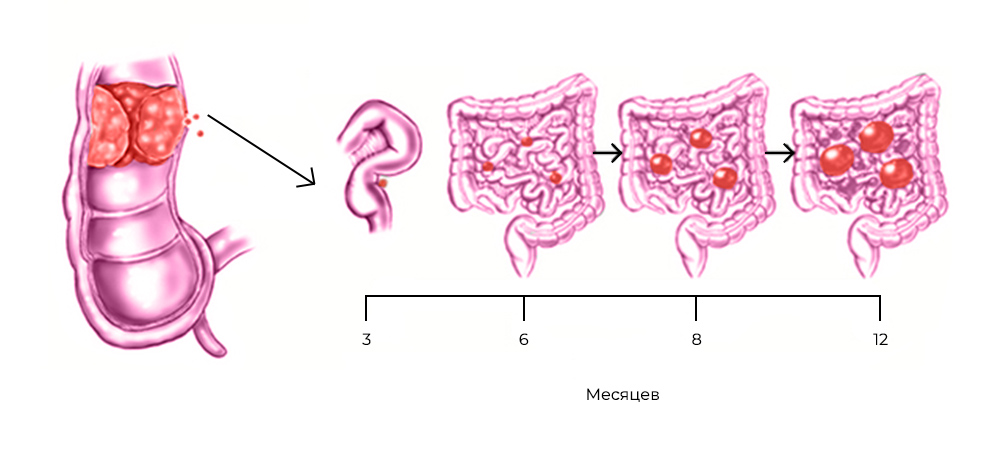
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
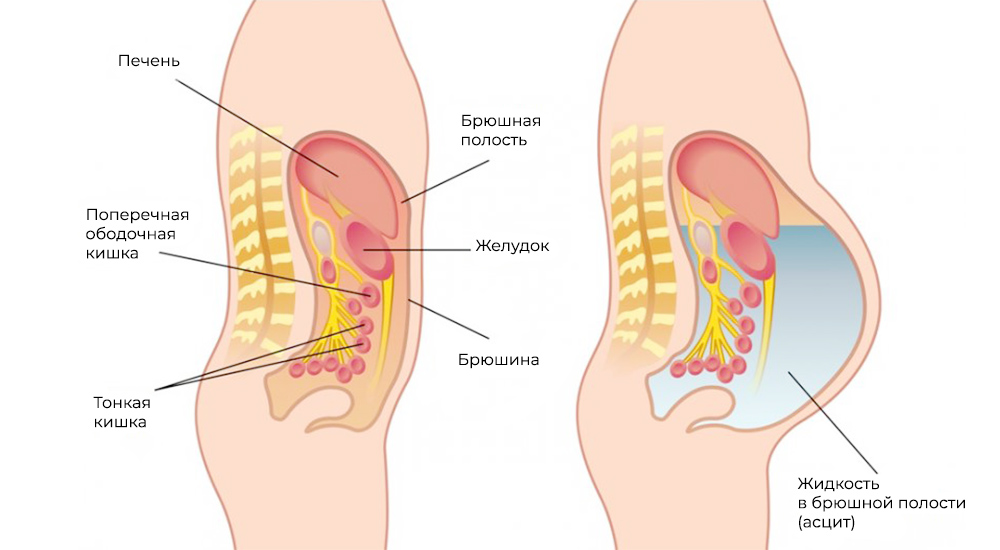
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
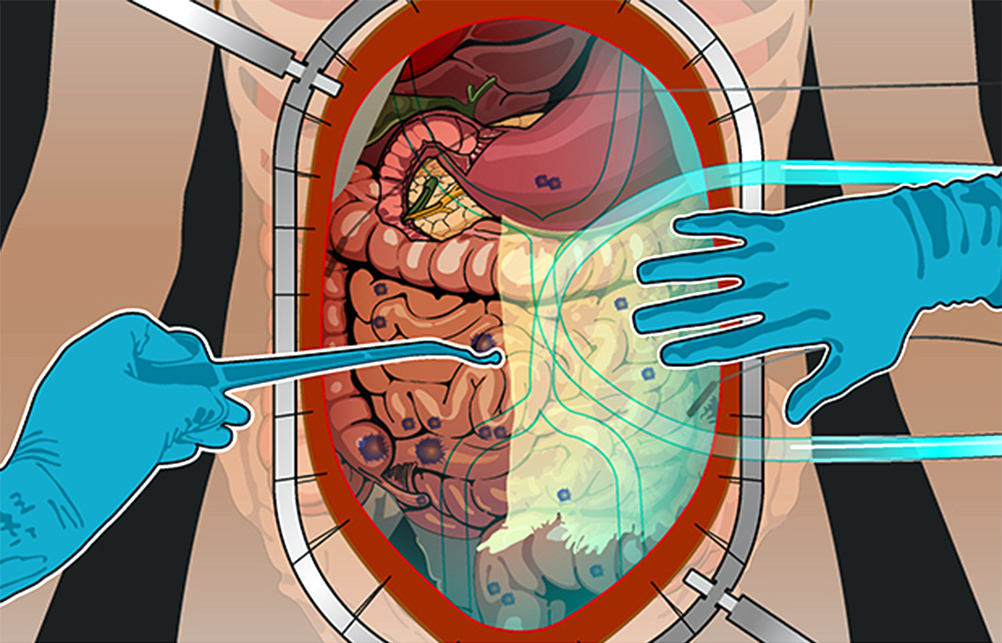
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
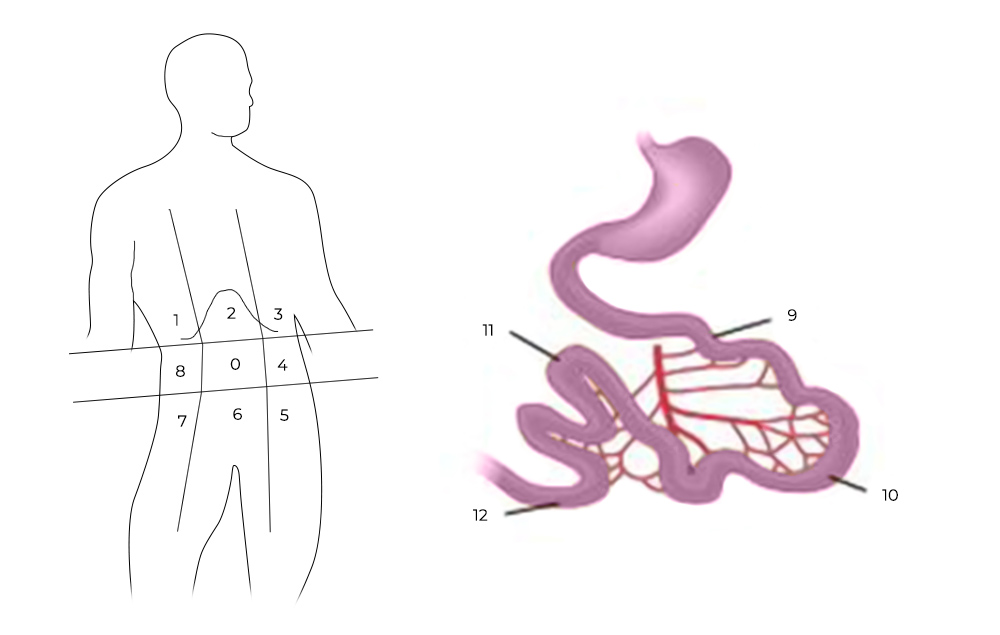
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
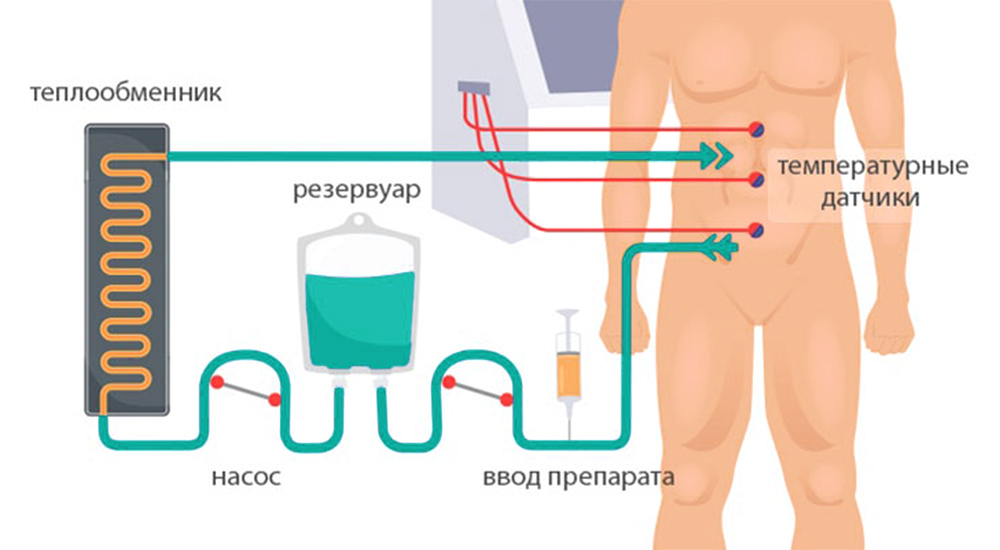
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Поиск новых более эффективных методов лечения обусловлен рядом клинических обстоятельств. Это и нарастающая частота рака яичников, и поздняя, как правило, диагностика заболевания в уже распространенной стадии (67%), и поразительная непредсказуемость клинического течения, даже если первичная опухоль небольшого размера, и, наконец, низкий процент 5-летней выживаемости (17—35%), — по существу, наиболее высокая смертность среди всех злокачественных новообразований женской половой сферы. Указанные обстоятельства подчеркивают актуальность научного поиска, связанного с повышением эффективности комплексного лечения рака яичников (Винницкая В. К., 1983). В этом плане, как нам представляется, необходимо исследовать возможность использования новых подходов для лечения рака яичников. При этом следует учитывать анатомо-физиологические особенности данной локализации рака.
Дело в том, что распространение процесса при раке яичников, как известно, происходит по брюшине и длительное время не выходит за ее пределы. Таким образом естественно формируется локальная мишень для химиопрепаратов. Это замкнутое пространство брюшной полости и малого таза, в котором располагаются все три элемента опухолевого роста: первичная опухоль, метастазы по брюшине и в сальнике, а также опухолевые клетки, взвешенные в асцитической жидкости (Detrick P.L., Myers С. Е. et al., 1978).
В этих условиях принципиально целесообразна внутрибрюшинная химиотерапия, которая обеспечивает непосредственный контакт химиопрепаратов с элементами опухоли. Такой подход подкрепляется данными Piver М. (1984), согласно которым скопления опухолевых клеток, даже при I стадии рака яичников навнешне интактном брюшинном покрове, при микроскопическом исследовании выявляются следующим образом: в области диафрагмы в 11,3%, на поверхности сальника — 3,3%, в промывных водах брюшной полости — 33%.
Это положение подкрепляется хорошо известной чувствительностью рака яичников к химиопрепаратам. Речь идет, таким образом, о максимальном радикализме химиотерапевтического лечения. Между тем, при системной химиотерапии максимальный радикализм ограничен функциональными возможностями кроветворной системы, уязвимостью других тканей (герминативный эпителий, эпителий желудочно-кишечного тракта и т.п.). В то же время внутрибрюшинная химиотерапия оказывает значительно меньшее общетоксическое влияние на макроорганизм по сравнению с системной химиотерапией (Markman М., 1987).
Таким образом, принцип внутрибрюшинной химиотерапии является очень важным при раке яичников, однако практическая реализация этого принципа ограничена во времени. В самом деле, внутрибрюшинную химиотерапию проводят лишь в послеоперационном периоде и до тех пор, пока функционирует трубка, введенная в брюшную полость (фактически не более 10 дней).
Другими словами, внутрибрюшинная химиотерапия при раке яичников практически оправдана во всех случаях: после нерадикальных операций для воздействия на остаточные, клинически видимые опухолевые элементы, а после так называемых радикальных операций для воздействия на комплексы опухолевых клеток в области брюшины. Значительные резервы внутрибрюшинной химиотерапии, связанные с непосредственным подведением химиопрепаратов к опухоли в высоких концентрациях и незначительными общетоксическими проявлениями, на самом деле не могут быть использованы из-за того, что метод ограничен во времени.
Отсюда, естественно, возникает идея пролонгированной химиотерапии, которая бы позволила вводить химиопрепараты внутрибрюшинно сколь угодно долго. Такой метод в идеале не должен снижать качество жизни больных и, с другой стороны, должен быть эффективен, надежен и прост в исполнении.
С учетом сказанного нами разработана методика перманентной внутрибрюшинной химиотерапии рака яичников. Смысл ее заключается в том, что в процессе операции в брюшную полость через переднюю брюшную стенку вводится два тонких полиэтиленовых катетера, наружные концы которых остаются на коже живота. Через эти катетеры, в любое время и в зависимости от необходимости, внутрибрюшинно можно вводить те или иные химиопрепараты, поддерживая необходимую им концентрацию.
Технически метод осуществляется следующим образом. После завершения оперативного вмешательства в области левого подреберья, по передней аксиллярной линии, отступи от нижнего края 11-го ребра на 2—3 см вниз, производят прокол со стороны кожи всей толщи передней брюшной стенки толстой иглой под контролем зрения так, чтобы кончик иглы вошел в свободную брюшную полость. Далее через просвет иглы в брюшную полость проводится тонкий полиэтиленовый катетер диаметром 2—3 мм. Катетер проталкивается до тех пор, пока его нижний конец не будет свисать в брюшную полость на расстояние 10—12 см от уровня прокола в брюшине. Далее игла извлекается наружу, при этом хирург со стороны брюшной полости пальцем или инструментом удерживает конец катетера. Таким образом катетер, после извлечения иглы, занимает ее место в толще брюшной стенки. При этом ткани брюшной стенки плотно охватывают катетер, как бы фиксируя его в заданном положении. Длина катетера подбирается с таким расчетом, чтобы его наружный конец отстоял от кожи примерно на 10—15 см. Аналогичная манипуляция производится и в области правого подреберья. Далее брюшная полость зашивается наглухо.
Катетеры, проведенные в брюшную полость, позволяют осуществлять внутрибрюшинную химиотерапию в течение неограниченного времени и дают возможность, в случае необходимости, непрерывного капельного орошения брюшной полости растворами химиопрепаратов. В соответствии с предложенной методикой внутрибрюшинная химиотерапия проводится обычно в течение месяца, после чего наружные концы микрокатетеров запаиваются раскаленным зажимом и фиксируются лейкопластырем к коже. При необходимости возобновить внутрибрюшинную химиотерапию запаянный конец катетера аккуратно срезается.
В этом случае, если в процессе оперативного вмешательства надвлагалищная ампутация матки оказалась технически выполнима, указанная методика дополняется следующей манипуляцией. Через цервикальный канал в культе шейки матки со стороны брюшной полости проводится толстая полиэтиленовая трубка (от одноразовой системы переливания крови), при помощи которой осуществляют дренаж полости малого таза. Это позволяет, во-первых, увеличить дозу химиопрепаратов, которые, омывая брюшную полость и полость таза, изливаются наружу через нижний дренаж. Кроме того, дренаж позволяет регулярно осуществлять цитологический контроль результатов лечения на его этапах. Нижний дренаж обычно удаляется через месяц, позволяя таким образом в процессе пролонгированной химиотерапии, по крайней мере, в самом ее начале, использовать максимальные дозы химиопрепаратов и своевременно эвакуировать из брюшной полости и полости малого таза продукты некробиоза.
Для внутрибрюшинной полихимиотерапии применялись следующие препараты: циклофосфан — курсовая доза 4000—6000 мг, Тио-ТЭФ — 200—400 мг, сарколизин — 300—400 мг, адриабластин — 80—120 мг, платидиам — 200 мг. Состав химиопрепаратов, последовательность их введения, интервалы между введениями и курсовая доза определялись индивидуально и зависели от оценки результатов предыдущей химиотерапии, чувствительности опухоли к тому или иному химиопрепарату, а также реакции организма на химиотерапию.
Обычно повторное введение химиопрепаратов применялось через 6 мес в тех случаях, когда операция была радикальной, и при этом в последующем периоде не отмечалось признаков рецидива или метастазов. В случае нерадикальной операции, на фоне клинической стабилизации процесса, указанная методика химиотерапии применялась через 3 мес.
Что же касается любых проявлений дестабилизации процесса, то они служили сигналом к немедленной повторной внутрибрюшинной химиотерапии.
Здесь следует обратить внимание на принципиально новую терминологию, которая по существу и определилась в процессе пролонгированной химиотерапии. Речь идет о клинической стабилизации и дестабилизации процесса, причем оба эти термина далеко не всегда коррелируются с наличием или отсутствием опухолевых масс. Дело в том, что, как видно из наших наблюдений, на фоне перманентной внутрибрюшинной. химиотерапии при обширных неоперабельных раках яичников, нередко наблюдается своеобразный феномен клинической стабилизации процесса, когда в течение длительного времени рост опухоли четко заторможен на фоне благоприятного общего состояния. В конечном счете дестабилизация наступает, но и она не всегда является фатальной, ибо повторные курсы внутрибрюшинной химиотерапии в ряде случаев позволяют получить повторную стабилизацию процесса.
Таким образом, использование перманентной внутрибрюшинной полихимиотерапии дает возможность не только в течение длительного времени сохранить жизнь тяжело больным, но и открывает принципиально новый феномен стабилизации опухолевого роста, который характеризует своеобразный статус больной, когда радикального излечения нет, но в то же время болезнь клинически не прогрессирует.
По данной методике было всего пролечено 42 больные с опухолями яичников, из них 11 после надвлагалищной ампутации матки с придатками с экстирпацией большого сальника, однако с остаточными опухолевыми элементами в брюшной полости, и 31—после нерадикального вмешательства. Средний возраст больных составил 52 года. Во всех случаях процесс был верифицирован гистологически и распределялся следующим образом: аденокарцинома — 60,7%, папиллярный рак— 17%, цистаденокарцинома — 22,3%.
Для оценки эффективности предложенной нами методики был проведен сравнительный анализ результатов лечения в контрольной группе из 68 больных раком яичников, получавших в после-операционном периоде внутрибрюшинную химиотерапию по обще-принятой методике с последующей системной химиотерапией. В этой группе надвлагалищная ампутация матки с придатками с экстирпацией большого сальника была выполнена в 18 случаях с остаточной опухолевой инфильтрацией в брюшной полости и в 50 случаях — нерадикальная операция. Клинический материал, характеризующий сказанное, представлен в табл. 1 и 2.

При сопоставлении данных, полученных в основной и контрольной группах, видно, что сроки появления рецидивов в контрольной группе значительно короче и дестабилизация процесса происходит быстрее.
Важно отметить, что в группе больных, получавших пролонгированную внутрибрюшинную химиотерапию, у первично неоперабельных в 7 случаях удалось произвести оперативное вмешательство, тогда как в контрольной группе такие случаи не имели места.
На основании проведенного нами исследования можно сделать следующие выводы:
1. Предложенный метод пролонгированной внутрибрюшинной химиотерапии прост и высокоэффективен, надежен и не сопровождается серьезными осложнениями.
2. Он позволяет значительно увеличить продолжительность жизни больных раком яичников.
3. Перманентное использование полиэтиленовых микроирригаторов не снижает качества жизни больных.
4. Полученный эффект при применении данной методики позволил определить принципиально новый клинический феномен — стабилизацию и дестабилизацию процесса при раке яичников.
Читайте также:

