Вирусы могут участвовать в злокачественном
Главная > Консультации > Детский врач > Существуют ли инфекции, способные спровоцировать рак? Онкогенные инфекции
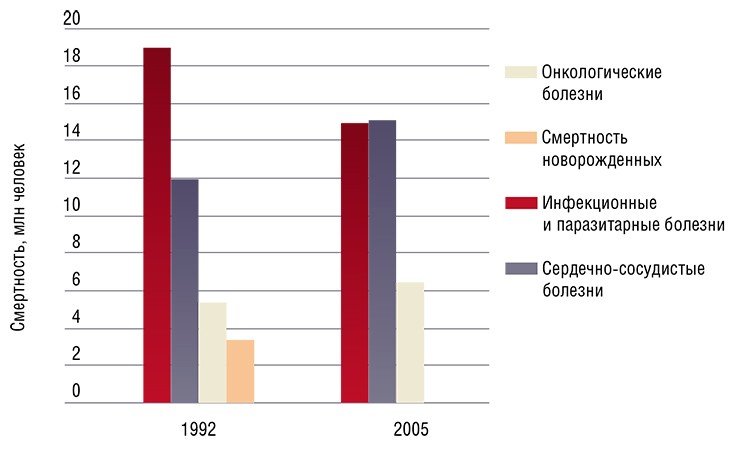
В настоящее время доказано, что от 15 до 20% новообразований человека имеют вирусное происхождение.
Вирусами называют мельчайшие организмы, большую часть из которых нереально разглядеть, даже используя обыкновенный микроскоп. Они состоят из небольшого количества ДНК и РНК генов, которые находятся в белковой капсуле. Эти вирусы проникают в живые клетки, где впоследствии начинают размножаться. Бывают также вирусы вызывающие рак, которые могут помещать свою ДНК в клетки, в скором времени спровоцировав появление онкологических заболеваний. Характерной чертой онкогенных вирусов является то, что они могут стимулировать клетки размножаться с необычно высокой скоростью, что может привести к повреждению генетического материала в этих клетках. Дополнительные факторы, такие как курение или воздействие определенных канцерогенов, могут вызывать окончательное превращение нормальных клеток в раковые. Эти воздействия (дополнительные факторы), наряду с индивидуальными генетическими особенностями каждого человека, могут объяснить, почему у некоторых людей с онкогенными инфекциями развивается рак, а у других нет.
К онковирусам относятся инфекции, которые провоцируют появление раковых заболеваний, а также вирусы, которые способствуют развитию воспалительных процессов, носящих хронический характер.
По заключению экспертов Международного Агентства по Изучению Рака (МАИР) прямым канцерогенным действием на человека обладают следующие вирусы:
- вирусы гепатита В и С, вызывающие рак печени;
- определенные типы папилломавирусов человека, являющиеся причинным агентом рака шейки матки, некоторых опухолей ано-генитальной области и других локализаций;
- вирус Эпштейна-Барр, принимающий участие в возникновении целого ряда злокачественных новообразований;
- герпесвирус человека 8-го типа, играющий важную роль в возникновении саркомы Капоши, первичной выпотной лимфомы, болезни Кастлемана и некоторых других патологических состояний;
- вирус Т-клеточного лейкоза человека, являющийся этиологическим агентом Т-клеточного лейкоза взрослых, перHIVной выпотной лимфомы (Primary Effusion Lymphoma, PEL), а также тропического спастического парапареза (TSP) и ряда других неонкологических заболеваний;
- вирус иммунодефицита человека (ВИЧ), не обладающий трансформирующими генами, но создающего необходимые условия (иммунодефицит) для возникновения рака.
Все они включены в санитарные правила и нуждаются в кратких комментариях.
В настоящее время существует глобальная эпидемия вируса гепатита В (HBV): на планете инфицировано этим вирусом более 350 млн. человек. Каждый год от инфекции HВV умирает 2 млн. человек, из них более 300 тыс. от рака печени. Вирусом гепатита С в мире инфицировано более 170 млн. человек, и их число ежегодно увеличивается на 3–4 млн. По данным экспертов, вирус гепатита С ежегодно становится причиной смерти 250–350 тыс. человек от цирроза, печеночной недостаточности и гепатоцеллюлярной карциномы. Из общего числа случаев рака печени (гепатокарцином) более половины связано с инфицированием HBV, четверть — с инфицированием HCV и 22% случаев — с другими причинами.
Инфицированность населения HBV колеблется от низкой, не превышающей 2% в США и странах Западной Европы, до высокой в странах Африки и Юго-Восточной Азии, приближающейся к 10%. Россия по уровню инфицированности населения HBV занимает промежуточное положение. В окружающих Россию странах (Средняя Азия, Закавказье, Молдавия) инфицированность населения по данным ВОЗ достигает 8%.
Пути заражения вирусом гепатита В (HBV): перинатальный (от матери к плоду), парентеральный (главным образом с кровью или другими биологическим жидкостями больного человека, попадающими непосредственно в кровь инфицируемого, особенно при употреблении инъекционных наркотиков) и половым путем. Заразиться можно в местах, где собираются лица, употребляющие инъекционные наркотики, в салонах пирсинга и татуажа, парикмахерских (маникюр, педикюр — при совместном пользовании общими бритвами и маникюрными принадлежностями). Половой контакт с партнером носителем инфекции в 30% случаев заканчивается инфицированием партнера. Велика вероятность заразиться вирусом, если человек имеет много половых партнеров. У инфицированной HBV матери может родиться инфицированный ребенок. Заражение происходит при родах или нарушении целостности плаценты в ходе беременности. Вирус гепатита B обнаруживается в слюне, слезах, моче и кале инфицированных лиц. Риск заражения, хотя и незначительный, существует при попадании их на поврежденную кожу и слизистые оболочки другого человека. С пищей, при разговоре, т. е. контактно-бытовым путем гепатит В не передается.
Пути заражения вируса гепатита С (HCV): в основном такие же как при HBV. Половой путь передачи гепатита С мало актуален (не более 3–5%), однако значение его возрастает при наличии большого количества партнеров, случайных связей. От инфицированной матери плоду вирус гепатита С передается редко, не более, чем в 5% случаев и только в процессе родов при прохождении родовых путей. Не отмечена передача вируса с молоком матери и контактно-бытовым путем.
Профилактика. Исходя из вирусной природы указанных заболеваний, вакцинация является наиболее эффективным способом предотвращения распространения инфекции, возникновения острого и хронического гепатита, а, следовательно, и рака печени. В 1980 г. приготовлена вакцина против вируса гепатита В. Согласно рекомендациям, принятым в 1999 г. в США и практикуемым в России, вакцина рекомендована для лиц от 0 до 19 лет. В настоящее время во многих странах мира, включая Россию, введена обязательная вакцинация против гепатита В (HBV) среди новорожденных, детей раннего возраста, подростков и лиц из групп риска. С целью профилактики распространения HBV и рака печени проводится тестирование всех беременных и доноров крови на поверхностный антиген вируса (HbsAg) и антитела к нему (HBs).
Вирусы папилломы человека (HPV) принадлежат к группе Papillomavirus и являются вирусами, которые поражают клетки эпителия эктодермального происхождения (кожа, слизистые половых органов, ротовой полости).
В настоящее время известно более 100 типов HPV, которые могут вызывать бородавки на различных частях тела, но лишь немногие из них связывают с различными злокачественными новообразованиями. Некоторые штаммы вируса папилломы распространяются половым путем и вызывают остроконечные бородавки. Передаваемые половым путем вирусы папилломы связаны с развитием рака шейки матки, полового члена и анального прохода (последние встречаются не так часто). К группе высокого онкогенного риска относят наиболее распространенные в Европе и в России 16-й и 18-й типы вируса (HPV 16 и HPV 18), а также менее распространенные 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы, ответственные, соответственно, за возникновение 65–75% и 18–20% случаев рака шейки матки (РШМ). Раннее обнаружение и лечение может уменьшить риск рака шейки матки, поэтому врачи советуют женщинам с выявленными вирусами папиломы периодически проводить тест мазок Папаниколау. Вирус папилломы человека является довольно распространенными венерическим заболеваниям с несколькими миллионами новых случаев инфицирования, диагностируемых каждый год.
Пути заражения. Передача инфекции осуществляется половым путем, возможны перинатальный (от матери к плоду) и оральный пути заражения. Большинство лиц обоего пола инфицируется вирусом в первые годы половой жизни. В последние 20–30 лет уровень инфицированности существенно возрос. У 90% женщин HPV инфекция протекает без явных клинических проявлений и вирус исчезает самостоятельно через год после инфицирования под влиянием иммунной системы организма. В трети случаев вирусную ДНК можно выявить более чем через год и в 10% — более чем через два года. Инфекция данным вирусом очень распространена среди здоровых женщин. К 50-летнему возрасту ею переболевает 8 женщин из 10.
Факторами риска для развития рака шейки матки служат раннее начало половой жизни, частая смена партнеров, сопутствующие урогенитальные инфекции (например, хламидийная или герпетическая), снижение клеточного иммунитета, гормональные воздействия (аборт, беременность, прием гормональных контрацептивов и др.), курение, неправильное питание (дефицит фолиевой кислоты), а также индивидуальные генетические особенности.
Вирус Эпштейн-Барра широко известен как вирус, который вызывает инфекционный мононуклеоз. Вирусом Эпштейн-Барра инфицировано практически всё население планеты. В развивающихся странах почти у каждого ребенка к пятилетнему возрасту выявляются антитела к этому вирусу. В развитых странах инфицированность несколько меньше: в США антитела выявляются у 50% выпускников средних школ, к сорока годам антитела к этому вирусу появляются у 90% населения. 15–25% взрослых являются выделителями вируса.
Данный вирус передается через контакт с жидкостью полости рта и носа инфицированного человека. Дети редко имеют выраженные симптомы вируса Эпштейн-Барра, но даже если они есть, симптомы, как правило, являются такими же, как при широко распространенных вирусных инфекциях. Вирус Эпштейн-Барра после заражения остается в организме, главным образом в лимфоцитах, всю остальную части жизни человека. Он находится в состоянии покоя в течение большей части времени, иногда проявляя себя, но не причиняя никакого реального вреда. При ослаблении организма и снижении защитных сил иммунной системы — вирус может активироваться и вызывать более агрессивные воздействия. Вирус Эпштейн-Барра ассоциируется, в первую очередь с развитием лимфобластомы, болезни Ходжкина, лимфомы носоглотки и лимфомы Беркитта, редкой формой рака, возникающего в лимфатических узлах. Кроме лимфобластомы, следует назвать такие вызываемые вирусом доброкачественные и злокачественные новообразования, как волосатоклеточная лейкоплакия полости рта, рак носоглотки и др., возникающие на фоне иммунодефицита организма различного происхождения.
Пути заражения. Основной путь передачи вируса — воздушно-капельный, но наиболее часто передача вируса происходит при непосредственных контактах слизистой рта (поцелуях). Заражение возможно и через содержащие вирус пищевые продукты, а также бытовым путём через руки и предметы обихода, при переливании крови и других парентеральных вмешательствах. Зафиксирован также половой путь передачи.
Ко-факторы. Поскольку у большинства лиц, инфицированных EBV, какой-либо патологии не возникает, то для ее появления, включая злокачественные новообразования, очевидно, необходимо воздействие на организм дополнительных факторов. Среди известных следует назвать паразитарные инфекции типа малярии; массивную инфекцию EBV в. раннем детском возрасте; ослабление иммунной системы; хроническое недоедание, а также использование в пищу продуктов, обладающих коканцерогенным действием; влияние любых факторов, вызывающих хромосомные мутации. Таким образом, можно сделать вывод, что инфицирование EBV является важным, но недостаточным условием для возникновения ассоциированных с ним онкологических заболеваний, чтобы возникла опухоль, необходимо действие ряда дополнительных факторов.
Открытый в 1994 г. герпесвирус саркомы Капоши в семействе герпесвирусов обозначен под номером 8 (HHV-8). В настоящее время считается доказанной его этиологическая роль в возникновении довольно редко встречающихся заболеваний, а именно саркомы Капоши (СК), выпотной В-клеточной лимфомы полостей тела (PEL) и болезни Кастлемана.
Распространенность HHV-8. Инфицированность населения HHV-8 в различных географических регионах существенно отличается и варьирует от долей процента в США и большинстве стран Западной Европы до 8–10% в странах Средиземноморья (Греция, Италия). Самый высокий процент серопозитивных лиц обнаружен в странах Восточной, Центральной и Западной Африки — странах, эндемичных для СК, где уровень инфицированности населения этим вирусом достигал 50–70%. В России уровень инфицированности HHV-8 среди доноров крови находится в пределах 4%.
Пути заражения. Основной путь передачи HHV-8 — половой, но также со слюной (при поцелуе), и с кровью (редко).
Профилактика. Учитывая половой путь передачи вируса основной профилактической мерой является практика безопасного секса, лечение хронического уропростатита у больных с выявленным HHV-8 в эякуляте и/или секрете предстательной железы, применение противовирусных препаратов в группах риска (больные, нуждающиеся в трансплантации органов и ВИЧ-инфицированные).
Профилактическая анти-вирусная (противоопухолевая) вакцина не создана, над ее изготовлением ведется работа.
Вирус Т-клеточного лейкоза человека (HTLV-1) — это онкогенный ретровирус, являющийся этиологическим фактором Т-клеточного лейкоза/лимфомы взрослых, протекающей чрезвычайно агрессивно со средней продолжительностью жизни около 6 месяцев, и нейро-дегенеративного заболевания под названием HTLV-1-ассоциированная миелопатия или тропического спастического парапареза. В регионах с высокой инфицированностью данным вирусом диагностируются также ассоциированные с вирусом увеиты, артриты, базедова болезнь, инсулинзависимый диабет, синдром Цезаря и др.
Распространенность. Спорадические случаи HTLV-1 инфекции встречаются во многих странах мира, включая Россию. Эндемичными же для этой инфекции являются некоторые регионы Японии, Южной Америки, Африки и часть стран Карибского бассейна.
Пути заражения. Существуют 3 основных пути передачи инфекции от инфицированных лиц: а) с молоком матери; б) при половом контакте главным образом через сперму; и в) с переливаемой кровью при гемотрансфузиях.
Ко-факторы. У большинства лиц, инфицированных HTLV-1, какой-либо патологии не возникает. После заражения вирусом ATL регистрируют не более чем у 1–5% вирусоносителей даже в эндемических для этого заболевания регионах и после длительного латентного периода, длящегося порой десятилетиями. Факторами, способствующими развитию ATL, являются паразитарные инфекции типа эписторхоза, использование иммунодепрессантов любого происхождения, ВИЧ-инфекция и др.
Профилактика. Для профилактики инфекции рекомендованы: отмена кормления грудным молоком младенцев инфицированными матерями; предохраняемый секс и контроль на присутствие HTLV-1 донорской крови не только в регионах с высоким уровнем распространения HTLV-1 среди населения, но и в других, т. к. переливание инфицированной вирусом крови, может способствовать его распространению и появлению заболеваний, связанных с HTLV-1 там, где они сейчас отсутствуют.
Этот вирус был открыт в 1983 г. и его ассоциация с синдромом приобретенного иммунодефицита (СПИД) доказана в 1984 г. Как уже упоминалось ранее, ВИЧ не обладает трансформирующим геном (онкогеном). Инфицированные им клетки (главным образом СD4+ Т-клетки и макрофаги) не подвергаются усиленной пролиферации (делению), а разрушаются, вызывая у инфицированного лица нарастающую степень иммунодефицита, и создавая тем самым условия, необходимые для возникновения опухоли. Доказано, что у больных СПИД`ом примерно 50% новообразований ассоциировано с Эпштейн-Барр вирусом или герпес вирусом саркомы Капоши (HHV-8). Чаще всего у таких больных диагностируют саркому Капоши либо одну из разновидностей не-ходжкинских лимфом. Характеристика этих новообразований, механизмы канцерогенеза, а также методы профилактики и лечения даны в предыдущих разделах, их можно найти также в многочисленных отечественных и зарубежных публикациях.
Несмотря на различную организацию онкогенных вирусов человека, неодинаковый спектр их клеток-мишеней, они обладают рядом общих биологических свойств, а именно:
- вирусы лишь инициируют патологический процесс, усиливая пролиферацию (разрастание ткани организма путём размножения клеток делением) и генетическую нестабильность инфицированных ими клеток;
- у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования возникает среди сотен, иногда тысяч инфицированных;
- продолжительность латентного периода от инфицирования до возникновения опухоли составляет иногда десятилетия;
- у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска, с более высокой возможностью ее возникновения;
- для злокачественной трансформации инфицированных клеток в организме человека необходимы дополнительные факторы и условия, приводящие к возникновению опухоли.
Профилактика активации вирусов и развития рака
- отказ от курения;
- коррекция питания и образа жизни;
- сокращение воздействия канцерогенных веществ;
- повышение защитной функции организма;
- определение и терапия заболеваний, находящихся в предраковой стадии;
- наблюдение групп высокого риска появления онкологий;
- диагностика рака на ранних стадиях.
Можно ли заразиться раком от больного человека, либо от носителя вируса?
То, что окружающие в безопасности рядом с онкобольными людьми, уже неоднократно доказано и подтверждено проведенными опытами. В 19 веке французским хирургом был выделен экстракт рака молочной железы. Затем он ввел его себе, и еще нескольким людям, участвовавшим в опыте добровольно, этот экстракт под кожу. В месте, куда была проведена инъекция, начались острые воспалительные процессы, которые прошли спустя несколько дней. Опыт в скором времени был проведен еще раз и результаты оказались те же.
Современные ученые также проводили исследования, которые подтвердили, что заразиться раком от другого человека невозможно. Медицинские работники провели анализ 350 тысяч процедур переливания крови, проводимые в течение 35 лет. У трех процентов доноров был обнаружен рак, однако ни один из людей, которым переливали кровь онкобольных, не был заражен.
Еще один важный вывод после проведенных медицинских исследований — генетика на появление раковых образований влияет гораздо больше, чем вирусы и другие факторы. Это значит, что попавший в организм онковирус имеет в развитии рака практически нулевую значимость, тогда как сбой в генетическом коде — ключевую.
Выводы
Вирусы, вызывающие рак — очень опасны для жизни и здоровья человека. Их профилактика и своевременная диагностика поможет максимально снизить риск появления серьезных последствий. При появлении каких-либо признаков вирусной инфекции необходимо срочно обратиться к компетентному специалисту и сдать анализы, которые помогут их выявить и вовремя принять необходимые меры.
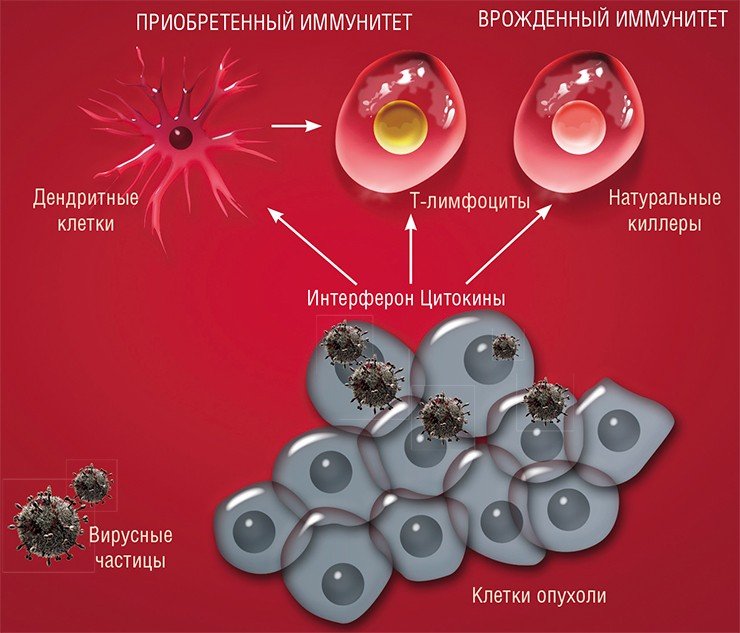
По-видимому, есть вирусы, которые паразитируют на человеке, размножаясь ограниченно в группах клеток и не причиняя видимого вреда своему хозяину. Однако при определенных условиях они могут мутировать с образованием более патогенных вариантов. В этом случае возникает острая вирусная инфекция, которая заканчивается, когда в организме сформируется специфический иммунитет к патогену.
Но несмотря на относительно слабую изученность вирусного сообщества человека, практически сразу после открытия вирусов был обнаружен удивительный факт: у онкобольных вирусная инфекция может повлиять на протекание злокачественного процесса. Были зафиксированы случаи улучшения состояния таких пациентов и даже наступление длительной ремиссии после перенесенного вирусного заболевания либо вакцинации.
На основе этой информации еще в начале XX в. родилась идея использовать вирусы в борьбе с раковыми заболеваниями человека.
Взлеты и падения
Возможность создания принципиально новой формы терапии онкологических заболеваний, основанной на присущей вирусам способности убивать клетки, в которых он размножается, была впервые показана в середине прошлого века на примере рака шейки матки (Newman, 1954).
В результате удалось выделить и типировать ряд непатогенных для людей энтеровирусов, на основе которых были созданы живые энтеровирусные вакцины для профилактики сезонных вирусных заболеваний. При этом в ряде случаев удалось наблюдать положительный клинический эффект и в отношении злокачественных заболеваний, вплоть до полного исчезновения первичной опухоли и метастазов.

В ходе дальнейших исследований вакцинотерапию получили более полутора тысяч больных на поздних стадиях опухолевого процесса, и у части из них было отмечено улучшение состояния (Ворошилова, Ваганова, 1969; Ворошилова и др., 1977; Ворошилова, 1988).
Но уже в начале 1990-х гг. онколитические вирусы вновь стали объектом пристального внимания исследователей после публикации работы, посвященной лечению глиобластомы модифицированным вирусом простого герпеса (Martuza, 1991).
За последующие десятилетия благодаря выдающимся достижениям в молекулярной биологии и генетике и стремительному развитию биотехнологических методов исследования удалось проделать огромную экспериментальную работу по описанию специфических взаимодействий онколитических вирусов с раковымм клетками и выявить перспективные для терапии вирусные штаммы и типы опухолей, которые они могут поражать.
Почему же вирусы – и не какая-нибудь специфическая группа, а все в целом – поражают в первую очередь именно опухолевую ткань? Причин этому несколько.
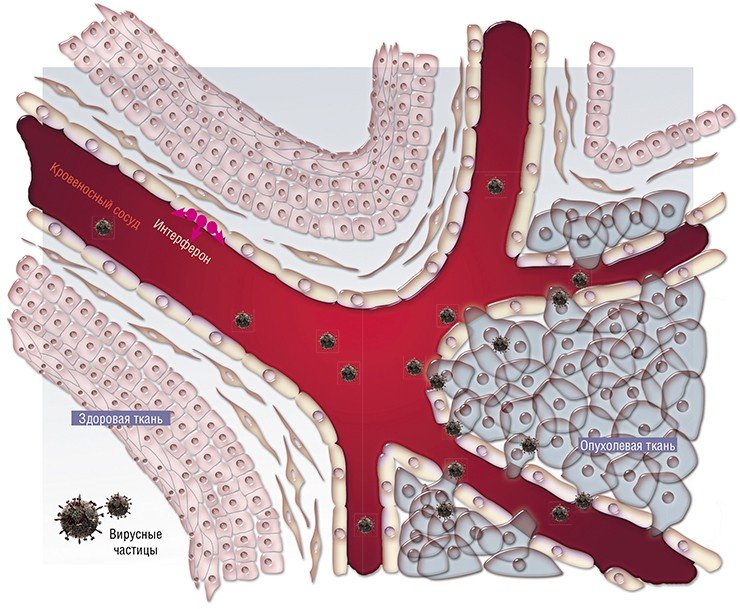
Таким образом, первая причина высокой чувствительности раковых клеток к вирусам – их физическая доступность.
Вторая причина связана со способами размножения самих инфекционных агентов. Дело в том, что вирусы в этом смысле не самодостаточны и используют для размножения ресурсы зараженной клетки. Обычно это происходит тогда, когда клетка сама находится в процессе деления и в ней присутствуют все ферменты, необходимые для репликации генетического материала и синтеза белков.
Некоторые вирусы имеют специальные механизмы, которые позволяют перевести клетку из покоящегося состояния в делящееся (к ним относятся и так называемые онкогенные вирусы, например, вирус папилломы, который вызывает рак шейки матки именно за счет стимуляции клеточного деления). Однако очень многие вирусы могут размножаться только в уже активно делящихся клетках, например, клетках слизистой (которая, как известно, в первую очередь поражается при сезонных вирусных инфекциях). И в этом смысле раковые клетки, главное занятие которых – деление, особенно беззащитны перед вирусной интервенцией.
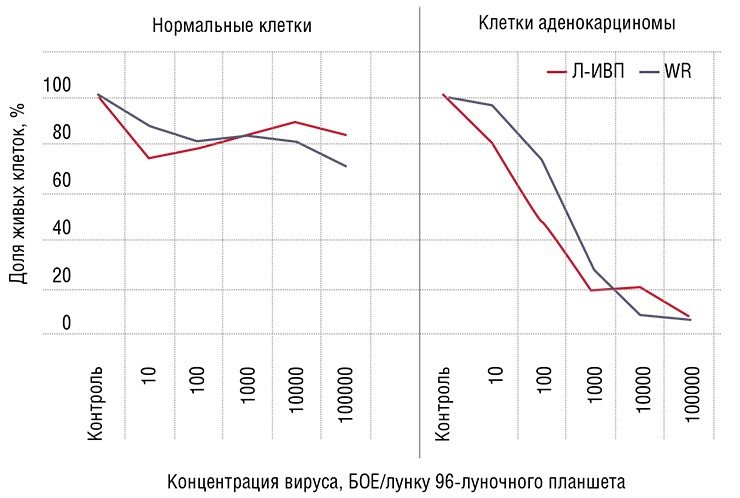
Здоровые – в безопасности
Таким образом, раковые клетки по милости самой природы служат готовой мишенью для вирусов. С использованием современных биотехнологий сегодня можно создавать вирусные препараты, которые будут специфически поражать и уничтожать только раковые клетки, не затрагивая здоровые.
Поэтому мишенью вируса должны стать хаотичные скопища активно делящихся клеток. При этом в первую очередь будут поражаться наименее дифференцированные, наиболее злокачественные клетки. Здоровые же дифференцированные клетки будут защищены от проникновения такого дефектного вируса механизмами противовирусной защиты.
Персональный подход
Для решения этой задачи, в частности, проводится селекция вирусов на их способность размножаться в различных культурах раковых клеток. На основе анализа генетической структуры таких вирусов можно определить, какие из приобретенных вирусом мутаций делают его наиболее действенным в отношении определенного типа опухолевых клеток.
Имея панель таких онколитических вирусов, можно будет, взяв биопсию опухоли от конкретного пациента, подобрать для него наиболее эффективный набор вирусных штаммов. Причем эту процедуру можно повторять по мере лечения, поскольку сама опухоль может меняться, ускользая от действия онковируса. В таком случае сможет помочь уже другой вариант вируса, а так как он будет отличаться по антигенной структуре от предыдущего, то не уничтожится под действием механизмов противовирусного иммунитета, сформировавшегося в ходе предыдущего лечения.
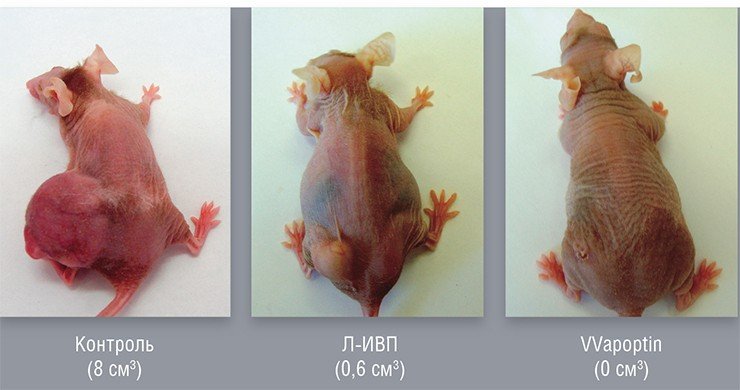
СИБИРСКИЙ КАНЦЕРОЛИЗИН
Онколитические вирусы можно дополнительно вооружить и генами, продуцирующими в раковой клетке белки, опасные лишь для этих клеток. Например, белок апоптин, выделенный из вируса птичьей анемии, по еще не совсем понятному механизму вызывает самоубийство исключительно только раковых клеток. На основе вируса осповакцины генно-инженерным способом уже создан такой штамм, способный эффективно уничтожать клетки опухоли человека, подсаженные лабораторным мышам.
Еще одна проблема терапии с помощью онколитических вирусов связана с разработкой наиболее эффективных способов их введения в организм. Ведь на пути вируса в организме встает много барьеров. К примеру, та же печень, являющаяся своего рода мощнейшим антивирусным фильтром.
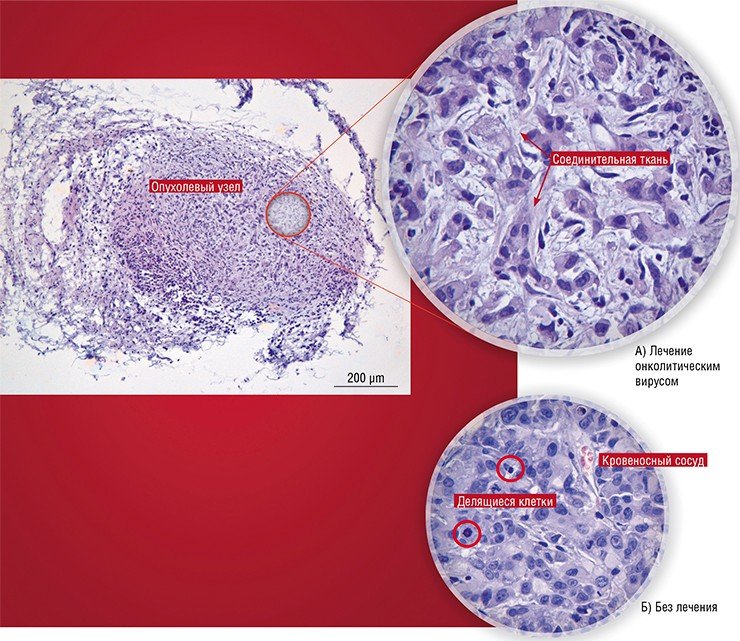
За и против
В настоящее время, несмотря на все успехи в изучении онколитических свойств вирусов, их применение в онкотерапии является, скорее, исключением, чем правилом.
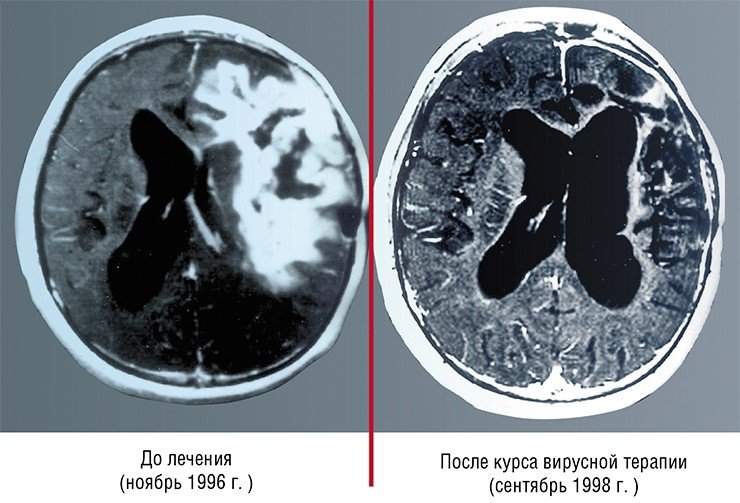
Так, разработанный в США препарат сегодня применяется с согласия пациента при лечении глиобластомы в качестве дополнительной терапии. В Китае лицензирован и успешно применяется для терапии карцином один из штаммов аденовируса, несущий две генетические делеции (Yu, 2007).
В Латвии после распада СССР были продолжены работы по изучению онколитических вирусов, начатые в рамках противополиомиелитных исследований. В результате на основе одного из энтеровирусов был создан и сегодня используется на практике препарат Ригвир, направленный против меланом, который можно вводить непосредственно в кровяное русло.
Всего же сегодня в мире проходят клинические испытания свыше тридцати разнообразных онколитических вирусных препаратов. И основная проблема здесь не столько научная, сколько экономическая. Дело в том, что терапия рака (в первую очередь химиотерапия) – это большие деньги. В условиях сложившегося и процветающего рынка химиотерапевтических препаратов применение новых, пусть даже и более безопасных биотерапевтических средств потребует весьма дорогостоящей перестройки всей системы лечения. А это не может не затронуть интересы крупных фармацевтических компаний.
Стратегия таких компаний в отношении нарождающихся разработок в области онколитических вирусов неоднозначна. Так, права на один из первых онколитических препаратов ONYX-015 вместе с самой компанией-разработчиком были приобретены одной известной фармацевтической фирмой, после чего исследования по этой теме были закрыты. С другой стороны, по¬скольку полностью остановить прогресс в этой области невозможно, уже сегодня во многих фармацевтических компаниях создаются подразделения, занимающиеся изучением вирусных онколитиков. Оптимизма добавляет и тот факт, что за последние пятнадцать лет число работ по этой тематике растет как снежный ком.
Одновременно с прогрессом в создании вирусных противораковых средств в обществе, как и в случае пресловутых генетически модифицированных организмов (ГМО), возникают разнообразные фобии и слухи. Они во многом базируются на недостаточной осведомленности широкой общественности в сути дела и раздуваются благодаря действиям некоторых заинтересованных компаний.
Действительно, вопрос о безвредности тех или иных вирусов пока изучен не до конца. Поэтому приходится мириться с тем, что на пути к широкому внедрению этих очень перспективных методов лечения рака будут вставать многие преграды. В любом случае, исследователи должны действовать очень обдуманно, осторожно взвешивая все возможные последствия.
Но, как учит история науки, подобные проблемы всегда вставали на пути любого нового перспективного метода лечения и, как правило, успешно преодолевались.
Сейчас крепнет уверенность, что знания, накапливающиеся в области вирусологии, иммунологии, биологии клетки и других смежных дисциплин, позволят (и уже позволяют!) создавать такие варианты вирусов, которые будут не только эффективно и избирательно уничтожать раковые клетки, не затрагивая нормальные, но еще и стимулировать в организме естественные механизмы противоопухолевой защиты.
В будущем основой для терапии рака могут стать искусственные вирусы. Уже сейчас дальней целью разработок московских и новосибирских специалистов является создание модульной вирусной системы (в будущем – полностью синтетической) – своего рода молекулярного конструктора, из которого исследователь по желанию сможет собрать из отдельных генетических компонентов нужный вариант онколитического вируса.
Такие синтетические вирусы не должны структурно напоминать природные. Это важно потому, что схожие вирусы способны рекомбинировать друг с другом, обмениваясь участками своего генома, благодаря чему терапевтический вирус может приобрести неполезные гены и, соответственно, нежелательные, опасные свойства. Можно разработать такой синтетический вирус, который по функциям и общему плану строения будет похож на природный, но по нуклеотидной последовательности будет настолько от него отличаться, что утратит способность к рекомбинации со своими природными собратьями.
Ворошилова М. К. Полезные для организма непатогенные штаммы энтеровирусов: профилактическое и лечебное их применение. М.,1988. С. 24–29.
Качко А. В. и др. Рекомбинантная плазмидная ДНК pAd5 f, несущая фрагмент генома аденовируса 5 типа с делецией в гене Е 1 В 55 К, и штамм мутантного аденовируса Adel2, обладающий селективной противоопухолевой активностью. Патент РФ № 2194755 (467) 05.03.01.
Качко А. В. и др. Варианты аденовируса типа 5 с делениями в ранних генах: способность к селективной репликации в р53 дефектных опухолевых клетках человека // Молекулярная биология. 2003. № 37 (5). С. 868–875.
Martuza R. L.et al. Experimental therapy of human glioma by means of a genetically engineered virus mutant//Science. 1991. V. 252. P. 854–856.
Первый за Уралом
Победители первого конкурса научных мегагрантов Правительства РФ, направленных на поддержку исследований под руководством ведущих ученых в российских вузах, были названы в октябре 2010 г. Всего на конкурс подавалось 507 заявок, которые были рассмотрены международными экспертами и утверждены Советом по грантам. Победители, среди которых оказался и Новосибирский национальный исследовательский государственный университет, получили финансирование в размере 150 млн рублей
Новосибирский национальный исследовательский государственный университет (НГУ) получил в 2010 г. три мегагранта правительства РФ, один из которых под руководством д.б.н., профессора П. М. Чумакова, предназначался для создания университетской лаборатории по исследованию онколитических вирусов.

В 2010—2012 гг. за счет средств мегагранта и софинансирования в НГУ реконструированы помещения для проведения практических занятий по микробиологии и частично – по аналитической химии. На этой базе был создан исследовательский комплекс из лаборатории микробиологии и вирусологии (руководитель П. М. Чумаков) и лаборатории бионанотехнологий (руководитель – проректор по научной работе НГУ, д.б.н., профессор С. В. Нетесов).
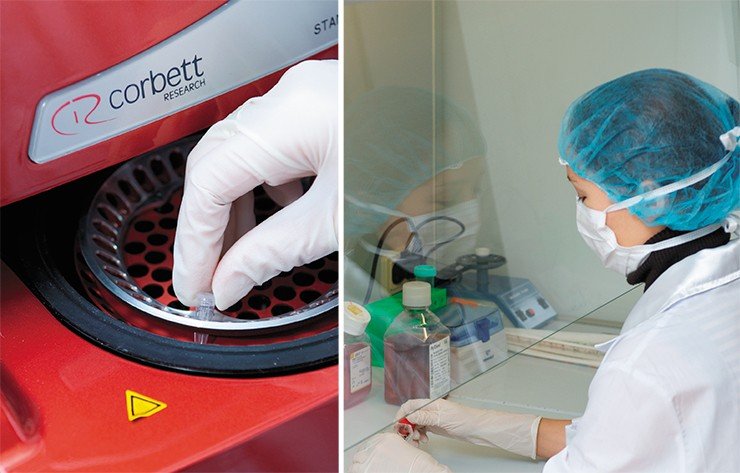
В вирусологическом боксе, оснащенном всем необходимым современным оборудованием для высокопроизводительной работы с непатогенными вирусами и их геномами, могут одновременно проводить исследования три сотрудника. Весной 2013 г. заканчивается реконструкция помещений для генно-инженерных работ, секвенирования геномов, а также биоинформационных и биотехнологических исследований.

В штат лабораторий вошли на долговременной основе несколько специалистов – докторов и кандидатов наук, а также аспиранты и студенты, ориентированные на научные исследования и разработки в самых современных областях микробиологии и молекулярной биологии. Во-первых, это изучение молекулярного разнообразия геномов вирусных возбудителей желудочно-кишечных и респираторных заболеваний человека и животных на территории азиатской части России. Во-вторых – создание онколитических рекомбинантных вирусов, а также бактерий, производящих рекомбинантные биологически активные белки человека, которые на сегодня признаются одними из самых перспективных противораковых препаратов.
Таким образом, принимая во внимание наличие в Научно-образовательном комплексе по наноматериалам и наносистемам НГУ нескольких суперсовременных электронных микроскопов, можно с утверждать, что в университете вступил в строй первый за Уралом современный лабораторный мини-комплекс по изучению микроорганизмов и разработке на их основе новых биомедицинских приложений.
Работы по этой тематике планируется проводить в сотрудничестве с передовыми биотехнологическими компаниями Новосибирской области и всего Сибирского федерального округа, а также, в случае взаимной заинтересованности, и с ведущими зарубежными предприятиями аналогичного профиля.
* Этот уровень биологической безопасности, по зарубежной классификации, используется для работы с возбудителями заболеваний человека, представляющими умеренную опасность для персонала и окружающей среды
Читайте также:

