Вандетаниб при раке легких
Конкурирующие интересы: авторы заявили, что конкурирующих интересов не существует.
Задуманные и разработанные эксперименты: SC WT. Выполнили эксперименты: WT WD. Проанализированы данные: WT WD SK XL Lian Zhang. Используемые реагенты / материалы / инструменты анализа: WT Leizhen Zheng JG Li Zhang. Написал газету: WT SC MP.
Оценить профиль эффективности и безопасности сочетания вандетаниба с химиотерапией у пациентов с прогрессирующим немелкоклеточным раком легкого (НМРЛ).
MEDLINE, EMBASE, Кокрановский центральный регистр контролируемых испытаний (CENTRAL), ASCO Abstracts, ESMO Abstracts, Wanfang Database, CNKI. Приемлемыми исследованиями были рандомизированные клинические испытания (РКИ), которые сравнивали эффективность и профиль безопасности добавления вандетаниба к химиотерапии с помощью одной химиотерапии у пациентов с продвинутым НМРЛ. Результаты включали общую выживаемость (ОС), выживаемость без прогрессирования (PFS), общую частоту ответа (ORR) и токсичность. Все метаанализы были выполнены с использованием диспетчера обзоров 5.1. Использовалась модель фиксированного эффекта, взвешенная по методу Мантела-Хензеля. Когда была обнаружена значительная гетерогенность (p 50%), был проведен дальнейший анализ (анализ подгрупп, анализ чувствительности или модель случайного эффекта) для определения потенциальной причины.
Результаты, полученные из 5 РКИ, включавших 2284 пациента, были включены в анализ. По сравнению с химиотерапией добавление вандетаниба приводило к значительному увеличению PFS (HR 0,79 [0,72-0,87], p 50%), был проведен дальнейший анализ (анализ подгрупп, анализ чувствительности или модель случайного эффекта) для определения потенциальной причины.
В нашем систематическом исследовании было проведено скрининг 67 исследований и было найдено 5 публикаций, посвященных 5 рандомизированным клиническим испытаниям (2 284 пациента), которые сравнивали химиотерапию с или без вандетаниба у пациентов с продвинутым НМРЛ [12] — [16]. Эти 5 публикаций включали 4 полные работы [12] — [15] и 1 аннотацию к конференции от ежегодного собрания ASCO [16]. Другие потенциально подходящие исследования были однорукими или не сочетались с химиотерапией и поэтому были исключены. Были включены три фазы II [12], [13], [16] и два этапа III [14], [15]. Рецензенты следили за выявлением исследований и извлечением данных. Контрольный список PRISMA и блок-схема для исследований были показаны в контрольном списке SIS PRISMA, диаграмме потока S1 PRISMA и
Рисунок 1
,
Характеристики включенных испытаний были представлены в
Таблица 2
, И методологические данные, потенциально связанные с предвзятостью 5 испытаний, были представлены в
Таблица 3
, Все 5 исследований включали иллюстрации, касающиеся рандомизации, и 2 из испытаний описали подробные методы, используемые для рандомизации [14], [15]. Таким образом, все испытания были описаны как 1 или 2 балла по критериям рандомизации. Во всех испытаниях описывалось использование двойной слепой методологии. В трех исследованиях была представлена подробная информация об изъятиях [12], [14], [15]. Все 5 испытаний были оценены как высокий балл (≥3) и были окончательно включены в анализ.
PS: Статус исполнения. Ван: Вандетаниб. Док: Доцетаксел. Пак: Паклитаксел. Автомобиль: карбоплатин. Пем: Пеметрексед. Джем: Гемцитабин. NR: нет отчета.
ITT: Предназначен для лечения. NC: Нет Clear.
Влияние лечения вандетанибом на ОС было получено непосредственно из опубликованных данных 5 включенных исследований. Ни одно из 5 исследований не сообщило о статистически значимом улучшении ОС. Мета-анализ показал, что комбинация вандетаниба и химиотерапии не приводила к статистическому улучшению ОС по сравнению с одной только химиотерапией (HR 0,96 [0,87-1,06], p = 0,44) без явной гетерогенности среди исследований (p = 0,74, I2 = 0%) (
фигура 2
). Исходя из недостатка эффективности для ОС у пациентов, не имеющих выбора, мы провели дальнейший анализ подгруппы, чтобы определить потенциальные группы, которые могут потенциально выиграть от вандетаниба. Анализ исследовательской подгруппы, определяемый гистологией (аденокарциномой или плоскоклеточным), сексом (мужчина или женщина), курением (курильщиками или некурящими) и линией терапии (терапия первой или второй линией), показал сходные результаты без статистической значимости во всех подгруппах (
Рисунок 3
). Когда явная гетерогенность была обнаружена в подгруппе мужчин (I2 = 61%) и курильщиков (I2 = 74%), использовалась модель случайного эффекта. Однако это не изменило конечных результатов анализов, которые не показали статистических значений.
В статье рассмотрен клинический случай, иллюстрирующий эффективность вандетаниба в качестве первой линии терапии метастатического медуллярного рака щитовидной железы (МРЩЖ), характеризующегося агрессивным клиническим течением. В половине случаев заболевание диагностируется на поздних стадиях (III–IV), когда требуется системная противоопухолевая терапия. Из-за низкой эффективности и высокой токсичности химиотерапии, нечувствительности опухоли к лучевой терапии большие надежды возлагаются на системную таргетную терапию мультикиназными ингибиторами. Первым из этой группы препаратов противоопухолевую эффективность у больных прогрессирующим МРЩЖ продемонстрировал вандетаниб. Сегодня назначение вандетаниба 300 мг/сут считается приоритетным направлением в лечении нерезектабельного и прогрессирующего МРЩЖ.
В статье рассмотрен клинический случай, иллюстрирующий эффективность вандетаниба в качестве первой линии терапии метастатического медуллярного рака щитовидной железы (МРЩЖ), характеризующегося агрессивным клиническим течением. В половине случаев заболевание диагностируется на поздних стадиях (III–IV), когда требуется системная противоопухолевая терапия. Из-за низкой эффективности и высокой токсичности химиотерапии, нечувствительности опухоли к лучевой терапии большие надежды возлагаются на системную таргетную терапию мультикиназными ингибиторами. Первым из этой группы препаратов противоопухолевую эффективность у больных прогрессирующим МРЩЖ продемонстрировал вандетаниб. Сегодня назначение вандетаниба 300 мг/сут считается приоритетным направлением в лечении нерезектабельного и прогрессирующего МРЩЖ.
На долю медуллярного рака щитовидной железы (МРЩЖ) приходится менее 5% всех случаев рака щитовидной железы и 13,4% всех случаев смерти от рака щитовидной железы. МРЩЖ диагностируется на III и IV стадиях заболевания более чем в 50% случаев [1]. Пятилетняя выживаемость пациентов с выявленными метастазами МРЩЖ составляет около 25%, десятилетняя – около 10% [1, 2]. В 20–25% случаев МРЩЖ представлен в рамках наследственных синдромов множественной эндокринной неоплазии (МЭН) 2-го типа (синдром Сиппла – МЭН IIa, семейный МРЩЖ и МЭН IIb). В остальных случаях МРЩЖ выявляется как спорадическое заболевание.
В основе наследственных синдромов лежит мутация гена RET, кодирующего трансмембранно расположенный рецептор тирозинкиназы. Активация данного рецептора приводит к бесконтрольной пролиферации С-клеток.
Спорадический МРЩЖ может возникнуть в любом возрасте, однако пик заболеваемости приходится на 30–60 лет [1]. Агрессивность течения данной формы МРЩЖ варьируется. Соматические мутации гена RET при нем описаны в 25–71% случаев [3]. При единичных отдаленных метастазах в пределах одного органа, медленном прогрессировании процесса эффективным может быть хирургическое лечение либо применение других методов местного воздействия (радиоабляция, фотодинамическая терапия, лучевая терапия, химиоэмболизация). Указанные процедуры не приводят к излечению, но могут отсрочить проведение системной терапии, снизить вероятность болевого синдрома, сдавления окружающих структур.
Среди цитотоксических препаратов наиболее востребованным при МРЩЖ считается доксорубицин. Он применяется самостоятельно или в комбинации с цисплатином. Чувствительность к данному лечению составляет 0–22% [3]. К сожалению, ответ всегда нерадикальный и продолжается несколько месяцев. Иммунотерапия с использованием дендритных клеток может быть эффективной, но пока это объект для изучения. Имеется опыт использования радиотаргетной терапии – описано несколько ответов на лечение [Иттрий-90 DOTA]-TOC у пациентов с МРЩЖ с высоким уровнем кальцитонина, накапливающим изотоп на Октреаскане с Индием-111 [4]. В неоперабельных случаях, при значительном распространении заболевания, а также при доказанном по критерию RECIST (Response Evaluation Criteriain Solid Tumor) прогрессировании МРЩЖ методом выбора в настоящее время является системная терапия мультикиназными ингибиторами. В большинстве стран одобрены два препарата данной группы – вандетаниб (Капрелса) и кабозантиниб (Кометрик). В России пока одобрен к применению только вандетаниб (ингибитор киназ генов RET, MET, VEGFR2) [3]. В исследованиях данный препарат показал частичный ответ у 45% пациентов. Безрецидивный период составил 19,5 месяца в группе плацебо и 30,5 месяца в группе вандетаниба. Из-за развития побочных эффектов препарат был отменен у 12% пациентов. 35% больных потребовалось снижение дозы.
Достичь полной ремиссии при использовании названных препаратов невозможно. Тем не менее в ряде клинических исследований прием препаратов позволил улучшить качество жизни пациентов за счет снижения диареи и других гормональных проявлений МРЩЖ и стабилизировать процесс [5].
Клинический случай
Пациентка, 60 лет, в 2002 г. перенесла тиреоидэктомию по поводу МРЩЖ Т3N0M0, стадия III. Получала заместительную гормонотерапию L-тироксином 125 мкг/сут постоянно. Регулярно проходила контрольное обследование: ультразвуковое исследование (УЗИ) шеи и брюшной полости, компьютерная томография (КТ) шеи и грудной клетки, анализ крови на гормоны (кальцитонин, тиреотропный гормон (ТТГ), периферические тиреоидные гормоны Т3, Т4), раковый эмбриональный антиген (СЕА). В январе 2008 г. при очередном обследовании выявлено повышение уровня кальцитонина в крови до 1700 пг/мл, увеличение размеров шейного лимфоузла справа, по данным УЗИ и КТ, до 0,9 × 0,5 мм. При тонкоигольной пункции увеличенного лимфоузла обнаружена цитологическая картина медуллярного рака. По поводу метастаза в шейном лимфоузле справа выполнена операция – лимфаденэктомия шеи справа. Послеоперационное гистологическое исследование подтвердило метастатическое поражение лимфоузла МРЩЖ. После операции уровень кальцитонина снизился до 412 пг/мл. Впоследствии осуществлялось динамическое наблюдение с прежним объемом обследования.
В марте 2013 г. уровень кальцитонина увеличился до 1250 пг/мл. Диагностированы рецидив в ложе удаленной опухоли щитовидной железы и повторный метастаз в шейный лимфоузел справа.
7 апреля 2013 г. выполнена операция – удаление рецидива опухоли, лимфаденэктомия шеи справа. Иммуногистохимический анализ послеоперационного материала показал метастазы медуллярного рака в шейном лимфоузле и мягких тканях шеи. После операции уровень кальцитонина составил 775 пг/мл, CEA – 154.
В июле 2014 г. зафиксировано прогрессирование заболевания. Появились жалобы на болезненность в правой надключичной области. При обследовании уровень кальцитонина – 1055 пг/мл. Результаты КТ шеи, грудной клетки и брюшной полости показали метастаз в надключичном лимфоузле справа, подключичном лимфоузле справа, медиастинальных лимфоузлах, 11-м и 12-м грудных позвонках. Общее состояние пациентки удовлетворительное.
С 12 августа 2014 г. была начата таргетная терапия препаратом вандетаниб (Капрелса) в дозе 300 мг/сут. В качестве сопутствующей терапии назначен Панангин – одна таблетка три раза в день. На третий день приема вандетаниба отмечались боли за грудиной в течение пяти минут, прошли самостоятельно. На 12-й день приема на подбородке появились единичные высыпания, не требовавшие лечения.
Каждые две недели таргетной терапии проводились контроль клинического и биохимического анализов крови, электролитов крови (кальций, магний, калий), забор крови на гормоны (ТТГ, Т3, Т4), электрокардиограмма (ЭКГ). Каждые два месяца приема вандетаниба выполнялось контрольное обследование: УЗИ шеи, КТ шеи, грудной клетки и брюшной полости, анализ крови на гормоны (кальцитонин, ТТГ, Т3, Т4), СЕА. Дополнительной терапии не требовалось.
На 34-й день лечения из-за повышения артериального давления (АД) до 220 мм рт. ст. препарат временно отменили и назначили эналаприл 5 мг два раза в сутки.
На 37-й день терапии, согласно результатам ЭКГ, зафиксирована отрицательная динамика в виде усиления потенциалов левого желудочка, нарушения процессов реполяризации переднебоковой стенки левого желудочка. Перерыв в приеме вандетаниба составил 12 дней. Общее самочувствие улучшилось, ЭКГ – с положительной динамикой, АД стабильное. Продолжен прием вандетаниба 150 мг/сут на фоне эналаприла и Панангина.
Через два месяца терапии на контрольном обследовании при оценке опухоли по критериям RECIST констатирована стабилизация процесса.
В течение 7,5 месяца пациентка принимала вандетаниб 150 мг. Общее самочувствие удовлетворительное, ЭКГ – QT 0,38 мм/с, АД стабильное, нежелательных явлений на фоне применения сниженной дозы препарата не зарегистрировано.
В апреле 2015 г. уровень кальцитонина увеличился до 3732 пг/мл, хотя, согласно данным КТ шеи, грудной клетки и брюшной полости, стабилизация процесса сохранялась. Дозу вандетаниба увеличили до 200 мг/сут. Через две недели на фоне приема препарата в указанной дозе отмечалось снижение уровня кальцитонина до 1291 пг/мл. Общее самочувствие – без ухудшения, повышение АД до 140 мм рт. ст. Пациентка принимала эналаприл 10 мг два раза в сутки.
После 19-месячной терапии вандетанибом в марте 2016 г. зафиксирована положительная динамика – уменьшение размеров шейных лимфоузлов, снижение уровня кальцитонина до 1176 пг/мл, стабилизация очагов в костях. Согласно данным КТ, при оценке опухоли по критериям RECIST зарегистрирована частичная регрессия опухоли (рис. 1 и 2).
В апреле 2016 г. появились жалобы на жидкий стул до семи раз в день, повышение АД до 200 мм рт. ст. ЭКГ показала увеличение интервала QT до 0,43 мм/с. Вандетаниб временно отменили, перерыв в лечении составил 14 дней. После стабилизации состояния прием вандетаниба с коррекцией дозы 150 мг/сут был продолжен.
В декабре 2016 г. отмечалось незначительное увеличение уровня кальцитонина до 1910 пг/мл. КТ – без динамики по сравнению с исследованием в марте 2016 г.: частичная регрессия опухоли сохранялась. Дозу вандетаниба увеличили до 200 мг/сут. Через две недели уровень кальцитонина снизился до 1100 пг/мл.
В феврале 2017 г. после 30 месяцев таргетной терапии вандетанибом рентгенологически подтверждена частичная регрессия опухоли, масса тела пациентки стабильная, сохранялись жалобы на периодический жидкий стул и периодическое повышение АД до 140 мм рт. ст. Состояние по шкале ECOG – 1. Пациентка ведет активный образ жизни, продолжает работать. За два с половиной года терапии вандетанибом гематологической токсичности не зафиксировано, с негематологическими нежелательными явлениями удалось быстро справиться. Планируется продолжить терапию вандетанибом до прогрессирования по критериям RECIST с оценкой эффективности каждые два месяца.
Рассмотренный клинический случай иллюстрирует потенциальный благоприятный эффект в отношении отдаленных результатов лечения при назначении вандетаниба в первой линии терапии метастатического МРЩЖ. Пациентка продолжает получать вандетаниб в течение двух с половиной лет. Отмечается частичная ремиссия. Данное лечение позволяет не только увеличить медиану общей выживаемости, но также значительно продлить время до прогрессирования, сохранить качество жизни и социальный статус больной.
Всем пациентам с установленным диагнозом МРЩЖ независимо от этиологии (спорадический, наследственный) в отсутствие данных об отдаленных метастазах показано хирургическое вмешательство с выполнением как минимум тиреоидэктомии с центральной лимфодиссекцией, при подозрении или доказанных метастазах в боковые лимфатические узлы шеи, верхнее средостение – радикальная лимфодиссекция в объеме пораженных уровней лимфоузлов [6]. Кроме хирургического лечения, возможности которого ограничены местной распространенностью и нерадикальностью вмешательства, до недавнего времени не существовало ни одного эффективного метода лечения с учетом слабой чувствительности медуллярной карциномы как представителя нейроэндокринных карцином к химиотерапии и дистанционной лучевой терапии [7]. При наличии отдаленных метастазов МРЩЖ, неоперабельных случаев местнораспространенного опухолевого процесса или высокого риска для жизни от хирургического вмешательства закономерно возникает вопрос о системной противоопухолевой терапии. Большие ожидания клиницисты возлагают на современные таргетные противоопухолевые препараты, позволяющие ингибировать ключевые киназные триггеры опухолевой активации [8]. Первым из них, подтвердившим эффективность и приемлемую безопасность в лечении больных МРЩЖ, согласно результатам клинических исследований фаз I–III, стал препарат вандетаниб (ZD6474) – низкомолекулярный ингибитор рецепторов тирозинкиназы: VEGFR2, EGRF и активности RET тирозинкиназы, в том числе RET-мутировавших онкопротеинов [9].
В рандомизированном плацебоконтролируемом клиническом исследовании фазы III (ZETA) у взрослых больных МРЩЖ на фоне приема 300 мг вандетаниба отмечалось увеличение периода без прогрессирования опухоли до 30 месяцев по сравнению с пациентами, получавшими плацебо, – 19 месяцев (относительный риск 0,46; 95%-ный доверительный интервал 0,31–0,69; p 2 /кг, как правило, позволяет нормализовать уровень ТТГ. Повышение уровня тиреотропина обычно не сопровождается уменьшением фракций периферических тиреоидных гормонов (Т3, Т4) ниже диапазона референсных значений нормы. Наиболее частыми побочными эффектами были диарея, кожная сыпь, тошнота и слабость. Токсичность также проявилась артериальной гипертензией, удлинением интервала QT на ЭКГ и повышением уровня ТТГ. Наиболее частыми побочными эффектами, в основном 1–2-й степени, требовавшими снижения дозы вандетаниба, были диарея (69%) и удлинение интервала QT на ЭКГ (68%). Необходимо отметить, что эти осложнения были выражены во время первого и второго цикла приема препарата, встречались в 3–6 раз реже и были менее выражены в третьем и последующих циклах [8].
Терапия вандетанибом удовлетворительно переносится и приводит к значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими методами лечения. В рассмотренном клиническом случае удалось сохранить качество жизни и социальный статус пациентки на протяжении всего периода лечения [5].
На современном этапе вандетаниб является препаратом выбора при неоперабельном и прогрессирующем МРЩЖ. Лечение может осуществляться препаратом в дозе 300 мг/сут с непрерывным контролем возможных нежелательных побочных эффектов, регулярной оценкой объективного ответа опухоли на основании критериев RECIST и уровня специфических опухолевых маркеров в сыворотке крови (кальцитонин, СЕА) [8].
Рак легких является самой распространенной болезнью среди прочих онкологических. Смертность от нее превышает 80%.
В зоне риска оказываются активные курильщики, а также люди, страдающие туберкулезом и другими легочными заболеваниями. Чаще болеют мужчины, чем женщины.
Не все, даже инновационные препараты, в состоянии справится с этим страшным недугом. Не зря, онкология считается чумой 21 столетия.
- Препараты при химиотерапии
- Гормональные препараты против рака
- Лекарства, уменьшающие боли
- Противовирусные и противоопухолевые лекарства для лечения рака
Виды лекарственных средств
Несмотря на это, нужно лечить эту патологию и лекарства от рака легких существуют. Множество исследователей и ученых работают над новыми препаратами для полного уничтожения болезни. Выбор метода лечения зависит от расположения и размера опухоли, от состояния пациента, стадии и вида рака. Рассмотрим, какие же виды лечения и медикаментозные препараты для лечения рака легких применимы в наше время.
На первых стадиях обнаружения онкологии легких проводится удаление опухоли, либо ее части, либо всего легкого. Такая операция назначается, когда опухоль небольшая, и она не успела распространиться на другие органы.
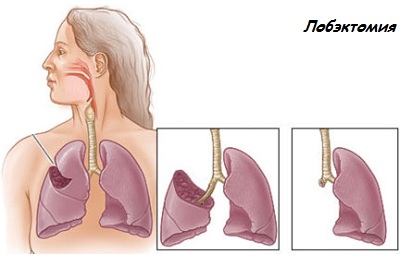
Операция имеет разновидности:
- Пульмонэктомия – удаляется все легкое целиком,
- Лобэктомия – удаляется только часть легкого.
Перед удалением рака нужно сдать необходимые анализы, чтобы удостовериться, что пациент в состояние перенести операцию. Существуют противопоказания, при которых операцию делать не можно. К ним относятся:
- сахарный диабет,
- сердечная, печеночная или почечная недостаточность,
- инфаркт миокарда.
При наличии таких заболеваний проводится другой вид лечения, например химиотерапия.
Химиотерапия является одним из основных и самых эффективных методов лечения этого недуга. Она приостанавливает рост раковых клеток. Но вместе с этим препараты негативно влияют на ряд органов, и организм в целом. Такие лекарства вводятся в кровь человека и могут действовать и распространяться по всему организму.
Доктор выписывают каждому пациенту индивидуальный курс процедур и приема лекарств после сдачи всех необходимых анализов. Перерыв необходим после каждого курса химиотерапии, так как для организма это большой стресс, он должен будет восстановиться через определенное время.
Есть много видов препаратов, которые применяются на практике. Препараты для лечения рака легких, которые используются параллельно с химиотерапией, делятся на два основных вида в зависимости от формы выпуска: таблетки и медикаменты для инъекций, которые вводятся внутривенно.
Среди них чаще всего встречаются следующие названия:
- Карбоплатин,
- Винорелбин,
- Паклитаксел,
- Цисплатин,
- Доцетаксес.
Лекарства также для лучшего эффекта используют в паре по назначению лечащего врача. Схему лечения доктора назначают индивидуально для каждого пациента. Раковые клетки быстро привыкают к препаратам, поэтому через определенное время их чередуют и применяют новые. При возникновении побочных эффектов доктора назначают дополнительные лекарственные препараты.
Химиотерапия может сочетаться с другими видами лечения, например хирургическим или лучевой терапией. Результат напрямую зависит от стадии развития болезни и ее течения.
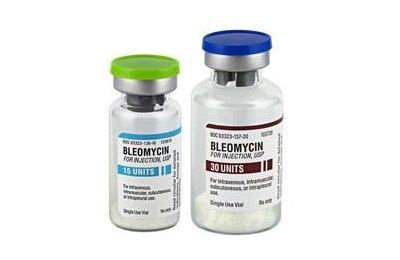
При плоскоклеточном раке легких химиотерапия имеет ряд особенностей. Такая болезнь возникает при раке кожи и слизистых, при наличии родинок и папиллом, которые быстро растут. Заболевание возникает при раке кожи. Для лечения назначают такие препараты, как:
- Блеомицин,
- Цисплатин,
- Метотрексат.


Часто препараты применяются комплексно. При грамотном подходе к лечению такой способ дает больным людям надежду на полное выздоровление.
Онкологические заболевания могут быть как мужскими, так и женскими. Их развитие зависит от половых гормонов: тестостерона и эстрогена. Главным заданием лекарств является снижение и блокирование их роста. Такой вид терапии изменяет количество гормонов для профилактики и лечения онкологии. Такая терапия будет эффективной, только если рак является гормоночувствительным.
Лечение подразделяется на:
- хирургическое,
- радиационное,
- лекарственное.
При начальной стадии используют хирургический способ, и опухоль удаляется. В случае наличия ряда противопоказаний применяются радиационное и лекарственное лечение.
Выбор зависит от состояния больного, его возраста и уровня гормонов.
При выборе вида лечения стоит обязательно проконсультироваться со специалистом и найти оптимальный вариант. Качество лечения зависит от количества гормонов у женщин и мужчин.
Рак легких отличается сильными болевыми ощущениями. Этот факт заставляет врачей выписывать пациенту обезболивающие препараты. К ним относятся: Трамадол, Ацетаминофен,Омнопон, Морфий и другое обезболивающие лекарство от рака. Одни препараты применяются самостоятельно, иные в комплексе с другими.
Часто практикуется применение блокаторов циклооксигеназы-2, которые не имеют побочных действий, таких как кровотечения, влияние на состояние желудка и прочих. Хотя организм часто привыкает к такому виду лечения. И периодические лекарства нужно чередовать и заменять.
Основной схемой, которая применяется для уменьшения болевого синдрома, есть:
![]()
ненаркотические анальгетики и адъювантные препараты: Напроксен, Аспирин, Пироксикам, Индометацин, Парацетамол, Лорноксикам.- применение слабых опиоидов, адъювантных перпаратов и анальгетиков: Кодеин, Трамадол.
- использование сильных опиоидов, ненаркотических анальгетиков и адьювантных средств: Фентанил, Метадон, Оксикодон, Бупренорфин и прочих лекарств, которые воздействуют на нервную систему.
Если боли не проходят, проводятся дополнительные исследования для выявления их причин и назначения лечения.
Метод иммунотерапии встречается все чаще, так как чем лучше организм борется с вирусами, тем сильнее он становится, тем больше вероятность побороть недуг. Такой вид лечения применяется в тех случаях, когда болезнь возникала под влиянием вирусов и инфекций. Это особенно актуально при легочной онкологии. Организм ослабляется и нуждается в дополнительной поддержке и помощи со стороны.
Для повышения иммунной сопротивляемости организма используют препараты, в которых содержится интерферон. Он помогает увеличить сопротивляемость организма, сдерживать развитие вирусов, а также полностью уничтожает их.
Сегодня существует множество лекарств, которые борются с такой проблемой. Группы препаратов разные, начиная от винкалкалоидов, и заканчивая антрациклинами. Выбор зависит от состояния пациента, его возраста и степени болезни.
Данный вид средств имеет узкий спектр действия, поэтому нужно знать их взаимодействие с другими препаратами, а также механизм действия.
Инновационные препараты для иммунотерапии рака легких
Существуют новейшие препараты для борьбы с недугом. Их суть заключается в стимулировании иммунитета и направлении его против заболевания. Преимущество заключается в том, что их можно использовать на всех стадиях онкологии.
В организм человека вводятся биологические вещества, такие как:
- моноклональные антитела,
- цитокины.
После чего они начинают бороться со злокачественными опухолями. Если опухоль перестает расти – значит препараты подействовали.
Этот вид лечения можно сочетать с другими для достижения лучшего эффекта. Над этим вопросом работаю лучшие врачи современной медицины. Кроме этого, ученые произвели новое средство, которое уничтожает рак. Оно состоит из смеси двух лекарств: Вандетаниба и Селуметиниба.
Исследователи считают, что лекарство должно помогать на всех стадиях протекания болезни, когда обычные уколы и антибиотики бессильны. Несмотря на то, что это новейшие средства, и они пока только тестируются, надежда на полное выздоровление больных есть. Побочные эффекты при употреблении препаратов могут быть следующими:
![]()
тошнота,- аллергия,
- слабость и усталость,
- низкое давление,
- кровотечения и гематомы,
- постоянные атаки со стороны вирусных и инфекционных возбудителей болезней при ослабленности и пониженной сопротивляемости организма,
- воспаление на слизистых.
Для восстановления сил необходимо принимать противовирусные препараты и железо. В ряде некоторых сложных случаев больным проводят переливание крови.
К проблеме нужно относиться серьезно. Лечить онкологию нужно комплексно. Важно подобрать квалифицированного и опытного врача, а также хорошо оборудованную клинику с новыми приспособлениями и компетентным персоналом.
За последние десятилетия наука серьезно продвинулась вперед в лечении рака. И хотя полная победа над этим заболеванием еще довольно далека, у врачей с каждым годом становится все больше эффективных инструментов для борьбы с опухолями.
Один из них – активизация собственного иммунитета человека против раковых клеток. Именно в иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов.
В чем плюсы и методы механизма, за открытие которого была присвоена Нобелевская премия, беседуем с заведующей дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидатом медицинских наук Еленой Россохой.

Заведующая дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидат медицинских наук Елена Россоха. Фото: Юлия КОРЧАГИНА
- Елена Ивановна, расскажите, как в норме действует иммунный ответ на возникновение злокачественных клеток?
- Иммунитет – это уникальная способность организма защищать себя от губительного воздействия внешних и внутренних потенциально опасных факторов, каковыми являются, в том числе, и раковые клетки.
Давайте разберемся, что такое рак? В норме все клетки организма проходят строго определенные стадии развития, выполняют заданные функции, размножаются по установленным правилам, а со временем стареют и умирают. Эта запрограммированная обязательная смерть нормальных клеток называется апоптоз. Но иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной.
Опухолевые клетки ежедневно появляются в организме любого человека и отличаются от здоровых наличием аномального белка - ракового антигена. Но в норме иммунитет вовремя распознает угрозу и уничтожает чужеродные элементы с помощью Т-лимфоцитов и других компонентов.
Кстати
Доказано, что если иммунитет подавлен ( ВИЧ , терапия иммуносупрессорами после пересадки органов), то риск развития онкологических заболеваний высок. И наоборот, раковые опухоли могут проходить сами собой без какого-либо специального лечения. Это явление получило название синдрома Перегрина по имени молодого священника, жившего в Италии в конце XIII века. У него была саркома (костная опухоль), требующая ампутации ноги. Хирургия тех времен не могла ему помочь, и юноше оставалось только уповать на Бога. Спустя некоторое время опухоль чудесным образом исчезла, а Святой Перегрин прожил долгую жизнь и умер в возрасте 80 лет без признаков рецидива.
- Почему же в какой-то момент иммунитет ослабляет свою защиту?
-В настоящее время механизмы взаимодействия опухолей и иммунной системы активно изучаются.

В иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов. Фото: Юлия КОРЧАГИНА
Кстати
За открытие иммунных контрольных точек PD-1 и CTLA-4, американцу Джеймсу Эллисону и японцу Тасуко Хондзё в 2018 году была вручена Нобелевская премия. Это открытие позволило совершить прорыв в лечении некоторых ранее смертельных опухолей.
- В чем отличие иммунотерапии от других видов лекарственного противоопухолевого лечения?
- Можно сказать, что открытие принципов иммунотерапии изменило саму парадигму противоопухолевой терапии. Раньше в ее основе лежало воздействие на опухолевую клетку. Сейчас в центре внимания онкологов находится иммунная система человека, возможности ее перепрограммирования и восстановления способности самостоятельно противостоять злокачественным опухолям.
- Какие виды опухолей можно лечить с помощью иммунотерапии, и какова эффективность такого лечения?
- В первую очередь, это распространенные метастатические процессы, 3 и 4 стадии рака, когда удалить злокачественное новообразование с помощью операции невозможно. Что касается видов опухолей, то иммунотерапию можно применить практически ко всем из них. Рак легкого, мочеполовой системы у мужчин и женщин, молочной железы, различные виды лимфом, опухоли головы и шеи, меланома.
Кстати, впервые подобные препараты начали использовать именно при меланоме. Это очень агрессивные опухоли, характеризующиеся быстрым ростом и метастазированием. Еще несколько лет назад такие пациенты, даже получая специальное противоопухолевое лечение, жили максимум шесть месяцев. Сейчас благодаря иммунотерапии, медиана выживаемости для них выросла до нескольких лет.
В лечении злокачественной меланомы достигнут самый высокий прогресс. Пожалуй, самый известный онкобольной, излечившийся благодаря иммунотерапии, бывший презедент США Джимми Картер. В возрасте 90 лет он сообщил об успешно перенесенной операции по удалению опухоли печени. Однако вскоре стало известно, что это - метастаз меланомы, тогда же были выявлены и метастазы в головной мозг. Немедленно начатая иммунотерапия дала результаты - уже через год лечения сообщалось, что у экс- президента не обнаружено никаких следов онкологических образований.
Вообще, в последние годы темпы появления новых лекарств для борьбы с опухолями, ускорились в геометрической прогрессии. Сейчас любая уважающая себя фармацевтическая компания одновременно разрабатывает десятки молекул. Не факт, что из каждой из них на выходе появится новый противоопухолевый препарат, но, тем не менее, благодаря такой высокой заинтересованности производителей, в мире регулярно появляются новые эффективные лекарства.
- Если механизм иммунотерапии так эффективен, прост и органичен замыслу самой природы, почему одним пациентам назначают такие препараты, а другим, с таким же диагнозом, - нет?
- Рак настолько сложное заболевание, что вряд ли когда-нибудь будет придумано универсальное лекарство от этой болезни. Поэтому и иммунотерапия – это не панацея, а всего лишь еще одна очень хорошая лекарственная опция.
Почему мы не назначаем одинаковые препараты пациентам с одинаковыми диагнозами - а что вы считаете одинаковым диагнозом? Это раньше мы лечили рак легкого, рак груди, рак почки и так далее. Сейчас пациента с таким определением статуса болезни ни один врач не сможет лечить эффективно.

Иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной. Фото: Юлия КОРЧАГИНА
Ученые давно доказали, что не существует абсолютно одинаковых раков. Поэтому мы сейчас лечим не опухоли, а их особенности - наличие определенных биомаркеров. В иммунотерапии это уровень экспрессии рецептора PD-L1 на опухолевых клетках. И чем этот уровень этот выше, тем более результативным будет лечение. Вот почему персонализация - тренд современной онкологии.
Онкологи уже научились применять иммунопрепараты не только в монорежиме, но и эффективно использовать их в сочетании с химиопрепаратами, таргетными и даже другими иммунными препаратами. Причем, комбинация двух или нескольких средств, как правило, имеет синергетический эффект, они многократно усиливают действие друг друга.
Полностью излечить метастатический процесс, к сожалению, нельзя. Наша задача, чтобы пациент жил долго и в хорошем качестве. И сегодня мы научились переводить рак в длительное хроническое течение, назначая последовательную терапию при прогрессировании заболевания.
- Может ли человек сам, не дожидаясь лечения в стационаре, купить иммунологический препарат и начать его использовать самостоятельно? Ведь многие из них выпускаются в форме таблеток – ничего сложного.
- Ни в коем случае! Любой иммунологический препарат должен приниматься под контролем врача, имеющего опыт работы с подобными средствами.
Иммунологические препараты при неграмотном применении могут вызывать тяжелые побочные явления. Например, у пациента появилась высокая температура, кашель одышка. Что это – аутоиммунная или обычная пневмония? Знать это крайне важно, ведь при схожем названии тактика лечения будет принципиально различной.
Токсичная реакция на иммунологический препарат может развиться как через несколько дней, так и через несколько лет после его применения, может пройти почти сразу, а может сохраняться годами. Понимание первопричин каждого из явлений крайне важно для его успешного лечения.
Конечно, такие тяжелые побочные эффекты развиваются редко, поэтому мы успешно лечим наших пациентов в условиях дневного стационара, однако быть готовыми к ним просто необходимо. Тем более не понятно, зачем так рисковать собственным здоровьем, ведь все препараты есть в наличии в диспансере, и пациенты получают их абсолютно бесплатно. А это отнюдь немалые деньги – одно введение такого препарата может стоить 500 тысяч рублей, а общий курс составляет до 18 процедур.
- Почему так дорого?
- Разработка нового иммунологического препарата стоит порядка миллиарда долларов. Это многоуровневый процесс, в ходе которого сначала изучаются общие и специфические свойства препарата, потом его тестируют на животных, затем на добровольцах, следующим этапом изучают степень его токсичности, и так далее.
На входе может стартовать десять потенциальных лекарств, а лет эдак через двадцать к финишу придет лишь один препарат. И только семь лет после разработки формула защищается патентом, по истечении этого срока буквально на следующий день заранее скопированный препарат начинает продаваться гораздо дешевле. Вот производители и успевают отбить затраты и заработать на своем изобретении.
- Можно ли профилактически укрепить иммунитет конкретно против онкологии?
- К сожалению, это невозможно. Иммунитету все равно, против кого бороться, для него и раковая клетка и вирус гриппа – одинаково опасны. Он либо работает, либо нет. Чтобы увереннее противостоять, в том числе развитию злокачественных патологий, нужно укреплять свой иммунный ответ в целом. Рекомендации тут стандартные: здоровый образ жизни, отказ от вредных привычек, правильное питание, постоянный контроль за хроническими болезнями высокого онкориска. Кроме этого существуют и специфические меры профилактики, например, вакцинация против рака шейки матки.
Ну а если есть выраженные проблемы с иммунитетом – частые простуды, головные боли, усталость, упадок сил, сонливость, раздражительность – то лучше обратиться к врачу.
- Ваше мнение: действительно ли иммунотерапия – это прорыв в онкологии, как об этом сейчас говорят?
- Это несомненный прорыв. Появление современных иммунных препаратов коренным образом изменило подход к терапии злокачественных опухолей. У этой категории лекарств есть важная особенность: однажды получив полный ответ на иммунотерапию, мы сохраняем его на годы. У цитостатиков и таргетных препаратов такого нет, там этот эффект длится в среднем от полугода до года. То, что новые препараты дают возможность превратить ра нее считавшееся смертельным заболевание в контролируемую хроническую болезнь или полностью от нее излечиться, вселяет надежду в миллионы больных.
Да, мы пока не можем вылечить всех. Но можем выделить иммунозависимую популяцию и полечить ее. Например, для рака легкого это около 25% всех пациентов. Это уже немало!
Бывает, что опухоли уходят полностью, как в случае со Святым Перегрином, однако следует признать, что это случается крайне редко. Чаще – они значительно уменьшаются в размерах или полностью регрессируют и такое состояние при назначении иммунотерапии может длиться очень долго. Сейчас все эти эффекты изучаются более активно, и я уверена, что ученых ждет еще масса революционных открытий.
Читайте также:



