Валериановая кислота с хлором
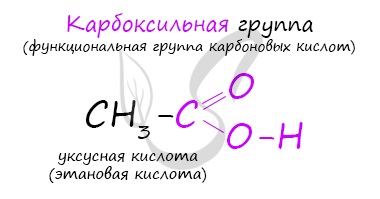
Карбоновые кислоты - класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
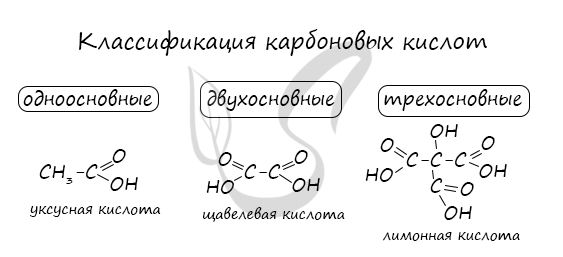
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные - 1 карбоксильная группа
- Двухосновные - 2 карбоксильных группы
- Трехосновные - 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
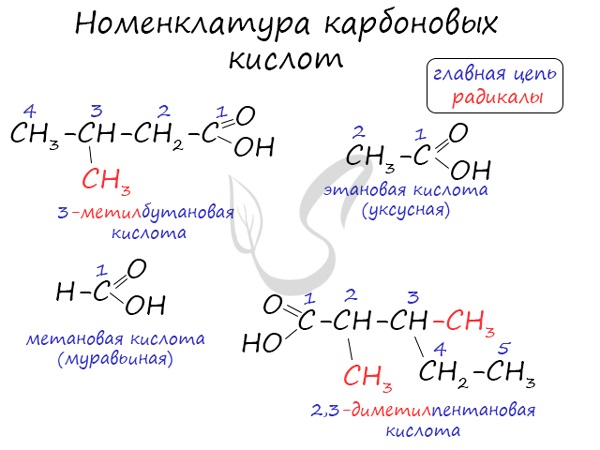
Названия карбоновых кислот формируются путем добавления суффикса "овая" к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая - HCOOH - муравьиная кислота
- Этановая - CH3-COOH - уксусная кислота
- Пропановая - C2H5-COOH - пропионовая кислота
- Бутановая - C3H7-COOH - масляная кислота
- Пентановая - C4H9-COOH - валериановая кислота
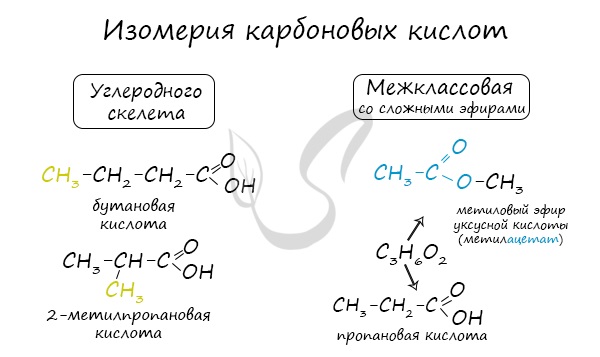
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
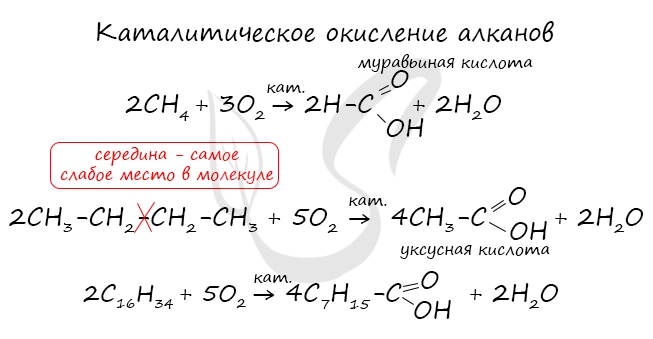
- Окисление алканов
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
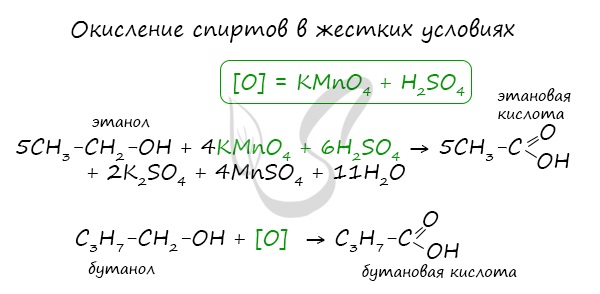
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды - реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом - свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

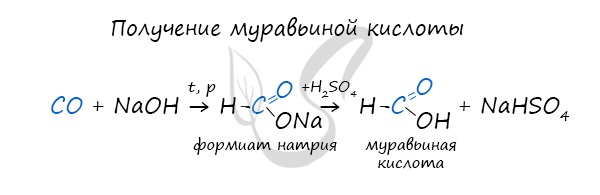
Существует специфический способ получения муравьиной кислоты, который заключается в реакции щелочи с угарным газом - образуется формиат (соль муравьиной кислоты). В результате добавления раствора серной кислоты к формиату получается муравьиная кислота.
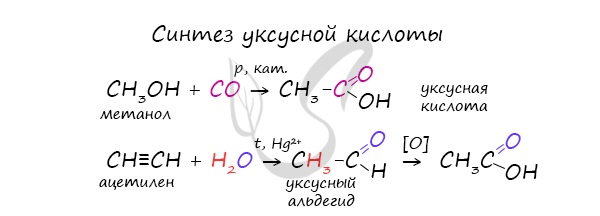
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее - у вторичного, и значительно сложнее - у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот - уксусная, чуть сильнее - хлоруксусная, за ней - дихлоруксусная и самая сильная - трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
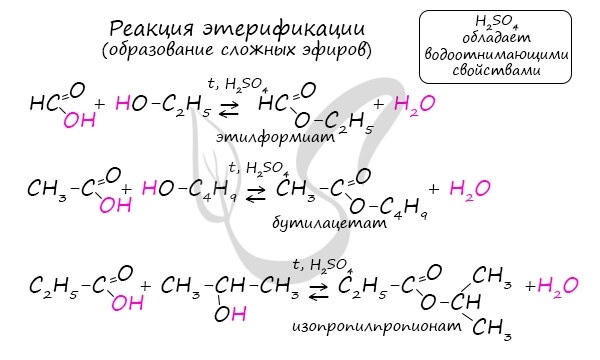
Получение сложных эфиров происходит в реакции этерификации (лат. aether - эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислот + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
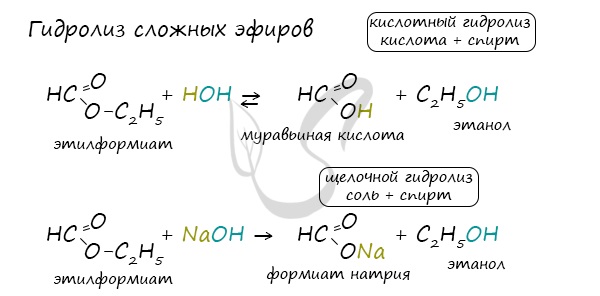
Для сложных эфиров характерной реакцией является гидролиз - их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной - необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
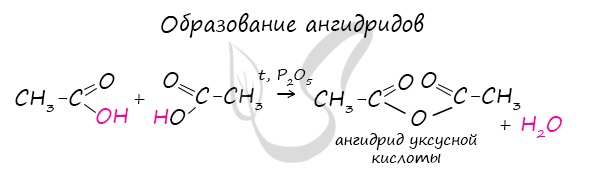
Ангидриды - химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
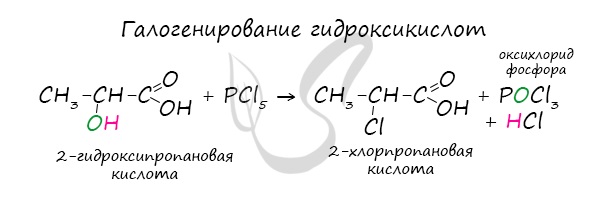
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
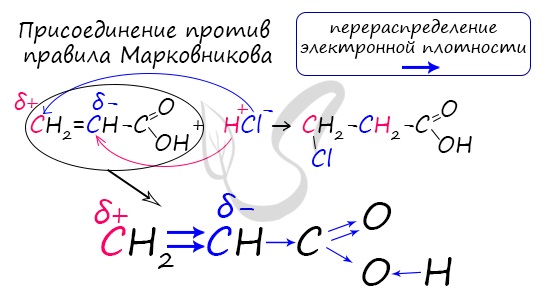
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
Наиболее сильной кислотой является трихлоруксусная, так как на ее атоме карбоксильной группы меньше всего электронной плотности.
Кислотой, которая вступает в реакцию серебряного зеркала, является муравьиная кислота.
Валериановой кислотой по-другому называют пентановую.
Межклассовым изомером карбоновых кислот являются сложные эфиры.
В результате щелочного гидролиза сложных эфиров образуются соль кислоты и спирт.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg + | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | Р | Н | ? | Н | Н | ? | Р | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | ? | ? | ? | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (  Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса " " содержит ошибку, нажмите на кнопку "Отправить". Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений.
Здесь, возможно, указаны не все изомеры данного вещества. Более полный поиск изомеров следует проводить по формуле. Например, чтобы получить изомеры вещества с формулой С6H10O6 , следует сделать запрос так: Изомеры - это соединения с одинаковым количественным составом (то есть одинаковым числом атомов каждого элемента), но разным строением. КАРБОНОВЫЕ КИСЛОТЫ. Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп
Общая формула предельных одноосновных карбоновых кислот: С n H 2n O 2 Классификация карбоновых кислот. 1. По числу карбоксильных групп: - одноосновные (монокарбоновые) - многоосновные (дикарбоновые, трикарбоновые и т.д.). По характеру углеводородного радикала: - предельные CH 3 -CH 2 -CH 2 -COOH ; бутановая кислота.
- непредельные CH 2 =CH-CH 2 -COOH ; бутен-3-овая кислота. НАЗВАНИЯ КАРБОНОВЫХ КИСЛОТ. цис-9-октадеценовая ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТ. 1. Изомерия углеродной цепи. Начинается с бутановой кислоты ( С 3 Н 7 СООН ), которая существует в виде двух изомеров: масляной (бутановой) и изомасляной (2-метилпропановой) кислот. 2. Изомерия положения кратной связи в непредельных кислотах, например: Бутен-3-овая кислота Бутен-2-овая кислота (винилуксусная кислота) (кротоновая кислота) 3. Цис-, транс-изомерия в непредельных кислотах, например:
4. Межклассовая изомерия: Карбоновые кислоты изомерны сложным эфирам: Уксусная кислота СН 3 -СООН и метилформиат Н-СООСН 3 5. Изомерия положения функциональных групп у гетерофункционалъных кислот. Например, существуют три изомера хлормасляной кислоты: 2-хлорбутановая, 3-хлорбутановая и 4-хлорбутановая. СТРОЕНИЕ КАРБОКСИЛЬНОЙ ГРУППЫ. Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризацией связи О–Н. Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается. ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ – в них гидроксогруппа замещена на некоторые другие группы. Все они при гидролизе образуют карбоновые кислоты.
ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ. 1. Окисление спиртов в жестких условиях – раствором перманганата или дихромата калия в кислой среде при нагревании.
2.Окисление альдегидов : раствором перманганата или дихромата калия в кислой среде при нагревании, реакцией серебряного зеркала, гидроксидом меди при нагревании.
3. Щелочной гидролиз трихлоридов : R-CCl3 + 3NaOH [R-C(OH) 3 ] + 3NaCl [ R - C ( OH ) 3 ] RCOOH + H 2 O 4. Гидролиз сложных эфиров. RCOOK + HCl R-COOH + KCl 5. Гидролиз нитрилов, ангидридов, солей. 1)нитрил: R - CN + 2 H 2 O –( H + ) RCOOH 2)ангидрид: ( R - COO )2 O + H 2 O 2 RCOOH 3)натриевая соль: R - COONa + HCl R - COOH + NaCl 6. Взаимодействие реактива Гриньяра с СО2: R-MgBr + CO2 R-COO-MgBr R-COO-MgBr -(+H2O) R-COOH +Mg(OH)Br 7. Муравьиную кислоту получают нагреванием оксида углерода (II) с гидроксидом натрия под давлением: NaOH + CO –(200 o C,p) HCOONa 8. Уксусную кислоту получают каталитическим окислением бутана: 9. Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия: ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ. 1. Кислотные свойства – замещение атома Н в карбоксильной группе на металл или ион аммония. 1.Взаимодействие с металлами 2.Взаимодействие с оксидами металлов 3.Реакция нейтрализации с гидроксидами металлов 4.Взаимодействие с солями более слабых и летучих (или нерастворимых) кислот 4*. Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими карбонатами и гидрокарбонатами. В результате наблюдается выделение углекислого газа. 2. Замещение гидроксильной группы: 5 .Реакция этерификации
6.Образование галоген-ангидридов – с помощью хлоридов фосфора ( III ) и ( V ).
7. Образование амидов:
8. Получение ангидридов. С помощью Р2О5 можно дегидратировать карбоновую кислоту – в результате получается ангидрид. 3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе ( -углеродный атом) 9.Галогенирование кислот – реакция идёт в присутствии красного фосфора или на свету. Особенности муравьиной кислоты. 1. Разложение при нагревании. Н - СООН –(H 2 SO 4 конц ,t) CO + H 2 O 2. Реакция серебряного зеркала и с гидроксидом меди ( II ) – муравьиная кислота проявляет свойства альдегидов. 3. Окисление хлором и бромом, а также азотной кислотой. Особенности бензойной кислоты. 1. Разложение при нагревании – декарбоксилирование. П
2. Реакции замещения в ароматическом кольце. Особенности щавелевой кислоты. 1. Разложение при нагревании
2. Окисление перманганатом калия.
Особенности непредельных кислот (акриловой и олеиновой). 1. Реакции присоединения. Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной: СН 2 = СН - СООН + Н Br Br-CH 2 -CH 2 -COOH Также к непредельным кислотам можно присоединять галогены и водород: 2. Реакции окисления При мягком окислении акриловой кислоты образуется 2 гидроксогруппы: 3СН2=СН-СООН+2 KMnO 4+2 H 2 O 2 CH 2( OH )- CH ( OH )- COO К + CH 2( OH )- CH ( OH )- COOH +2 MnO 2 Свойства солей карбоновых кислот. 1. Обменные реакции с более сильными кислотами и со щелочами. CH3-COONa + HCl CH3-COOH + NaCl 2. Термическое разложение солей двухвалентных металлов (кальция, магния, бария)- образуются кетоны. 3. Сплавление солей щелочных металлов со щелочью (реакция Дюма)- получаются алканы. 4. Электролиз водных растворов солей карбоновых кислот (реакция Кольбе). Свойства галогенангидридов 1. Гидролиз – получается кислота. 2. Реакции ацилирования бензола, аминов, солей фенола. C Читайте также:
|

























