Валентность йода с хлором
Общие сведения о валентности йода
В виде простого вещества йод представляет собой кристаллы черно-серого (темно-фиолетового) цвета с металлическим блеском и резким запахом. Пары йода, также, как и его растворы в органических растворителях, окрашены в фиолетовый цвет.
Валентность йода в соединениях
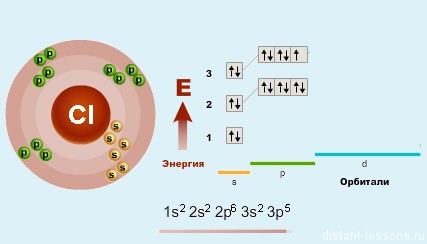
Йод – пятьдесят третий по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в пятом периоде в VIIA группе. В ядре атома йода содержится 53 протона и 74 нейтрона (массовое число равно 127). В атоме йода есть пять энергетических уровней, на которых находятся 53 электрона (рис. 1).

Рис. 1. Строение атома йода.
Электронная формула атома йода в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):

Наличие одного неспаренного электрона свидетельствует о том, что йод способен проявлять валентность I (низшая валентность) в своих соединениях (HI, HIO).
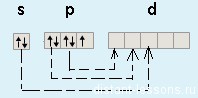
Для атома йода характерно наличие нескольких возбужденных состояний из-за того, что орбитали 5d-подуровня являются вакантными (на четвертом энергетическом слое помимо 5s- и 5p-подуровней есть еще и 5d-подуровень). Сначала распариваются электроны 5p -подуровня и занимают свободные d-орбитали, а после – электроны 5s-подуровня:



Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что йод проявляет в своих соединениях валентности III (AuI3, HIO2), V (HIO3) и VII (HIO4) (высшая валентность).
Примеры решения задач
| Задание | Напишите уравнения реакций, протекающих при электролизе водного растворов иодида калия с инертными электродами. |
| Ответ | KI ↔ K + + I — . |
| Задание | При взаимодействии хлора с иодидом калия был получен йод массой 50,8 г. Определите объем хлора, измеренный при нормальных условиях, который потребовался для этого. |
| Решение | Запишем уравнение реакции взаимодействия хлора с иодидом калия: |
Найдем количество вещества йода (молярная масса – 260 г/моль):
n (I2) = 50,8 / 260 = 0,2 моль.
Согласно условию задачи n(I2) : n(Cl2) = 1:1, значит n(I2) = n(Cl2) =0,2моль. Тогда, объем хлора, потребовавшийся для осуществления данной реакции равен:
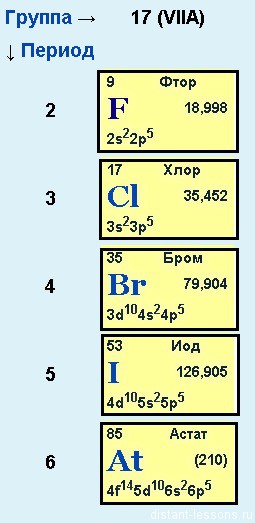
или подгруппа фтора
Фтор, хлор, бром, йод и астат
Общее электронное строение:
nS 2 np 5
И, как всегда, все не так просто, как хотелось бы…
Как уже было замечено в предыдущих лекциях (подгруппа кислорода) у первого элемента — F (фтора) все соответствует общей формуле — на внешнем уровне 7 электронов. А вот у хлора (Cl) — элемента 3-го периода появляется свободная d-орбиталь и возможность распаривать на нее электроны.
Благодаря этой возможности — распаривать электроны p-подуровня на d-подуровень, для всех элементов кроме фтора (. ) возможны степени окисления +1, +3, +5 и +7.
- Валентность элементов:
- валентность фтора = 1,
- валентность хлора и остальных галогенов — 1,3,5 и 7
- Степени окисления:
- степень окисления фтора = -1 — типичный неметалл, самый сильный неметалл — просто КОРОЛЬ неметаллов — самый верхний в группе и самый левый в периоде.;
- степень окисления хлора и остальных галогенов = -1 (минимальная степень окисления), +1 , +3, +5 и +7 (максимальная степень окисления) в минимальной с.о. элементы будут проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства галогенов
- Фтор — F2 — светло-желтый газ;
![]()
- Хлор Cl2 — желто-зеленый газ;
- Бром — Br2 — бурая жидкость;
- Йод — J2 — темно-фиолетовые кристаллы, металлический блеск.
Химические свойства галогенов
Фтор — самый активный неметалл, нет веществ, с которыми он не вступал бы в реакции, он НИКОГДА не проявляет положительные степени окисления. Это КОРОЛЬ неметаллов.
1. Взаимодействие с водородом :
F2 + H2 = 2HF — плавиковая кислота
2. Взаимодействие с металлами:
F2 + 2Li = 2LiF — фторид лития (галогениды )
3. Взаимодействие с неметаллами:
F2 + O2 = OF2 (кислород здесь проявляет с.о. +2)
4.Окислительный свойства:
Сl2 + H2S = S + 2HCl
5. Взаимодействие с водой:
раствор HF — плавиковая кислота
Cl2 + H2O ↔ HCl + HClO — оксокислоты хлора
Не смотря на то, что эти реакции написаны для фтора и хлора, естественно, они применимы и к брому, и к йоду (кроме взаимодействия с кислородом — там придется элементы поменять местами).
Как и во всех других группах, химические свойства соединений галогенов подчиняются законам периодичности:
- сверху вниз в подгруппе восстановительные свойства усиливаются.
- сила кислот сверху вниз увеличивается
- с увеличением степени окисления элемента в оксосоединениях усиливаются окислительные свойства.
Отдельно мы разберем Кислоты хлора — их немало, и их названия, а тем более называния солей, желательно знать наизусть
Иод в таблице менделеева занимает 53 место, в 5 периоде.
| Символ | I |
| Номер | 53 |
| Атомный вес | 126.9044700 |
| Латинское название | Iodium, Jodium |
| Русское название | Иод |
Электронная схема иода
I: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5
Короткая запись:
I: [Kr]5s 2 4d 10 5p 5
Порядок заполнения оболочек атома иода (I) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Иод имеет 53 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
5 электронов на 5p-подуровне
Степень окисления иода
Атомы иода в соединениях имеют степени окисления 7, 5, 3, 1, 0, -1.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы иода
Валентность I
Атомы иода в соединениях проявляют валентность VII, V, III, I.
Валентность иода характеризует способность атома I к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа I
Квантовые числа определяются последним электроном в конфигурации, для атома I эти числа имеют значение N = 5, L = 1, Ml = 0, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Раствор нитрата калия сливали с осадка и упаривали.
Полученные кристаллы калиевой селитры очищали дополнительной перекристаллизацией. Куртуа не был простым ремесленником. Проработав три года в аптеке, он получил разрешение слушать лекции по химии и заниматься в лаборатории Политехни-ческой школы в Париже у знаменитого Фуркруа. Свои познания он приложил к изучению золы морских водорослей, из которой тогда добывали соду. Куртуа заметил, что медный котел, в котором выпаривались зольные растворы, разрушается слишком быстро. В маточном растворе после упаривания и осаждения кристаллических сульфатов натрия и калия оставались их сульфиды и, видимо, что-то еще. Добавив к раствору концентрированной серной кислоты, Куртуа обнаружил выделение фиолетовых паров. Не исключено, что нечто подобное наблюдали коллеги и современники Куртуа, но именно он первым перешел от наблюдений к исследованиям, от исследований — к выводам.Вот эти выводы (цитируем статью, написанную Куртуа): «В маточном растворе щелока, полученного из водорослей, содержится достаточно большое количество необычногои любопытного вещества.
Свойства обычные и необычные
Превратить иод в пар легче даже, чем в жидкость.Чтобы расплавить иод, нужна довольно низкая темпера тура: +113 ,5° С, но, кроме того, нужно, чтобы пар-додъное давление паров иода над плавящимися кристалов было не меньше одной атмосферы. Иными словами, I узкогорлой колбе иод расплавить можно, а в открытой лабораторной чашке — нельзя. В этом случае пары иода не накапливаются, и при нагревании иод возгонится — перейдет в газообразное состояние, минуя жидкое, что обычно и происходит при нагревании этого вещества. Кстати, температура кипения иода ненамного больше температуры плавления, она равна всего 184,35° С. Но не только простотой перевода в газообразное состояние выделяется иод среди прочих элементов. Очень своеобразно, например, его взаимодействие с водой.Элементарный иод в воде растворяется неважно: при 25° С лишь 0,3395 г/л.
Тем не менее можно получить значительно более концентрированный водный раствор элемента № 53, воспользовавшись тем же нехитрым приемом, который применяют медики, когда им нужно сохранить подольше йодную настойку (3- или 5%-ный раствор иода в спирте): чтобы йодная настойка не выдыхалась, в нее добавляют немного йодистого калия KI. Это же вещество помогает получать и богатые иодом водные растворы: иод смешивают с не слишком разбавленным раствором йодистого калия.Молекулы KI способны присоединять молекулы элементарного иода.
Если с каждой стороны в реакцию вступает по одной молекуле, образуется красно-бурый три-иодид калия. Йодистый калий может присоединить и боль шее число молекул иода, в итоге получаются соединения различного состава вплоть до КI9. Эти вещества называют пол и н од идами. Полииодиды нестойки, и в их растворе всегда есть элементарный иод, причем в значительно большей концентрации, чем та, которую можно получить прямым растворением иода. Во многих органических растворителях — сероуглеро де, керосине, спирте, бензоле, эфире, хлороформе — иод растворяется легко. Окраска неводных растворов иода не отличается постоянством. Например, раствор его в сероуглероде — фиолетовый, а в спирте — бурый. Чем это объяснить? Очевидно, фиолетовые растворы содержат иод в виде молекул I2 Если же получился раствор другого цвета, логично предположить существование в нем соединении иода с растворителем. Однако не все химики разделяютэту точку зрения.
Часть их считает, что различия в окраске йодных растворов объясняются существованием разного рода сил, соединяющих молекулы растворителя нрастворенного вещества.Фиолетовые растворы иода проводят электричество, так как в растворе молекулы I 2 частично диссоциируют на ионы I + и I — . Такое предположение не противоречит представлениям о возможных валентностях иода. Главные валентности его: 1 — (такие соединения называют иоди-дами), 5 + (иодаты) и 7 + (периодаты). Но известны также соединения иода, в которых он проявляет валентности 1+ и 3+, играя при этом роль одновалентного пли трехвалентного металла. Есть соединение иода с кислородом, в котором элемент № 53 восьмивалентен,— IO 4 . Но чаще всего иод, как и положено галогену (на внешней оболочке атома семь электропов), проявляет валентность 1 — . Как и другие галогены, он достаточно активен — непосредственно реагирует с большинством металлов (даже благородное серебро устойчиво к действию пода лишь при температуре до 50° С), но уступает хлору и брому, не говоря уже о фторе. Некоторые элементы — углерод, азот, кислород, сера, селен — в непосредственную реакцию с иодом не вступают.
Оказывается, йода на Земле меньше, чем лютеция
Биологические функции йода
Признаки йодной недостаточности видны также у некоторых людей, изображенных на портретах и картинах Рембрандта, Дюрера, Ван-Дейка…В нашей стране, большинство областей которой удалены от моря, борьба с эндемическим зобом ведется постоянно — прежде всего средствами профилактики. Простейшее и надежнейшее средство — добавка микродоз иодидов к поваренной соли.Интересно отметить, что история лечебного применения иода уходит в глубь веков. Целебные свойства веществ, содержащих иод, были известны за 3 тыс. лет до того, как был открыт этот элемент. Китайский кодекс 1567 г. до н. э. рекомендует для лечения зоба морские водоросли… Антисептические свойства иода в хирургии первым использовал французский врач Буанэ. Как ни странно, самые простые лекарственные формы иода — водные и спиртовые растворы — очень долго не находили применения в хирургии, хотя еще в 1865—1866 гг. великий русский хирург Н. И. Пирогов применял йодную настойку при лечении ран.
Пятое знакомство — сугубо утилитарное.
Иодом интересуются не только медики. Он нужен геологам и ботаникам, химикам и металлургам.Подобно другим галогенам, иод образует многочисленные иод органические соединения, которые входят в состав некоторых красителей.Соединения иода используют в фотографии и кинопромышленности для приготовления специальных фотоэмульсий и фотопластинок.Как катализатор иод используется в производстве искусственных каучуков.Получение сверхчистых материалов — кремния, титана, гафния, циркония—также не обходится без этого элемента. Иодидный способ получения чистых металлов применяют довольно часто.Йодные препараты используют в качестве сухой смазки для трущихся поверхностей из стали и титана. Изготавливаются мощные йодные лампы накаливании.Стеклянная колба такой лампы заполнена не инертным газом, а парами иода, которые сами излучают свет при высокой температуре.
Иод и его соединения используются в лабораторной практике для анализа и в хемотронных приборах, действие которых основано на окислительно-восстановительных реакциях иода…Немало труда геологов, химиков и технологов уходит на поиски йодного сырья и разработку способов добычи иода. До 60 -х годов прошлого столетия водоросли были единственным источником промышленного получения иода. В 1868 г. иод стали получать из отходов селитряного производства, в которых есть иодат и иодид натрия. Бесплатное сырье и простой способ получения иода из селитряных маточных растворов обеспечили чилийскому иоду широкое распространение. В первую мировую войну поступление чилийской селитры и иода прекратилось, и вскоре недостаток иода начал сказываться на общем состоянии фармацевтической промышленности стран Европы. Начались поиски рентабельных способов получения иода.
ЙОД И ЧЕЛОВЕК. Организм человека не только не нуждается в больших количествах иода, но с удивительным постоянством сохраняет в крови постоянную концентрацию (10 -5 —10 -6 %) иода, так называемое йодное зеркало крови. Из общего количества иода в организме, составляющего около 25 мг, больше половины находится в щитовидной железе. Почти весь иод, содержащийся в этой железе, входит в состав различных производных тирозина — гормона щитовидной железы, и только незначительная часть его, около 1%, находится в виде неорганического иода I 1- . Большие дозы элементарного иода опасны: доза 2—3 г смертельна. В то же время в форме иодида допускается прием внутрь намного больших доз. Если ввести в организм с пищей значительное количество неорганических солей йода, концентрация его в крови повысится в 1000 раз, но уже через 24 часа йодное зеркало крови придет к норме. Уровень йодного зеркала строго подчиняется закономерностям внутреннего обмена и практически не зависит от условий эксперимента. В медицинской практике иодорганические соединения используют для рентгенодиагностики. Достаточно тяжелые ядра атомов й ода рассеивают рентгеновские лучи. При введении внутрь организма такого диагностического средства получаются исключительно четкие рентгеиовские снимки отдельных участков тканей.
ИОД И КОСМИЧЕСКИЕ ЛУЧИ. Академик В. И. Вернадский считая, что в образовании иода в земной коре большую роль играют космические лучи, которые вызывают в земной коре ядерные реакции,то есть превращения одних элементов в другие. Благодаря этим превращениям в горных породах могут образовываться очень небольшие количества новых атомов, в том числе атомов йода.
ИОД —СМАЗКА. Всего 0,6% иода, добавленного к углеводородным маслам, во много раз снижают работу трения в подшипниках из нержавеющей стали и титана. Это позволяет увеличить нагрузку на трущиеся детали более чем в 50 раз.
ИОД И СТЕКЛО. Йод применяют для изготовления специальногополяроидного стекла. В стекло (или пластмассу) вводят кристаллики солей йода, которые распределяются строго закономерно. Колебания светового луча не могут проходить через них во всех направлениях. Получается своеобразный фильтр, называемый поляроидом, который отводит встречный слепящий поток света. Такое стекло используют в автомобилях. Комбинируя несколько поляроидов или вращая поляроидные стекла, можно достигнуть исключительно красочных эффектов — это явление используют в кинотехнике и в театре.
Статья на тему Йод свойства
I
химический элемент VII группы периодической системы Д.И. Менделеева: относится к галогенам. И. активно влияет на обмен веществ, тесно связан с функцией щитовидной железы; в организме человека содержится в виде неорганического йодида и составной части тиреоидных гормонов и их производных. Элементарный Й., неорганические и органические соединения Й. используются в качестве лекарственных средств и как реактивы в лабораториях, в т.ч. клинико-диагностических.
Атомный номер йода 53, атомная масса 126,9045. Природный Й. состоит из одного стабильного изотопа с массовым числом 127. Известны 24 радиоактивных изотопа Й. с массовыми числами от 117 до 139, включая два изомера ( 121м I и 126м I). В медицине применяют четыре радиоизотопа йода: 123 I, 125 I, 131 I и 132 I. Первым из искусственных радиоактивных изотопов нашел широкое клиническое применение йод-131 (позднее йод-132), но затем в радиодиагностике эти изотопы стали постепенно вытесняться радиофармацевтическими препаратами с йодом-123 (для исследований in vivo) и с йодом-125 (главным образом для радиоиммунохимических исследований in vitro).
Элементарный Й. представляет собой темно-серые кристаллы с фиолетовым металлическим блеском, tпл. 113,6°, tкип. 184,35°. При медленном нагревании Й. испаряется (возгоняется) с образованием фиолетовых паров, имеющих резкий специфический запах.
Йод растворим в большинстве органических растворителей, в воде он растворяется гораздо хуже. Он проявляет отрицательную и положительную валентность, однако соединения, в которых йод положительно валентен, мало устойчивы и почти не встречаются в природе. В соединениях йод может иметь валентности — 1 (йодиды), + 5 (йодаты) и + 7 (перйодаты), известны также соединения Й. с валентностью + 1 (гипойодиты). Биологической активностью и антисептическими свойствами Й. обладает лишь в положительно валентной форме.
В природе Й. распространен почти повсеместно, он содержится во всех живых организмах, воде, минеральных водах, минералах, почве. В земной коре его содержится мало (4․10 -5 % по массе). Наибольшее количество Й. сконцентрировано в морской воде (0,06 мг/мл), воздухе и почвах приморских районов. В этих же районах отмечается наиболее высокое содержание Й. в растительных продуктах (зерновых, овощах, картофеле, фруктах) и в продуктах животного происхождения (мясе, молоке, яйцах). Относительно много Й. содержится в мясе некоторых морских рыб и устриц. Особенно богаты Й. морские водоросли и губки. Очень много Й. в рыбьем жире. Содержание Й. в 1 л питьевой воды в среднем равно 0,2—2,0 мкг. Отмечена зависимость содержания Й. в окружающей среде от содержания органических веществ в почве, что имеет большое значение для возникновения очагов эндемического зоба.
По своему значению для жизнедеятельности организма Й. относится к истинным микроэлементам (Микроэлементы). Основное физиологическое значение Й. определяется его участием в функции щитовидной железы (Щитовидная железа). Поступающий в щитовидную железу Й. подвергается окислению и включается в процесс биосинтеза тиреоидных гормонов (Тиреоидные гормоны). Недостаточное поступление Й. приводит к нарушению функции железы, ее гиперплазии и развитию зоба эндемического (Зоб эндемический). В организме взрослого человека содержится 20—30 мг йода, причем около 10 мг — в щитовидной железе. Концентрация Й. в крови в норме составляет 669,8 ± 275,8 нмоль/л (8,5 ± 3,5 мкг/100 мл), 35% этого количества Й. находится в плазме крови (три четверти — в виде органических соединений). Содержание Й. в тканевых жидкостях не превышает 1 /3— 1 /4 от его содержания в плазме крови. Кроме того, Й. частично депонируется в липидах. При гипертиреозе содержание Й. в крови может возрастать до 7,9 мкмоль/л (100 мкг/100 мл). Повышение концентраций Й. в крови отмечается также при некоторых заболеваниях печени и беременности. При гипотиреозе содержание Й. в крови может резко снизиться, в основном за счет его органических соединений.
Принято считать, что человек должен получать минимум 50—60 мкг йода в сутки. Однако многие исследователи полагают, что для обеспечения оптимального функционирования щитовидной железы требуются значительно большие количества йода (200 мкг в сутки и более). Радиобиологические исследования показали, что в организме здорового человека за сутки катаболизируется до 300 мкг тироксина и трийодтиронина, при этом с мочой выделяется 50 мкг иода.
Элементарный Й. легко и быстро всасывается через кожу и слизистые оболочки, а в парообразном состоянии — через легкие. Скорость всасывания элементарного Й. из желудочно-кишечного тракта во многом зависит от качественного состава пищи. Содержащиеся в ней белки и жиры связывают элементарный Й. и замедляют его всасывание в кишечнике.
В значительных количествах Й. накапливается в органах осуществляющих его выделение из организма. При сифилисе и туберкулезе Й. накапливается также в гуммах и туберкулезных очагах, что, возможно, связано с высоким содержанием в них липидов.
Из организма Й. выводится главным образом почками (до 70—80% от введенного количества) и частично слюнными, молочными, потовыми, железами слизистой оболочки желудка.
Иод токсичен. При хронической интоксикации парами Й. или его соединениями наблюдаются слезотечение, насморк, кашель, слюнотечение, тошнота, рвота, головная боль, появляется угревая сыпь (йодизм). При попадании на кожу Й. может вызывать дерматиты. В тяжелых случаях возможно развитие специфического поражения кожи — йододермы. При отравлениях элементарным Й. язык и слизистая оболочка ротовой полости становятся бурыми, выдыхаемый воздух имеет специфический запах Й., ощущается жжение во рту и в верхних отделах желудочно-кишечного тракта, отмечаются слюнотечение, головная боль, отек гортани, носовые кровотечения, сыпь, морфологически похожая на крапивницу, пятнистую эритему и т. п., альбуминурия, гемоглобинурия.
Признаки острого отравления Й. в очень тяжелых случаях дополняются анурией, угнетением ц.н.с. отеком легких. Рвотные массы после приема элементарного Й. внутрь имеют коричневую или голубую (при наличии в желудочном содержимом крахмала) окраску. После отравлений Й. в течение долгого времени у пострадавшего отмечают слабость, угнетение системы иммунитета.
При оказании первой помощи больного нужно перенести на свежий воздух, согреть и обеспечить ему полный покой. Необходимо провести немедленную ингаляцию кислорода и 5% раствора натрия тиосульфата, внутривенно ввести 30—50 мл 10—20% раствора натрия тиосульфата. Внутрь назначают обильное питье мучного отвара, жидкого крахмального клейстера, водной суспензии активированного угля, молока (но не при отравлении йодоформом!), слизистых отваров, 5% раствора натрия тиосульфата (2—4 стакана), щелочных минеральных вод. Показано полоскание рта, горла и носа 2% раствором натрия бикарбоната; промывание желудка 1—3% раствором натрия тиосульфата, который переводит элементарный Й. в менее токсичный йодид натрия. При отравлениях любыми препаратами Й. применяют также солевые слабительные и средства симптоматической терапии.
Предельно допустимая концентрация паров йода и его соединений в воздухе рабочей зоны составляет 1 мг/м 3 .
Для качественного обнаружения Й. к исследуемому материалу приливают крахмальный клейстер и 1—2 капли хлорной воды; в присутствии Й. появляется синее окрашивание, исчезающее при нагревании и снова появляющееся при охлаждении. Выявить Й. можно также, прилив в пробирку с исследуемым материалом бензол, бензин или хлороформ с последующим добавлением хлорной воды. При встряхивании пробирки выделяющийся Й. переходит в слой растворителя, окрашивая его в характерный для Й. сине-фиолетовый цвет.
Количественное определение Й. производят титрованием испытуемого раствора азотнокислым серебром в присутствии индикатора или титрованием такого раствора в кислой среде тиосульфатом натрия в присутствии крахмального клейстера (см. Титриметрический анализ).
Препараты йода. В медицинской практике применяют препараты, содержащие элементарный йод, — раствор йода спиртовой, раствор Люголя (см. Антисептические средства), препараты, способные освобождать элементарный йод — йодинол, йодоформ, кальцийодид; препараты, диссоциирующие с образованием ионов йода (йодиды), — калия йодид и натрия йодид; препараты, содержащие прочно связанный йод, — йодолипол, билитраст и другие рентгеноконтрастные вещества; радиоактивные препараты йода.
Элементарный Й. обладает выраженными противомикробными свойствами. По характеру противомикробного действия Й. идентичен другим галогенам (хлору, брому), но вследствие меньшей летучести действует более продолжительно. Препараты, способные освобождать элементарный Й. (йодоформ и др.), оказывают противомикробное действие только при контакте с тканями и микроорганизмами, вызывающими восстановление связанного Й. до элементарного. В отличие от элементарного Й. йодиды практически не активны в отношении бактериальной флоры.
Для препаратов элементарного Й. характерно выраженное местнораздражающее действие на ткани. В высоких концентрациях эти препараты вызывают прижигающий эффект. Местное действие элементарного Й. обусловлено его способностью осаждать тканевые белки. Препараты, отщепляющие элементарный Й., оказывают значительно менее выраженное раздражающее действие, а йодиды обладают местнораздражающими свойствами только в очень высоких концентрациях.
Влияние препаратов Й. на обмен веществ проявляется усилением процессов диссимиляции. При атеросклерозе они вызывают некоторое снижение концентрации холестерина и β-липопротеинов (см. Липопротеины) в крови; кроме того, повышают фибринолитическую и липопротеиназную активность сыворотки крови и замедляют скорость свертывания крови.
Накапливаясь в сифилитических гуммах, Й. способствует их размягчению и рассасыванию. Однако накопление Й. в туберкулезных очагах приводит к усилению в них воспалительного процесса. Выделение Й. экскреторными железами сопровождается раздражением железистой ткани и усилением секреции, поэтому препараты Й. (в малых дозах) обладают отхаркивающим действием и стимулируют лактацию. Однако в больших дозах они могут вызывать угнетение лактации.
Препараты Й. используют для наружного и внутреннего применения. Наружно назначают главным образом препараты элементарного Й. в качестве раздражающих и отвлекающих средств. Кроме того, эти препараты и препараты, отщепляющие элементарный Й., применяют в качестве антисептических средств.
Внутрь препараты Й. назначают при гипертиреозе, эндемическом зобе, третичном сифилисе, атеросклерозе, хронических интоксикациях ртутью и свинцом; в качестве отхаркивающих средств внутрь используют йодиды.
Противопоказаниями для внутреннего и парентерального применения препаратов Й. являются туберкулез легких, заболевания почек, геморрагический диатез, беременность, некоторые кожные заболевания (пиодермия, фурункулез) и повышенная чувствительность к йоду.
Калия йодид (kalii iodidum; синоним: калий йодистый, Kalium iodatum) представляет собой бесцветные или белые кубические кристаллы либо белый мелкокристаллический порошок без запаха, солено-горького вкуса. Растворим в воде (1:0,75), спирте (1:12) и глицерине (1:2,5).
Применяют для лечения и профилактики эндемического зоба, при гипертиреозе, сифилисе, глазных заболеваниях (катаракта и др.), актиномикозе легких, кандидозе, бронхиальной астме и в качестве отхаркивающего средства. Препарат назначают внутрь (в растворах и микстурах) из расчета по 0,3—1 г на прием, 3—4 раза в день после еды; при третичном сифилисе — в виде 3—4%. раствора по 1 столовой ложке 3 раза в день после еды. При актиномикозе легких применяют 10—20% растворы препарата по 1 столовой ложке 4 раза в день. Внутривенное введение растворов калия йодида противопоказано в связи с угнетающим действием ионов калия на сердце.
Формы выпуска: порошок: таблетки, содержащие по 0,5 г калия йодида и по 0,005 г калия карбоната. Хранение: в хорошо укупоренных банках оранжевого стекла.
Кальцийодин (Calciiodinum; синоним: кальция йодбегенат, сайодин) представляет собой смесь кальциевых солей йодбегеновой кислоты и других йодированных жирных кислот. Он имеет вид крупного желтоватого, жирного на ощупь порошка без запаха или со слабым запахом жирных кислот. Практически не растворим в воде, очень мало растворим в спирте и эфире, легко растворим в теплом безводном хлороформе. Содержит не менее 24% йода и 4% кальция.
Переносится лучше неорганических препаратов Й.: не раздражает слизистую оболочку желудка и кишечника, практически не вызывает явлений йодизма.
Применяют при атеросклерозе, нейросифилисе, бронхиальной астме, хроническом бронхите и других хронических заболеваниях, при которых показано лечение препаратами Й. Назначают внутрь по 0,5 г 2—3 раза в день после еды, таблетку следует хорошо раскрошить. Лечение проводят повторными курсами длительностью по 2—3 нед. с двухнедельными перерывами между отдельными курсами.
Форма выпуска: таблетки по 0,5 г. Хранение: в хорошо укупоренных банках темного стекла.
Натрия йодид (Natrii iodidum: синоним: натрий йодистый, Natrium iodatum) представляет собой белый кристаллический порошок без запаха, соленого вкуса. На воздухе сыреет и разлагается с выделением Й. Растворим в воде (1:0,6), спирте (1:3) и глицерине (1:2). По свойствам и показаниям к применению соответствует йодиду калия.
Назначают внутрь по 0,3—1 г 3—4 раза в день. В отличие от калия йодида препарат можно вводить внутривенно. При необходимости в вену вводят 10% раствор натрия йодида по 5—10 мл через 1—2 дня. Всего на курс лечения назначают 8—12 вливаний.
Форма выпуска: порошок. Хранение: в хорошо укупоренных банках оранжевого стекла, в сухом месте.
Натрия йодид и калия йодид входят в состав противоастматической микстуры по прописи Траскова (Mixtura antiasthmatica Trascovi).
Раствор йода спиртовой 5% (Solutio lodi spirituosa 5%, синоним: настойка йодная 5%, Tinctura lodi 5%, список Б) — прозрачная жидкость красно-бурого цвета с характерным запахом. Содержит йода 50 г, калия йодида 20 г, воды и 95% спирта поровну до 1 л.
Применяют наружно в качестве антисептического средства, например для обработки операционного поля и рук хирурга, при туалете и хирургической обработке ран, а также как раздражающее и отвлекающее средство. Внутрь принимают для профилактики и лечения атеросклероза, а также при лечении сифилиса. Для профилактики атеросклероза назначают по 1—10 капель 1—2 раза в день курсами по 30 дней 2—3 раза в год, для лечения атеросклероза — по 10—12 капель 3 раза в день, сифилиса — от 5 до 50 капель 2—3 раза в день. Препарат принимают в молоке после еды.
Детям в возрасте старше 5 лет можно давать по 3—6 капель 2—3 раза в день (по показаниям). Детям до 5 лет препарат не назначают.
Высшие дозы для взрослых внутрь: разовая — 20 капель, суточная — 60 капель.
Формы выпуска: в склянках оранжевого стекла по 10, 15 и 25 мл: в ампулах по 1 мл. Хранение: в защищенном от света месте.
Раствор йода спиртовой 10% (Solutio lodi spirituosa 10%, синоним: настойка йодная 10%, Tinctura lodi 10%, список Б) — жидкость красно-бурого цвета с характерным запахом. Содержит йода 100 г, 95% спирта до 1 л. При прибавлении к препарату воды выпадает мелкокристаллический осадок йода.
По свойствам, показаниям к применению (за исключением лечения сифилиса) и дозировке соответствует 5% спиртовому раствору йода. Детям внутрь препарат не назначают.
Высшие дозы для взрослых внутрь: разовая — 10 капель, суточная — 30 капель.
Форма выпуска: в склянках оранжевого стекла по 10, 15 и 25 мл. Хранение: в защищенном от света месте. Препарат готовят на непродолжительный срок (до 1 мес.) и отпускают только по специальным требованиям.
Библиогр.. Зилва Дж.Ф. и Пэннелл П.Р. Клиническая химия в диагностике и лечении, пер с англ., с. 186, M., 1988; Монач В.О. Йод и проблемы жизни, Л., 1974, библиогр.
II
химический элемент VII группы периодической системы элементов Д.И. Менделеева, ат. номер 53, ат. масса 126,9045; относится к галогенам; недостаток Й. в организме приводит к нарушению деятельности щитовидной железы.
Читайте также:


