Вакцина от меланомы в нии им петрова
Онкоиммунология является достаточно новым и перспективным направлением в лечении рака. В клинике онкоиммунологии в НМИЦ им. Н.Н. Петрова в рамках этого направления успешно применяется инновационная методика – вакцинотерапия дендритными клетками. Вот уже полтора десятка лет она показывает хорошие результаты лечения при таких видах онкологических заболеваний, как кожная меланома, саркома мягких тканей, рак кишечника, а также рак почки. С 2010 года коллективом специалистов научного отдела онкоиммунологии проведено более 1580-и лечебных циклов для 203-х больных. Результаты впечатляют. Поэтому именно сейчас пришло время для определения путей более широкого использования методики и расширения спектра заболеваний, в борьбе с которыми она может применяться.
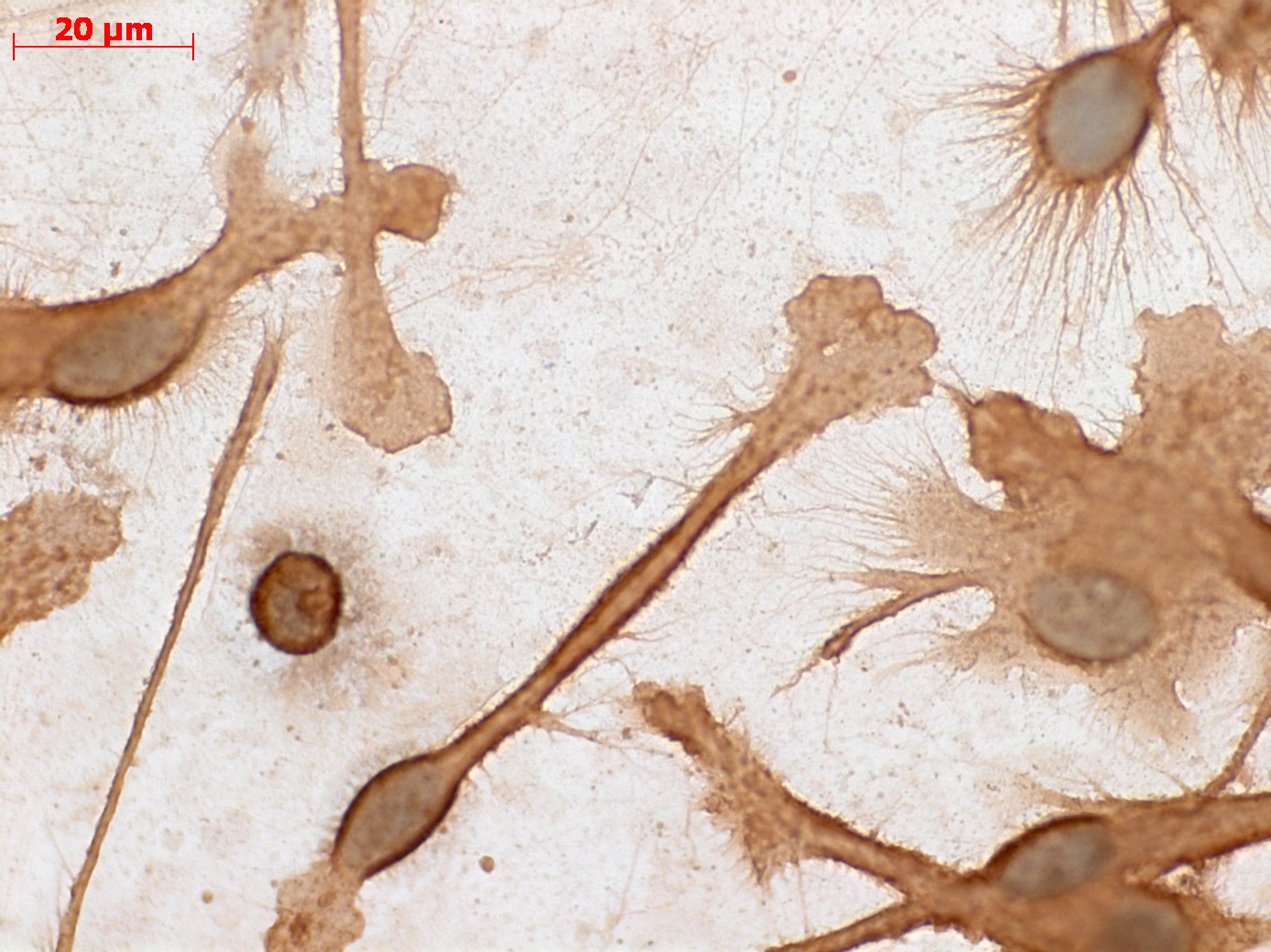
Патент на онкоиммунологический способ лечения "Иммунотерапия костно-мозговыми дендритными клетками больных солидными опухолями" зарегистрирован НИИ им. Н.Н. Петрова в 2003 г. В 2008 г. запатентована вакцина на основе дендритных клеток. В 2010 г. получено разрешение Минздрава РФ на применение этой медицинской технологии в клинической деятельности. На сегодняшний день, лечение индивидуальными противоопухолевыми вакцинами доступно только для детей; для взрослых лечение платное.
Лечение индивидуальной противоопухолевой вакциной на основе дендритных клеток пациента в клинике онкоиммунологии в Санкт-Петербурге может быть назначено пациентам, соответствующим определенным критериям включения и исключения, как взрослым, так и детям.
Хотим предупредить Вас, что, к сожалению, вакцинотерапия это не панацея. Она применяется при сОлидных опухолях (опухолях органов), в комплексе с другими методами лечения. Эффективность вакцин - стойкая ремиссия, зафиксирована у 46% пациентов, которые получали этот вид терапии.
Для того, чтобы определить возможность прохождения вакцинотерапии необходимо:
- Записаться на первичный бесплатный прием онколога НИИ онкологии им. Н.Н. Петрова.
- Врач соберет анамнез, уточнит, какие обследования необходимо сделать. Даст направление на иммунологическое и иные исследования, с результатами которых нужно записаться на прием онкоиммунолога НИИ.

В зависимости от заболевания врач первичного приема может отменить то или иное исследование из п. 1-3 стандартного списка, а также уточнить параметры исследования 4. Стандартный список см. ниже.
Обследования, результаты которых необходимо иметь на руках во время первичного приема онкоиммунолога (должны быть выполнены в течение последних 30 дней):
- МРТ головного мозга, брюшной полости и малого таза с контрастированием.
- КТ органов грудной клетки с контрастированием.
- Остеосцинтиграфия.
- Биохимический анализ крови: АлТ, АсТ, ГГТ, билирубин общий, общий кальций, мочевина, мочевая кислота, креатинин, общий белок, глюкоза, железо, СРБ, ЛДГ.
Срок выполнения: 1-2 рабочих дня. - Расширенный иммунный статус 9 параметров.
Срок выполнения: 5-14 рабочих дней. Материал: кровь. - Клинический анализ крови развернутый (с подсчетом лейкоцитарной формулы, подсчетом тромбоцитов, описанием морфологии клеток).
Срок выполнения: 1-2 рабочих дня. - Во время приема онкоиммунолог, как правило, назначает пациенту молекулярно-генетическое исследование. Его стоимость варьируется в зависимости от диагноза и показателей, которые надо проанализировать.
Срок выполнения от 14 до 30 рабочих дней. Материал: блоки, стекла (предварительно пересмотренные в лаборатории НМИЦ онкологии им. Н.Н. Петрова).
МРТ и КТ выполняются с промежутком 1 день.
Обследования после остеосцинтиграфии проводятся через 3 дня (начиная с дня, следующего за днем проведения этого обследования).
Рекомендуем Вам выполнить исследования 4 и 6 в лаборатории НМИЦ онкологии.
Внимание!! Мы ждем Вас на консультации в клинике онкоиммунологии со всеми имеющимися медицинскими документами и их ксерокопиями: эпикризами, результатами обследований и анализов за прошедшие периоды (чтобы врач мог проанализировать динамику) и пр. Обязательно возьмите с собой свою гистологию: блоки и стекла.
Запись на анализы и прием по телефону (812) 43-99-555 с 9 до 21 часа
![]()
В комздраве рассказали, как петербуржцы с онкозаболеваниями смогут получить свои лекарства![]()
Петербургский онколог: Революция в онкологии свершилась не для всех пациентов![]()
Молчание поневоле. Как помочь, если голос пропал

Пациентам с меланомой и раком почки тогда могли предложить только хирургическое лечение, системного лекарственного лечения в адъювантном (послеоперационном, поддерживающем) режиме они не получали - стандартная химиотерапия малоэффективна. То есть эти диагнозы звучали, как приговор.
Когда они обнаружили аналог гена tag7 в клетках иммунной системы человека, предположили, что он может использоваться в противоопухолевой терапии. Исследования Института биологии гена РАН и стали научной базой для создания вакцины на основе аутологичных опухолевых клеток, модифицированных геном tag7/PGRP-S.
Следующее исследование проводилось с 2001 по 2014 год на базе научного отдела онкоиммунологии НМИЦ онкологии им. Н.Н. Петрова, в нем приняли участие 80 пациентов: 68 с меланомой кожи и 12 - с раком почки. У 26 (33%) пациентов установлена III, у 54 (67%) – IV стадия заболевания.
Вакцина изготавливается из клеток опухоли, которые берутся из операционного материала самих пациентов. Их образцы модифицировали геном tag7, а затем способность опухолевых клеток размножаться уничтожалась с помощью радиации. Модифицированные опухолевые клетки могут жить в организме пациента около двух месяцев, не давая смертельно опасного потомства, но они синтезируют в это время белок Tag7, который привлекает и активирует клетки иммунной системы.
Полученную вакцину (то есть модифицированные клетки) вводили пациентам подкожно каждые три недели до прогрессирования заболевания или в течение двух лет с момента начала лечения. В первом случае ее получали 19 человек: 17 с меланомой, 2 с раком почки - после полного удаления опухоли. Во втором - после неполного удаления опухоли и уже после обнаружения метастазов – 61 пациент: 51 с меланомой кожи, 10 с раком почки. Никто из них не лечился другими иммунотерапевтическими препаратами и методами – их тогда просто не было.
Экспериментальное лечение завершилось к 2014 году и началось наблюдение за пациентами – до 2018 года. Анализ его отдаленных результатов, которые в первую очередь определяются по общей выживаемости, опубликован в журнале Oncologist.
Общая выживаемость – это процент пациентов с определенным типом и стадией рака, которые не умерли от любых причин в течение определенного периода времени после постановки диагноза.
Так, 5-летняя общая выживаемость в совместной группе больных и меланомой, и раком почки составила 25,1%. Различий в общей выживаемости между ними не было. 10-летняя общая выживаемость составила 22% для пациентов с меланомой кожи, 42% – для пациентов с меланомой кожи с благоприятным прогнозом. Для сравнения: по данным, описанным в медицинской литературе, 10-летняя общая выживаемость пациентов с меланомой кожи, получавших ипилимумаб (иммуноонкологический препарат, зарегистрированный в России в 2016 году), составила 17%.
Медиана общей выживаемости (время, которое переживают 50% участников исследования) – 6,6 лет в группе благоприятного прогноза и 4,6 мес.– в группе неблагоприятного прогноза. Для пациентов с меланомой кожи III-IV стадии для половины участников исследования с благоприятным прогнозом выживаемость составила 2,3 года, при этом 31% из них прожили более 10 лет. В группе неблагоприятного прогноза медиана общей выживаемости составила всего около 5 месяцев.
Исследователи сделали вывод: геномодифицированная аутологичная вакцина –дополнительная возможность продлить жизнь тысячам пациентов с меланомой кожи и раком почки, потому что до сих пор ни один из применяемых сейчас препаратов не стал панацеей, ни у одного из них нет 100-процентной эффективности. Вакцина сможет дать шанс на ремиссию тем, для кого возможности стандартного лечения исчерпаны. Вопрос только в том, когда сможет.

ИММУНИТЕТ ПРОТИВ РАКА
Разработка и внедрение в медицинскую практику лекарственных препаратов, которые стимулируют "иммунные силы" организма для сопротивления злокачественному опухолевому процессу, сделало онкоиммунологию одним из самых перспективных направлений в лечении раковых заболеваний.
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
О клеточной иммунотерапии и индивидуальных противоопухолевых вакцинах, которые успешно применяются в НИИ онкологии им. Н.Н. Петрова для лечения онкологических больных (в том числе с III и IV стадией заболевания), рассказывает эксперт – руководитель отдела онкоиммунологии и Центра клеточных технологий доктор медицинских наук Ирина Александровна Балдуева.
***Иммунные силы
Злокачественные новообразования - это заболевания не отдельных органов, а всей системы организма, от состояния иммунитета зависит их развитие, а также эффективность лечения. Научный прорыв, который был сделан в этой сфере в последние десятилетия, дал больным надежду на современное результативное лечение.
Новые методы иммунотерапии - индивидуальные терапевтические противоопухолевые вакцины - разрабатываются в НИИ онкологии им. Н.Н. Петрова с 1998 года. За это время мы создали 5 противоопухолевых вакцин.
Кроме этого, мы занимаемся исследованием иммуногенности злокачественных опухолей и их метастазов – определяем насколько та или иная опухоль может быть потенциальной мишенью для иммунной системы. Перспективное направление - проработка оригинальных методов индивидуализации диагностики и лечения на основе иммунологических и молекулярно-генетических методов.
***Индивидуальные противоопухолевые вакцины
Разработанные в НИИ клеточные технологии с успехом используются в онкологии – создаются аутологичные (индивидуальные) вакцины на основе собственных опухолевых клеток пациента. В основе многих вакцин – дендритные клетки, которые активируют клетки иммунной системы на уничтожение ими раковых клеток.
Вакцинация проходит курсом, инъекции делаются с периодичностью, которую определяет врач и которая зависит от состояния больного. Лечение назначается после прохождения основного курса. Дело в том, что опухоль состоит из разных типов клеток и базовое лечение может подавлять основную их популяцию, но есть клоны клеток, которые к нему резистентны и провоцируют прогрессирование заболевания.
Некоторым больным рекомендуется лечение после операции, ведь риск того, что опухоль возникнет снова, достаточно высок. Показано это, например, при меланоме кожи.
Действенны комплексные программы – иммунотерапия в сочетании с фотодинамической терапией, низкодозной химиотерапией и другими видами лечения.
НИИ онкологии специализируется на клеточной иммунотерапии меланомы, саркомы мягких тканей, рака толстого кишечника, рака почки, мочевого пузыря, молочной железы и легких. В настоящее время здесь проходит порядка десяти исследований противоопухолевых вакцин, разработанных специалистами Центра клеточных технологий НИИ. И.А. Балдуева ведет амбулаторный прием в КДО НИИ онкологии в пос. Песочный, а также в КДЦ на ул.Красного Текстильщика.

В России начаты работы по созданию индивидуализированной вакцины от наиболее агрессивного рака кожи – меланомы. Синтезированное вещество заблокирует возникновение рецидива опухоли. В конце 2020 года ученые планируют начать клинические испытания на людях. Главным исполнителем работы по госконтракту является Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина.

Меланома представляет собой наиболее агрессивную форму рака кожи. По данным ВОЗ, ежегодно в мире выявляется 132 тыс. новых случаев болезни. Для лечения меланомы применяется хирургическое вмешательство, лучевая и химиотерапия, но обычно после первичного удаления опухоли в большинстве случаев наступает рецидив.
Предыдущие исследования разных случаев меланомы показали, что опухоли на поздних этапах развития имеют механизмы избегания узнавания иммунной системой человека. Из-за этого иммунная система не может определить раковые клетки как чужеродные и уничтожить их. Новый подход заключается в том, чтобы выявить уникальные мутации, которые появились в раковых клетках конкретного пациента. Зная эти мутации, можно синтезировать неоантигены — короткие белки, которые идентичны участкам белков из опухолевой клетки, но отличаются от белков здоровых клеток.
Синтезированные неоантигены в виде вакцины вводятся пациенту после удаления первичной опухоли, и клетки иммунитета (Т-клетки) тренируются реагировать на них. Поэтому при появлении метастаз Т-клетки связываются с белками из раковых клеток, чтобы распознать и уничтожить их. Этот способ вместе с иммуностимулирующей терапией должен исключить возникновение рецидива.

Чтобы убедиться в состоятельности рабочей гипотезы, ученые вначале испытают вакцину на животных. Для этого заготовлены мыши чистой линии C57Bl/6. Все они имеют практически одинаковый геном, так как скрещиваются только с мышами той же линии.

Сначала мышам привьют клетки меланомы, чтобы искусственно смоделировать развитие настоящей опухоли. Потом будет прочитан геном (а точнее, экзом — не весь геном, а самые значимые его части) здоровой и опухолевой ткани каждой мыши. Эти последовательности нуклеотидов сравнят и найдут отличия, которые помогут выбрать наиболее вероятных кандидатов на роль неоантигенов для вакцины.

По словам завгруппой генной иммуноонкотерапии Института биоорганической химии РАН Ирины Алексеенко, несколько неоантигенных вакцин против меланомы уже были испытаны и на животных, и на людях, но далеко не все из них продемонстрировали эффективность.
— Результаты первого испытания неоантигенной вакцины на людях были опубликованы в 2015 году, исследование проводилось в США всего на трех пациентах с меланомой. Было показано, что такие вакцины могут влиять на течение болезни. В 2017 году уже исследователи из Германии отчитались о результатах применения неоантигенной вакцины у больных с меланомой: у девяти из 13 больных после лечения полностью исчезли опухолевые очаги и через год наблюдения не было обнаружено рецидива заболевания, — рассказала Ирина Алексеенко.
Однако, отмечает она, в ряде клинических испытаний применение неоантигенных вакцин не приводило к улучшению у онкологических больных. Это связано с тем, что эффективность таких вакцин зависит от того, насколько правильные неоантигены были выбраны и синтезированы учеными.
— Успешность вакцины, разрабатываемой нашими учеными, также будет зависеть от того, насколько им удастся подобрать и синтезировать правильный набор неоантигенов, способный активировать иммунный ответ против опухоли, — подчеркнула Ирина Алексеенко.
Разработка вакцины началась в апреле этого года. Ученые надеются дойти до клинических испытаний на людях в конце 2020 года. На начальном этапе расчетная стоимость вакцины для конкретного пациента составит 1,5 млн рублей, впоследствии возможно ее удешевление.
Клеточные технологии сегодня получают практическое применение в самых разных областях отечественной медицины – от косметологии до кардиологии. Но если в одних случаях клеточные продукты используются пока в экспериментальном порядке или проходят стадию клинических исследований, то в других – уже имеют статус терапевтически эффективной и одобренной регуляторами методики. Наиболее яркий пример клинического внедрения – иммунотерапия злокачественных новообразований с помощью дендритно-клеточной вакцины, созданной 20 лет назад в Санкт-Петербурге учеными НИИ (сейчас – НМИЦ) онкологии им. Н.Н. Петрова. О том, в каких обстоятельствах рождалась и отрабатывалась уникальная методика, Vademecum рассказала один из ее авторов – руководитель Центра клеточных технологий и научного отдела онкоиммунологии НМИЦ Ирина Балдуева.
– В чем суть терапии с помощью дендритно‑клеточной вакцины?
– Если объяснять упрощенно, то мы берем у пациента образец опухоли, которая уже не отвечает на другие методы лечения, выделяем опухолевые клетки и клетки крови и в лабораторных условиях модифицируем их таким образом, чтобы иммунная система начинала их распознавать, а затем вводим полученную дендритную вакцину пациенту. Дендритные клетки умеют распознавать антигены опухолевых клеток (раково‑тестикулярные антигены) и помогают иммунной системе с ними справляться.
– Как давно вы занялись этой темой?
– После медицинского училища я поступила в мединститут и параллельно работала медсестрой в хирургическом отделении. Там я часто общалась с онкологическими больными, и каждый говорил о том, как ему хочется жить – хотя бы еще несколько лет. Мне уже тогда стало ясно, что та же, например, химиотерапия помогает далеко не всем, высока вероятность прогрессирования заболевания, и надо что‑то делать, искать то, что сможет помочь этим людям. Я стала эту тему исследовать, на втором курсе института поняла, что следует сосредоточиться на иммунной системе, которая отвечает за многие изменения в организме, в том числе за борьбу с инфекционными, аутоиммунными и онкологическими заболеваниями. Так я стала изучать иммунологию. После института по распределению Минздрава я попала в НИИ онкологии им. Н.Н. Петрова. Специальности иммунолога тогда, конечно, не существовало, поэтому я занялась наукой. Параллельно работала в 31‑й городской больнице, где позже возглавила лабораторию иммунологии – там пришлось работать с клетками костного мозга, используемыми сегодня при изготовлении дендритно‑клеточных вакцин. И когда в 1998 году мне предложили войти в научную группу в НИИ онкологии в качестве иммунолога, я не раздумывая согласилась.
– Почему иммунология стала интересна НИИ онкологии?
– Минздрав выделял средства на научную работу института, а так как направление было признано перспективным, его постоянно поддерживали. В развитие темы вкладывал собственные средства и сам НИИ.
– А за рубежом в то время иммунотерапию изучали, практиковали?
– Из научной литературы я знала, что дендритными клетками занимаются в Париже в Онкологическом институте Густава Русси, и курирует там это направление Лоранс Зитвогель. Мы ей написали, пригласили в Петербург. Она приехала, посмотрела, дала множество дельных советов. Потом я отправилась на стажировку в ее институт. Сама Зитвогель училась в Америке, где подобные лаборатории появились заметно раньше. Она рассказывала, как трудно было организовать ее лабораторию в Париже, притом что работала она на том этапе только с дендритными клетками подопытных мышей. Первые человеческие дендритные клетки в лаборатории Зитвогель получили к 2000 году, параллельно с нами. Так что можно сказать, что в Европе НИИ им. Н.Н. Петрова был в этой тематике одним из первых, а в 2003‑2004 годах это удалось сделать коллегам из РОНЦ им. Н.Н. Блохина.
– Какие практические результаты принесли ваши исследования на сегодняшний день?
– То есть дендритно‑клеточная вакцина под действие 180‑ФЗ не подпадает?
– Нет. По идее, производство и применение таких вакцин должны регулироваться отдельным законом – о минимально манипулируемом клеточном продукте. Такого документа пока нет, и неизвестно, когда он появится. Дело в том, что 180‑ФЗ распространяется на клеточные линии, которые получаются в результате размножения в лаборатории, а у нас они скорее созревают в лабораторных условиях – мы их учим распознавать опухолевые антигены. Тот самый закон, которого пока нет, должен будет распространяться на все виды трансплантации костного мозга, не подпадающей под действие 180‑ФЗ. Получается, две наши дендритные вакцины – единственные легитимно используемые у нас в стране: на их применение есть разрешение Росздравнадзора, а 180‑ФЗ на них не распространяется. Все остальные существующие в отрасли продукты (включая другие наши разработки), подпадающие под действие 180‑ФЗ, пока не зарегистрированы и применяться не могут. Причем у некоторых коллег были подобные нашим разрешения Росздравнадзора на использование клеточных технологий – в косметологии, комбустиологии, но с появлением 180‑ФЗ, пусть толком и не работающего, их применение стало невозможным.
– Как ваши вакцины работают?
– С 1998 года мы пролечили более 700 человек. Основные профили и локализации – меланома, саркома мягких тканей, рак кишечника, молочной железы, почек. Все эти новообразования являются иммуногенными. Когда уже появляются метастазы, тогда этих иммуногенных антигенов становится все больше. Так что наша вакцина рассчитана на пациентов с исчерпанными возможностями. Удается продлить их жизнь как минимум на год.
– То есть полностью излечиться с помощью дендритно‑клеточной вакцины нельзя?
– У нас есть в практике такие случаи, например, при меланоме. Есть пациенты, которые продолжают лечение в течение 10 лет – болезнь отступила, но сохранился риск, что заболевание вернется и вернется в иной форме. Бывало, пациент полностью излечился от саркомы мягких тканей, а через четыре года у него появились метастазы в головном мозге. Клетки скрылись от иммунной системы, в какой‑то момент активизировались и спровоцировали рецидив, который оказался крайне агрессивным. Именно поэтому мы не только проводим иммунотерапию, но и в целом занимаемся иммунной системой пациента. Обычно иммунитет истощен, его надо восстанавливать, чтобы у клеток появились силы отвечать на наше лечение. Это не так просто, система может заработать через месяц, а может и через два‑три.
– Есть мнение, что методики, подобные вашей, следует использовать на более ранних стадиях онкозаболеваний, не подвергая пациента лучевой и химиотерапии. Что вы по этому поводу думаете?
В нашем центре прием ведут пять таких специалистов. К нам приходит пациент, и мы определяем, что ему необходимо – можно ли сейчас подключить ему иммунотерапию. То есть мы уже на том клиническом пути, о котором вы говорите.Что является препятствием? К сожалению, и консультации, и сама иммунотерапия осуществляются только на платной основе. Пока у государства нет возможности поддерживать это направление. Хотя иммунотерапию можно было бы использовать в качестве высокотехнологичной медицинской помощи. Мы подавали наши протоколы в Минздрав, но нам ответили: надо дождаться появления закона о минимально манипулируемых клеточных продуктах. При этом иммунотерапия нисколько не дороже некоторых онкопрепаратов.
– Каково, по вашим расчетам, соотношение стоимостей этих методик?
– Например, первая линия химиотерапии при саркоме мягких тканей недорогая. А вот совокупные затраты на вторую линию химиотерапии в целом по России достигают от 0,4 до 4,1 млрд рублей в год. Такая вилка связана с разницей в цене препаратов. Вакцину близко не сравнить по стоимости – это 43 тысячи рублей за одно введение. Как правило, пациенты лечатся в течение первого года ежемесячно, второго года – раз в три месяца, и третьего – раз в полгода. А дальше уже остается только наблюдение. Мы удешевили весь процесс до минимума, отработана каждая доза. У нас даже диссертационная работа на эту тему есть.
– За счет чего курс лечения можно удешевить? Более точно рассчитывать дозы?
– Опытным путем мы стали уменьшать дозу вакцины, смотреть, при каком ее минимальном объеме сохраняется активность клеток, какие нужны для этого внешние условия. Можно сэкономить на компонентах вакцины. Например, ростовой фактор – это отдельный препарат, который сегодня уже производится и в России. Питательных, культуральных сред, факторов дифференцировки недостаточно, если их будет больше, мы сможем еще снизить стоимость курса лечения. Среды, например, мы покупаем в Германии. Хорошо бы иметь отечественный аналог. Еще одна проблема – расходные материалы из пластика: мы используем импортные изделия, потому что у нас их выпуск не налажен.
– Как пациенты вас находят? Вы вкладываетесь в продвижение?
– Нет, здесь работает так называемое сарафанное радио. Пациенты и их родственники очень много общаются друг с другом, много читают, ищут варианты. Очень многие уезжают на такое лечение за рубеж, например, в Израиль, а когда у них кончаются деньги, им говорят, что то же самое можно сделать в Санкт‑Петербурге.
– Куда, помимо Израиля, уезжают лечиться российские пациенты?
– Германия, Канада, США, Япония. Везде это очень дорого. И наша задача в том, чтобы это направление у нас не свернулось из‑за банального отсутствия госфинансирования, работающих законов и так далее.
– Вы рассматриваете в перспективе создание на базе НМИЦ онкологии лаборатории полного цикла, способной обеспечивать вакцинами другие клиники?
– Конечно, такие планы есть. Но в нынешних неопределенных условиях мы пока можем только объединиться с коллегами. В ближайшее время мы организуем Ассоциацию биомедицинских клеточных продуктов, как раз призванную развивать полный цикл производства, – ради снижения стоимости вакцин и других продуктов. В Петербурге есть почти все для этого – я имею в виду предприятия, которые производят компоненты для вакцины. Для организации полного цикла нужно лицензировать производство, получить сертификат GMP, все это требует для начала нормативного обоснования, а затем финансов. Сейчас готовится Национальная программа по борьбе с онкозаболеваниями, надеюсь, и на наше направление получится изыскать средства.
– У ассоциации уже есть конкретные предложения по развитию отрасли?
– Да, мы подготовили целый пакет различных уточнений и предложений. Важно обозначить в подзаконных актах, каким образом будет осуществляться лицензирование производства, какие требования следует предъявлять к средам и самому продукту, какую подготовку должны иметь биотехнологи. Кроме того, мы предлагаем Минздраву сохранить уже существующие наработки. Важно, чтобы нас не отбросили снова на экспериментальную стадию. Проверить еще раз эффективность разработок можно, главное, чтобы в целом процесс не останавливался.
– Когда вы ожидаете принятия закона о минимально манипулируемых клеточных продуктах?
– Мы понимаем, что документ будет принят в обозримом будущем, и надеемся, что он будет более тщательно проработан, чем 180‑ФЗ. Мы в любом случае сделаем все, чтобы ему соответствовать. Но самым важным остается вопрос финансирования. Как обычно бывает? Научное учреждение разрабатывает и передает компетенции клинике или фармкомпании. Мы не против такого пути, но необходимо, чтобы разработки и их авторы достойно финансировались. Зарплаты в науке и в практической сфере кратно разнятся, и не в пользу ученых. А мы готовим специалистов не для того, чтобы они куда‑то ушли. Мы не бедствуем, зарабатываем как можем сами, также лаборатория получает дополнительные средства из бюджета Центра, но тем не менее.
Torange/НМИЦ онкологии им. Н.Н. Петрова/Indicator.Ru
Исследователи из НМИЦ онкологии им. Н. Н. Петрова создали новую вакцину против рака, которая может быть создана из собственных опухолевых клеток пациента. Ее применение увеличило пятилетнюю выживаемость до 25,1% пациентов и десятилетнюю выживаемость до 22% пациентов с III–IV стадиями меланомы кожи и рака почки. Исследователи также обнаружили, что на эффективность лечения злокачественных новообразований влияет уровень продукции опухолевыми клетками белка MICA, который блокирует рецепторы Т-лимфоцитов. Свою статью исследователи опубликовали в журнале The Oncologist.
Затем ученые обнаружили аналог гена tag7 в клетках иммунной системы человека. Они предположили, что его можно использовать в противоопухолевой терапии. Чтобы изготовить вакцину, ученые на первом этапе отобрали образцы опухоли пациентов. Затем авторы переносили образцы в культуру, трансфицировали геном tag7, после чего с помощью ионизирующего излучения уничтожали способность опухолевых клеток размножаться. Трансфицированные опухолевые клетки могут жить в организме пациента до двух месяцев, не вызывая при этом онкологических заболеваний. При этом клеточные структуры могут синтезировать белок Tag7, который привлекает и активирует иммунную систему.
Полученный продукт вводили пациентам подкожно каждые три недели до прогрессирования заболевания или в течение двух лет с момента начала лечения. С 2001 по 2014 год в исследовании, которое проводилось на базе научного отдела онкоиммунологии НМИЦ онкологии им. Н. Н. Петрова, приняли участие 80 пациентов. Из них 68 с меланомой кожи и 12 с раком почки. У 26 (33%) пациентов медики установили III стадию заболевания, у 54 (67%) — IV стадию. В качестве адъювантной терапии вакцину получали 19 больных: 17 с меланомой, 2 с раком почки. В лечебном режиме, то есть после неполного удаления опухоли и уже после обнаружения метастазов, — 61 пациент: 51 с меланомой кожи, 10 с раком почки. Никто из них не получал другого лечения.
С 2014 по 2018 год ученые наблюдали за пациентами. Оказалось, что пятилетняя общая выживаемость в совместной группе больных и меланомой, и раком почки составила 25,1%. Различий в общей выживаемости между ними не было. При этом десятилетняя общая выживаемость составила 22% для пациентов с меланомой кожи, 42% — для пациентов с меланомой кожи с благоприятным прогнозом. Для сравнения, обычно пятилетняя общая выживаемость больных с меланомой кожи, получавших ипилимумаб (иммуноонкологический препарат), составила 17%.
В ходе исследования ученые также пытались выяснить, благодаря чему лечение генномодифицированной вакциной было эффективно для одних пациентов и не эффективно для других. Для этого они оценивали свойства опухоли, индивидуальные у каждого пациента. Выяснилось, что прогноз выживаемости коррелирует с уровнем белка MICA. Если этот белок избыточно продуцируется опухолевыми клетками, то его молекулы попадают в опухолевое микроокружение, а затем в кровоток, где соединяются с рецепторами на Т-лимфоцитах и NK-клетках (клетках-киллерах) и блокируют их способность уничтожать раковые. Таким образом, от присутствия белка MICA зависела эффективность лечения пациента.
Читайте также:





