Универсальными лабораторными маркерами нейроэндокринных опухолей являются
Локализация НЭО крайне разнообразна, но чаще всего они обнаруживаются в органах пищеварительной системы (более 50 %): прямая (17,2 %) и тонкая кишка (13,4 %), желудок (6,0 %), поджелудочная железа (6–7 %). НЭО занимают второе место в общей структуре онкологической патологии ЖКТ, уступая лидерские позиции лишь колоректальному раку. Около 27 % случаев НЭО возникают в легких (согласно базе данных Surveillance, Epidemiology, and End Results (SEER) 1975-2016) [1].
Еще недавно обсуждались вопросы включения НЭО в список орфанных заболеваний. Но в настоящее время отмечается увеличение частоты встречаемости этой патологии, в том числе из-за улучшения диагностических возможностей (в частности, распространение гастроскопии, колоноскопии, капсульной эндоскопии).
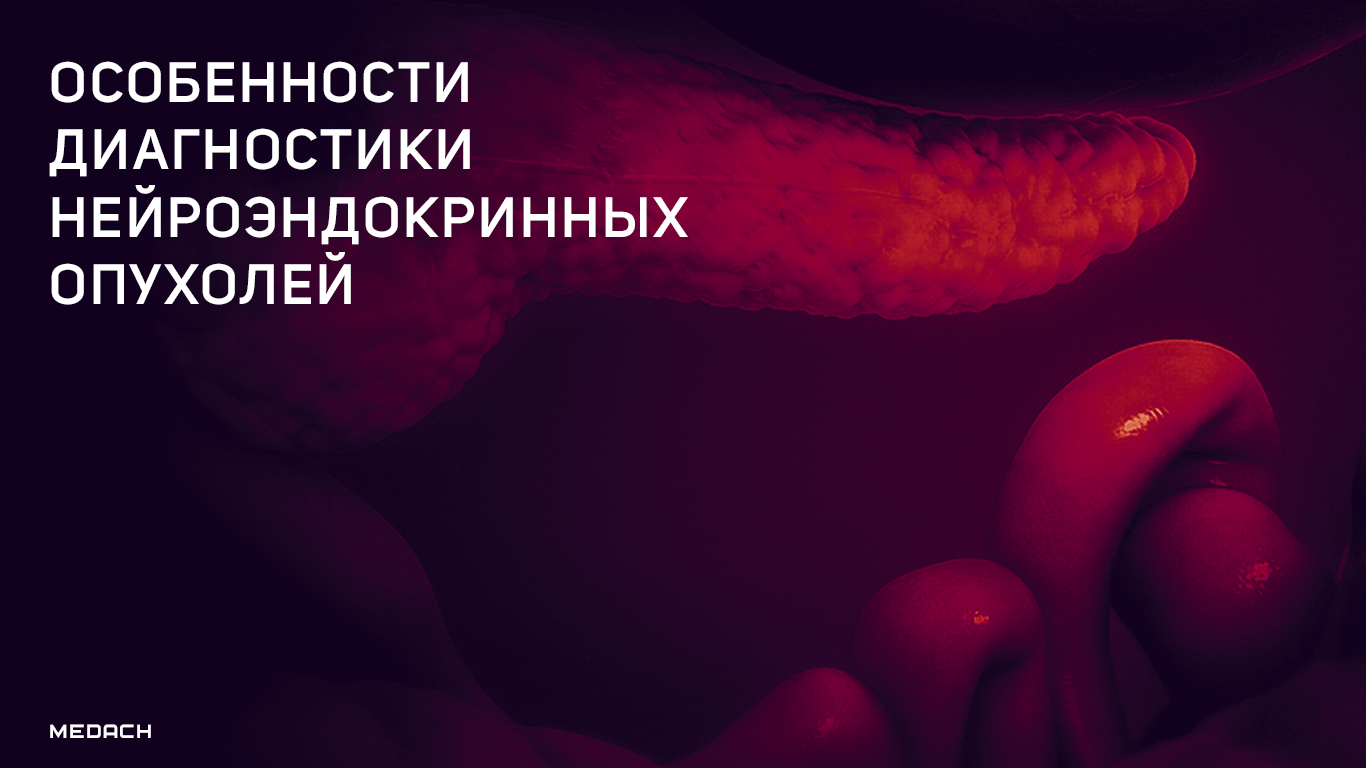
НЭО классифицируют в зависимости от отдела эмбриональной кишечной трубки: из передней, средней и задней кишки (табл. 1) [2].
Табл.1 | Классификация НЭО по эмбриогенезу [2].
Карциноидный синдром — важный клинический признак. В основном, он обусловлен эффектами серотонина, а также брадикинина, гистамина, дофамина и в меньшей степени других биологически активных веществ (БАВ).
Клинические проявления карциноидного синдрома разнообразны. Наиболее часто у пациентов отмечается гиперемия кожи лица, приливы, диарея, боль в животе. У 60 % пациентов отмечают формирование карциноидной болезни сердца, с нарушением работы преимущественно клапанного аппарата правых отделов (стеноз и/или недостаточность легочного и трехстворчатого клапанов). Серьезным осложнением является декомпенсация нарастающей сердечной недостаточности. Морфологическим субстратом служит выраженный диффузный фиброэластоз эндокарда. Возможны появления телеангиоэктазий, одышки, пеллагры, бронхоспазма. Усиливается продукция соединительнотканных компонентов, в частности, коллагена. Это ведет к фиброзированию и стенозу брыжеечных артерий, фиброзирующему стенозу уретры. Ввиду склонности к развитию спаечного процесса в брюшной полости нарастает риск формирования кишечной непроходимости.
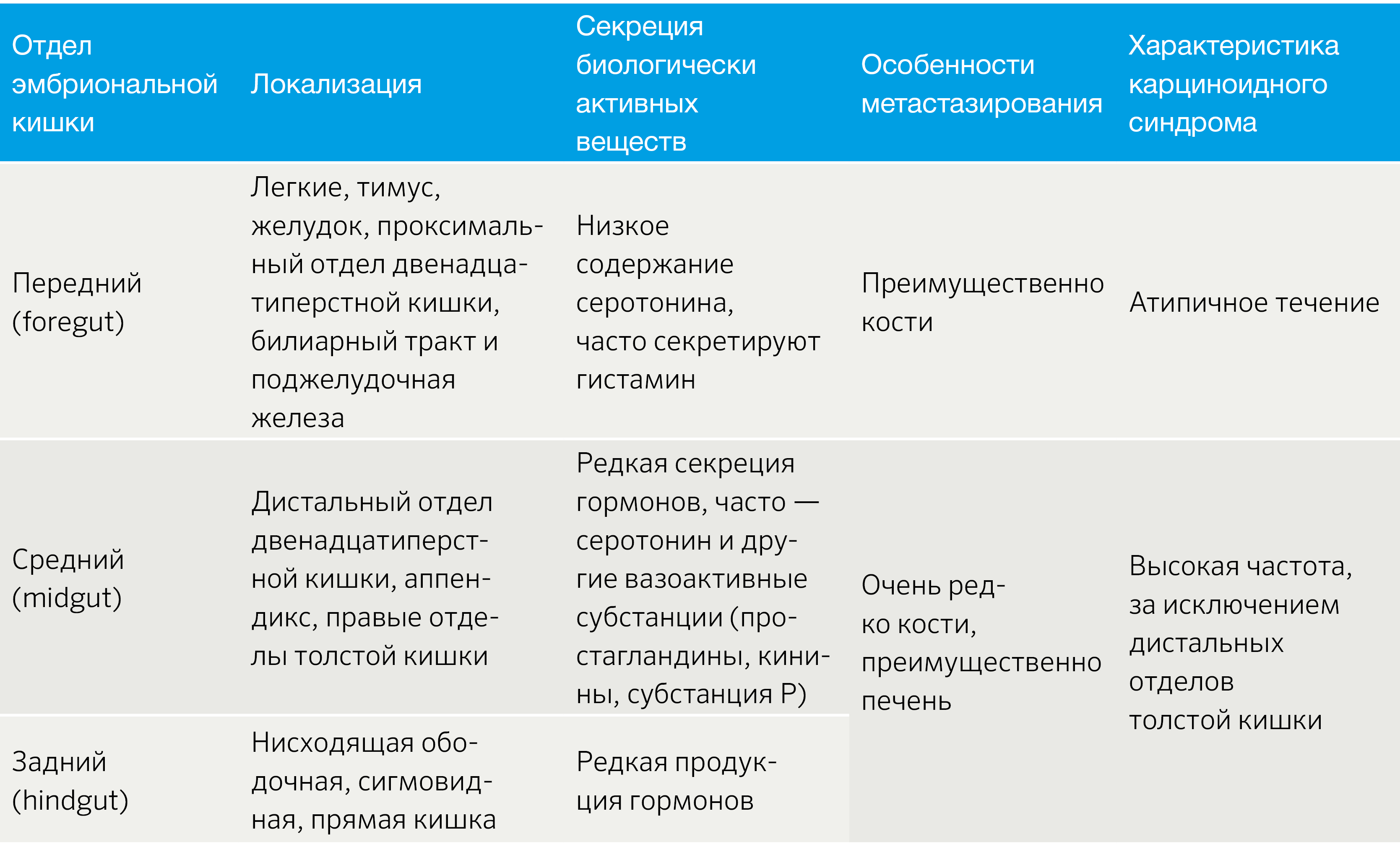
Важным аспектом является функциональный статус опухоли. В зависимости от наличия продукции БАВ выделяют функционирующие (табл. 2) и нефункционирующие новообразования [3].
Табл.2 | Функционирующие НЭО [3].
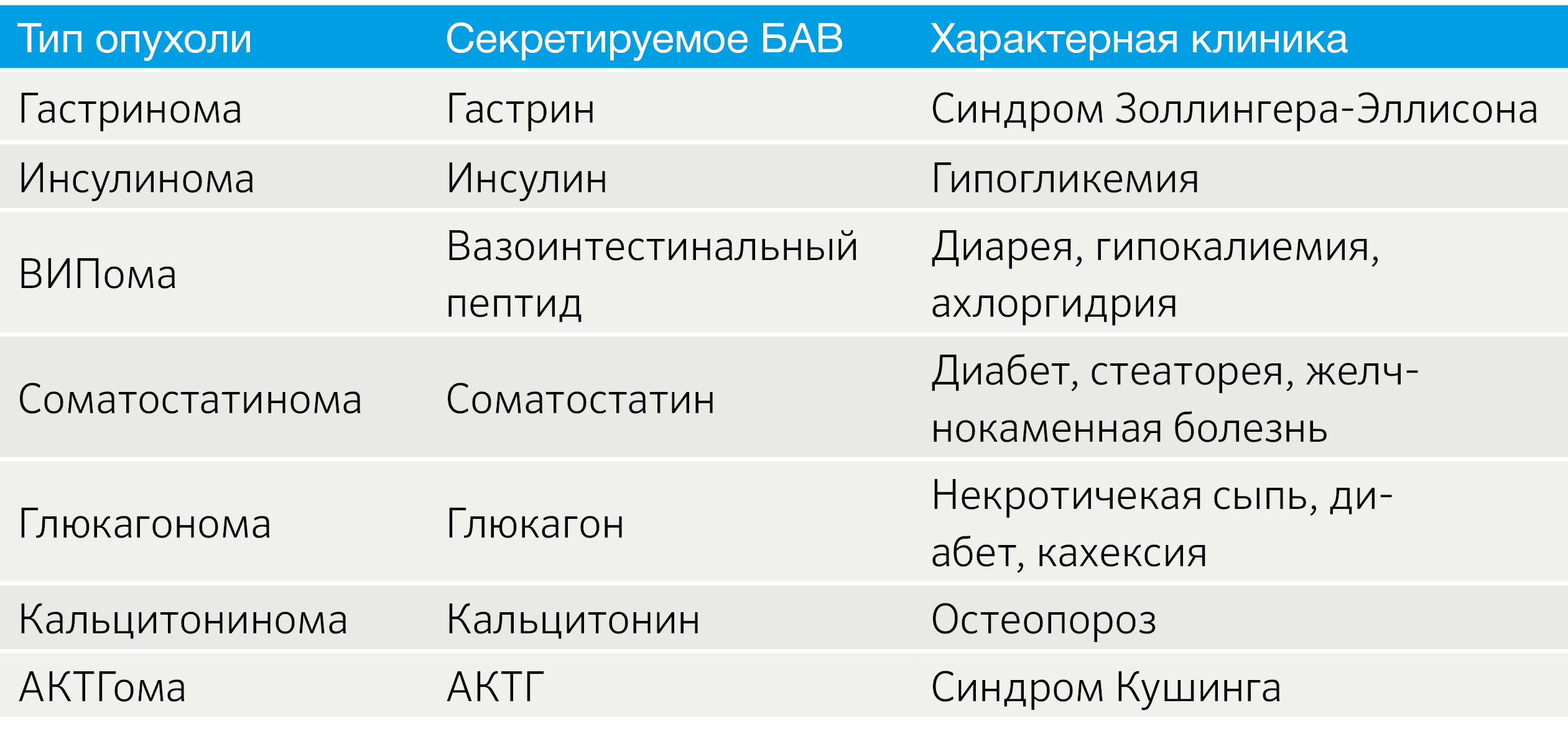
Особенности TNM-классификации определяются локализацией НЭО. НЭО легких стадируются как немелкоклеточный рак легких, для НЭО ЖКТ и поджелудочной железы разработаны рекомендации Европейского общества по изучению НЭО (ENETS) [4]. Также установление стадии TNM для всех анатомических локализаций регламентируется руководством, созданным Американским объединенным комитетом по раковым заболеваниям (the American Joint Committee on Cancer, AJCC) [5, 6]. Так как эти системы не идентичны, возникают вопросы унификации подходов к стадированию. Например, была создана модифицированная система ENETS (mENETS), для диагностики НЭО поджелудочной железы (pNET) (табл. 3) [7].
Табл.3 | Стадирование НЭО поджелудочной железы согласно модифицированной системе ENETS (mENETS) [7].
И вот мы подходим к той черепахе, на которой стоят киты онкологической диагностики. Это, несомненно, гистологическая верификация диагноза. Как и многие опухолевые заболевания, морфологические градации НЭО подвергались различным модификациям, уточнениям, дополнениям. Дискуссии в этой области в итоге привели к созданию 4-ой редакции классификации ВОЗ (2017 год) [8]. Именно она является актуальной на настоящий момент и заключение при проведении патологоанатомическом исследовании должно отвечать введенным в ней понятиям и требованиям.
Параметрами морфологической оценки нейроэндокринных новообразований являются: гистологическое строение опухоли, определение сосудистой и периневральной инвазии, митотический индекс. Несмотря на многообразия источников НЭО, морфологическая картина является сходной (рис. 1) [9].
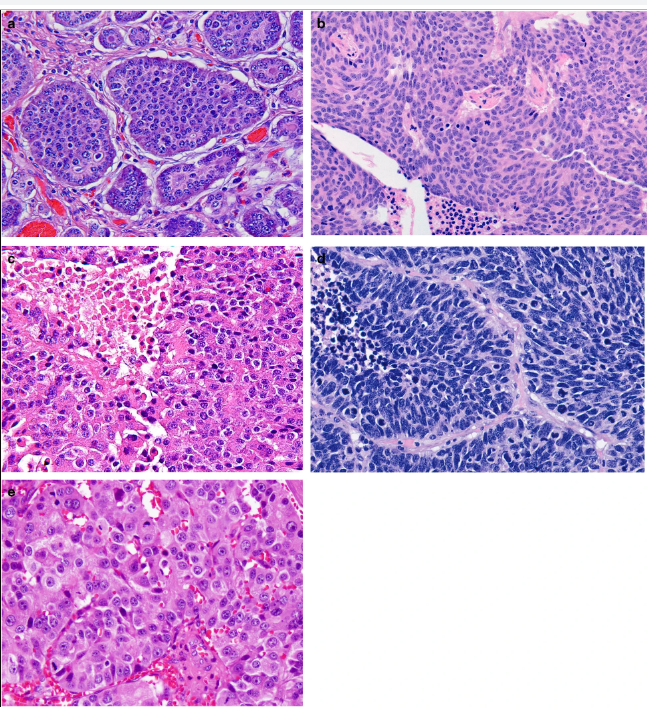
Нейроэндокринное происхождение атипичных клеток доказывает положительная экспрессия так называемых общих нейроэндокринных маркеров. Основные из них это хромогранин А, окрашивающий компоненты нейросекреторных гранул, и пептид синаптофизин, накапливающийся в мелких синаптических везикулах. Также применяется дополнительно установление экспрессии рецепторов соматостатина 2 и 5 типов (SSTR2 и SSTR5). В этом случае возможно определить чувствительность опухолевых клеток к аналогам соматостатина.
Степень злокачественности НЭО определяют на основании двух основных критериев: уровня дифференцированности опухолевых клеток и их пролиферативной активности. Традиционно выделяют три степени злокачественности (grade): G1, G2, G3. Для НЭО ЖКТ и поджелудочной железы введены понятия высокодифференцированных и низкодифференцированных новообразований (или нейроэндокринного рака (карциномы), НЭР). Высокодифференцированные НЭО объединяют G1 (менее 2 митозов на 10 репрезентативных полей зрения (РПЗ) при большом увеличении микроскопа (х400) и индекс Ki-67 ≤ 2%), G2 (2–20 митозов на 10 РПЗ и индекс Ki-67 3–20 %), G3 (> 20 митозов на 10 РПЗ и индекс Ki-67 > 20 %). Grade 3 опухоли разделяют на мелко- и крупноклеточный рак. Опухоли мелкоклеточного типа построены из однотипных клеток округлой, овальной или вытянутой формы, мелкого размера, со скудной цитоплазмой и нечеткими границами. Ядра имеют характерный вид за счет нежного хроматина и невизуализирующихся ядрышек. Определяются массивные некрозы. Крупноклеточные НЭР образованы, соответственно, клетками крупного или среднего размера, с низким ядерно-цитоплазматическим соотношением, выраженной атипией ядер, содержащих гранулярный хроматин и четкие ядрышки. В опухолевой ткани выявляются мультифокальные некрозы, значительное число митозов [8, 9].
Индекс Ki-67 определяют как средний процент окрашенных ядер при учете 500–2000 злокачественно трансформированных клеток (рис. 2) [9].
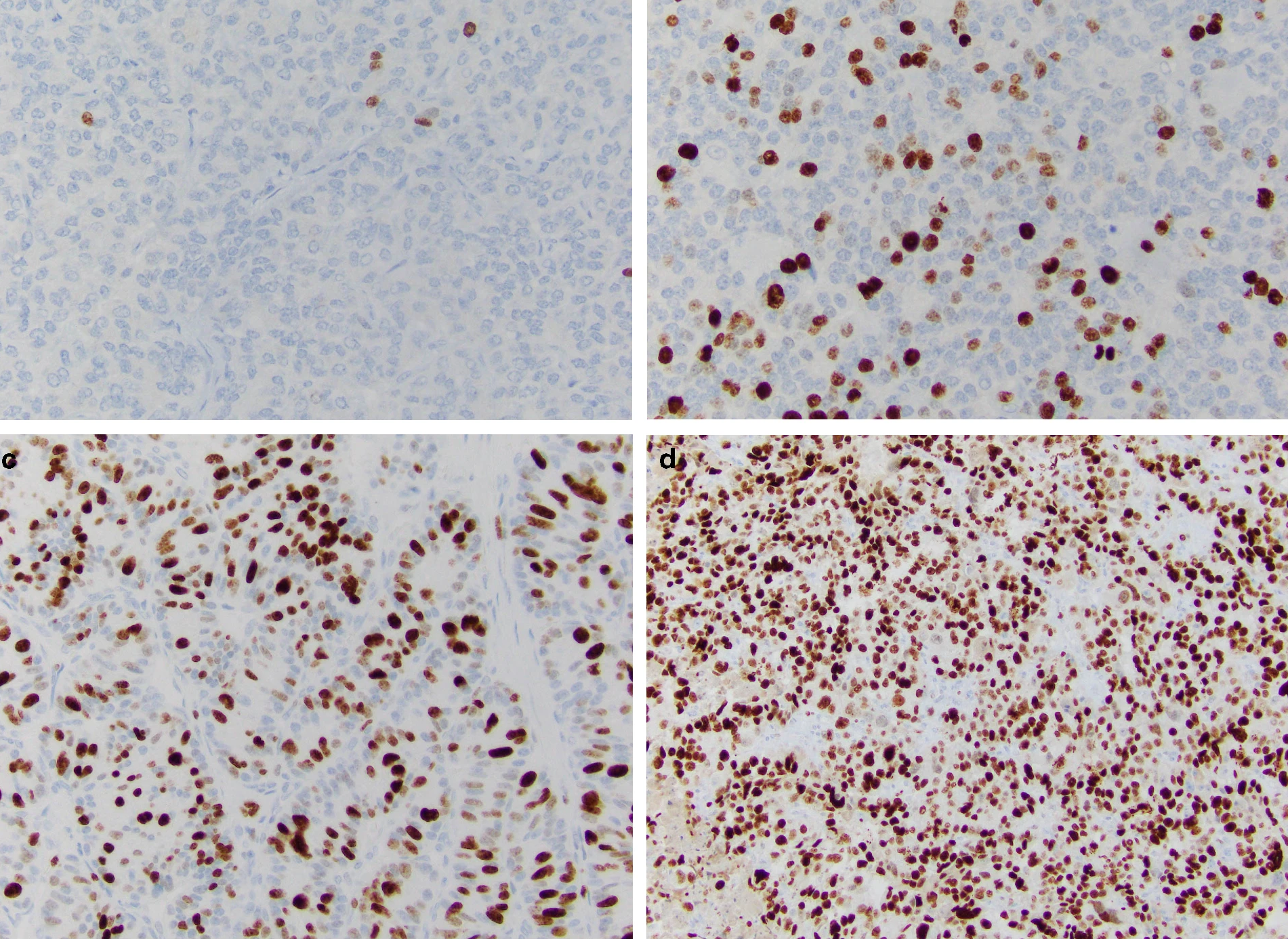
Рассмотрим различия понятий НЭО G3 и НЭР при локализации в поджелудочной железе. Несмотря на высокую степень злокачественности НЭО G3 гистологически имеют органоидную модель строения (рис. 3), отсутствие некрозов [10]. При иммуногистохимическом исследовании опухолевая ткань сохраняет экспрессию общих маркеров нейроэндокринной дифференцировки (диффузно и интенсивно определяется экспрессия синаптофизина, зачастую хромогранина А), а также панкреатические экзокринные или эктопические гормоны. Кроме того, в них отсутствует выраженная экспрессия p53 и утрата экспрессии RB (также определяются иммуногистохимически).
НЭР поджелудочной железы — это опухоли низкой степени дифференцировки и соответственно высокой степени злокачественности. Экспрессия общих маркеров нейроэндокринной дифференцировки атипичными клетками снижается: синаптофизин определяется слабо или диффузно, хромогранин А также слабо или фокально. Экзокринные гормоны отрицательны в таких опухолях [9]. Часто определяется экспрессия р53, белков ремоделирования хроматина DAXX (death-associated protein 6) и ATRX (АТФ-зависимая хеликаза), потеря экспрессии RB (белок ретинобластомы) и ISL1 (энхансер гена инсулина 1) [11].
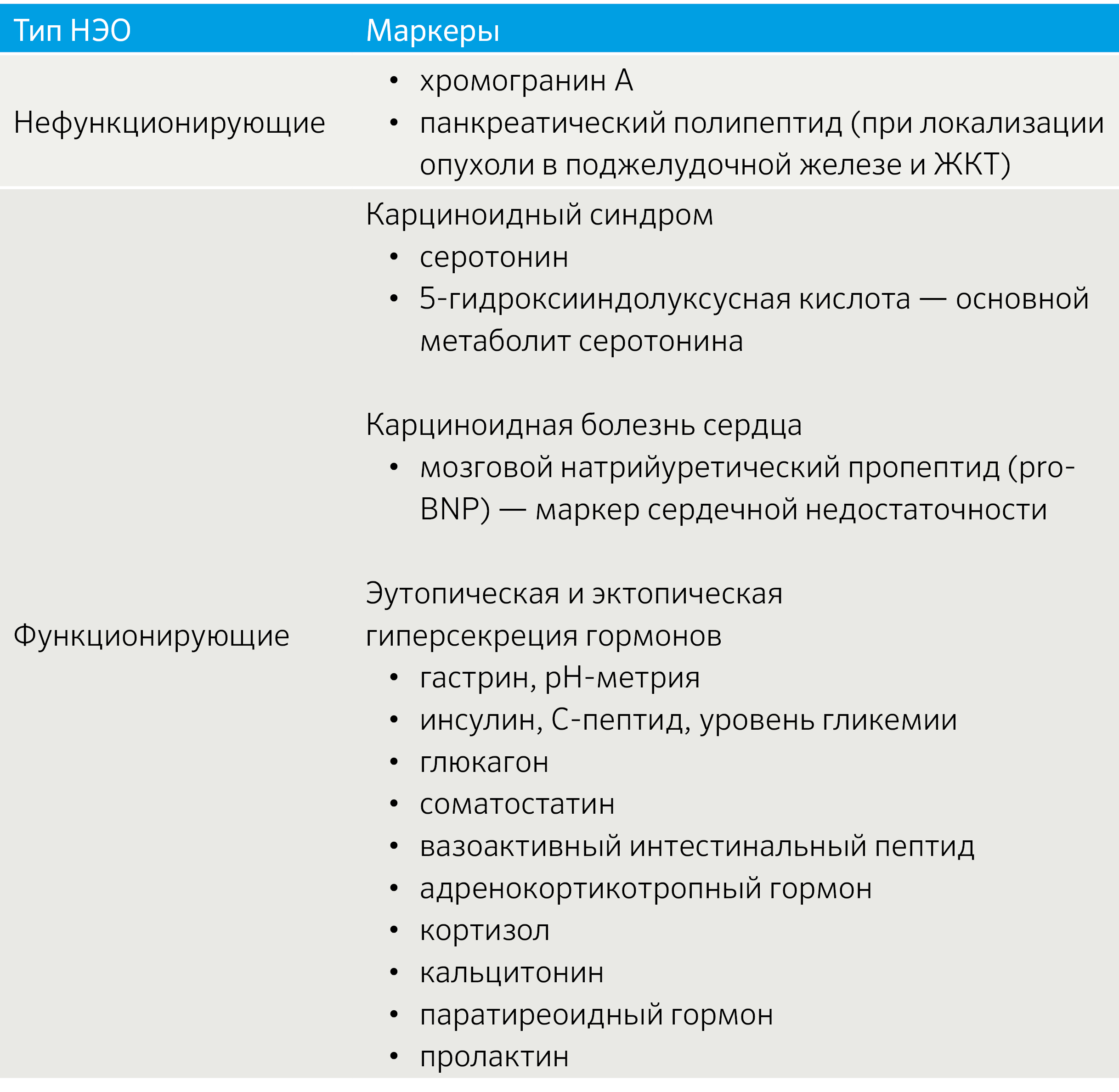
Ввиду многообразия секретирующего профиля НЭО биохимическая диагностика включает различные маркеры, комбинируемые с учетом клинической картины (табл. 4).
Табл. 4 | Спектр биохимических маркеров НЭО [2].
Радионуклидная диагностика играет важную роль в топической характеристике НЭО. Она включает методы специфической метаболической визуализации ( 123 I-MIBG), рецепторной визуализации ( 111 In-октреотид, 68 Ga-DOTA-TOС/DOTA-NOC/DOTA-TATE) и неспецифической метаболической визуализации ( 18 F-FDG, 18 F-DOPA).
123 I-метайодбензилгуанидин (MIBG) является аналогом норадреналина (норэпинефрина). Он накапливается в адренергических тканях и опухолях, происходящих из них. Сцинтиграфия с 123 I-MIBG используется для диагностики нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки [12].
Для рецепторной визуализации применяют 111 In (индий)-октеотид. Он выявляет высокодифференцированные нейроэндокринные опухоли, опухоли из клеток островкового аппарата поджелудочной железы (гастринома, глюкагонома, инсулинома). Также для верификации НЭО ЖКТ применяется соматостатин-рецепторная сцинтиграфия, так как большинство из них имеют рецепторы к соматостатину (SSTR) на поверхности опухолевых клеток (чаще 2 и 5 типа).
Выбор радионуклидного метода связан со степенью дифференцировки опухолевых клеток. Первичная диагностика НЭО Grade 1 и 2 проводится путем ПЭТ/КТ с радиофармпрепаратами (РФП), мечеными галлием 68 (является ПЭТ-радионуклидом). Сродство (аффинитет) РФП к конкретному подтипу трансмембранных рецепторов соматостатина определяет выбор диагностического индикатора (ПЭТ-лиганда, представленного различными модификациями DOTA). Например, для визуализации НЭО, экспрессирующих рецепторы подтипов SSTR2a и SSTR2b, применяют 68 Ga-DOTA-TATE (DOTA-Tyr3-октреотад). 68 Ga-DOTA-NOC (DOTA-1-Nal3-октреотид) выявляет подтипы SSTR3 и SSTR5, 68 Ga-DOTA-ТOC (DOTA-Tyr3-октреотид) — рецепторы SSTR5 [13].
При отсутствии возможности проведения данного исследования следует выполнить однофотонную эмиссионную компьютерную томографию (ОФЭКТ)/КТ (гибридный метод визуализации) с соматостатин-рецепторным радиофармпрепаратом.
Для недифференцированных НЭО Grade 3 и НЭР при отрицательных результатах соматостатин-рецепторной сцинтиграфии рекомендуется ПЭТ неспецифическая метаболическая визуализация с использованием других РФП. В частности, ПЭТ/КТ c 18F-фтордезоксиглюкозой (18F-ФДГ), которая неэффективна при высокодифференцированных НЭО [14]. Также рассматривают применение 18F-L–DOPA (дигидроксифенил-аланин) — меченого предшественника допамина, который эффективен для обнаружения медуллярного рака щитовидной железы, НЭО, параганглиомы и феохромоцитомы [15].
Общеизвестно, что нейроэндокринные опухоли (апудомы) возникают лишь в тех органах пищеварительной, дыхательной, мочеполовой, нервной, экзо- и эндокринной систем, в которых имеется как минимум один эндокринно-клеточный (нейроэндокринный или апудоцитарный) дифферон. Последний представлен обычно тем или иным количеством взаимосвязанных или автономных гранулосодержащих клеток (экскреторных или инкреторных гранулоцитов), вырабатывающих, как правило, продукты-предшественники биогенных аминов или другие продукты гормональной природы.
Зачастую, как, например, в кишечном эпителии или уротелии, такой дифферон рецессивен по отношению к профильному эпителиоцитарному дифферону, придающему органу черты специализации.
В некоторых органах, например, в больших слюнных железах, нейроэндокринный дифферон развит настолько слабо, что даже тщательные поиски апудоцитов в нормальных эпителиальных структурах крайне редко приводят к положительным результатам [Антонова, 1990]. В таких органах особенно отчетливо обнаруживается внутридифферонная (субдифферонная) морфофункциональная специализация нейроэндокринных клеток. И следует подчеркнуть, что изучение и маркировка этой специализации с целью подразделения апудоцитарного дифферона еще только начинается.
В экзо- и эндокринных органах этот дифферон, напротив, является доминантным и определяет морфофункциональный профиль органа. Известно также, что в органах и тканях, имеющих в своем составе как эпителиоклеточный, так и эндокринно-клеточный (нейроэндокриниый, апудоцитарный, инкреторно-гранулоцитарный) дифферон, развиваются опухоли карциноидного типа, паренхима которых построена почти исключительно из клеток нейроэндокринного ряда, а также опухоли, в построении которых в той или иной мере участвуют как эпителиоциты, так и апудоциты [Аничков, Толыбеков, 1987; Anichkov, Seryozhin, 1989].
Существует две группы маркеров, используемых при изучении опухолей, в построении которых участвуют клетки нейроэндокринных дифферонов. Одна группа — неспецифических маркеров — не включает метчики диффероно- и субдиффероноспецифичных продуктов. Ее часто обозначают группой маркеров широкого спектра. Сюда входят метки: каналов трансмембранного транспорта ионов натрия и кальция; рецепторов для специфических лигандов (молекул), например, фактора роста нерва; протеинов цитоскелета, например, промежуточных филаментов, нейрофиламентов; нейронспецифической энолазы; компонентов матрикса гранул (хромогранина, Leu-7); компонентов мембран гранул (цитохром В-561, синаптофизин); энзимов, синтезирующих амины.
Вторая группа — диффероноспецифических маркеров — включает метки регуляторных пептидов. Ниже мы последовательно рассмотрим маркеры вначале первой, затем второй группы.
Практическая важность маркеров широкого спектра (первая группа) состоит в ориентации патолога на нейроэндокриниый характер дифференцировки изучаемой ткани. Это важно, особенно в тех случаях, когда обычные гистологические методики такой характер не вскрывают. Дело в том, что эффективность этих маркеров не связана с уровнем экспрессии какого-то продукта в гранулах ней-роэндокринных клеток. Она достаточно стабильна и при экспрессии предшественников конечного продукта, и при общем низком уровне цитологической дифференцировки апудоцита.
Одним из классов маркеров широкого спектра, выявляемых в апудоцитах, является класс цитокератинов. Ранее мы говорим подробно об этих протеинах. Здесь же следует отметить, что в нейроэндокринных дифферонах обнаружены СК № 8 и 18. Не содержат последних лишь клетки опухолей мозгового слоя надпочечников, параганглиом, а также стероид-продуцирующие "адренокортикомы", гормон-продуцирующие опухоли яичек, яичников, а также меланоциты.
- Причины развития
- Особенности нейроэндокринных опухолей
- Классификация нейроэндокринных опухолей
- Виды нейроэндокринных опухолей и их симптоматика
- Диагностика заболевания
- Лечение
- Прогноз выживаемости
Нейроэндокринные опухоли (НЭО) образуются из апудоцитов, или APUD-клеток. Эти клетки разбросаны по всему организму и составляют самую древнюю часть эндокринной системы. Они одновременно похожи на нервные клетки и клетки желез внутренней секреции, так как могут реагировать на сигналы извне или изменения состояния организма, способны производить гормоны, выполняющие разные функции.
Опухоли APUD-системы встречаются редко, и их бывает сложно диагностировать. Чаще всего они возникают в желудочно-кишечном тракте, но могут поражать и другие органы. Особенность нейроэндокринных новообразований в том, что опухолевые клетки производят повышенное количество гормонов, и из-за этого могут возникать определенные симптомы.
Согласно данным американского реестра SEER, в 2004 году заболеваемость нейроэндокринными опухолями в США составила 5 случаев на 100 тысяч населения. В России статистика, к сожалению, отсутствует, но, вероятно, заболеваемость находится на аналогичном уровне.
По данным американских экспертов, распространенность нейроэндокринных опухолей ежегодно растет. В первую очередь это связывают с изменениями в характере питания, неблагоприятной экологической обстановкой.
По данным все того же реестра SEER, новообразования APUD-системы часто диагностируются на поздних стадиях: в 50% случаев опухоль успевает распространиться на окружающие ткани, в регионарные лимфоузлы, дать отдаленные метастазы.
Причины развития
У некоторых людей нейроэндокринные опухоли возникают в результате генетических заболеваний:
- Множественная эндокринная неоплазия (МЭН, MEN) вызвана мутацией в гене MEN, RET или CDKN1B. У больных может развиваться множество нейроэндокринных новообразований и опухолей в железах внутренней секреции. Некоторые из этих опухолей доброкачественные, некоторые — злокачественные. Выделяют четыре типа множественной эндокринной неоплазии: MEN1, MEN2A, MEN2B и MEN4. При MEN1 чаще всего возникают нейроэндокринные опухоли в паращитовидных железах, поджелудочной железе, гипофизе, иногда в пищеварительном тракте и легких. У большинства пациентов с MEN2A и MEN2B обнаруживают медуллярные карциномы (разновидность опухоли щитовидной железы), в некоторых случаях — аденомы паращитовидных желез, феохромоцитому. При MEN4 чаще всего встречаются аденомы гипофиза и паращитовидных желез.
- Болезнь Гиппеля-Линдау возникает при мутации в гене VHL. У больных в разных частях тела развиваются кисты и опухоли. Среди этих опухолей встречаются нейроэндокринные, в том числе НЭО поджелудочной железы, феохромоцитома.
- Нейрофиброматоз I типа вызван мутацией в гене NF1. Некоторые люди получают эту мутацию от родителей, у других она возникает спонтанно. Основное проявление заболевания — множество доброкачественных новообразований нервов и кожи. Повышен риск развития опухолей APUD-системы в желудочно-кишечном тракте, поджелудочной железе, феохромоцитомы.
- Туберозный склероз приводит к возникновению доброкачественных новообразований в разных органах, включая кожу, глаза, головной мозг, сердце, легкие, почки. Повышен риск развития НЭО.
У людей, которые не являются носителями этих мутаций, нейроэндокринные новообразования тоже могут возникать. Причины до конца не известны. Многие исследования показали, что одним из важнейших факторов риска является наследственность. Если в семье есть люди, у которых была обнаружена нейроэндокринная опухоль, то у остальных членов риски тоже повышены, особенно у ближайших родственников больных (родителей, детей, сестер и братьев). Кроме того, риск опухолей APUD-системы повышен в семьях с отягощенным анамнезом по раку толстой кишки, молочной железы, легкого.
Известны и другие факторы риска, но их роль нельзя считать полностью доказанной:
- Курение может способствовать развитию нейроэндокринных опухолей в легких, желудке, тонкой кишке и поджелудочной железе.
- Хронический атрофический гастрит, как показали некоторые исследования, способствует развитию НЕО в желудке.
- Сахарный диабет связывают с возникновением новообразований APUD-системы в поджелудочной железе, желудке.
Ученые пока не могут сказать, повышаются ли риски при частом употреблении алкоголя, нездоровом питании (много животных жиров), у людей с лишним весом. Нужны дополнительные исследования.
Особенности нейроэндокринных опухолей
Нейроэндокринные клетки не привязаны к какому-либо конкретному органу. Они разбросаны по всему организму. Хотя опухоли чаще всего и возникают в пищеварительном тракте, в более редких случаях они обнаруживаются и в других местах. В 15% случаев найти первичную опухоль не удается.
Нейроэндокринные опухоли могут производить гормоны, которые вызывают в органах определенные эффекты, и из-за этого пациент испытывает те или иные симптомы. Такие новообразования называют функционирующими. Если гормоны не вырабатываются — это нефункционирующая опухоль.
Классификация нейроэндокринных опухолей
Существуют разные классификации нейроэндокринных опухолей. Ниже в таблице представлены основные группы:
Стадию нейроэндокринных опухолей определяют в соответствии с общепринятой системой TNM:
- T — размер первичной опухоли, ее прорастание в окружающие ткани.
- N — поражение регионарных (близлежащих по отношению к опухоли) лимфатических узлов.
- M — наличие отдаленных метастазов.
Классификация по стадиям различается в зависимости от того, в каком органе находится нейроэндокринное новообразование. Например, стадию опухоли APUD-системы в легком определяют так же, как для немелкоклеточного рака легкого. Для нейроэндокринных новообразований в желудке, тонкой кишке, червеобразном отростке, ободочной, прямой кишке и поджелудочной железе разработаны собственные системы классификации по стадиям.
Виды нейроэндокринных опухолей и их симптоматика
Так как существуют разные типы нейроэндокринных опухолей, и они могут находиться в разных органах, то и симптомы различаются. Можно выделить три основные группы проявлений. Первая — это общие симптомы, характерные для любого типа рака: слабость, повышенная утомляемость, снижение аппетита, потеря веса без видимой причины.

Вторая группа симптомов связана с локализацией опухоли и ее размерами, сдавлением анатомических структур и нарушением функции пораженного органа. Беспокоят боли в определенной части тела, тошнота, упорный хронический кашель, расстройства стула, мочеиспусканий, кровотечения, необычные выделения. При поражении печени, желчных протоков, поджелудочной железы развивается механическая желтуха.
Третья группа симптомов вызвана гормонами, которые продуцируют нейроэндокринные клетки:
- диарея — жидкий стул более трех раз в сутки;
- постоянная жажда, голод, частые мочеиспускания, — признаки повышения уровня глюкозы в крови;
- повышенная утомляемость, раздражительность, дрожь, головокружение, судороги, потери сознания — признаки снижения уровня глюкозы в крови;
- язвенная болезнь, которая не поддается лечению;
- тревожность;
- сыпь на коже.
Желудочно-кишечный тракт — наиболее распространенное место локализации нейроэндокринных опухолей. Такие новообразования часто называют карциноидными опухолями. Частота поражения разных отделов пищеварительного тракта:
- тонкая кишка — 39%;
- прямая кишка — 15%;
- червеобразный отросток (аппендикс) — 7%;
- толстая кишка — 5–7%;
- желудок — 2–4%.
Опухоли в пищеварительном тракте вызывают классический карциноидный синдром. Он проявляется в виде покраснения и ощущения тепла в области лица, диареей, одышкой, симптомами, напоминающими бронхиальную астму, слабостью, учащенным сердцебиением, увеличением веса без видимой причины, высоким артериальным давлением, его частыми колебаниями.
Вторым по частоте местом локализации опухолей APUD-системы после НЭО ЖКТ являются легкие. Примерно в 30% случаев нейроэндокринное новообразование возникает в бронхиальной системе.
Феохромоцитома — опухоль надпочечников (иногда в других частях тела), которая вырабатывает гормоны стресса: адреналин и норадреналин. В результате избыточного уровня гормонов возникают приступы (кризы), во время которых человек испытывает беспокойство, страх, озноб, дрожь, головную боль и боль в грудной клетке, его кожа становится бледной, учащается сердцебиение, возникают экстрасистолы, тошнота, рвота.
Рак из клеток Меркеля — злокачественная опухоль кожи. Она встречается очень редко, но отличается высокой агрессивностью, рано распространяется в лимфатические узлы, метастазирует. Патология проявляется в виде одного или нескольких узелков на коже красного и синюшного цвета. Они могут изъязвляться. Рак из клеток Меркеля сложно диагностировать, зачастую его выявляют уже на поздних стадиях.
Диагностика заболевания
В большинстве случаев нейроэндокринные новообразования обнаруживаются случайно, когда человек проходит обследование по другому поводу. Опухоль можно обнаружить с помощью таких методов диагностики, как:
- Ультразвуковое исследование.
- Эндоскопические исследования: гастроскопия, колоноскопия, бронхоскопия.
- Рентгенография с контрастным усилением. Перед исследованием пациенту дают выпить раствор, который помогает четко увидеть контуры желудка, кишечника.
Диагноз подтверждается с помощью биопсии. Обнаружив патологическое образование, врач удаляет из него фрагмент ткани и отправляет в лабораторию для исследования под микроскопом. Если опухоль предположительно является феохромоцитомой, к биопсии прибегают только в крайних случаях, так как она сопряжена с серьезными рисками.
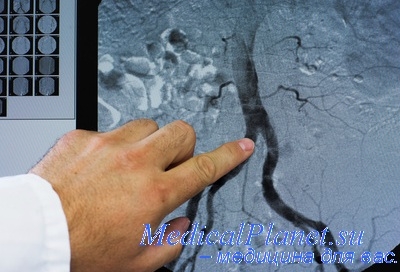
Компьютерная томография и МРТ помогают обнаружить опухоль, оценить ее размеры, локализацию, степень распространения в организме, обнаружить метастатические очаги. Для поиска метастазов применяют ПЭТ-сканирование. Врач может назначить анализы, которые помогают обнаружить гормоны, вырабатываемые опухолью, например, исследование мочи на 5-HIAA — продукт обмена серотонина. Определение уровня хромогранина А в крови помогает контролировать эффективность лечения.
Лечение
Выбор лечения зависит от типа опухоли, ее локализации, степени злокачественности, стадии. В некоторых случаях, если нейроэндокринное новообразование является высокодифференцированным и практически не растет, врач назначает активное наблюдение. Нужно периодически являться на осмотры, проходить КТ, МРТ, сдавать анализы крови. Как только появляются признаки роста или распространения в организме, начинают активное лечение.
В большинстве случаев нейроэндокринные новообразования успешно лечатся хирургическим путем. Во время операции удаляют саму опухоль и некоторое количество окружающих тканей. Затем удаленный материал изучают в лаборатории. Если получен негативный край резекции, это означает, что опухолевая ткань удалена полностью.
Если радикальное вмешательство невозможно, может быть выполнена циторедуктивная операция, во время которой стараются удалить как можно большее количество опухолевой ткани.
Если у пациента имеются признаки карциноидного синдрома, есть риск, что его состояние во время операции может сильно ухудшиться. Врач-анестезиолог должен быть осведомлен о такой возможности и принять необходимые меры.
При неоперабельных опухолях назначают медикаментозное лечение, лучевую терапию. Применяют различные виды химиопрепаратов, таргетные препараты, иммунотерапию. Терапия аналогами соматостатина помогает справиться с симптомами и замедлить рост опухоли.
Если нейроэндокринные опухолевые очаги имеются в печени, может быть проведена радиочастотная аблация, эмболизация артерии, питающей опухоль. Врачи Европейской клиники обладают большим опытом в проведении таких вмешательств.
Прогноз выживаемости
Прогноз зависит от того, какой вид опухоли был диагностирован, насколько она агрессивна, на какой стадии находится. Лечение преследует одну из двух целей:
- Полностью удалить опухолевые очаги. Если по результатам обследований не выявляются признаки присутствия опухоли в организме, констатируют ремиссию.
- Избавить пациента от симптомов и сдержать рост новообразования. При этом больной может прожить довольно долго.
Стоит поговорить с врачом перед началом лечения, спросить, какой будет цель, какого результата можно ожидать, и что планируется делать в случае, если ситуация ухудшится, опухоль рецидивирует.
Нейроэндокринные опухоли
Гистологическое строение опухоли из нейроэндокринных клеток одинаковое независимо от органа поражения.
Они могут иметь типичный карциноидный или недифференцированный вид.
В раке недифференцированного нейроэндокринного типа отмечают способность к слизепродуцированию, что может затруднить диагностику этого гистологического варианта.
Выявление белков-маркеров, характерных для нейроэндокринной дифференцировки, в отдельных клетках рака не дает оснований для выделения такого случая в группу нейроэндокринных опухолей. Для постановки диагноза необходимо доказать продукцию нейроэндокринных гранул у 50% и выше клеточной популяции рака.
Нейроэндокринные опухоли диагностируют у 2-5% пациенток с раком молочной железы (РМЖ). В клинике нейроэндокринного рака крайне редко отмечают проявление синдрома нейроэндокринной секреции, в то же время при лабораторных исследованиях определяют повышенный уровень в крови хромогранина А.
В зависимости от вида роста и степени анаплазии клеток выделяют солидный нейроэндокринный рак, мелко/овсяноклеточный рак, нейроэндокринный крупноклеточный рак.
Солидный нейроэндокринный рак характеризуется сплошным типом роста с гнездными или трабекулярными структурами, с тонкими фиброваскулярными перегородками. Редко можно отметить образование структур типа розеток или палисадов. В соседних участках можно видеть внутрипротоковый папиллярный или дольковый рак. Митотическая активность клеток возрастает в альвеолярных участках рака.
Мелко/овсяноклеточный РМЖ по морфологической характеристике и иммунофенотипу неотличим от мелко/овсяноклеточного рака легкого. Часто отмечают метастазирование по ходу лимфатических сосудов.
Нейроэндокринный крупноклеточный рак построен из крупного или среднего размера клеток, расположенных хаотично. В опухоли выражен полиморфизм клеток и высокий уровень митотической активности.
Окраска по Гримелиусу выявляет аргирофильные гранулы, однако при оценке этой реакции необходимо учитывать только клетки с темными гранулами. Доказательством нейроэндокринной дифференцировки является позитивная реакция с антителами, выявляющими хромогранин и синаптофизин.
Для недифференцированных форм рака характерен хромогранин А, для более зрелых опухолей — хромогранин Б. Только 16% случаев нейроэндокринного рака дают окраску на синаптофизин. Мелкоклеточные варианты в 100% случаев экспрессируют нейронспецифическуто энолазу, но только в 50% — хромогранин А и синаптофизин, в 20% — стиреоидтрансформирующий фактор-1 (TTF-1).
Иногда трудно бывает отличить первичную нейроэндокринную опухоль молочной железы от метастаза. Для первичного поражения молочной железы типичным является позитивная реакция опухолевых клеток к цитокератину 7 и негативная к цитокератину 20, также характерно наличие в близлежащих тканях внутрипротокового рака.
Важна также информация о наличии рецепторов эстрогена и прогестерона в ядрах клеток рака. При нейроэндокринных раках в 100% клеток сохраняется экспрессия Е-кадгерина, что позволяет дифференцировать его от долькового рака.
Прогноз зависит исключительно от степени атипии клеток, причем следует учитывать, что мелкоклеточные варианты всегда рассматривают как недифференцированные (фото 72).

Фото 72. Нейроэндокринный (овсяноклеточный) рак молочной железы из мелких клеток, недифференцированный тип. Гематоксилин-эозин, х 100
Специфических генных аномалий при нейроэндокринных раках не выявлено.
Инвазивный папиллярный рак
Это форма РМЖ с более благоприятным прогнозом. Составляет 1-2% в структуре рака молочной железы. Термин не следует использовать для определения инвазивного РМЖ, утратившего папиллярное строение в своем инвазивном компоненте, даже при условии сохранения его в небольших неинвазивных участках рака. Среди пациенток с этим раком преобладают женщины в постменопаузальный период.
Опухоль характеризуется прежде всего мягкой консистенцией, но не такой как консистенция медуллярного рака. Структура опухоли более рыхлая, напоминающая рак мочевого пузыря. В случае внутрикистозной локализации опухоли можно четко выявить папиллярный тип роста.
Характерным микроскопическим признаком данной опухоли является образование сосочковых структур. Это классические папиллярные структуры, более грубые или более нежные в зависимости от степени развития стромы. По периферии инвазивного папиллярного рака отмечают поля солидного роста.
У клеток опухоли апокриновый тип строения с более или менее выраженной цитоплазмой. В Уз случаев выявляют инвазию лимфатических сосудов. В 23% случаев отмечено вовлечение в опухолевый процесс кожи или соска, но без педжетоидной трансформации.
Результаты разных исследований отмечают разную выживаемость. Достоверно прогнозировать клиническое течение рака только на основании гистологического строения опухоли невозможно, и лишь наличие метастазов в аксиллярных лимфатических узлах позволяет создать предварительную картину выживаемости (фото 73-75).

Фото 73. Инвазивный папиллярный рак молочной железы. Гематоксилин-эозин, х 100

Фото 74. Инвазивный папиллярный рак молочной железы. Гематоксилин-эозин, х 100

Фото 75. Инвазивный папиллярный рак молочной железы. Гематоксилин-эозин, х 100
Инвазивный микропапиллярный рак
Характеризуется наличием мелких гнезд опухолевых клеток, лежащих в ячейках светлой стромы. Анализ показывает большую склонность к инвазии стенки сосудов.
Частота заболеваемости этим видом рака составляет менее 2%, хотя в 3-6% случаев инвазивного РМЖ также можно выявить участки микропапиллярного роста.
Типичным является расположение мелких желез как бы в пустоте, клеточный полиморфизм слабо выражен, нехарактерны некрозы и лимфоидная инфильтрация стромы (фото 76).

Фото 76. Инвазивный микропапиллярный рак молочной железы. Опухолевые клетки с признаками апокринизации. Гематоксилин-эозин, х 200
Довольно часто в инвазивном микропапиллярном раке выявляют инвазию стенки сосудов (60%). В 72-77% первично выявленного рака отмечают наличие метастазов в периферических лимфатических узлах (фото 76).
Л.М. Захарцева, М.В. Дятел, А.В. Григорук
Читайте также:

