Укол от рака за 125 тыс долларов
Как они побеждают онкологию и сколько стоят?
25.10.2018 в 13:19, просмотров: 11866
Каждый год почти 10 миллионов человек в мире получают онкодиагноз. В России рак обнаруживают ежегодно у 27 тысяч пациентов. Смертность от него находится на втором месте, уступая лишь сердечно-сосудистым заболеваниям. Победить болезнь сейчас пытаются ученые всего мира. И у них это постепенно получается. В октябре 2018 года Нобелевскую премию по медицине дали Джеймсу Эллисону из США и Тасуку Хондзё из Японии за новый метод лечения рака.

Заведующий научным отделом онкоиммунологии Национального медицинского исследовательского центра онкологии им. Н. Н. Петрова Ирина БАЛДУЕВА рассказала, как работает новое лечение и когда нам удастся вылечить рак.
В норме наша иммунная система постоянно отслеживает, вовремя отлавливает и уничтожает раковые клетки. Но бывает, что иммунитет перестает видеть, распознавать их и, соответственно, бороться с ними. В итоге развивается болезнь. Один из способов лечения — химиотерапия — может убить далеко не все опухолевые клетки. Некоторые выживают и дают рост новой опухоли. Иммуноонкологические препараты (за их изобретение в этом году и дали Нобелевскую премию. — Ред.) способны заставить иммунные клетки организма увидеть опухоль и убить ее. Эти препараты связываются со специальными белками (CTLA-4 и PD-1. — Ред.) на поверхности клеток иммунной системы (Т-лимфоцитов. — Ред.), на раковой клетке и растормаживают противоопухолевый иммунный ответ. Он запускается, лимфоциты замечают раковые клетки и разрушают их.
Это настоящий прорыв в онкологии и иммунологии, это будущее. Какие виды рака можно лечить с помощью новой терапии? Если в опухоли есть определенные маркеры, то эти препараты можно назначать вне зависимости от расположения рака. Но если этих маркеров нет, то иммунная терапия не поможет. Представьте, что рак — это кубик Рубика. Так вот, новые препараты умеют блокировать, предположим, только синие квадратики. Если они в кубике Рубика есть, то опухоль можно победить. Но сейчас разрабатываются препараты, которые направлены и на другие квадратики — красные, желтые, зеленые. Как только мы научимся блокировать все части нашего воображаемого кубика Рубика, то научимся лечить и все виды рака.
СЛУЧАЙНОЕ ОТКРЫТИЕ
Открытие было сделано больше 20 лет назад. В медицине, биологии не бывает такого: сегодня открыл, а завтра уже получил Нобелевскую премию. Все лауреаты работают много лет, это длинный путь.
Что касается данного открытия, то оно было сделано очень интересным образом. [Ученые] изучали препарат для лечения аутоиммунных заболеваний — то есть агрессии иммунитета на ткани и клетки собственного организма. Все новые лекарства в обязательном порядке тестируют на аутогенность; должно быть доказано, что они не вызывают опухолевый рост. Так вот, препарат, о котором я вам рассказываю, подвергли такому же испытанию. Его давали лабораторным животным с различными видами опухоли. И оказалось, что лекарство разрушало их! Это был невероятный удивительный побочный эффект! Как получилось, что препарат, направленный на то, чтобы затормозить аутоиммунные реакции, убил опухоль? Ученые стали выяснять это и в процессе сделали открытие белков CTLA-4 и PD-1. На основании этого появились и иммуноонкологические препараты.

ЧУДО-ТАБЛЕТКИ НЕТ
Сейчас врачи-онкологи получили целый арсенал лекарственных средств. Они позволяют контролировать опухолевый рост и излечивать пациентов, которые до недавнего времени считались безнадежными. При этом надо понимать, что одной чудо-таблетки, которая раз и навсегда победит любой рак, нет. Ведь опухоль очень многолика, ее клетки находятся в разных фазах цикла: одни отдыхают, другие делятся, в-третьих происходят какие-то мутации.
Поэтому необходимо выстраивать индивидуальный подход к каждому пациенту. Если опухоль быстро растет, нужны химиопрепараты, которые будут ее разрушать. Таргетная терапия направлена на определенные белки, влияющие на рост и распространение опухоли.
Контроль за раковыми клетками, которые остались после применения химиопрепаратов — это, конечно, иммунная терапия.
Сейчас идут исследования в области генной терапии. Ее суть заключается в том, что у пациента забирают его собственные Т-клетки (они составляют часть иммунной системы. — Ред.), помещают в них гены, которые способны распознать злокачественные клетки и разрушить их, и вводят их обратно пациенту. Такое лечение может помочь больным лейкозом, которые нечувствительны к трансплантации костного мозга, к химиопрепратам и иммунной терапии. Такие лекарства уже есть за рубежом, они используются (предполагается, что в США курс генной терапии будет стоит около 300 тысяч долларов. Это примерно 19,7 миллионов рублей. — Ред.). Мы тоже разрабатываем похожий препарат. Одно его введение может излечить пациента! Я уверена, за это (исследования в области генной терапии при лечении рака. — Ред.) тоже непременно будет вручена Нобелевская премия.
ПОБОЧНЫЕ ЭФФЕКТЫ
У химиотерапии есть побочные эффекты. Например, тошнота, рвота, проблемы с пищеварением и так далее. Они могут длиться около 10 дней, а потом — пройти. К сожалению, побочные эффекты при применении иммуноонкологических препаратов более длительные. И мы их только учимся лечить. Иммунная система начинает возмущаться и атаковать собственные клетки. В результате возникают очень серьезные аутоиммунные болезни. Например, воспалительные заболевания кишечника, надпочечников, воспаление щитовидной железы. Не исключено, что в результате такого лечения рак не пройдет, но к нему добавится, например, язвенный колит или болезнь Крона. Вот такая непростая история. Иммунная терапия — это не волшебная таблетка, которую выпил и ты здоров. Но онкологи сейчас учатся обращаться с этими препаратами и справляться с побочными эффектами.
МИЛЛИОНЫ НА ЛЕЧЕНИЕ
Многие иммуноонкологические препараты уже зарегистрированы в России. Например, ипилимумаб, ниволумаб. Последний используется для профилактики прогрессирования рака. Например, пациента прооперировали, но есть высокий риск дальнейшего распространения заболевания.
К сожалению, все эти препараты пока очень дорогие. Например, некоторое время назад стоимость ипилимумаба — для лечения необходимо четыре введения этого препарата — достигала четырех миллионов рублей. Но сейчас ипилимумаб стоит значительно меньше. Здесь работает простое правило: чем больше препарат используется пациентами, тем он становится дешевле. Кроме того, Министерство здравоохранения Российской Федерации закупает некоторые препараты, и пациенты получают их.
На первой-второй стадии рака можно обойтись более дешевыми способами лечения, но, например, на третьей (стадия, при которой опухоль уже появилась в близлежащих тканях, но ее нет в других частях тела. — Ред.) или четвертой стадии (опухоль распространилась в отдаленные от места первичного поражения органы тела. — Ред.) — финансовые затраты уже очень серьезные, а лечение болезни требует очень больших усилий. Поэтому мы сейчас постепенно возвращается к тому, что надо проводить регулярные профосмотры и выявлять заболевание на ранних стадиях. К сожалению, рак сейчас очень помолодел, например, к нам приходят молодые 23-летние девушки с раком молочной железы. Но и лечение прогрессирует. Рак сейчас — это хроническое заболевание, которое требует постоянного контроля. Но не надо к нему относиться как к приговору. Я уверена, мы уже на пути к его излечению.
Новые прорывы обязательно будут, долго ждать не придется. Речь идет не о 20–30 годах, а о гораздо меньшем времени.
Антирак
Среди онкобольных существует поверье: раковая опухоль – это живой организм. И если его ранить, но не убить, он становится агрессивнее и быстрее пожирает человека. Увы, современные методы лечения рака, относительно доступные в России, как раз и нацелены на то, чтобы ранить, но не убить. В то же время в мире вовсю идут исследования инновационных способов лечения онкозаболеваний. Стоит ли ждать от медицины прорыва? Если не от нашей, то хотя бы от мировой?
Если и стоит, то только не тем, кто уже заболел. Им нужно лечиться проверенными средствами, которые хорошо себя показали уже сейчас, и не надеяться на чудо.
Каждый третий мужчина и каждая четвёртая женщина на Земле становятся жертвами рака, говорится в статье, опубликованной в журнале JAMA Oncology. По словам доктора Владимира Цимберга, в России ежедневно от рака умирают тысяча человек. Одна из причин – у нас заболевание диагностируют на более поздних стадиях, чем в Америке и Европе.
Потому лечение онкологии стало выгодным бизнесом, в который пришло огромное количество шарлатанов и мародёров.
Иммунитет как оружие
Иммунотерапия является новейшим и действенным методом, который применяется для лечения многих форм рака на любых, даже самых поздних стадиях. Сейчас этот метод широко изучается и применяется за границей, ему посвящается множество статей в медицинских журналах. Значимость иммунотерапии для медицины сравнивают с открытием антибиотиков и химиотерапии.
Особенно популярна иммунотерапия в Израиле, который считается Меккой медицинского туризма. Впрочем, из-за этого за пределами земли обетованной уже начала появляться масса клиник с так называемыми израильскими методиками, которые, по сути, занимаются чем угодно, но только не здоровьем пациента.
Суть иммунотерапии в том, что организм учится самостоятельно бороться с раковыми клетками. Сам собой напрашивается вывод о том, что иммунитет у пациента должен быть в хорошем состоянии, – впрочем, эта проблема может быть решена с помощью курса лекарств. Для успеха лечения нужно сделать так, чтобы организм активизировался. Большинство раковых клеток имеют на поверхности опухолевые антигены – белки или углеводы. Они могут быть обнаружены и уничтожены иммунной системой. Иммунотерапия активирует иммунитет, превращая его в оружие против многих видов рака.
Индивидуальное лекарство
В целом эта методика выглядит так: пациенту вводят биологические препараты, обладающие противоопухолевой активностью. В них содержится определённое количество следующих действующих веществ: цитокинов, моноклональных антител. Сами эти препараты не являются токсичными и вызывают минимум побочных эффектов, что выгодно отличает их от традиционных коктейлей, применяемых при химиотерапии. При попадании в организм они начинают уничтожать злокачественные клетки, а система питания опухоли оказывается перекрытой. Таким образом рост опухоли прекращается, злокачественный процесс блокируется, метастазы в этом случае не возникают.
Различают два вида иммунотерапии: ингибиторы контрольных точек иммунного ответа, которые снимают иммунитет с тормозов, позволяя ему увидеть и уничтожить рак, CAR Т-клеточная терапия, которая совершает более целенаправленную атаку на раковые клетки.
Ингибиторы контрольных точек иммунного ответа блокируют способность некоторых белков ослаблять ответную реакцию иммунной системы на опухолевые антигены.
В обычное время такие белки сдерживают иммунную систему, которая своим слишком агрессивным поведением может навредить организму. Но в случае с раком все средства хороши.

Планируется, что реализация новой программы в 2020 году не только позволит приобрести авто тем, кто в нём нуждается, но и поддержит российский автопром на фоне пандемии.
Для лечения злокачественных опухолей в США одобрено четыре препарата, активизирующих иммунную систему: ипилимумаб (Ipilimumab, MDX-010, MDX-101), пембролизумаб (Кейтруда), ниволумаб (Опдиво) и атезолизумаб (Тецентрик).
Все эти лекарства уже можно купить в России через Интернет. Насколько это безопасно – вопрос риторический. Зато Интернет даёт прекрасную возможность ознакомиться с ценами. 40 мг ниволумаба стоят 940 долларов, 100 мг – 2350 долларов. Сайт продавца настоятельно советует покупать лекарство в Израиле и получать в аэропорту обратно до 18% от его стоимости в виде НДС.
Вещество, полученное в итоге, обрабатывается специальным способом, подсвечивается, после чего вводится в организм пациента при помощи инъекции. Действовать вакцина начинает мгновенно. Сторонники этого метода утверждают, что через несколько месяцев опухоль разрушится полностью. Называют и статистику излечения: от 60 до 80%. Для онкологии это довольно высокий показатель. И тем не менее иммунотерапия пока недостаточно исследована. Можно было бы сказать, что это рискованное лечение, но в случае с раком этот термин звучит несколько неуместно.
В ход идёт ежовка
Коварство рака состоит в том, что существует множество типов болезни, которые постоянно видоизменяются и приспосабливаются к лечению. Поэтому огромная удача для пациента – найти своего онколога, который правильно определит тип рака и назначит лечение, подходящее именно конкретному пациенту. Впрочем, методы могут оказаться самые неожиданные.
Сейчас учёные возлагают большие надежды на таргетную терапию опухолей. Этот метод лечения онкозаболеваний применяется в основном в комплексе с химиотерапией, лучевой терапией, иммунотерапией и т.д. Особенностью таргетной терапии является высокая специфичность и избирательность действия. Это позволяет при максимальном лечебном эффекте минимизировать вредное воздействие на организм пациента. Но именно поэтому перед назначением таргетной терапии приходится проводить сложные и долгие исследования. В любом случае это направление является пока экспериментальным.
Потому наиболее эффективными пока остаются традиционные средства. Они известны. Прежде всего оперативное вмешательство. Кроме того, это химиотерапия, которая считается достаточно эффективным способом лечения, но тяжело переносится пациентами. Также это гормональные лекарственные препараты. Считается, что они наиболее эффективны при лечении гормонозависимых опухолей – рака молочной железы, матки, простаты, а также при опухолях поджелудочной железы, почек, при меланомах. Не стоит забывать и про противовирусные средства, ведь некоторые виды рака развиваются вследствие деятельности вирусов.
Разработка передовых лекарств — долгий и ресурсозатратный процесс. Он растягивается на десятилетия и требует миллиардов долларов на НИОКР. На выходе же может получиться препарат, который будет стоить больше $2 млн. Сумма, неподъемная для большинства населения планеты. Сегодня мы расскажем о препаратах генной терапии, которые выходят на рынок развитых стран и являются самыми дорогими лекарствами современности.
Что чувствовали родители Донована, когда их новорожденному ребенку поставили столь страшный диагноз? Они были просто опустошены и подавлены. Однако доктор предложил им поучаствовать в экспериментальной программе по тестированию лекарства от СМА с генетически модифицированным вирусом. Последний нес здоровые копии гена, в котором нуждался малыш.
После начала экспериментального лечения состояние мальчика стало медленно улучшаться. Тем не менее ему по-прежнему нужны инвалидная коляска для перемещения и питательная трубка для еды. Сейчас он ходит в детский сад и делает те же вещи, что и обычные люди. Такую же положительную динамику продемонстрировали и другие дети, участвовавшие в экспериментальном лечении. Беда только, что за пределами исследовательской клиники применяемое лекарство стоит бешеных денег.
My sweet nephew wants to tweet! "@Indians I might be small & fighting SMA1, but I am definitely your BIGGEST fan!! ❤️- Donovan" #WWWindians pic.twitter.com/wDUfwbwrTf
В мае этого года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило выход на рынок препарата от СМА — самого дорогого лекарства в истории. Оно оценивается в $2,125 млн. Приобрести его можно в рассрочку на пять лет, выплачивая по $425 тыс. в год. Лекарство от редкого генетического заболевания разработала фирма AveXis, которая принадлежит фармацевтической компании Novartis. Препарат предназначен для детей в возрасте до 24 месяцев. Его вводят внутривенно или в спинномозговой канал.
Работает лекарство по принципу большинства препаратов генной терапии, число которых за последние два года увеличилось с нуля до считанных единиц. Появляющаяся же в СМИ цена этих лекарств всякий раз поражает умы потребителей.
На пороге эры препаратов генной терапии
Доставлять нуклеиновую кислоту (ДНК) в клетку пациента в качестве лекарственного метода придумали уже давно. Первые попытки модифицировать ДНК были предприняты еще в начале 80-х годов. А первый успешный перенос генов был осуществлен в мае 1989 года. С тех пор было проведено более 2 тыс. клинических испытаний, однако первые одобренные лекарства в массовом порядке начали поступать на рынок западного мира только в последние два года.
Генная терапия до сих пор с выходом первых препаратов считается экспериментальной техникой, которая в отдельных случаях позволит избежать длительного приема таблеток или хирургического вмешательства. Генная терапия может быть перспективным лекарством для борьбы с наследственными болезнями, некоторыми типами рака и вирусными инфекциями. Сейчас ведутся разработки в нескольких направлениях: замена мутировавшего гена, который вызывает болезнь, его здоровой копией; инактивация мутантного гена; ввод в организм нового гена, который позволит бороться с болезнью.
Мутировавшие гены приводят к отсутствию или недостатку определенного белка в организме. Для доставки генов в клетки используют генетически сконструированный носитель. Часто в качестве таких переносчиков выступают вирусы, которые эффективно заражают клетки. Но их модифицируют таким образом, чтобы они не могли вызвать заболевания. Эти вирусы интегрируют свой генетический материал, в котором находится и здоровая копия нужного человеку гена, в хромосому клетки человека или или в ядро клетки.
Вирус вводят как прямо в ткани организма, так и в лабораторных условиях в образец клеток пациента. Потом эти клетки возвращаются в организм человека.
Так как эта техника относительно молода, существуют риски для здоровья. Вплоть до развития рака. А потому заявки на потенциально небезопасные клинические испытания могут быть отклонены регуляторами. За каждым протоколом исследований следят, обсуждают вопросы этичности и безопасности исследований.
Первое подобное лекарство было одобрено в Европе семь лет назад и для своего времени стало самым дорогим в истории. Пример препарата, который был создан для лечения дефицита липопротеиновой липазы, очень показателен. Из-за этого наследственного заболевания кровеносные сосуды закупориваются жиром, что приводит к летальному исходу.
Лекарство было одобрено еще в 2012 году и предполагало, что полный курс лечения включает в себя 60 инъекций в мышцы ног за одну сессию. Разработчики препарата потратили сотни миллионов евро на генетические исследования, проведение клинических испытаний и одобрение со стороны регуляторов. Все это в итоге привело к банкротству компании. Ее активы были выкуплены другим предприятием, которое в 2012 году установило ценник на препарат в размере $1,6 млн. Спустя три года цену пересмотрели, снизив до $1 млн.

В то время это было самое дорогое лекарство из доступных на рынке. Вот только спроса на него не было. У тех немногочисленных пациентов, которые столкнулись с этим заболеванием, не было достаточной суммы, чтобы позволить себе препарат. К 2016 году только один человек получил его на коммерческой основе. А в 2017-м владелец прав на лекарство заявил, что не будет продлевать лицензию на его продажу. Три дозы, которые хранились на складах компании, были переданы трем пациентам за символическую сумму в 1 евро.
Почему так дорого?
Парад препаратов генной терапии в США начался с 2017 года. Но они определенно не смогут побить по продажам жаропонижающие.
Два года назад было одобрено лекарство, которое заметно дешевле описанных выше, — стоит всего-то $475 тыс. Оно предназначено для лечения редкого заболевания глаз — амавроза Лебера (ретинальной дистрофии). Суть болезни в том, что из-за дефектного гена в сетчатке умирают светочувствительные клетки, а их восстановления не происходит.
С помощью этого препарата зрение пациентов улучшается. Они могут видеть вещи, которые раньше были недоступны их зрению (звезды, Луну), а также делать знакомые нам вещи: читать, ездить на велосипеде, гулять в сумерках и по ночам самостоятельно.

Но цена этого лекарства является главным препятствием на пути его широкого внедрения. Хочешь больше? Плати.
Предшественник препарата от СМА, с описания которого мы начали эту статью, стоит $750 тыс. за первый год лечения и дополнительно $375 тыс. за каждый последующий. Другие одобренные FDA лекарства для генной терапии стоят $375—875 тыс.
Почему эти препараты стоят таких бешеных денег? В качестве одной из причин называют чрезмерный надзор регулятора, который удлиняет и удорожает путь к одобрению и выводу лекарства на рынок. По некоторым оценкам разработка и клинические испытания одного одобренного лекарства для генной терапии стоят несколько миллиардов долларов. Покрыть же эти расходы практически невозможно, так как многие генетические заболевания чрезвычайно редки: например, СМА по статистике возникает у одного из 10 тыс. новорожденных.
Специфика препаратов генной терапии предполагает, что они чаще создаются для конкретных людей. Из-за этого клиническое испытание на одном участнике стоит около $1 млн. Для первой фазы процедуры одобрения лекарства необходимо от 20 до 80 испытуемых. На третьей фазе их число должно вырастать до сотен и тысяч. Конечно, для препаратов генной терапии такого числа испытуемых сложно добиться, но затраты все равно высоки.
К тому же у разработчиков лекарств на руках могут десятилетиями находиться патенты на изобретения, что по сути делает этих людей монополистами. В результате они могут устанавливать цены на таком уровне, который позволит максимизировать доходы в короткий срок и не бояться конкуренции.
А что говорят фармкомпании? Руководители Novartis защищают многомиллионную цену на свое лекарство доводами о том, что единоразовое лечение более ценно, чем дорогие и длительные процедуры, которые обходятся в сотни тысяч долларов каждый год.

Независимые эксперты из Института клинических и экономических исследований подмечают, что препарат этой фармкомпании попал в верхнюю границу диапазона рентабельности. По их расчетам ценностно-ориентированная цена на лекарство должна была варьироваться в диапазоне от $1,1 млн до $1,9 млн.
Аналитики с Wall Street в свою очередь прогнозируют, что к 2022 году создатели препарата смогут заработать около $2 млрд. За счет простых граждан? Не только. Государственные программы закупки лекарств в США и страховые возьмут на себя большую часть расходов. Примеры тому уже есть. Аналог этого препарата от СМА, требующий ежегодных процедур, в прошлом году принес своим производителям $1,7 млрд.
Может ли быть достаточным оправданием для фармкомпаний возмещение затрат на научно-исследовательскую работу таким поразительным образом? Современные корпорации ориентированы на демонстрацию роста прибыли каждый квартал, и разочаровать инвесторов не хочет никто.
Ковидный госпиталь на базе Медицинского научно-образовательного центра (МНОЦ) МГУ имени М.В. Ломоносова принял первых больных 21 апреля и завершил свою работу 13 июня. Оказалось, что здесь удалось добиться лучших результатов лечения COVID-19 в Москве . За весь период умерло 4 пациента, а среди тяжелых больных, попавших на ИВЛ, летальность составила менее 14% (для сравнения — в среднем по городу и по миру — до 70 — 80%). Заразилось коронавирусом 18 медиков из 220 сотрудников госпиталя, смертельных случаев среди медперсонала не было.
Какие подходы применяли в Университетской клинике МГУ, чтобы добиться таких результатов? Продолжаем разговор с зав. кафедрой терапии факультета фундаментальной медицины МГУ, заведующим отделом возраст-ассоциированных заболеваний Медицинского научно-образовательного центра, доктором медицинских наук, врачом-кардиологом Яной Орловой.
ЛЕКАРСТВО ОТ КАШЛЯ ЗА 80 РУБЛЕЙ
- Большинство тех, кто заболел или боится заболеть, переживают из-за фиброзных изменений в легких. Говорят, у вас была разработана специальная терапия, которая может снизить угрозу развития фиброза. Такое возможно?!
- Да, мы запустили соответствующее клиническое исследование. Пока нет его окончательных результатов, но отработанная клиническая практика у нас есть.
- Что же вы делали для спасения легких?
- Мы применяли комбинацию бромгексина и спиронолактона (оба — давно известные очень дешевые лекарства. - Ред.). Бромгексин это отхаркивающее средство, которое многие годы назначается пациентам с пневмониями и с кашлем. В то же время экспериментальные данные показали, что этот препарат может блокировать определенный фермент и затруднять проникновение коронавируса в клетки. Правда, именно на этот эффект мы в меньшей степени рассчитывали у стационарных больных, поскольку такое действие актуально главным образом на раннем этапе болезни. А вот отхаркивающий эффект бромгексина действительно помогает пациентам с COVID. Я слышала, что наши коллеги в Питере запустили исследование бромгексина с профилактической целью. Будем ждать результатов.

Заразилось коронавирусом 18 медиков из 220 сотрудников госпиталя, смертельных случаев среди медперсонала не было Фото: Иван МАКЕЕВ
ПРЕГРАДА ДЛЯ ФИБРОЗА
- Второй препарат — спиронолактон — традиционно широко используется в кардиологии для лечения сердечной недостаточности, тяжелой гипертонии. Обладает небольшим мочегонным, магний- и калийсохраняющим действием, - продолжает Яна Орлова . - У него есть несколько механизмов, благодаря которым он может быть полезен при коронавирусной инфекции.
И, может быть, самый важный момент. Почти у всех наших пациентов мы наблюдали гипокалиемию (снижения уровня калия. - Ред.). При коронавирусной инфекции калий усиленно выводится из организма, и в научных статьях даже есть предположения, что гипокалиемия служит пусковым механизмом цитокинового шторма. Так что спиронолактон имеет реальный шанс снизить риск этого опасного осложнения. Но основное, на мой взгляд, это то, что снижение уровня калия в организме крайне вредно для сердца и запускает жизненно опасные нарушения ритма, увеличивая риск внезапной смерти. Мы, как и все другие, восполняли калий капельницами, но задерживать его в организме с помощью спиронолактона оказалось эффективнее.

Мужчины точно болеют тяжелее, чем женщины; пожилые — тяжелее, чем молодые; полные люди тяжелее, чем пациенты без лишнего веса Фото: Иван МАКЕЕВ
КОГДА ВЫПИСЫВАЛИ ПАЦИЕНТОВ
- Яна Артуровна, сколько в среднем по времени у вас находились пациенты?
- Около 10 — 14 дней. Но кто-то и 50 дней.
- Вы заметили признаки, по которым можно предположить, что болезнь у привезенного человека, скорее всего, пойдет по тяжелому пути?
- В мире проводились такие исследования, наша клиническая практика их подтвердила. Мужчины точно болеют тяжелее, чем женщины; пожилые — тяжелее, чем молодые; полные люди тяжелее, чем пациенты без лишнего веса. Мужчины с классическим мужским типом облысения, большим количеством растительности на лице, можно сказать, брутальные мужчины, болеют тяжелее.
- При каких условиях вы выписывали пациентов?
- Мы действовали максимально приближенно к рекомендациями Минздрава : чтобы температура в течение трех дней была не выше 37,5 градусов; чтобы С-реактивный белок (показатель воспаления) был ниже 10 мг/л, и сатурация, то есть уровень кислорода в крови, выше 96%.
- Как часто у вас заболевали врачи и медсестры?
Потом накопилась и усталость людей, и вирусная нагрузка. К середине второго месяца у нас стали появляться заболевшие. Тяжело больных не было. Часть сотрудников мы лечили у себя в обсервации, часть лечилась дома. Всего из медперсонала заразилось 18 человек (меньше 10%).
- Врачи что-то принимали для профилактики? Витамины С, D, цинк?
- Я видела рекомендации американских нутрициологов, они позитивно высказываются насчет приема цинка, мелатонина и витамина С. По витамину D были несколько противоречивые данные. Но мы своим сотрудникам никаких подобных рекомендаций не давали. У нас вся профилактика была связана с минимизацией контактов и другими мерами эпидбезопасности.
ЧИТАЙТЕ ТАКЖЕ
Вирусолог рассказал, можно ли продезинфицировать маски от коронавируса солнечным светом
А также почему эпидемия набирает силу в южных странах и влияет ли солнце на заболеваемость - все это в интервью Георгия Викулова (подробности)
СЛУШАЙТЕ ТАКЖЕ
Юрий Стоянов: Подвиг медиков по борьбе с коронавирусом нужно узаконить. Они должны получать пожизненные льготы

Причиной смерти пациента-испытателя назвали неожиданную реакцию организма на экспериментальный препарат производства "Биокад". Ранее фармзавод удостоился похвалы Минздрава за "фантастические результаты" в лечении опухолей. Лекарство должно было появиться на рынке ещё год назад. Не остановит ли смерть добровольца исследования и когда ждать отечественное лекарство от рака — в расследовании Лайфа.
Одна из самых секретных разработок российской медицины попала в неприятную историю, которая могла бы так и остаться в стенах петербургской лаборатории. Рассказываем, как российские учёные изобретали молекулу для лечения меланомы и рака лёгких и с какими трудностями столкнулись.
1. Экспериментальный препарат стал главной темой онкологического конгресса
В ноябре 2018 года состоялся XXII Российский онкологический конгресс. Представители фармзавода "Биокад" и врачи рассказали об успешных испытаниях на людях новейшего отечественного лекарства от рака. Он заставляет иммунные клетки атаковать опухоль.
Речь о препарате под кодовым названием BCD-100. Это одна из самых засекреченных разработок отечественной фармацевтики — не разглашают даже имена учёных, разработавших молекулу (основное действующее вещество).
Препарат показал ошеломляющие результаты в лечении неоперабельной меланомы. Когда опухоль даёт метастазы, зловредные клетки проникают в окружающие органы и там формируют вторичные очаги болезни. Справиться с метастазирующей меланомой гораздо труднее. Однако BCD-100 сумел полностью убрать подобные опухоли у 7% пациентов. Ещё у 29% пациентов размер опухоли уменьшился не меньше чем на треть. В исследовании участвовало 126 онкобольных с неоперабельной меланомой. Испытания финансировал сам "Биокад".
Меланома (рак кожи)
Не самый частый, но один из самых агрессивных видов рака (≈74 тысяч больных в РФ). С 1950-х мировая заболеваемость выросла на 600%
Однако пациентов ждут серьёзные побочные эффекты, которые стали сюрпризом и для врачей — препарат-то новый.
"Внедрение [иммунотерапии], по-русски сказать, взорвало химиотерапевтам мозг. Мы столкнулись со спектром сложных и не понятных для нас [побочных] реакций. Может поражаться любой орган: начиная от щитовидной железы и заканчивая воспалением сосудов".
онколог центра им. Блохина Михаил Федянин
Но в декабре 2018 года НИИ онкологии им. Н.Н.Петрова (Санкт-Петербург) презентовал новые данные о результатах того же исследования.
У пациентов, принимавших BCD-100, чаще воспалялась щитовидная железа, чем у пациентов, принимающих аналогичные зарубежные препараты. Об этом заявил на конференции Федянин, то же впоследствии подтвердил и химиотерапевт из НИИ онкологии им. Н.Н. Петрова Алексей Новик. Его выступление находится в открытом доступе. Однако другие показатели побочных явлений не сильно отличались от уже выпущенных на рынок аналогов, так что Новик осторожно назвал BCD-100 "не менее безопасным", чем ему подобные.
2. Летальный исход, о котором умолчали
В ноябрьском выступлении доктор Федянин коротко обмолвился: были описаны смертельные случаи после приёма подобных препаратов. Одна из причин летальности — воспаление сердечной мышцы (миокардит).
Ни Федянин, ни Новик подолгу не останавливались на опасностях подобного рода препаратов. Врачи не упомянули и о смертельном случае с одним из пациентов-добровольцев. А самое главное, этого не сделала медицинский директор фармзавода "Биокад" Юлия Линькова.
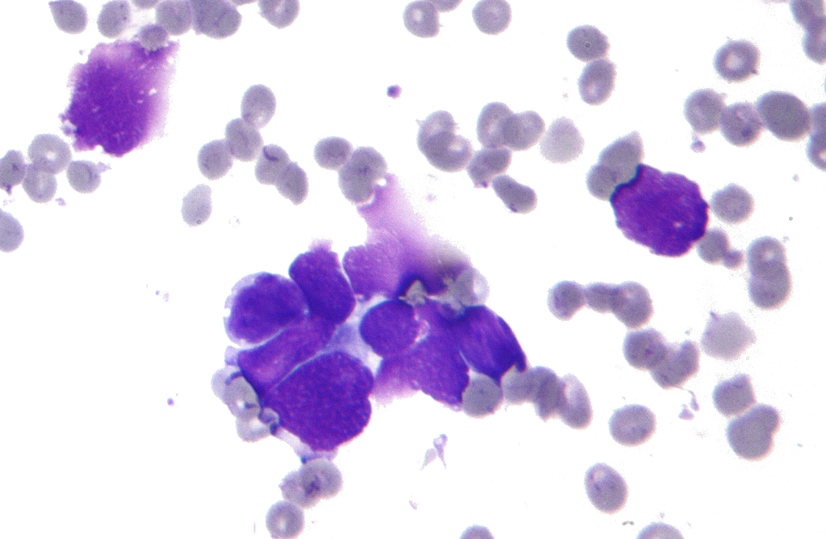
Представители завода "Биокад" вовремя не проинформировали государственные службы о смерти пациента из-за приёма BCD-100. Об этом говорится в материалах проверки Росздравнадзора, которые попали в Лайф из прокуратуры.
"В ходе клинического исследования препарата BCD-100 по протоколу Miraculum уполномоченное лицо ЗАО "Биокад" Юлия Линькова [не сообщила] в Росздравнадзор о летальной непредвиденной нежелательной реакции на данный препарат".
Материалы проверки Росздравнадзора от 26.11.18
Линькова обязана была уведомить о произошедшем либо через защищённую информационную систему Росздравнадзора, либо просто по электронной почте.
В том же предписании Росздравнадзор отмечает, что ни в 2017-м, ни в 2018-м в адрес ведомства вообще не поступало данных о безопасности трёх других препаратов, которые разрабатывает "Биокад".
Недавние исследования показали — больше половины российских медиков не сообщают в Росздравнадзор о побочных эффектах на препараты, с которыми столкнулись их пациенты. Ещё 8% вообще считают, что рассказывать о нежелательных реакциях нецелесообразно.
3. В надежде на "чудо"
Ещё в 2016 году министр здравоохранения Вероника Скворцова назвала результаты использования BCD-100 фантастическими. Протоколу, по которому исследовали лекарство, даже придумали соответствующее метафорическое название. С латыни "miraculum" переводится как " чудо". И действительно, с некоторыми пациентами BCD-100 сотворил чудо.
У 64-летней пациентки из Питера был опухолевый очаг в лёгком
Через несколько месяцев после приёма BCD-100 опухоль заметно уменьшилась в объемах. Это видно на снимках НМИЦ им. Н.Н.Петрова.
Но для других пациентов чудо обернулось проблемами или трагедией. Побочные эффекты от BCD-100 испытывали 80% пациентов, заявил на ноябрьской конференции доктор Федянин.
Чтобы разобраться, как работает BCD-100, важно понимать принцип работы иммунной системы человека.
Очень упрощённо иммунитет можно описать как систему "свой-чужой". Некоторые клетки крови умеют распознавать чужеродные бактерии и опасные тела и уничтожать их. Такой тип иммунных клеток называют Т-лимфоцитами. Получается эдакий "иммунный спецназ", который способен проникать через стенки сосудов в окружающие ткани и проводить там боевые действия против чужаков.
На поверхности Т-лимфоцита живёт белок PD-1, который отвечает за восприятие чужеродных клеток. Раковые же клетки "прячутся" от лимфоцитов, обманывая белок PD-1. Лимфоциты начинают думать, что раковая клетка — "своя", и не трогают смертельную опухоль.
Учёные по всему миру ломают головы над тем, как взломать маскировку и обучить лимфоциты распознавать в раковой клетке врага. Как уверяют создатели Miraculum, именно это им и удалось.

Создатели препарата рассчитывают, что его можно будет использовать не только для лечения меланомы и рака лёгких, но и других видов онкологии.
Поначалу на заводе "Биокад" рассчитывали выпустить лекарство на рынок в 2018 году. Сейчас сроки отодвинулись до 2022 года. Причин может быть множество: от недостаточного финансирования до неожиданно вскрывшихся проблем при использовании препарата.
В одном из интервью представители завода сравнивали цены на зарубежные аналогичные препараты. Выходило, что лечиться израильскими либо японскими средствами стоит примерно 9 миллионов рублей за курс. Отечественные разработчики обещали существенно меньшую цену за курс BCD-100. Возможно, в разы.
Хронология разработки препарата
4. Человечество писало кровью правила исследований препаратов
Лайф попросил эксперта, который много лет занимается клиническими исследованиями, рассказать о морально-этической стороне испытаний препаратов на людях. Вот что рассказала исполнительный директор Ассоциации организаций по клиническим исследованиям Светлана Завидова.
"Человечество двигалось к системе регулирования через лекарственные трагедии. Где-то, конечно, своим умом доходили, но в основном двигателем послужил негативный опыт, который и приводил к разработке тех или иных правил. Правила писали "на крови".
Светлана Завидова, Ассоциация по клиническим исследованиям
Один из первых мировых законодательных актов на тему регулирования исследований препаратов появился в США в 1938 году. Взяться за его разработку пришлось после того, как из-за неподтверждённого по критериям безопасности препарата сульфаниламида погибло 107 человек, большинство из которых — дети. Именно после этой трагедии фармпроизводителей обязали подтверждать безопасность лекарств. В том числе и на пациентах.
Исследования на людях идут в три фазы и длятся годами. В первую, как правило, включают только здоровых добровольцев. Вторая фаза — это испытания на пациентах, страдающих от конкретного заболевания. Обычно в них участвует несколько сотен человек. Третья фаза — самая масштабная: здесь в выборку могут включить несколько тысяч больных. Именно на третьей фазе появляется большинство данных о побочных реакциях и их частоте. Все добровольцы подписывают информированное согласие, соглашаясь на все риски (вплоть до летального исхода). Для многих пациентов участие в испытаниях — последний шанс.
Только при успешном завершении третьей стадии препарат регистрируют в госорганах и завозят в аптеки.
Второй случай изучают в медвузах как пример халатного отношения к безопасности препарата в угоду его продаваемости. Препарат талидомид в середине ХХ века был одним из самых продаваемых успокоительных и снотворных. Особенно его рекомендовали беременным и кормящим матерям, чтобы справляться с ночной бессонницей, утренней тошнотой и беспокойством. При этом никакие тесты влияния таблеток на плод не проводились. Препарат активно продавался в Европе. Через несколько лет стали чаще рождаться дети с патологиями: у новорожденных не было рук, ног либо ушей.
Ещё год потребовался властям нескольких стран, чтобы увязать страшную статистику с популярностью талидомида. Всё это время компания-производитель не признавала связи между этими событиями и продолжала рекламировать лекарство как безопасное.
5. Биокад: мы ничего не пытались скрыть!
Действия петербургской фармацевтической компании, которая не сообщила в Росздравнадзор о смерти пациента, на первый взгляд выглядят попыткой скрыть негатив во избежание репутационных и иных потерь. Однако в "Биокаде" заявляют, что специально ничего не утаивали.
"Первично полученные данные не соответствовали определению "Серьёзная непредвиденная нежелательная реакция". После получения дополнительных сведений информация была передана в Росздравнадзор".
Юридический департамент ЗАО "Биокад"
— Предположение о том, что ЗАО "Биокад" пыталось скрыть летальный случай, не соответствует действительности, поскольку данная информация сообщалась в ряд компетентных органов и учреждений, — добавили представители фармзавода. — Компания провела внутреннюю проверку, по результатам которой были детализированы внутренние процедуры.
Один из корпусов завода "Биокад" в Петербурге.
Компания "Биокад" создана в 2001 году. Это одна из крупнейших биотехнологических компаний России, где разрабатывают, изучают и производят новые типы лекарств. В штате трудятся более 1800 человек. Компания фокусируется на препаратах для терапии онкологических и аутоиммунных заболеваний, также ведёт разработки в области терапии других социально значимых заболеваний.
19 апреля 2019 года Национальный медицинский исследовательский центр радиологии Минздрава сообщил об увеличении числа онкобольных в стране. На первом месте в России рак лёгких. Каждый год онкологией заболевают около 600 тысяч человек. Всего в России на онкологическом учёте стоят 3,6 миллиона человек.
Читайте также:

