Укажите последовательность стадий морфогенеза опухоли
Морфогенез опухолей
1) возникает ли опухоль без каких-либо предшествующих изменений сразу, "с места в карьер" — de novo — или же стадийно?
2) в случае стадийного развития опухоли, какова сущность этих стадий, в том числе и процесса метастазирования?
3) развивается ли неоплазма из одной трансформированной клетки, и тогда все опухолевые клетки относятся к одному клону, или же опухолевому росту предшествует трансформация многих клеток?
4) каково взаимодействие опухоли и организма-опухоленосителя?
Стадийность морфогенеза опухолей
На первые два вопроса о развитии опухолей de novo или стадийно отвечают две теории — скачкообразной и стадийной трансформации.
Теория скачкообразной трансформации. В соответствии с этой теорией H.Ribbert, M.Borst, B.Fischer (1914) опухоль может развиться без предшествующих изменений тканей, о чем свидетельствуют данные экспериментального вирусного канцерогенеза, а также разнообразные клинические наблюдения. Теоретически возможность скачкообразного развития опухоли подтверждается существованием одноступенчатой модели вирусного канцерогенеза. В подавляющем же большинстве экспериментальных моделей опухолей речь идет о многоступенчатом развитии опухолей.
1) очаговая гиперплазия;
2) диффузная гиперплазия;
3) доброкачественная опухоль;
4) злокачественная опухоль.
В настоящее время расшифрованы и уточнены следующие стадии морфогенеза злокачественных опухолей:
- стадия предопухоли — гиперплазии и предопухолевой дисплазии;
- стадия неинвазивной опухоли (рак на месте);
- стадия инвазивного роста опухоли;
Вопрос о взаимоотношении доброкачественных и злокачественных опухолей решается неоднозначно. Бесспорно, существуют доброкачественные опухоли, которые могут трансформироваться в злокачественные. Примером могут служить аденоматозные полипы, аденомы и папилломы, в которых развиваются фокусы малигнизации и рак. Но есть также доброкачественные опухоли, практически никогда не трансформирующиеся в злокачественные аналоги.
Предопухолевая дисплазия. Развитию большинства злокачественных опухолей предшествуют предопухолевые процессы, что наиболее детально изучено в группе эпителиальных опухолей и опухолей системы крови и лимфоидной ткани. В первом случае речь идет о предраке, во втором — о предлейкозе и предлимфоме. К предопухолевым процессам в настоящее время относят диспластические процессы, которые характеризуются развитием изменений как в паренхиматозных, так и стромальных элементах. Основными морфологическими критериями диспластических процессов считают появление признаков клеточного атипизма в паренхиме органа при сохранной структуре ткани. В строме очагов дисплазии регистрируются изменения состава экстрацеллюлярного матрикса, появление клеточного инфильтрата, фибробластическая реакция и др. При дисплазии эпителия обнаруживаются полиморфные эпителиальные клетки с гиперхромными ядрами и фигурами митозов не только в базальных отделах, утолщается базальная мембрана, накапливаются коллагены определенных типов и появляются лимфоидные инфильтраты. В случае предлейкоза увеличивается процент бластных клеток до 9. Помимо стереотипных проявлений дисплазии как предопухолевого процесса, в разных органах и тканях имеются и свои специфические черты.
В большинстве органов диспластический процесс развивается при наличии пролиферации клеточных элементов на фоне предшествующей гиперплазии в связи с хроническим воспалением и дисрегенерацией. Однако в ряде случаев дисплазия сочетается с атрофией ткани, как это бывает при атрофическом гастрите с перестройкой эпителия, а также при циррозе печени. Сочетание дисплазии и атрофии не случайно, так как и тот, и другой процессы имеют общие генетические механизмы, в которых участвует ряд клеточных онкогенов, генсупрессор р53 и др. В одних ситуациях активация данных генов приводит к апоптозу и атрофии без или в сочетании с дисплазией, в других — к пролиферации также без или в сочетании с дисплазией.
На стадии дисплазии методами иммуногистохимии и молекулярной биологии регистрируются перестройки в работе онкопротеинов, факторов роста, интегриновых рецепторов и адгезивных молекул. Причем генетические перестройки могут значительно опережать морфологические изменения и служить ранними признаками предопухолевых изменений.
Стадия неинвазивной опухоли. Прогрессировавие дисплазии связывают с дополнительными воздействиями, ведущими к последующим генетическим перестройкам и злокачественной трансформации. В результате возникает малигнизированная клетка, которая некоторое время делится, формируя узел (клон) из себе подобных клеток, питаясь за счет диффузии питательных веществ из тканевой жидкости прилежащих нормальных тканей и не прорастая в них. На данной стадии опухолевый узел не имеет еще своих сосудов. Причина этого неизвестна. Вероятно, малая масса опухоли обусловливает недостаточную продукцию факторов, стимулирующих ангиогенез и стромообразо-вание в опухоли. Однако, по нашему мнению, представляется более верной точка зрения об отсутствии в неинвазивной опухоли определенных генных перестроек, которые необходимы для осуществления инвазивного роста.
В случае рака стадия роста опухоли "самой в себе" без разрушения базальной мембраны и без образования стромы и сосудов называется стадией рака на месте — cancer in situ, и выделяется в самостоятельную морфогенетическую стадию. Длительность течения данной стадии может достигать 10 лет и более. Стадия инвазивной опухоли. Она характеризуется появлением инфильтрирующего роста. В опухоли появляются развитая сосудистая сеть, строма, выраженная в различной степени, границы с прилежащей неопухолевой тканью отсутствуют за счет прорастания в нее опухолевых клеток.
Инвазия опухоли протекает в три фазы и обеспечивается определенными генетическими перестройками. Первая фаза инвазии опухоли характеризуется ослаблением контактов между клетками, о чем свидетельствуют уменьшение количества меж клеточных контактов, снижение концентрации некоторых адгезивных молекул из семейства CD44 и др. и, наоборот, усиления экспрессии других, обеспечивающих мобильность опухолевых клеток и их контакт с экстрацеллюлярным матриксом. На клеточной поверхности снижается концентрация ионов кальция, что приводит к повышению отрицательного заряда опухолевых клеток. Усиливается экспрессия интегриновых рецепторов, обеспечивающих прикрепление клетки к компонентам экстрацеллюлярного матрикса — ламинину, фибронектину, коллагенам. Во второй фазе опухолевая клетка секретирует протеолитические ферменты и их активаторы, которые обеспечивают деградацию экстрацеллюлярного матрикса, освобождая тем самым опухоли путь для инвазии. В то же время продукты деградации фибронектина и ламинина являются хемоаттрактантами для опухолевых клеток, которые мигрируют в зону деградации в третьей фазе инвазии, а затем процесс повторяется снова.
Стадия метастазирования. Это заключительная стадия морфогенеза опухоли, сопровождающаяся определенными гено- и фенотипическими перестройками опухоли. Процесс метастазирования связан с распространением опухолевых клеток из первичной опухоли в другие органы по лимфатическим, кровеносным сосудам, периневрально, имплантационно, что легло в основу выделения видов метастазирования.
Процесс метастазирования объясняется с помощью теории метастатического каскада, в соответствии с которой опухолевая клетка претерпевает цепь (каскад) перестроек, обеспечивающих распространение в отдаленные органы. В процессе метастазирования опухолевая клетка должна обладать определенными качествами, позволяющими ей проникать в прилежащие ткани и просветы сосудов (мелких вен и лимфатических сосудов); отделяться от опухолевого пласта в ток крови (лимфы) в виде отдельных клеток или небольших групп клеток; сохранять жизнеспособность после контакта в токе крови (лимфы) со специфическими и неспецифическими факторами иммунной защиты; мигрировать в венулы (лимфатические сосуды) и прекрепляться к их эндотелию в определенных органах; осуществлять инвазию микрососудов и расти на новом месте в новом окружении.
Метастатический каскад условно может быть разделен на четыре этапа:
- формирование метастатического опухолевого субклона;
- инвазия в просвет сосуда;
- циркуляция опухолевого эмбола в кровотоке (лимфотоке);
- оседание на новом месте с формированием вторичной опухоли.
Процесс метастазирования начинается с появления метастатического субклона опухолевых клеток с измененной плазмолеммой, в результате чего клетки теряют межклеточные контакты и приобретают способность к передвижению. Затем опухолевые клетки мигрируют через экстрацеллюлярный матрикс, прикрепляясь интегриновыми рецепторами к ламинину, фибронектину, коллагеновым молекулам базальной мембраны сосуда, осуществляют ее протеолиз за счет выделения коллагеназ, катепсина, эластазы, гликозаминогидролазы, плазмина и др. Это позволяет опухолевым клеткам инвазировать базальную мембрану сосуда, прикрепляться к его эндотелию, а затем, изменяя свои адгезивные свойства (супрессия адгезивных молекул семейства САМ), отделяться как от опухолевого пласта, так и от эндотелия сосуда. На следующем этапе формируются опухолевые эмболы, которые могут состоять только из опухолевых клеток или же из опухолевых клеток в сочетании с тромбоцитами и лимфоцитами. Фибриновое покрытие таких эмболов может защищать опухолевые клетки от элиминации клетками иммунной системы и действия неспецифических факторов защиты. На заключительном этапе опухолевые клетки взаимодействуют с эндотелием венул за счет "homing''-рецепторов и молекул семейства CD44, происходит прикрепление и протеолиз базальной мембраны, инвазия в периваскулярную ткань и рост вторичной опухоли.
Клональные теории происхождения и эволюции опухоли
Важнейшим в онкогенезе является вопрос о том, развивается ли злокачественная опухоль при малигнизации одной клетки или нескольких. Ответ на этот вопрос неоднозначен, так как, хотя большинство опухолей и имеет моноклоновое происхождение, существует небольшое число опухолей, формирующихся из нескольких клеток.
Теория моно к л оно в о г о происхождения опухолей. У большинства опухолей такое происхождение доказывается наблюдениями неоплазм у женщин, гетерозиготных по изоформе глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ). Известно, что ген Г-6-ФДГ локализуется в Х-хромосомах, одна из которых получена от матери, а другая от отца. Одна из двух Х-хромосом, содержащихся в каждой клетке, инактивируется на стадии бластоцисты, и в клетке остается единственная Х-хромосома, кодирующая ту или иную изоформу Г-6-ФДГ. Это приводит к тому, что все клетки женского организма подразделяются на две группы в зависимости от изоформы Г-6-ФДГ. Описанная гетерогенность по Г-6-ФДГ свойственна многим женщинам негритянского происхождения. При этом установлено, что развивающиеся у них опухоли состоят из клеток только одного вида по изоформе Г-6-ФДГ, т.е. имеют моноклоновое происхождение. Методом инактивации Х-хромосомы доказано моноклоновое происхождение аденом и карцином толстой кишки, аденом околощитовидной железы. При хроническом миелолейкозе имеется другой маркер моноклонового происхождения опухолевых клеток — филадельфийская хромосома, при Т- и В-клеточных лимфомах и лейкозах — специфические перестройки генов Т- и В-рецепторов, выявляемые с помощью блот-анализа ДНК. Моноклоновое происхождение сопровождается ростом опухоли на начальной стадии развития в виде одного узла — т.е. имеет место уницентрической характер роста.
Однако моноклоновость уже развившейся опухоли может быть результатом не моноклонового ее происхождения, а возникать в итоге селекции наиболее злокачественного клона опухолевых клеток и вытеснения им менее злокачественных клонов.
Теория поликлонового происхождения опухолей. Поликлоновое происхождение опухолей встречается значительно реже, чем моноклоновое, и характерно для опухолей с мультицентричным характером роста, таких как полипоз толстой кишки, мультицентрический рак молочной железы и печени и др.
Мультицентрический характер роста может обусловливать и формирование единого узла опухоли при близком расположении и слиянии нескольких очагов роста. Это положение впервые ооосновал Willis в своей теории опухолевого поля (1967). Согласно данной теории, возможно образование одновременно нескольких очагов пролиферации клеток с их последующей трансформацией. По мере роста опухолевые очаги сливаются. При этом опухолевые клетки принадлежат к разным клонам.
В ходе прогрессии опухоли может происходить ее клепальная эволюция, т.е. могут появляться новые клоны опухолевых клеток, возникающие в результате вторичных мутаций, что приводит к поликлоновости опухоли и доминированию наиболее агрессивных клонов как итог клональной селекции. Доброкачественные опухоли характеризуются доминированием опухолевых клеток одного клона на протяжении всего существования, в то время как в злокачественных опухолях постоянно прогрессирует поликлоновость, особенно при низкодифференцированных высокозлокачественных вариантах. Теория клональной эволюции может помочь в объяснении не только прогрессии злокачественной опухоли и метастазирования, но также дать ответы на следующие вопросы: почему в опухолях может возникать феномен "метаплазии" — изменения дифференцировки клеток на отдельных участках? Как может усиливаться злокачественность опухоли со временем или особенно после проведения противоопухолевой терапии? Почему возникают устойчивые к противоопухолевым воздействиям опухоли спонтанно и после терапевтических воздействий (феномен множественной лекарственной устойчивости опухоли).
Взаимодействие опухоли и организма-опухоленосителя
Взаимодействие опухоли и организма-опухоленосителя складывается из действия опухоли на организм и защиты организма-опухоленосителя от опухоли.
Действие опухоли на организм хозяина. Проявляется в локальном и общем воздействии.
Локальное воздействие включает в себя нарушения метаболизма, сдавление прилежащих и разрушение растущей опухолью сохранных тканей, прорастание стенок сосудов, что может приводить к местному венозному застою. Некроз и изъязвление опухоли могут сопровождаться кровотечением, присоединением вторичных инфекций.
Общее воздействие опухоли на организм хозяина может приводить к развитию различных анемий, раковой интоксикации, раковой кахексии и паранеопластических синдромов. Остановимся на двух последних проявлениях.
Раковая кахексия. Характеризуется истощением больного с развитием бурой атрофии миокарда, печени и скелетной мускулатуры. Возникновение раковой кахексии связывают с увеличением уровня белкового обмена в ткани опухоли, которая становится ловушкой всех питательных веществ и обрекает организм на "голодание". В последние годы развитие раковой кахексии связывают также с усиленной продукцией а-ФНО макрофагами и другими клетками в организме-опухоленосителе. а-ФНО называется кахектином, и его патогенетическая роль в возникновении кахексии доказана пока только в экспериментах на животных.
Паранеопластические синдромы. Это синдромы, обусловленные наличием опухоли в организме. Патогенез их различен, но всегда ключевое событие обусловлено воздействием неоплазмы. При гормонально-активных опухолях могут возникнуть различные эндокринопатии, как, например, синдром Иценко — Кушинга при аденомах передней доли гипофиза или нейроэндокринных опухолях легких; гиперкальциемия и остеопороз при аденомах околощитовидных желез и раке легкого. Опухоль, особенно на стадии метастазирования, воздействует на свертывающую и противосвертывающую систему крови, сама продуцирует факторы, усиливающие коагуляцию крови, и способствует развитию различных тромбопатий (мигрирующие тромбофлебиты, небактериальный тромбоэндокардит) и афиб-риногенемии. При опухолевом росте описан широкий спектр иммунопатологических процессов с иммунокомплексными, антительными и цитотоксическими механизмами развития. Эти процессы приводят к возникновению у онкологических больных нейропатий, миопатий и дерматопатий.
Механизмы противоопухолевой защиты организма. Они разнообразны и складываются из защитных реакций с участием процессов репарации мутированного участка ДНК, сбалансированной работы генов-супрессоров и клеточных онкогенов, а также из факторов неспецифической и специфической, иммунной и неиммунной защиты.
В защите от опухоли имеют значение реакции клеточного и гуморального иммунитета. Основными клетками, участвующими в противоопухолевой иммунной защите, являются специфические цитотоксические Т-лимфоциты, способные распознавать мембраносвязанные опухолевые антигены, а также антигены, относящиеся к антигенам I класса основного комплекса гистосовместимости; натуральные Т-килле-ры (NK-клетки), вызывающие деструкцию опухолевых клеток без предварительной сенсибилизации. Лизис осуществляется за счет непосредственного связывания с опухолевыми клетками или же через Fc-фрагменты противоопухолевых антител; макрофаги осуществляют как неспецифическое повреждение опухолевых клеток через выделение а-ФНО и других факторов, так и специ фическое иммунное повреждение путем присоединения к Fc-фрагментам противоопухолевых антител и через активацию Т-лимфоцитов, выделяющих 7-интерферон и другие цитокины.
Антительный механизм противоопухолевого иммунитета может осуществляться связыванием противоопухолевыми антителами комплемента с формированием литического комплекса, который взаимодействует с опухолевой клеткой, присоединением к опухолевой клетке через Fc-фрагмент противоопухолевых антител NK-клеток и макрофагов.
Интересным является вопрос о неэффективности иммунных реакций в защите от опухоли. Эту неэффективность, вероятно, можно объяснить развитием иммуносупрессии у онкологических больных, наличием феномена антигенного ускользания опухоли в связи с антигенной лабильностью, антигенным упрощением ее клеток, а также усилением роста опухоли под влиянием противоопухолевых антител.
МОРФОГЕНЕЗ ОПУХОЛЕЙ
Разбирая морфогенез опухолей, необходимо остановиться на четырех вопросах: 1) возникает ли опухоль без каких-либо предшествующих изменений сразу, "с места в карьер" — de novo — или же стадийно? 2) в случае стадийного развития опухоли, какова сущность этих стадий, в том числе и процесса метастазирования? 3) развивается ли неоплазма из одной трансформированной клетки, и тогда все опухолевые клетки относятся к одному клону, или же опухолевому росту предшествует трансформация многих клеток? 4) каково взаимодействие опухоли и организма-опу-холеносителя?
На первые два вопроса о развитии опухолей de novo или стадийно отвечают две теории — скачкообразной и стадийной трансформации.
Теория скачкообразной трансформации.В соответствии с этой теорией H.Ribbert, M.Borst, B.Fischer (1914) опухоль может развиться без предшествующих изменений тканей, о чем свидетельствуют данные экспериментального вирусного канцерогенеза, а также разнообразные клинические наблюдения. Теоретически возможность скачкообразного развития опухоли подтверждается существованием одноступенчатой модели вирусного канцерогенеза. В подавляющем же большинстве экспериментальных моделей опухолей речь идет о многоступенчатом развитии опухолей (см. лекцию 20 "Опухолевый рост").
Теория стадийной трансформациипри опухолевом росте была разработана отечественным онкологом-экспериментатором Л.М.Шабадом (1968), который одним из первых высказывался о решающем значении мутации соматических клеток в происхождении злокачественных опухолей. В 60-х годах, изучая экспериментальный канцерогенез в различных органах, он предложил выделять четыре стадии в морфогенезе злокачественных опухолей, три из которых относятся к предопухолевым процессам: 1) очаговая гиперплазия; 2) диффузная гиперплазия; 3) доброкачественная опухоль; 4) злокачественная опухоль.
В настоящее время расшифрованы и уточнены следующие стадии морфогенеза злокачественных опухолей:
▲ стадия предопухоли — гиперплазии и предопухолевой дисплазии;
▲ стадия неинвазивной опухоли (рак на месте); а стадия инвазивного роста опухоли;
Вопрос о взаимоотношении доброкачественных и злокачественных опухолей решается неоднозначно. Бесспорно, существуют доброкачественные опухоли, которые могут трансформироваться в злокачественные. Примером могут служить аденоматозные полипы, аденомы и папилломы, в которых развиваются фокусы малигнизации и рак. Но есть также доброкачественные опухоли, практически никогда не трансформирующиеся в злокачественные аналоги.
Предопухолевая дисплазия. Развитию большинства злокачественных опухолей предшествуют предопухолевые процессы, что наиболее детально изучено в группе эпителиальных опухолей и опухолей системы крови и лимфоидной ткани. В первом случае речь идет о предраке, во втором — о предлейкозе и предлимфоме. К предопухолевым процессам в настоящее время относят диспластические процессы, которые характеризуются развитием изменений как в паренхиматозных, так и стромальных элементах. Основными морфологическими критериями диспластических процессов считают появление признаков клеточного атипизма в паренхиме органа при сохранной структуре ткани. В строме очагов дисплазии регистрируются изменения состава экстрацеллюлярного матрикса, появление клеточного инфильтрата, фибробластическая реакция и др. При дисплазии эпителия обнаруживаются полиморфные эпителиальные клетки с гиперхромными ядрами и фигурами митозов не только в базальных отделах, утолщается базальная мембрана, накапливаются коллагены определенных типов и появляются лимфоидные инфильтраты. В случае предлейкоза увеличивается процент бластных клеток до 9. Помимо стереотипных проявлений дисплазии как пред опухолевого процесса, в разных органах и тканях имеются и свои специфические черты, о чем будет сказано в соответствующих лекциях в частном курсе патологической анатомии.
В большинстве органов диспластический процесс развивается при наличии пролиферации клеточных элементов на фоне предшествующей гиперплазии в связи с хроническим воспалением и дисрегенерацией. Однако в ряде случаев дисплазия сочетается с атрофией ткани, как это бывает при атрофическом гастрите с перестройкой эпителия, а также при циррозе печени. Сочетание дисплазии и атрофии не случайно, так как и тот, и другой процессы имеют общие генетические механизмы, в которых участвует ряд клеточных онкогенов, ген-супрессор р53 и др. В одних ситуациях активация данных генов приводит к апоптозу и атрофии без или в сочетании с дисплазией, в других — к пролиферации также без или в сочетании с дисплазией.
На стадии дисплазии методами иммуногистохимии и молекулярной биологии регистрируются перестройки в работе онкопро-теинов, факторов роста, интегриновых рецепторов и адгезивных молекул. Причем генетические перестройки могут значительно опережать морфологические изменения и служить ранними признаками предопухолевых изменений.
Стадия неинвазивной опухоли. Прогрессирова-ние дисплазии связывают с дополнительными воздействиями, ведущими к последующим генетическим перестройкам и злокачественной трансформации. В результате возникает малигнизированная клетка, которая некоторое время делится, формируя узел (клон) из себе подобных клеток, питаясь за счет диффузии питательных веществ из тканевой жидкости прилежащих нормальных тканей и не прорастая в них. На данной стадии опухолевый узел не имеет еще своих сосудов. Причина этого неизвестна. Вероятно, малая масса опухоли обусловливает недостаточную продукцию факторов, стимулирующих ангиогенез и стромообразо-вание в опухоли. Однако, по нашему мнению, представляется более верной точка зрения об отсутствии в неинвазивной опухоли определенных генных перестроек, которые необходимы для осуществления инвазивного роста.
В случае рака стадия роста опухоли "самой в себе" без разрушения базальной мембраны и без образования стромы и сосудов называется стадией рака на месте — cancer in situ, и выделяется в самостоятельную морфогенетическую стадию. Длительность течения данной стадии может достигать 10 лет и более.
Стадия инвазивной опухоли. Она характеризуйся появлением инфильтрирующего роста. В опухоли появляется развитая сосудистая сеть, строма, выраженная в различной степени, границы с прилежащей неопухолевой тканью отсутству- 1От за счет прорастания в нее опухолевых клеток.
Инвазия опухоли протекает в три фазы и обеспечивается определенными генетическими перестройками. Первая фаза инвазии опухоли характеризуется ослаблением контактов между клетками, о чем свидетельствуют уменьшение количества меж. клеточных контактов, снижение концентрации некоторых адгезивных молекул из семейства CD44 и др. и, наоборот, усиления экспрессии других, обеспечивающих мобильность опухолевых клеток и их контакт с экстрацеллюлярным матриксом. На клеточной поверхности снижается концентрация ионов кальция, что приводит к повышению отрицательного заряда опухолевых клеток. Усиливается экспрессия интегриновых рецепторов, обеспечивающих прикрепление клетки к компонентам экстрацеллюлярного матрикса — ламинину, фибронектину, коллагенам. Во второй фазе опухолевая клетка секретирует протеолитические ферменты и их активаторы, которые обеспечивают деградацию экстрацеллюлярного матрикса, освобождая тем самым опухоли путь для инвазии. В то же время продукты деградации фибронектина и ламинина являются хемоаттрактантами для опухолевых клеток, которые мигрируют в зону деградации в третьей фазе инвазии, а затем процесс повторяется снова.
Стадия метастазирования. Это заключительная стадия морфогенеза опухоли, сопровождающаяся определенными гено- и фенотипическими перестройками опухоли. Процесс метастазирования связан с распространением опухолевых клеток из первичной опухоли в другие органы по лимфатическим, кровеносным сосудам, периневрально, имплантационно, что легло в основу выделения видов метастазирования.
Процесс метастазирования объясняется с помощью теории метастатического каскада,в соответствии с которой опухолевая клетка претерпевает цепь (каскад) перестроек, обеспечивающих распространение в отдаленные органы. В процессе метастазирования опухолевая клетка должна обладать определенными качествами, позволяющими ей проникать в прилежащие ткани и просветы сосудов (мелких вен и лимфатических сосудов); отделяться от опухолевого пласта в ток крови (лимфы) в виде отдельных клеток или небольших групп клеток; сохранять жизнеспособность после контакта в токе крови (лимфы) со специфическими и неспецифическими факторами иммунной защиты; мигрировать в венулы (лимфатические сосуды) и прекрепляться к их эндотелию в определенных органах; осуществлять инвазию микрососудов и расти на новом месте в новом окружении.
Метастатический каскад условно может быть разделен на четыре этапа:
▲ формирование метастатического опухолевого субклона;
▲ инвазия в просвет сосуда;
▲ циркуляция опухолевого эмбола в кровотоке (лимфотоке);
▲оседание на новом месте с формированием вторичной опухоли (рис. 5).
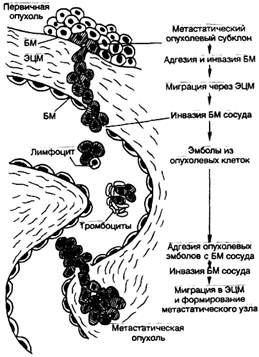
Рис. 5. Метастатический каскад [Cotran R.S., Robins L.S., 1989]. БМ — базальная мембрана; ЭЦМ — экстрацеллюлярный матрикс.
Процесс метастазирования начинается с появления метастатического субклона опухолевых клеток с измененной плазмолеммой, в результате чего клетки теряют межклеточные контакты и приобретают способность к передвижению. Затем опухолевые клетки мигрируют через экстрацеллюлярный матрикс, прикрепляясь интегриновыми рецепторами к ламинину, фибронектину, коллагеновым молекулам базальной мембраны сосуда, осуществляют ее протеолиз за счет выделения коллагеназ, катепсина, эластазы, гликозаминогидролазы, плазмина и др. Это позволяет опухолевым клеткам инвазировать базальную мембрану сосуда, прикрепляться к его эндотелию, а затем, изменяя свои адгезивные свойства (супрессия адгезивных молекул семейства САМ), отделяться как от опухолевого пласта, так и от эндотелия сосуда, "а следующем этапе формируются опухолевые эмболы, которые могут состоять только из опухолевых клеток или же из опухолевых клеток в сочетании с тромбоцитами и лимфоцитами. Фибриновое покрытие таких эмболов может защищать опухолевые клетки от элиминации клетками иммунной системы и действия неспецифических факторов защиты. На заключительном этапе опухолевые клетки взаимодействуют с эндотелием венул за счет "homing''-рецепторов и молекул семейства CD44, происходит прикрепление и протеолиз базальной мембраны, инвазия в периваскулярную ткань и рост вторичной опухоли.
Согласно теории прогрессии опухолей (1969 г.), происходит постоянный стадийный прогрессирующий рост опухоли с прохождением качественно разных стадий. При этом проявляется автономность не только роста, но и других признаков опухоли, как полагал автор теории. Последнее утверждение спорно, поскольку злокачественность опухоли всегда имеет материальную основу (активный синтез онкопротеинов, факторов роста, их рецепторов). Это меняет проявления морфологического атипизма опухоли, что используют в прогнозировании продолжительности жизни пациентов.
При изучении морфогенеза опухолей необходим ответ на следующие вопросы:
· Возникает ли опухоль без предшествующих изменений или стадийно?
· В случае стадийного развития опухоли, какова сущность стадий, в том числе процесса метастазирования?
· Возникает ли опухоль из одной трансформированной клетки (тогда все опухолевые клетки принадлежат к одному клону) или опухолевому росту предшествует трансформация многих клеток?
· Каково взаимодействие опухоли и организма-опухоленосителя?
Теории опухолевой трансформации
На первые два вопроса о развитии опухолей de novo или стадийно отвечают теории скачкообразной и стадийной трансформации.
· Теория скачкообразной трансформации. Развитие опухоли возможно без предшествующих изменений тканей, о чём свидетельствуют данные экспериментального вирусного канцерогенеза и клинические наблюдения. Теоретически возможность скачкообразного развития опухоли подтверждает одноступенчатая модель вирусного канцерогенеза. Однако в большинстве экспериментальных моделей опухолей представлено их многоступенчатое развитие.
· Теория стадийной трансформации при опухолевом росте разработана отечественным онкологом-экспериментатором Л.М. Шабадом. Он одним из первых предположил роль мутаций соматических клеток в происхождении злокачественных опухолей.
В 1960-х годах он предложил выделять в морфогенезе злокачественных опухолей следующие стадии: очаговая гиперплазия, диффузная гиперплазия, доброкачественная опухоль, злокачественная опухоль.
В настоящее время в морфогенезе злокачественных опухолей выделяют стадию предопухоли (гиперплазии и предопухолевой дисплазии), стадию неинвазивной опухоли (рак in situ), стадию инвазивного роста опухоли и стадию метастазирования.
Взаимоотношение доброкачественных и злокачественных опухолей сложно. Существуют доброкачественные опухоли, способные к трансформации в злокачественные (аденоматозные полипы, аденомы, папилломы с фокусами малигнизации и рака). Однако часть доброкачественных опухолей почти никогда не переходит в злокачественные.
Развитию большинства злокачественных опухолей предшествуют предопухолевые процессы, что наиболее детально изучено для эпителиальных опухолей, опухолей системы крови и лимфоидной ткани. В первом случае речь идёт о предраке, во втором — о предлейкозе и предлимфоме. К предопухолевым процессам относят дисплазии с развитием изменений как в паренхиматозных, так и стромальных элементах. Основные морфологические критерии диспластических процессов — появление признаков клеточного атипизма в паренхиме органа при сохранной структуре ткани. В строме очагов дисплазии находят изменения состава межклеточного матрикса, появление клеточного инфильтрата, фибробластическую реакцию и др. При дисплазии эпителия обнаруживают полиморфные эпителиальные клетки с гиперхромными ядрами и фигуры митозов не только в базальных отделах, утолщение базальной мембраны, накопление определённых типов коллагенов, появление лимфоидных инфильтратов. При предлейкозе относительное содержание бластных клеток увеличено до 9%. Помимо общих проявлений дисплазии как предопухолевого процесса, в разных органах и тканях есть специфические признаки.
В большинстве органов диспластический процесс развивается при наличии пролиферации клеточных элементов на фоне предшествующей гиперплазии, связанной с хроническим воспалением и дисрегенерацией. Однако возможно сочетание дисплазии с атрофией ткани (при атрофическом гастрите с перестройкой эпителия, циррозе печени). Сочетание дисплазии и атрофии не случайно, так как оба процесса имеют общие генетические механизмы, в них участвует ряд клеточных онкогенов, ген-супрессор p53 и др. Активация данных генов приводит к апоптозу и атрофии, иногда — к пролиферации. Те и другие процессы могут протекать в сочетании с дисплазией или без неё.
На стадии дисплазии методами иммуногистохимии и молекулярной биологии выявляют перестройки в работе онкопротеинов, факторов роста, интегринов и других молекул адгезии. Генетические перестройки могут значительно опережать морфологические изменения, это важно для ранней диагностики предопухолевых процессов (рис. 7-7).
Стадия неинвазивной опухоли
Прогрессирование дисплазии связывают с дополнительными воздействиями, ведущими к генетическим перестройкам и злокачественной трансформации. В результате возникает малигнизированная клетка. Она делится, формируя узел (клон) подобных ей клеток, питаясь за счёт диффузии веществ из тканевой жидкости прилежащих нормальных тканей и не прорастая в них. На этой стадии опухолевый узел ещё не имеет своих сосудов. Причина последнего неизвестна. Предполагают, что это связано с малой массой опухоли и недостаточной продукцией факторов, стимулирующих ангиогенез и стромообразование в опухоли. Однако более вероятна другая точка зрения — об отсутствии в неинвазивной опухоли определённых генных перестроек, необходимых для инвазивного роста.
При эпителиальных злокачественных новообразованиях стадию роста опухоли без разрушения базальной мембраны, без образования стромы и сосудов называют раком на месте (cancer in situ) и выделяют в самостоятельную морфогенетическую стадию. Длительность течения данной стадии может превышать 10 лет.
Стадия инвазивной опухоли
Характерно появление инфильтрирующего роста. В опухоли возникает развитая сосудистая сеть, выраженная в различной степени строма, границы с прилежащей неопухолевой тканью отсутствуют за счёт прорастания в неё опухолевых клеток. Инвазия опухоли имеет три фазы.
· Первая фаза. Происходит ослабление связей между клетками, о чём свидетельствуют уменьшение количества межклеточных контактов,
Рис. 7-7.Генетические перестройки при предраке и раке толстой кишки
снижение концентрации молекул адгезии и др. Активизированы факторы, обеспечивающие мобильность опухолевых клеток и их контакт с межклеточным матриксом. Усилена экспрессия интегринов, способствующих прикреплению клетки к компонентам межклеточного матрикса: ламинину, фибронектину, коллагенам.
· Вторая фаза. Опухолевая клетка выделяет протеолитические ферменты и их активаторы. Они обеспечивают деградацию межклеточного матрикса, освобождая путь для инвазии. Продукты деградации фибронектина и ламинина — хемоаттрактанты для опухолевых клеток.
· Третья фаза инвазии — миграция опухолевых клеток в зону деградации.
Стадия метастазирования — заключительная стадия морфогенеза опухоли. Процесс метастазирования связан с распространением опухолевых клеток из первичной опухоли в другие органы по лимфатическим, кровеносным сосудам, периневрально, имплантационно, что легло в основу выделения видов метастазирования.
Процесс метастазирования объясняет теория метастатического каскада. В соответствии с ней опухолевая клетка претерпевает цепь (каскад) перестроек, обеспечивающих распространение в отдалённые органы. При метастазировании опухолевая клетка должна иметь определённые качества, позволяющие ей проникать в прилежащие ткани и просветы сосудов (мелких вен и лимфатических сосудов), отделяться от опухолевого пласта в ток крови (лимфы) в виде клеток или небольших групп клеток, сохранять жизнеспособность после контакта со специфическими и неспецифическими факторами иммунной защиты; мигрировать в венулы (лимфатические сосуды) и прикрепляться к их эндотелию в определённых органах, проникать в микрососуды и расти на новом месте в новом окружении.
В метастатическом каскаде условно можно выделить следующие этапы:
· формирование метастатического опухолевого субклона;
· инвазия в просвет сосуда;
· циркуляция опухолевого эмбола в кровотоке (лимфотоке);
· оседание на новом месте с развитием вторичной опухоли.
Процесс метастазирования начинается с появления метастатического субклона опухолевых клеток с изменённой плазмолеммой. Эти клетки теряют межклеточные контакты и приобретают способность к передвижению. Затем опухолевые клетки мигрируют через межклеточный матрикс, прикрепляясь при помощи интегринов к ламинину, фибронектину, коллагеновым молекулам базальной мембраны сосуда, осуществляют её протеолиз за счёт выделения коллагеназ, катепсина, эластазы, гликозаминогидролазы, плазмина и др. Это позволяет опухолевым клеткам инвазировать базальную мембрану сосуда, прикрепляться к его эндотелию, а затем, изменяя свои адгезивные свойства (супрессия адгезивных молекул), отделяться от опухолевого пласта и эндотелия сосуда.
Следующий этап — формирование опухолевых эмболов, состоящих только из опухолевых клеток или в сочетании с тромбоцитами и лимфоцитами. Фибриновое покрытие таких эмболов может защищать опухолевые клетки от уничтожения клетками иммунной системы и действия неспецифических факторов защиты.
Заключительный этап — взаимодействие опухолевых клеток с эндотелием венул за счёт хоминга рецепторов и молекул CD44, прикрепление и протеолиз базальной мембраны, проникновение в периваскулярную ткань и рост вторичной опухоли.
Морфология опухолевого роста
Дата добавления: 2018-05-09 ; просмотров: 267 ;
Читайте также:

