Тюляндин рак молочной железы
На прошедшем в Сан-Антонио очередном конгрессе, посвященном диагностике и лечению рака молочной железы, были сообщены результаты нескольких важных исследований, которые могут повлиять на нашу клиническую практику.
Исследование FACT: фульвестрант в первой линии гормонотерапии больных метастатическим раком молочной железы
Фульвестрант – препарат, деградирующий рецепторы эстрогенов в клетке опухоли молочной железы, в течение долгого времени использовался в клинической практике в дозе 250 мг в/м каждые 4 недели для проведения гормонотерапии больных метастатическим раком молочной железы в постменопаузе. В этой дозе фульвестрант по данным рандомизированных исследований показал равную эффективность с тамоксифеном в первой линии гормонотерапии и с ингибиторами ароматазы во второй линии. С учетом большей стоимости препарата фульвестрант, как правило, использовался в третьей линии. Проведенные фармакокинетические исследования показали, что возможной причиной недостаточной эффективности препарата является использование его в дозе 250 мг. Было предложено увеличить дозу лекарства до 500 мг каждые 28 дней с первоначальным введением препарата каждые 2 недели для создания стабильной максимальной концентрации в крови. В этой дозе фульвестрант был использован при проведении рандомизированного исследования CONFIRM, в котором сравнивали его эффективность с дозировкой 250 мг каждые 4 недели при проведении второй линии гормонотерапии у больных метастатическим раком молочной железы в постменопаузе [1]. В этом исследовании было показано преимущество дозы в 500 мг по сравнению с дозой 250 мг, медиана времени до прогрессирования составила 6,5 мес. и 5,5 мес. соответственно (HR=0.8, p=0.006), а медиана общей продолжительности жизни – 26,4 месяца и 22,3 месяца соответственно (HR=0,81, p=0.02). Увеличение дозы фульвестранта не привело к увеличению токсичности. Таким образом, повысив дозу фульвестранта с 250 мг до 500 мг в/м каждые 28 дней исследователи уменьшили относительный риск прогрессирования на 20% и риск смерти от рака молочной железы на 19% у больных в постменопаузе при проведении второй линии гормонотерапии.
Это исследование послужило основанием для проведения рандомизированного исследования II фазы по сравнению фульвестранта в дозе 500 каждые 28 дней (первые 3 дозы препарата вводятся с интервалом в 2 недели) и анастрозола в дозе 1 мг внутрь ежедневно в качестве первой линии гормонотерапии больных метастатическим раком, в исследование было включено 205 женщин [2]. Назначение фульвестранта в сравнении с анастрозолом сопровождалось увеличением медианы времени до прогрессирования с 13,1 мес. до 23,4 мес. (HR=0,66) и медианы общей продолжительности жизни с 48,1 мес. до 54,1 мес. (HR=0,70, p=0,041). Подгрупповой анализ выявил преимущество фульвестранта во всех анализируемых группах. Токсичность терапии была сопоставима в обеих группах. В этом исследовании удивляет существенное увеличение времени до прогрессирования и общей продолжительности жизни на фоне лечения фульвестрантом, что послужило основанием для проведения в настоящее время рандомизированного исследования III фазы по сравнению фульвестранта и анастрозола при проведении первой линии гормонотерапии рака молочной железы. Позитивный результат этого исследования откроет двери для использования фульвестранта в качестве первой линии гормонотерапии у метастатических больных.
Новый биомаркер у больных HER2+ позитивным раком молочной железы
Интригующие данные были получены при анализе результатов адъювантной терапии с включением трастузумаба у больных операбельным HER2 раком молочной железы в зависимости от содержания инфильтрирующих опухоль лимфоцитов (tumorinfiltratinglymphocytes – TILs). Известно, что наличие в опухоли TILs является косвенным свидетельством активного противоопухолевого иммунитета и сочетается с улучшением прогноза у больных операбельным раком молочной железы. Авторы проанализировали 925 больных, получавших лечение в рамках протокола N9831, который предусматривал назначение больным HER2 операбельным раком молочной железы химиотерапии (AC × 4, паклитаксел × 4) только или химиотерапии в сочетании с трастузумабом в течение года. Ранее было показано, что назначение трастузумаба уменьшает относительный риск смерти от рака молочной железы на 37% [3]. Анализируемые больные, половина из которых получала трастузумаб, а другая нет, были разделены в зависимости от содержания в опухоли TILs на высокий уровень (>60% клеток в опухоли представлено TILs) и низкий ( Поделиться |

- Как возникает рак молочной железы?
- Типы рака молочной железы
- Причины и факторы риска
- Симптомы рака молочной железы
- Самостоятельная диагностика рака груди
- Диагностика
- Стадии рака молочной железы
- Лечение рака молочной железы
- Прогноз при раке молочной железы
Как возникает рак молочной железы?
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными .
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
Типы рака молочной железы
Злокачественные опухоли груди делятся на два типа: протоковые и железистые. Протоковый рак молочной железы встречается чаще. Он может быть внутриэпителиальным (in situ) и инвазивным. У внутриклеточного протокового рака молочной железы более благоприятный прогноз, он редко дает метастазы и излечивается в 98% случаев. Инвазивный же вариант опухоли склонен к бесконтрольному росту и генерализации процесса.
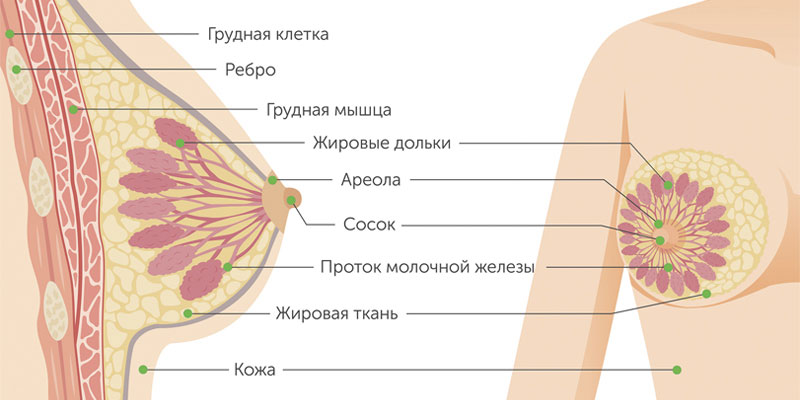
Железистый рак молочной железы может быть дольковым (инвазивная лобулярная карцинома) или произрастать из других клеток железистой ткани. Для долькового рака нередко характерен мультицентричный рост. Скорость увеличения в размерах и сроки метастазирования форм узлового рака груди зависят от степени дифференцировки опухоли.
Причины и факторы риска
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Симптомы рака молочной железы
На ранних стадиях рак молочной железы, как правило, никак клинически не проявляется. Чаще всего опухоль обнаруживается самими больными или выявляется случайно при проведении профилактических исследований.
Пациентки обычно жалуются на наличие пальпируемого образования, выделения из соска. Боль является редким симптомом рака грудной железы, однако болевой синдром может выйти на первый план на этапе генерализации процесса, в особенности при распространении метастазов в кости.
Довольно часто выявляются такие признаки рака груди, как появление асимметрии вследствие изменения размеров пораженной железы. Уменьшение, смещение кверху, деформация и сморщивание молочной железы может наблюдаться при скиррозной (фиброзной) форме опухоли. Напротив, увеличивается грудь на стороне поражения при быстром росте образования или из-за отека, который формируется по причине нарушенного оттока лимфы.
При распространении новообразования в подкожную клетчатку могут наблюдаться изменения кожи. При этом выявляются следующие симптомы рака молочной железы:
Иногда, при распространении опухоли на поверхность кожи могут наблюдаться такие признаки рака груди, как покраснение и изъязвление. Наличие этих симптомов говорит о запущенности процесса.
Изменения соска тоже могут определяться, но только на поздних стадиях. При этом имеют место такие симптомы рака грудной железы, как:
- Симптом Форга — на стороне поражения сосок находится выше, чем на здоровой стороне.
- Симптом Краузе — сосок утолщен, складки ареолы заметно выражены.
Такой признак рака молочной железы, как патологические выделения, является довольно редким, но в ряде случаев может быть единственным симптомом, который выявляется при осмотре. Часто выделения носят кровянистый характер, реже встречаются серозные и гнойные.
Также были выделены особые формы рака груди, которые проявляются типичной симптоматикой. К ним относятся:
- Отечно-инфильтративная форма, для которой характерно увеличение и отечность железы, мраморный цвет кожи, выраженная гиперемия.
- Маститоподобная. Данный вид рака груди проявляется уплотнением пораженной груди, повышением температуры тела.
- Рожистоподобная форма, при которой на коже выявляются очаги (иногда появляются изъязвления), которые внешне напоминают рожистое воспаление.
- Панцирная форма характеризуется наличием множественных узлов, за счет которых происходит сморщивание и деформация железы.
- Рак Педжета — поражает сосок и ареолу. При данной разновидности наблюдают утолщение соска, изменение кожи в виде покраснения и уплотнения, образование корок и чешуек.
Иногда люди, интересуясь по каким признакам можно распознать наличие опухоли молочной железы, по ошибке ищут симптомы рака грудины. Данное название является неверным, так как грудина является центральной плоской костью грудной клетки и даже при метастазировании злокачественного образования груди практически никогда не поражается.
Самостоятельная диагностика рака груди
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц после менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
Диагностика
Диагностика рака молочной железы начинается с беседы. На этом этапе для врача важно оценить жалобы женщины и выяснить, встречались ли случаи рака молочной железы в её семье, если да — насколько часто. Это помогает заподозрить наследственную форму рака, связанную с мутациями в генах BRCA1, BRCA2, NBS1, CHECK, TP53.
Далее врач осматривает, ощупывает молочные железы, проверяет, нет ли в них узлов и уплотнений, не увеличены ли лимфатические узлы в подмышечной, надключичной и подключичной областях.
После осмотра врач может направить женщину на маммографию — рентгенографию молочной железы. Показаниями к этому исследованию являются: уплотнения в молочной железе, изменения со стороны кожи, выделение крови из соска, а также любые другие симптомы, которые могут указывать на злокачественную опухоль. Также для диагностики рака молочной железы назначают ультразвуковое исследование. Маммография и УЗИ являются взаимодополняющими методами, каждый из них имеет свои преимущества:
Маммография
УЗИ молочных желез
Позволяет обнаружить патологические изменения за 1,5–2 года до появления симптомов.
При кровянистых выделениях из соска можно провести дуктографию — рентгенографию с контрастированием молочных протоков. Это помогает получить дополнительную полезную информацию.
Высокая чувствительность — точная диагностика до 90% случаев рака.
Возможность обнаружить микрокальцинаты до 0,5 мм.
Безопасность — нет воздействия на организм рентгеновскими лучами.
Хорошо подходит при высокой плотности ткани молочной железы, у молодых женщин (до 35–45 лет).
Позволяет отличать кисты (полости с жидкостью) от плотных опухолей.
Позволяет оценить состояние регионарных лимфатических узлов.
Хорошо подходит для контроля положения иглы во время биопсии.
Магнитно-резонансная томография — высокоинформативный метод диагностики злокачественных опухолей молочной железы. Ее применяют при лобулярном раке, когда неинформативны маммография и УЗИ, а также для оценки размеров и расположения опухоли, что помогает определиться с тактикой хирургического лечения. МРТ может применяться для скрининга у женщин-носительниц аномальных генов, связанных с повышенным риском рака молочной железы, при отягощенном семейном анамнезе.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:

В лаборатории проводят цитологическое и гистологическое исследование, то есть оценивают строение отдельных клеток и ткани. В настоящее время доступны молекулярно-генетические исследования: они помогают выявить мутации, за счет которых произошло злокачественное перерождение, и подобрать оптимальную противоопухолевую терапию.
Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой , что также влияет на схему лечения.
После того как рак диагностирован, важно определить его стадию и понять, насколько сильно он распространился в организме. Для этого применяют следующие исследования:

Стадии рака молочной железы
Стадирование при раке молочной железы опирается на общепринятую систему TNM. Буква T в этой аббревиатуре обозначает размер первичной опухоли:
Буквой N обозначают наличие метастазов в регионарных лимфатических узлах. N0 — очаги в лимфатических узлах отсутствуют. N1, N2 и N3 — поражение разного количества лимфатических узлов.
Буква M обозначает наличие отдаленных метастазов. Рядом с ней может быть указана одна из двух цифр: M0 — нет отдаленных метастазов, M1 — отдаленные метастазы имеются.
В зависимости от значений T, N и M, выделяют пять основных стадий рака молочной железы (внутри некоторых из них есть подстадии):
- Стадия 0: рак на месте.
- Стадия I: опухоль в молочной железе диаметром до 2 см.
- Стадия II: опухоль в молочной железе диаметром до 5 см и более, могут быть метастазы в подмышечных лимфоузлах на стороне поражения.
- Стадия III: опухоль в молочной железе до 5 см и более, может прорастать в грудную стенку или в кожу, имеются очаги в регионарных лимфатических узлах.
- Стадия IV: опухоль может быть любых размеров, не имеет значения, поражены ли регионарные лимфоузлы. Если обнаруживают отдаленные метастазы, всегда диагностируют рак четвертой стадии.
Лечение рака молочной железы
Стратегия лечения рака молочной железы должна подбираться индивидуально для каждой пациентки с учетом таких факторов, как тип опухоли, стадия, чувствительность новообразования к гормональной терапии. Берется во внимание и общее состояние больной. Если опухоль обнаружена на ранних стадиях и выбрана правильная тактика ведения пациентки, то шанс полностью вылечить рак груди является весьма высоким.
Выберите врача-онколога и запишитесь на приём:

Пластический хирург, онколог-маммолог, доктор медицинских наук
Российский онкологический научный центр им. Н.Н. Блохина, Москва
Две публикации в недавних номерах Journal of Clinical Oncology посвящены выбору адъювантной химиотерапии у больных операбельным раком молочной железы [1,2]. В работе Giordano et al. [1] анализируется частота назначения антрациклин-содержащих и таксан-содержащих (безантрациклиновых) комбинаций для проведения адъювантной терапии с 1998 по 2009 год по базам данных страховки Medicare и частных страховых компаний США (около 35 000 больных). Авторы отмечают, что в анализируемой когорте начиная со второй половины 2005 года происходит снижение частоты назначения антрациклин-содержащих комбинаций и значительно растет частота назначения таксан-содержащих (см. рис.1).
Рисунок 1. Частота назначения антрациклин-содержащих и таксан-содержащих комбинаций
для проведения адъювантной терапии больных раком молочной железы (Giordano SH et al., JCO 2012, 30:2232).
Это снижение наблюдается во всех возрастных группах, при всех фенотипах заболевания и не зависит от географии проведения лечения. Несмотря на падение, антрациклин-содержащие комбинации все еще чаще назначаются женщинам моложе 65 лет с HER2-негативным раком молочной железы, в то время как пожилым и больным любого возраста с HER2-позитивным раком чаще назначают безантрациклиновые комбинации на основе таксанов. Это связано с публикацией и представлением на международных конгрессах в 2005 году предварительных результатов исследований US Oncology trial 9735 и BCIRG 006 [3,4]. Окончательные результаты этих исследований были опубликованы позднее [5,6].
В исследовании 9735 проведено сравнение эффективности и токсичности назначения 4 курсов комбинации доцетаксел и циклофосфан (ТС) в сравнении с 4 курсами химиотерапии доксорубицин и циклофосфан (АС) [5]. Комбинации ТС достоверно улучшили результаты безрецидивной (7-летняя безрецидивная выживаемость составила 81% для ТС и 75% для АС, р.=0,033, снижение относительное риска прогрессирования на 26%) и общей (7-летняя общая выживаемость 87% и 82% соответственно, р=0,032, снижение относительного риска смерти составило 31%) выживаемости (см. рис. 2). Улучшение результатов лечения наблюдалось независимо от возраста, статуса гормональных рецепторов и HER2.
Рисунок 2. Кривые безрецидивной и общей выживаемости больных раком молочной железы, получавших адъювантную химиотерапию комбинациями ТС и АС в рамках исследования US Oncology trial 9735 (Jones SE et al. J Clin Oncol 2009 27:1177-1183).
Это улучшение результатов лечения было достигнуто при умеренном усилении гематологической токсичности в группе ТС (частота фебрильной нейтропении 5% для ТС и 2,5% для АС) и равной кардиотоксичности (или скорее ее отсутствии, ибо клинически значимая сердечная недостаточность была зарегистрирована только у одной больной в группе АС). Полученные результаты дали основание рекомендовать назначение безантрациклиновой комбинации ТС для проведения адъювантной терапии больным раком молочной железы.
В исследовании BCIRG 006 проведена оценка эффективности добавления трастузумаба к различным режимам адъювантной химиотерапии: антрациклиновый ACTH (доксорубицин, циклофосфан, доцетаксел, трастузумаб) и безантрациклиновый TCH (доцетаксел, циклофосфан, трастузумаб) [6]. В контрольной группе использовали назначение режима ACT (доксорубицин, циклофосфан, доцетаксел). Добавление трастузумаба достоверно уменьшило частоту рецидивов (снижение относительного риска прогрессирования заболевания на 36% и 25% при использовании ACTH и TCH соответственно по сравнению с химиотерапией АСТ только) и обусловило тенденцию к уменьшению числа умерших от прогрессирования опухолевого процесса (снижение относительного риска смерти на 37% и 23% соответственно). В результате 5-летняя безрецидивная выживаемость составила 75% для АСТ, 81% для ТСН и 84% для АСТН.
Рисунок 3. Кривые выживаемости больных HER2-позитивным раком молочной железы после адъювантной терапии
в рамках исследования BCIRG 006 (Slamon D et al. N Engl J Med 2011, 365:1273-1283).
Хотя дизайн исследования не предполагал сравнение групп больных, получавших АСТН и ТСН, результаты исследования были восприняты как свидетельство равной эффективности антрациклиновых и безантрациклиновых комбинаций в сочетании с трастузумабом у больных HER2-позитивным раком молочной железы. С учетом меньшего риска возникновения кардиомиопатий авторы исследования сделали вывод о преимуществе назначения комбинации ТСН, обладающей равной эффективностью и меньшей токсичностью по сравнению с антрациклиновой комбинацией.
Результаты этих двух исследований обусловили снижение частоты назначения антрациклиновых и увеличение частоты назначения безантрациклиновых комбинаций отдельно или в сочетании с трастузумабом в качестве адъювантной терапии у больных операбельным раком молочной железы. Остается неизвестным, как эти изменения повлияли на отдаленные результаты лечения.
В июньском номере журнала Journal of Clinical Oncology опубликован комментарий, посвященный выбору режима адъювантной химиотерапии у больных HER2-позитивным раком молочной железы [2]. Добавление трастузумаба к адъювантной химиотерапии достоверно и существенно улучшает результаты лечения операбельным раком молочной железы по данным нескольких рандомизированных исследований 9. Во всех этих исследованиях, ставивших первоочередную задачу по оценке эффективности трастузумаба, в качестве режимов химиотерапии использовались антрациклин-содержащие комбинации. Авторы комментария подробно и критично рассматривают цели, дизайн и результаты исследования BCIRG 006 и подчеркивают ошибочность отказа от антрациклиновых комбинаций при проведении адъювантной терапии больным HER2-позитивным раком молочной железы.
Во-первых, как уже говорилось, дизайном исследования не предполагалось сравнение двух групп больных, получавших трастузумаб, с целью определения наилучшего режима химиотерапии. Дизайн исследования предполагал лишь сравнение контрольной группы с каждой в отдельности группой химиотерапии и трастузумаба. Результаты безрецидивной выживаемости несколько лучше (на 3%) при назначении АСТН в сравнении с TCH. Это не позволяет исключить вероятность большей эффективности антрациклиновой комбинации.
Во-вторых, хотя в литературе отсутствуют данные о сравнении двух режимов химиотерапии АСТН и ТСН в качестве адъювантной химиотерапии, результаты рандомизированного исследования свидетельствуют о большей непосредственной эффективности и лучших отдаленных результатах антрациклиновых комбинаций в сочетании с трастузумабом и еженедельного паклитаксела в сочетании с трастузумабом по сравнению с ТСН в качестве предоперационной системой терапии [12].
В-третьих, предклинические и клинические данные свидетельствуют о синергизме адъювантного назначения антрациклинов и таксанов у больных HER2-позитивным раком молочной железы [13,14]. Значение карбоплатина в этой популяции больных не определено. Создание комбинации ТСН базируется на предклинических данных о синергизме производных платины и трастузумаба. Между тем, в клиническом исследовании у больных метастатическим HER2-позитивным раком молочной железы получены одинаковая эффективность комбинаций ТН и ТСН, что ставит под сомнения целесообразность добавления карбоплатина к доцетакселу [15].
В-четвертых, комбинация ACTH, возможно, не лучшая по эффективности антрациклиновая комбинация для проведения адъювантной терапии у больных HER2-позитивным раком молочной железы. Известно, что назначение антрациклинов и таксанов каждые 2 недели превосходит по эффективности 3-недельное введение этих препаратов в качестве адъювантной терапии [16]. Показано, что еженедельное введение паклитаксела является наиболее эффективным режимом назначения таксанов, особенно при совместном назначении с трастузумабом после антрациклинов при проведении адъювантной терапии [17]. Таким образом, режим АСТН может быть модифицирован на основании имеющегося клинического опыта с целью повышения эффективности и снижения токсичности.
В-пятых, основной причиной отказа от антрациклинов при проведении адъювантной химиотерапии является потенциальная кардиотоксичность препарата, которая усиливается при одновременном назначении с трастузумабом, и риск развития вторичных острых лейкозов. Частота развития вторичных лейкозов у больных в исследовании ВСIRG была одинаковой в обеих группах (по одному случаю в каждой группе за 5 лет наблюдения) [6]. Кардиомиопатии 3-4 степени отмечены у 21 больного в группе ACTH и у 4 больных в группе TCH. Однако за время наблюдения ни один больной с кардиомиопатией не умер от этого осложнения. У большинства больных со временем на фоне адекватной терапии происходит улучшение или даже нормализация сократительной способности миокарда. Разработаны критерии риска возникновения кардиомиопатии при проведении терапии трастузумабом (возраст старше 65 лет, фракция выброса левого желудочка в диапазоне 50-55%, наличие артериальной гипертензии), позволяющие снизить риск этого осложнения до 1% при назначении антрациклиновых режимов в сочетании с трастузумабом [18].
В заключение, антрациклин-содержащая адъювантная химиотерапия теряет популярность и активно замещается безантрациклиновыми комбинациями на основе таксанов. Без сомнения, выигрывают от перехода на безантрациклиновые комбинации больные с повышенным риском развития кардиомиопатии. Для остальных больных отдаленные последствия такого перехода неизвестны. Однако для больных с HER2-позитивным раком молочной железы отказ от антрациклинов выглядит преждевременным. До тех пор, пока нет свидетельств о преимуществе безантрациклиновых комбинаций, полученных при проведении правильно спланированных рандомизированных исследований, комбинации с включением антрациклинов и таксанов в сочетании с трастузумабом должны оставаться основой адъювантной терапии больных HER2-позитивным раком молочной железы.
- Giordano SH, Lin Y-L, Kuo YF, Hortobagui GH, Goodwin JS. Decline in the use of anthracyclines for breast cancer. J Clin Oncol 2012, 30:2232-2239.
- Burstein HJ, Piccart-Gebhart MJ, Perez EA, et al. Choosing the best trastuzumab-based adjuvant chemotherapy regimen: Should we abandon anthracyclines. J. Clin Oncol 2012, 30:2179-2182.
- Jones SE, Savin MA, Holmes FA, et al. Phase III trial comparing doxorubicin plus cyclophosphamide with docetaxel plus cyclophosphamide as adjuvant therapy for operable breast cancer. J Clin Oncol 2006, 24:5381-5387.
- Slamon DJ, Eiermann W, Robert N, et al. Phase III randomized trial comparing doxorubicin and cyclophosphamide followed by docetaxel with doxorubicin and cyclophosphamide followed by docetaxel and trastuzumab with docetaxel, carboplatin, and trastuzumab in HER2 positive early breast cancer patients: BCIRG006 Study. Breast Cancer Res Treat 2005, 94(suppl):s5.
- Jones S, Holmes FH, O’Shaughnessy J, et al. Docetaxel with cyclophosphamide is associated with an overall survival benefit compared with doxorubicin and cyclophosphamide: 7-year follow-Up of US Oncology research trial 9735. J Clin Oncol 2009, 27:1177-1183.
- Slamon D, Eiermann W, Robert N, et al. Adjuvant trastuzumab in HER2-positive breast cancer. N Engl J Med 2011, 365:1273-1283.
- Perez EA, Romond EH, Suman VJ, et al. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal growth factor receptor 2-positive breast cancer: Joint analysis of data from NCCTG N9831 and NSABP B-31. J Clin Oncol 2011, 29:3366-3373.
- Gianni L, Dafni U, Gelber RD, et al. Treatment with trastuzumab for 1 year after adjuvant chemotherapy in patients with HER2-positive early breast cancer: A 4-year follow-up of a randomised controlled trial. Lancet Oncol 2011, 12:236–244.
- Joensuu H, Kellokumpu-Lehtinen PL, Bono P, et al. Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer. N Engl J Med 2006, 354:809-820.
- Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): A randomized controlled superiority trial with a parallel HER2-negative cohort. Lancet 2010, 375:377-384.
- Perez EA, Suman VJ, Davidson NE, et al. Sequential versus concurrent trastuzumab in adjuvant chemotherapy for breast cancer. J Clin Oncol 2011, 29:4491-4497.
- Bayraktar S, Gonzalez-Angulo AM, Lei X, et al. Efficacy of neoadjuvant therapy with trastuzumab concurrent with anthracycline- and nonanthracycline-based regimens for HER2-positive breast cancer. Cancer 2012, 118:2385-2393.
- Gennari A, Sormani MP, Pronzato P, et al. HER2 status and efficacy of adjuvant anthracyclines in early breast cancer: A pooled analysis of randomized trials. J Natl Cancer Inst 2008, 100:14-20.
- Hayes DF, Thor AD, Dressler LG, et al. HER2 and response to paclitaxel in node-positive breast cancer. N Engl J Med 2007, 357:1496-1506.
- Valero V, Forbes J, Pegram MD, et al. Multicenter phase III randomized trial comparing docetaxel and trastuzumab with docetaxel, carboplatin, and trastuzumab as first-line chemotherapy for patients with HER2-gene-amplified metastatic breast cancer (BCIRG 007 study): Two highly active therapeutic regimens. J Clin Oncol 2011, 29:146-156.
- Citron ML, Berry DA, Cirincione C, et al. Randomized trial of dose-dense versus conventionally scheduled and sequential versus concurrent combination chemotherapy as postoperative adjuvant treatment of node-positive primary breast cancer: First report of Intergroup Trial C9741/Cancer and Leukemia Group B Trial 9741. J Clin Oncol 2003, 21:431-439.
- Sparano JA, Wang M, Martino S, et al. Weekly paclitaxel in the adjuvant treatment of breast cancer. N Engl J Med 2008, 358:1663-1671.
- Tan-Chiu E, Yothers G, Romond E, et al. Assessment of cardiac dysfunction in a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel, with or without trastuzumab as adjuvant therapy in node-positive, human epidermal growth factor receptor 2–overexpressing breast cancer: NSABP B-31. J Clin Oncol 2005, 23:7811-7819.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
На прошедшем в Сан-Антонио очередном конгрессе, посвященном диагностике и лечению рака молочной железы, были сообщены результаты нескольких важных исследований, которые могут повлиять на нашу клиническую практику.
Исследование FACT: фульвестрант в первой линии гормонотерапии больных метастатическим раком молочной железы
Фульвестрант – препарат, деградирующий рецепторы эстрогенов в клетке опухоли молочной железы, в течение долгого времени использовался в клинической практике в дозе 250 мг в/м каждые 4 недели для проведения гормонотерапии больных метастатическим раком молочной железы в постменопаузе. В этой дозе фульвестрант по данным рандомизированных исследований показал равную эффективность с тамоксифеном в первой линии гормонотерапии и с ингибиторами ароматазы во второй линии. С учетом большей стоимости препарата фульвестрант, как правило, использовался в третьей линии. Проведенные фармакокинетические исследования показали, что возможной причиной недостаточной эффективности препарата является использование его в дозе 250 мг. Было предложено увеличить дозу лекарства до 500 мг каждые 28 дней с первоначальным введением препарата каждые 2 недели для создания стабильной максимальной концентрации в крови. В этой дозе фульвестрант был использован при проведении рандомизированного исследования CONFIRM, в котором сравнивали его эффективность с дозировкой 250 мг каждые 4 недели при проведении второй линии гормонотерапии у больных метастатическим раком молочной железы в постменопаузе [1]. В этом исследовании было показано преимущество дозы в 500 мг по сравнению с дозой 250 мг, медиана времени до прогрессирования составила 6,5 мес. и 5,5 мес. соответственно (HR=0.8, p=0.006), а медиана общей продолжительности жизни – 26,4 месяца и 22,3 месяца соответственно (HR=0,81, p=0.02). Увеличение дозы фульвестранта не привело к увеличению токсичности. Таким образом, повысив дозу фульвестранта с 250 мг до 500 мг в/м каждые 28 дней исследователи уменьшили относительный риск прогрессирования на 20% и риск смерти от рака молочной железы на 19% у больных в постменопаузе при проведении второй линии гормонотерапии.
Это исследование послужило основанием для проведения рандомизированного исследования II фазы по сравнению фульвестранта в дозе 500 каждые 28 дней (первые 3 дозы препарата вводятся с интервалом в 2 недели) и анастрозола в дозе 1 мг внутрь ежедневно в качестве первой линии гормонотерапии больных метастатическим раком, в исследование было включено 205 женщин [2]. Назначение фульвестранта в сравнении с анастрозолом сопровождалось увеличением медианы времени до прогрессирования с 13,1 мес. до 23,4 мес. (HR=0,66) и медианы общей продолжительности жизни с 48,1 мес. до 54,1 мес. (HR=0,70, p=0,041). Подгрупповой анализ выявил преимущество фульвестранта во всех анализируемых группах. Токсичность терапии была сопоставима в обеих группах. В этом исследовании удивляет существенное увеличение времени до прогрессирования и общей продолжительности жизни на фоне лечения фульвестрантом, что послужило основанием для проведения в настоящее время рандомизированного исследования III фазы по сравнению фульвестранта и анастрозола при проведении первой линии гормонотерапии рака молочной железы. Позитивный результат этого исследования откроет двери для использования фульвестранта в качестве первой линии гормонотерапии у метастатических больных.
Новый биомаркер у больных HER2+ позитивным раком молочной железы
Интригующие данные были получены при анализе результатов адъювантной терапии с включением трастузумаба у больных операбельным HER2 раком молочной железы в зависимости от содержания инфильтрирующих опухоль лимфоцитов (tumorinfiltratinglymphocytes – TILs). Известно, что наличие в опухоли TILs является косвенным свидетельством активного противоопухолевого иммунитета и сочетается с улучшением прогноза у больных операбельным раком молочной железы. Авторы проанализировали 925 больных, получавших лечение в рамках протокола N9831, который предусматривал назначение больным HER2 операбельным раком молочной железы химиотерапии (AC × 4, паклитаксел × 4) только или химиотерапии в сочетании с трастузумабом в течение года. Ранее было показано, что назначение трастузумаба уменьшает относительный риск смерти от рака молочной железы на 37% [3]. Анализируемые больные, половина из которых получала трастузумаб, а другая нет, были разделены в зависимости от содержания в опухоли TILs на высокий уровень (>60% клеток в опухоли представлено TILs) и низкий ( Поделиться |
Читайте также:

