Теория прогрессии лейкозов воробьев
1. Острый миелобластный (спонтанный и индуцированный).
2. Острый миеломонобластный (основная форма и псевдопромиелоцитарный вариант).
3. Острый монобластный.
4. Острый промиелоцитарный (макрогранулярный, микрогранулярный вариант).
5. Острый эритромиелоз (острый эритролейкоз, эритромиелоз, эритромегакариобластный).
6. Острый мегакариобластный (основная форма и вариант с миелофиброзом).
8. Острый лимфобластный лейкоз детей (ни Т-, ни В-форма, Т-форма, пре-Т-форма, В-форма, пре-В-форма, ни Т- ни В-форма с Ph' -хромосомой).
9. Острый лимфобластный лейкоз взрослых (формы те же, что и у детей).
10. Острый плазмобластный.
11. Острый макрофагальный.
12. Острый недифференцируемый.
13. Острый неклассифицируемый.
Хронические лейкозы
1. Хронический миелолейкоз (вариант с Ph'-хромосомой и без Ph'-хромосомы).
2. Сублейкемический миелоз (собственно сублейкемический миелоз, миелофиброз, остеомиелосклероз).
3. Хронический эритромиелоз (собственно хронический эритромиелоз, хронический эритромиелоз с миелофиброзом - форма Ваган).
5. Хронический мегакариоцитарный лейкоз.
6. Хронический моноцитарный (миеломоноцитарный) лейкоз.
7. Хронический лимфолейкоз.
8. Хронический тучно-клеточный лейкоз.
9. Лимфоматоз кожи (болезнь Сезари).
10. Волосатоклеточный лейкоз.
11. Парапротеинемические гемобластозы:
- Болезнь тяжелых цепей.
- Болезнь легких цепей.
Выделяют начальную стадию заболевания, развернутую и терминальную.
ОСТРЫЕ ЛЕЙКОЗЫ
(Leucosis acuta)
Острыми лейкозами называют опухоли кроветворной системы, морфологическим субстратом которых являются молодые, так называемые бластные, клетки. Эти клетки обладают свойствами безудержной пролиферации, но утрачивают способность дифференцироваться в зрелые формы.
Этиология. Известно 5 групп основных этиологических факторов, способных вызвать острый лейкоз.
1. Ионизирующая радиация.
2. Воздействие химических мутагенов (бензол; цитостатические препараты - азатиоприн, хлорбутин, миелосан; медикаменты, обладающие миелотоксическим действием - левомицетин, бутадион).
3. Вирусы (Эпштейна-Барр, HTLV-1), способные вызвать повышенную пролиферацию лимфатических клеток, в условиях чего значительно повышается вероятность опухолевой мутации.
4. Наследственные факторы. Острый лейкоз чаще возникает у лиц с наследственными хромосомными аномалиями.
5. Иммунные нарушения (наследственные и приобретенные).
Патогенез. Большинство указанных факторов вызывает увеличение частоты мутаций кроветворных клеток, во время которых возможно появление злокачественной клетки, способной стать родоначальницей опухолевого клона. В здоровом организме каждая мутированная клетка (в том числе и опухолевая) уничтожается иммунной системой. В случае дефектности последней опухолевая клетка, пролиферируя, создает опухолевый клон. Происходит постепенное увеличение опухолевой массы до определенного предела, после которого начинается вытеснение нормальных ростков кроветворения и возникает клинико-морфологическая картина острого лейкоза.
Классификация. Существует 13 форм острого лейкоза, название которых происходит от названий тех клеток, из которых возникла опухолевая клетка (см. гемобластозы).
Клиника. Начало заболевания может быть различным, но чаще заподозрить острый лейкоз позволяет появление тяжелых, трудно поддающихся лечению воспалительных процессов ротовой полости (язвенно-некротическая ангина, стоматит), кишечника (энтеропатия, парапроктит), верхних дыхательных путей, геморрагического синдрома, рефрактерной к лечению анемии. В дальнейшем клиническая картина складывается из сочетания пяти основных синдромов - интоксикационного, анемического, геморрагического, гиперпластического, инфекционных осложнений.
Интоксикационный синдром обусловлен повышенным распадом лейкозных клеток. Проявляется общей слабостью, потливостью, недомоганием, повышением температуры до субфебрильных цифр.
Анемический синдром обусловлен вытеснением бластными клетками красного ростка костного мозга. Проявляется бледностью кожных покровов и слизистых оболочек, одышкой при физической нагрузке, потемнением в глазах, тахикардией, снижением содержания гемоглобина ниже 115 г/л и эритроцитов менее 3,7´10 12 /л в периферической крови.
Геморрагический синдром обусловлен вытеснением бластными клетками мегакариоцитарного ростка костного мозга. Проявляется спонтанными петехиальными кровоизлияниями на коже, появлением синяков, кровоточивостью слизистых оболочек (носовые, маточные, желудочно-кишечные кровотечения), снижением количества тромбоцитов в периферической крови (менее 40‰ или 180´10 9 /л), увеличением времени кровотечения по Дьюку более 4 минут и снижением ретракции кровяного сгустка (менее 40%).
Гиперпластический синдром обусловлен распространением лейкозных клеток по кроветворной системе и имплантацией их с последующей локальной пролиферацией в различных органах и тканях. Наиболее часто поражается нервная система (нейролейкемия), печень, селезенка (гепатоспленомегалия), кожа (лейкемиды кожи), яички, десны, реже - почки, миокард, легкие.
В периферической крови при остром лейкозе может быть два типа изменений: а) панцитопения без бластных клеток (так называемая алейкемическая фаза острого лейкоза); б) панцитопения в сочетании с бластными клетками (лейкемическая фаза). Реже наблюдается гиперлейкоцитоз в сочетании с бластемией, анемией и тромбоцитопенией.
В костном мозге обнаруживается значительное увеличение процента бластных клеток (до 60-80 и более) при отсутствии увеличения промежуточных форм.
В течение заболевания выделяют 3 стадии - начальную, развернутую и терминальную. Для начальной стадии характерно наличие гематологических признаков острого лейкоза без каких-либо клинических проявлений. Развернутая стадия характеризуется присоединением клинических симптомов болезни, терминальная - неэффективностью терапии и резким угнетением нормальных ростков кроветворения.
Диагностика. Окончательный диагноз острого лейкоза устанавливается только при обнаружении повышенного количества не способных к дифференцировке бластных клеток в костном мозге.
Отнести острый лейкоз к той или иной форме можно только с помощью цитохимического исследования обнаруженных бластных клеток (проведение реакции на пероксидазу, липиды, кислую фосфотазу, гликоген, a-нафтилэстеразу, хлорацетатэстеразу, кислые мукополисахариды).
Если в костном мозге имеется менее 30% бластных клеток - говорят о малопроцентной форме острого лейкоза.
Лечение. Основные принципы терапии острого лейкоза следующие:
2. По разным программам лечится острый лимфобластный лейкоз и недифференцированный лейкоз, с одной стороны, и все нелимфобластные - с другой.
3. Цитостатическое лечение всех острых лейкозов должно начинаться сразу же после установления диагноза. Исключение составляет только малопроцентная форма (цитостатические препараты не назначаются до тех пор, пока содержание бластных клеток в костном мозге не превысит 30%) и острый эритромиелоз.
4. Все программы предусматривают этапность лечения - индукция ремиссии, консолидация ремиссии, поддерживающая терапия в период ремиссии, лечение рецидива, профилактика и лечение нейролейкемии.
5. Во время проведения терапии должны соблюдаться следующие условия, позволяющие предотвратить осложнения:
а) анализ крови должен проводиться не реже 1 раза в 3-4 дня;
б) при снижении числа лейкоцитов крови до 2,0´10 9 /л доза цитостатических препаратов (за исключением винкристина) должна быть уменьшена вдвое. При снижении лейкоцитов менее 1,0´10 9 /л, а также при появлении высокой лихорадки (39°С и выше), язвенно-некротического стоматита, диареи цитостатические препараты должны быть отменены;
в) если при лечении винкристином появляется полиневрит - этот препарат должен быть отменен или заменен винбластином;
г) при исходном низком уровне лейкоцитов (менее 2,0´10 9 /л) и тромбоцитов (менее 50,0´10 9 /л) - доза цитостатических препаратов сразу должна быть уменьшена наполовину.
Лечение острого лимфобластного и недифференцированного лейкозов. Основными препаратами одной из программ индукции ремиссии этих лейкозов являются винкристин, рубомицин, преднизолон. Лечение указанными препаратами (PVR) проводится в течение 4 недель. При этом винкристин назначают по 1,5 мг/м 2 1 раз в 7 дней в/в, рубомицин по 60 мг/м 2 2 дня подряд на 2-й неделе терапии (11 и 12 дни), преднизолон по 40 мг/м 2 в день внутрь с 1 по 28 день.
После наступления ремиссии (признаками которой являются содержание бластных клеток в костном мозге менее 5%, уровень лейкоцитов в периферической крови не менее 1,5´10 9 /л и тромбоцитов не менее 100´10 9 /л и отсутствие внекостномозговых пролифератов) переходят на поддерживающую терапию - 6-меркаптопурином, метотрексатом и циклофосфаном (ММЦ). Меркаптопурин назначается по 50 мг/м 2 внутрь ежедневно, метотрексат по 20 мг/м 2 внутрь на 6-й день недели, циклофосфан по 200 мг/м 2 внутрь на 7-й день недели. Каждые 1,5-2 месяца в период непрерывной поддерживающей терапии этими препаратами назначается курс СОАР (циклофосфан 150 мг/м 2 в/в с 1 по 4-й день, винкристин 2 мг в 1-й день в/в, цитозар 150 мг/м 2 с 1 по 4-й день в/в капельно, преднизолон 60 мг/м 2 внутрь с 1 по 4-й день). Во время проведения курса СОАР и в течение последующей недели комбинацию ММЦ не проводят, затем в течение недели ее проводят в половинной дозе, затем - в полной до следующего курса СОАР. При возникновении рецидива вновь возвращаются к схеме PVR либо назначают комбинации СОАР, POMP, СОР, L-аспарагиназу. При достижении ремиссии после рецидива проводят поддерживающую терапию по программе, с помощью которой достигнута ремиссия, но перерывы между курсами увеличивают до 2-3 недель.
Профилактика нейролейкемии осуществляется путем 5-кратного эндолюмбального введения (с интервалом в 3-4 дня) метотрексата (12,5 мг/м 2 ) и цитозара (5, 15, 30, 30, 30 мг) в сочетании с назначением внутрь меркаптопурина (25 мг/м 2 ежедневно) и циклофосфана (100 мг/м 2 1 раз в неделю) в течение всего периода профилактики нейролейкемии. С целью профилактики нейролейкоза применяют облучение головы и шеи гамма-лучами в общей дозе 24 Гр.
Лечение нейролейкемии также проводится с помощью эндолюмбального введения метотрексата и цитозара, но количество введений увеличивается до появления трехкратно нормального цитологического состава спинномозговой жидкости.
Более современная программа предусматривает добавление к схеме PVR L-аспарагиназы, а также удлинение до 8 недель и двухфазность периодов индукции и консолидации ремиссии.
Лечение острых нелимфобластных лейкозов.
Основными препаратами для лечения этих лейкозов являются цитозар и рубомицин. Программа предусматривает в качестве индукции ремиссии проведение 2-х курсов "7+3" с интервалом в 14 дней. В этих схемах цитозар назначается по 100 мг/м 2 2 раза в день (с интервалом 12 часов) в/в в течение 7 дней и рубомицин по 45 мг/м 2 в сутки в/в 1 раз в день в 1, 2, 3-й дни курса. Консолидация ремиссии проводится двумя курсами "7+3".
Поддерживающая терапия состоит из ежемесячных 5-дневных курсов цитозара, вводимого п/к 2 раза в день по 100 мг на каждое введение в сочетании с тиогуанином (по 100 мг/м 2 внутрь 2 раза в день с интервалом в 12 часов) или с циклофосфаном (1000 мг/м 2 в/в в 1-й день курса), или с рубомицином (в 1-й и 2-й день курса по 45 мг/м 2 в/в).
При возникновении рецидива, а также для лечения резистентных форм используют высокие дозы цитозара (3 г/м 2 каждые 12 часов в/в в течение 4-6 дней) изолированно или в сочетании в L-аспарагиназой, высокими дозами рубомицина или препаратами нового поколения - амсакрином, вепезидом (этопозидом), идарубицином, митоксантроном.
Малопроцентная форма острого лейкоза лечится глюкокортикостероидами (20 мг/сутки), трансфузиями эритромассы.
При остром эритромиелозе назначают переливание эритромассы и лишь в терминальной стадии - цитостатики (малые дозы цитозара, VAMP-терапия).
Острый промиелоцитарньш лейкоз, кроме программной цитостатической терапии требует лечения ДВС-синдрома (введение свежей или антигемофильной плазмы, антиферментных препаратов, гепарина). При данной форме острого лейкоза в лечении используют препараты витамина А (ретиноин), способствующие дифференцировке и созреванию опухолевых клеток.
Помимо цитостатической терапии лечение острых лейкозов предусматривает заместительную терапию компонентами крови (эритроцитарной и тромбоцитарной массой); активную и пассивную иммунокоррегирующую терапию, дезинтоксикацию, борьбу с инфекционными осложнениями, а также с осложнениями цитостатической терапии (миелодепрессией, энтеропатией, токсическим гепатитом).
Прогноз. При правильном лечении выздоровление (отсутствие рецидива в течение 5 лет поддерживающей терапии) наступает у 50% взрослых больных острым лимфобластным лейкозом и у 30% больных миелобластным лейкозом.
ХРОНИЧЕСКИЕ ЛЕЙКОЗЫ
ХРОНИЧЕСКИЙ МИЕЛОЛЕЙКОЗ
(Myeloleucosis chronica)
Хронический миелолейкоз - опухоль, возникающая в результате соматической мутации одной из клеток - предшественниц миелопоэза.
Начало заболевания в большинстве случаев бессимптомно, в связи с этим врач встречается с больным, когда заболевание находится в стадии развернутого клинического течения. Первым симптомом заболевания является нейтрофильный лейкоцитоз со сдвигом до миелоцитов и промиелоцитов. Жалобы на слабость, боли в левом подреберье, потливость появляются с нарастанием лейкоцитоза более 20-30´10 9 /л. Иногда первым симптомом заболевания является тяжесть в левом подреберье, обусловленная спленомегалией, которая встречается в начале болезни у 85% больных.
Гематологическая картина болезни характеризуется лейкоцитозом, сочетающимся с характерными изменениями в лейкоцитарной формуле: появлением незрелых гранулоцитов (промиелоцитов, миелоцитов, метамиелоцитов, а иногда и бластных клеток), базофилией, нередко эозинофилией, что получило название эозинофильно-базофильной ассоциации. Как правило, наблюдается тромбоцитоз. Содержание гемоглобина и эритроцитов в начале заболевания существенно не меняется, однако у некоторых больных заболевание начинается с эритроцитоза (эритремическая фаза хронического миелолейкоза). В отдельных случаях встречаются анемия и тромбоцитопения.
Костный мозг богат клеточными элементами в основном за счет незрелых форм гранулоцитов. В трепанате отмечается почти полное вытеснение жира преимущественно гранулоцитарными клетками и рассасывание костной ткани. При кариологическом исследовании почти во всех клетках костного мозга - гранулоцитах, моноцитах, эритрокариоцитах и мегакариоцитах, за исключением лимфоцитов, - обнаруживается филадельфийская хромосома (транслокация фрагмента 22 пары хромосомы на 9 пару). В нейтрофилах резко снижена активность щелочной фосфатазы. В сыворотке крови значительно увеличено содержание витамина В12 и гистамина.
Заболевание в своем развитии проходит две стадии - моноклоновую (стадия развернутого клинического течения) и поликлоновую (терминальная стадия). Если в стадию развернутого клинического течения состояние больного зависит от объема патологического кроветворения, то в терминальной стадии этого не наблюдается. Клинически терминальная стадия проявляется ухудшением состояния больного и появлением новых симптомов: прогрессивным увеличением селезенки и печени, возникновением лейкемидов в коже, увеличением лимфатических узлов, присоединением инфекции. Важнейшим и ранним признаком терминальной стадии и приближающегося бластного криза является развитие рефрактерности к миелосану.
Терминальная стадия меняет всю гематологическую картину болезни. Наиболее характерным для этой стадии заболевания является бластный криз - быстрое нарастание количества бластных клеток в крови и костном мозге. Нередко бластному кризу предшествуют своеобразные изменения в лейкоцитарной формуле в виде относительного уменьшения сегментоядерных и палочкоядерных нейтрофилов при увеличении количества миелоцитов, промиелоцитов и бластных клеток, составляющих небольшое количество по отношению к другим форменным элементам. В этот период заболевания могут наблюдаться лейкопения, анемия и тромбоцитопения.
Лечение.В настоящее время считается, что больные хроническим миелолейкозом в стадии развернутого клинического течения должны лечиться амбулаторно. Показанием для госпитализации являются нарушение соматической компенсации больного, присоединение инфекционных осложнений, необходимость гемотрансфузионной терапии, неэффективность амбулаторной терапии. Основными средствами лечения являются миелосан, миелобромол, гидроксимочевина.
Лечение назначается сразу после установления диагноза (первично-сдерживающая терапия). При первично-сдерживающей терапии миелосан назначается 1-3 раза в неделю в зависимости от величины лейкоцитоза. При лейкоцитозе 15-20´10 9 /л достаточно 2-4 мг в неделю, при лейкоцитозе 25-30´10 9 /л - 6 мг, при лейкоцитозе 35-40´10 9 /л назначают 2-4 мг миелосана ежедневно. Однако необходимо помнить о возможной повышенной индивидуальной чувствительности к этому препарату.
В тех случаях, когда в момент установления диагноза имеются выраженные клинико-гематологические проявления, назначается курсовая терапия миелосаном. В этом случае миелосан назначают ежедневно. Ориентировочно при высоте лейкоцитоза 60-80´10 9 /л назначают 4 мг в день. Доза миелосана более 8 мг в день не назначается из-за возможных осложнений (аплазия костного мозга). Непременным условием миелосанотерапии является уменьшение дозы препарата в два раза при снижении лейкоцитоза вдвое и отмена лечения, а затем переход на поддерживающую терапию при лейкоцитозе 15-20´10 9 /л. Необходимо также помнить, что в первые 2-3 недели лечения количество лейкоцитов в крови возрастает, состав клеток омолаживается, а затем наступает снижение лейкоцитов. Этот феномен является показателем эффективности терапии.
Наряду с миелосаном в терапии развернутой стадии миелолейкоза применяется миелобромол, который обычно назначается в дозе 250 мг в день. При неэффективности монохимиотерапии назначают сочетания препаратов с 6-меркаптопурином, метотрексатом.
После получения терапевтического эффекта переходят на поддерживающую терапию, которая проводится так же, как первично-сдерживающая.
Гидроксимочевину назначают при исходном количестве лейкоцитов 100-150´10 9 /л по 50 мг/кг ежедневно под контролем уровня лейкоцитов. Поддерживающая доза 10-20 мг/кг ежедневно.
В терминальную стадию заболевания назначается полихимиотерапия по схемам лечения острых лейкозов.
Экспертиза трудоспособности. Решение вопроса о трудоспособности должно проводиться строго индивидуально с учетом условий труда, психоэмоциональных нагрузок, профессии больного. Неоправданно раннее направление во МСЭК наносит тяжелую психическую травму, особенно лицам молодого возраста. При невозможности выполнять работу по специальности необходимо ставить вопрос о трудоустройстве.
- Аспиранту
- Ординатору
- Врачу
- Пациенту
- Донору
- Контакты
- Аспиранту
- Ординатору
- Врачу
- Пациенту
- Донору
- Контакты





- Главная >
- К 90-летию А. И. Воробьёва
К 90-летию А. И. Воробьёва
1 ноября 2018 года исполнилось 90 лет Врачу с большой буквы, выдающемуся ученому, талантливому организатору здравоохранения Андрею Ивановичу Воробьёву.
Школа Андрея Ивановича Воробьёва — это десятки настоящих учёных, учеников, это сотни новых открытий и многие тысячи спасённых жизней.
Научный коллектив под руководством Андрея Ивановича внес принципиальный вклад в развитие современной гематологии как в клиническом плане, так и в фундаментальном и экспериментальном отношениях.
В 1964 г. А. И. Воробьёв выдвинул оригинальную теорию опухолевой прогрессии лейкозов, опирающаюся на явление повышенной мутабельности опухолевых клеток, появление субклонов в ранее моноклональной опухоли. Вместо бытовавшего ранее описательного подхода к опухолевому росту выявлены универсальные закономерности развития злокачественных опухолей с учетом морфологических, функциональных, цитогенетических и клинических признаков опухолевого роста.
Вместе с Таисией Владимировной Шишковой А. И. Воробьёв описал дисгормональную кардиопатию — особую форму поражения сердца, расценивавшуюся ранее как инфаркт миокарда.
Одним из направлений работы школы А. И. Воробьёва явилось изучение радиационной патологии. Им было дано классическое описание патогенеза лучевой болезни, создана единственная в мире комплексная система биологической дозиметрии, включающая анализ кинетики клеточных популяций, анализ хромосомных перестроек и морфологических изменений тканей. Это привело к разработке теоретических основ патогенетической интенсивной терапии в лучевой патологии, гематологии и других состояниях, характеризующихся массивным распадом тканей. Незаменимость такой терапии в условиях массовых радиационных поражений особенно наглядно подтверждена при ликвидации последствий аварии на Чернобыльской АЭС в 1986 году. Применение её в условиях массового радиационного поражения позволило провести точную диагностику и сортировку пострадавших, обеспечив тем самым раннюю и адекватную терапию. Работы по изучению последствий Чернобыльской катастрофы доказали пороговость онкогенного воздействия радиации малой мощности.
В работах А. И. Воробьёва и его школы разработана уточненная классификация опухолей лимфатической системы, учитывающая органоспецифичность, морфологию и чувствительность к цитостатическим препаратам. Основанные на ней программы терапии позволили достигнуть выдающихся успехов в лечении ряда лимфатических опухолей.
А. И. Воробьёв развил в Гематологическом научном центре РАМН (до 1987 г. — Центральный институт переливания крови МЗ СССР) ряд новых научных направлений и значительно расширил его клинику, где сегодня на высшем уровне осуществляется лечение широчайшего круга гематологических заболеваний, включая трансплантацию гемопоэтических стволовых клеток крови, трансплантацию почки и терапию критических состояний.
Под руководством Андрея Ивановича сотрудники ГНЦ РАМН принимали участие в оказании помощи пострадавшим практически во всех техногенных и природных катастрофах последних десятилетий: армянское (1988 г.) и сахалинское (1994 г.) землетрясения, чернобыльская авария, взрывы на железной дороге, Беслан. Воробьёв разработал современные методы лечения ДВС и краш-синдрома, сформулировал принципы оказания медицинской помощи в условиях катастроф.
Работа Андрея Ивановича Воробьёва неразрывно связана с преподаванием не только гематологии, но и кардиологии, трансфузиологии, морфологии, дифференциальной диагностики и интенсивной терапии критических состояний.
Важнейшими чертами врача Воробьёв считает сосредоточенность на пациенте, способность выделить главное и действовать немедленно, а главным недостатком — упрямство. Он всегда готов признать свою ошибку и решительно перестраивает диагноз и стратегию, если появляются новые факты или новое понимание.
Андрей Иванович Воробьёв, будучи первым Министром здравоохранения Российской Федерации (1991—1992 гг.), приложил максимум усилий для сохранения и развития здравоохранения после развала СССР. На этом посту он боролся за сохранение лучших черт отечественной системы здравоохранения. Ему принадлежит инициатива Указа Президента (сентябрь 1992г.) о финансировании дорогостоящих видов лечения, который спас медицину от деградации, и до сего дня поддерживает существование бесплатных для населения, высококвалифицированных медицинских услуг.
Глубокоуважаемый Андрей Иванович, дальнейших творческих Вам успехов, здоровья и долгих лет жизни!
В настоящее время доказан основной моноклоновый механизм развития того или иного лейкоза. Это подтверждают следующие данные:
- наличие одинаковых структурных изменений в хромосомах всех лейкозных клеток у одного больного;
- наличие однотипных поверхностных и цитоплазматических антигенов в опухолевых клетках;
- способность лейкозных клеток синтезировать иммуноглобулины одного типа.
Установлено, что трансформации нормальной кроветворной клетки в лейкозную (опухолевую) способствует подавление иммунной системы, а главным образом — снижение активности антимутационных (антитрансформационных) механизмов противоопухолевой защиты.
В патогенезе лейкозов и других видов гемобластозов важное место занимает процесс опухолевой прогрессии. Впервые концепция опухолевой прогрессии применительно к опухолям молочной железы мышей была сформулирована Фулдсом в 1949 г., а применительно к лейкозам — А.И. Воробьёвым в 1965 г.
В настоящее время обнаружен не только моноклоновый, но и поликлоновый механизм развития повторных мутаций в опухолевых клетках, приводящий к развитию мутантных клонов-субклонов.
В развитии лейкозов, как и других видов гемобластозов, выявлены следующие закономерности опухолевой прогрессии: атипизм роста, атипизм обмена, атипизм структуры и атипизм функций опухолевых клеток. В частности, доказано наличие таких событий:
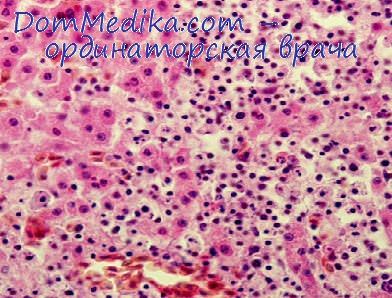
- последовательное развитие двух стадий образования опухолевых клеток: моноклоновой (доброкачественной) и поликлоновой (злокачественной); увеличение количества незрелых и бластных опухолевых клеток в крови;
- закономерная замена дифференцированных клеток в хронически протекающих лейкозных опухолях на бластные клетки;
- потеря способности лимфоидных и плазматических опухолевых структур секретировать соответствующие иммуноглобулины;
- прогрессирующее угнетение нормальных ростков кроветворения;
- частый переход алейкемической формы в лейкемическую;
- потеря опухолевыми клетками морфологической, биохимической и цитохимической идентифицируемости;
- изменение формы и размера ядра опухолевых клеток (замена округлой формы на неправильную форму с увеличением размера);
- способность внекостномозговых опухолей метастазировать в костный мозг;
- связь появления метастазов вне органов кроветворения с появлением нового клона опухолевых клеток;
- возможность появления и нарастания резистентности кроветворной опухоли к антибластному лечению, в том числе в процессе проведения цитостатической терапии.
Следует отметить, что каждый этап прогрессии лейкоза (как и других гемобластозов) представляет собой качественное изменение кроветворных клеток. Можно заключить, что опухолевая прогрессия — именно качественное изменение в метаболизме, структуре и функциях бластных клеток, возникающее в результате повышенной изменчивости и трансформации их генетического аппарата и приводящее к развитию сначала моноклоновости, затем — поликлоновости и в заключение — к отбору и сохранению наиболее автономных субклонов.
Если на протяжении длительного времени опухолевого роста отсутствуют свойства опухолевой прогрессии, то такой лейкоз именуют доброкачественным (хроническим), а если выявляют закономерности опухолевой прогрессии, то такой лейкоз относят к злокачественным опухолям кроветворной системы.
В патогенезе лейкозов (как и других гемобластозов) большое значение имеет не только развитие и прогрессирование опухолевой кроветворной ткани, но и угнетение нормального (эритроидного, миелоидного, тромбоцитарного) кроветворения, механизмы которого обусловлены такими причинами:
- «постепенное вытеснение нормального микроокружения и сдавление нормальных кроветворных клеток быстро размножающимися и растущими опухолевыми клетками и соединительнотканными структурами;
- большая способность опухолевых клеток синтезировать колониестимулирующие факторы, а также более активно отвечать на ростовые факторы;
- большая способность опухолевых клеток к использованию питательного материала;
- большая устойчивость опухолевых клеток к гипоксии и недо-окисленным продуктам.
Патогенез лейкоза.

Шатохин Юрий Васильевич — заведующий отделением, доктор медицинских наук, профессор, врач высшей категории.

Снежко Ирина Викторовна — кандидат медицинских наук, врач-гематолог высшей категории, доцент кафедры.

Турбеева Елизавета Андреевна — редактор страницы.

Патогенез лейкоза.
По современным представлениям, лейкоз — это опухоль. В основе его лежит первичная патология клеток кроветворения, сопровождающаяся нарушением процессов их пролиферации и дифференциации и возникновением клонов опухолевых (лейкозных) клеток.
Прогрессивная пролиферация этих клеток приводит к поражению как облигатного, так и факультативных органов кроветворения и уменьшению плацдарма нормального гемопоэза.
Источником опухолевого роста являются ближайшие потомки стволовой клетки, ограниченно полипотентные или унипотентные клетки — предшественницы кроветворения. В настоящее время- подтверждена роль мутации и определены признаки клоновости патологических клеток при лейкозах: первичная мутация возникает только в одной из родоначальных клеток кроветворения.
При этом клетка утрачивает способность к нормальному созреванию и дифференциации. Возникает клон патологических клеток с нестабильным генетическим аппаратом, способных к бластной трансформации и живущих по законам опухолевой прогрессии (А. И. Воробьев, 1965, 1968; А. И. Воробьев, М. Д. Бриллиант, 1973, 1976; Руководство по гематологии, 1979).
Начало учению о развитии лейкозного процесса, т. е. об опухолевой прогрессии при лейкозах, положено А. И. Воробьевым в 1965 г. К настоящему времени это учение разработано применительно ко всем формам лейкоза с соответствующими патогенетическими методами их терапии (А. И. Воробьев, 1965, 1968; А. И. Воробьев, М. Д. Бриллиант, 1976). Для этой группы опухолей определены характерные этапы развития, составляющие суть их прогрессии.
1. Угнетение нормальных ростков кроветворения, в первую очередь того, из которого развился лейкоз. Данный этап развития лейкозов практически обязателен, хотя при хронических лейкозах это угнетение имеет место в терминальной стадии заболевания.
2. Наступление властного криза, смена дифференцированных клеток властными, молодыми с нежным структурным ядром. Это неотъемлемое свойство прогрессии лейкозов.
3. Утрата ферментной специфичности — общее свойство бластных клеток при острых лейкозах и бластных кризах. Клетки становятся морфологически и цитохимически недифференцируемыми по принадлежности к тому или иному ряду кроветворения.
4. Изменение ядра и цитоплазмы лейкозных бластных клеток: вместо круглых появляются неправильной формы и увеличенные ядро и цитоплазма.
5. Рост лейкозных клеток вне органов гемопоэза: пролифераты из лейкозных клеток появляются в коже, почках, мозговых оболочках и т. п. В различных органах пролифераты не равноценны, они представляют разные этапы прогрессии.
6. Скачкообразный или постепенный уход опухоли из-под контроля цитостатического воздействия — химического, лучевого, гормонального.
7. Нарастание процесса: бластные элементы выходят в кровь, лейкопения переходит в лейкоцитоз.
Этапы прогрессии — это есть и этапы злокачественности лейкоза. В основе опухолевой прогрессии, как полагает автор, лежит нестабильность генетического аппарата опухолевых клеток, которым свойствен переход из неактивного состояния в активное (феномен разрепрессирования генов).
Лейкоз может последовательно проходить все этапы прогрессии, но может быть и так, что первые признаки болезни застают процесс уже на конечном этапе, и тогда цитостатическис методы терапии оказываются неэффективными.
Настоящая классификация развития лейкозного процесса имеет большое практическое значение, ибо смысл ее заключается в поисках цитостатических препаратов, адекватных каждому этапу злокачественности (А. И. Воробьев, М. Д. Бриллиант, 1976).
Читайте также:

