Сульфат меди реагирует с хлором
Задание 6.1
Из предложенного перечня выберите два вещества, с каждым из которых железо реагирует без нагревания.
1) хлорид кальция (р-р)
2) сульфат меди (II) (р-р)
3) концентрированная азотная кислота
4) разбавленная соляная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Источник - Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Железо будет реагировать с раствором сульфата меди (II). Данная реакция обусловлена тем, что железо в ряду активностей металлов (в электрохимическом ряду напряжений) стоит левее меди (следовательно, железо активнее меди). В связи с этим железо способно вытеснять медь из ее соли:
Fe + CuSO4 = FeSO4 + Cu
В случае хлорида кальция железо реагировать не будет, так как кальций находится в указанном ряду левее железа, следовательно, является более активным металлом.
Также железо реагирует без нагревания с разбавленной соляной кислотой с образованием хлорида железа (II):
Fe + 2HCl = FeCl2 + H2↑ (без доступа воздуха).
Также напомним, что в концентрированной азотной кислоте железо пассивируется.
Ответ: 24
Задание 6.2
Из предложенного перечня выберите два вещества, с каждым из которых реагирует углерод.
1) оксид свинца (IV)
2) сульфат меди (II) (р-р)
3) разбавленная соляная кислота
4) концентрированная серная кислота
5) хлорид хрома (III) (р-р)
Запишите в поле ответа номера выбранных веществ.
Углерод будет восстанавливать оксид свинца (IV):
2C + PbO2 = Pb + 2CO
Углерод будет взаимодействовать с концентрированной серной кислотой при нагревании:
C + 2H2SO4 (конц.) = CO2↑ + 2SO2↑ + 2H2O
Ответ: 14
Задание 6.3
Из предложенного перечня выберите два вещества, с каждым из которых реагирует медь.
1) гидроксид калия (р-р)
2) хлор
3) сульфат цинка (р-р)
4) хлорид натрия (р-р)
5) нитрат серебра (р-р)
Запишите в поле ответа номера выбранных веществ.
Медь будет реагировать с хлором:
Cu + Cl2 = CuCl2
Медь будет реагировать с раствором нитрата серебра, так как медь находится в ряду активности металлов левее серебра, следовательно, является более активным металлом:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Ответ: 25
Задание 6.4
Из предложенного перечня выберите два вещества, с каждым из которых алюминий реагирует без нагревания.
1) сера
2) нитрат меди (II) (р-р)
3) хлорид калия (р-р)
4) концентрированная серная кислота
5) разбавленная соляная кислота
Запишите в поле ответа номера выбранных веществ.
Алюминий будет реагировать с раствором нитрата меди (II), так как алюминий находится в ряду активностей металлов (в электрохимическом ряду напряжений) левее меди, следовательно, является более активным металлом и способен вытеснять медь из ее соли:
2Al + 3Cu(NO3)2 = 2Al(NO3)3 + 3Cu
Алюминий также реагирует без нагревания с разбавленной соляной кислотой с образованием хлорида алюминия:
2Al + 6HCl = 2AlCl3 + 3H2↑.
Для реакций с серой и концентрированной серной кислотой требуется нагревание.
С хлоридом калия алюминий реагировать не будет.
Ответ: 25
Задание 6.5
Из предложенного перечня выберите два вещества, с каждым из которых реагирует кремний.
1) бром
2) хлорид калия (р-р)
3) оксид магния
4) концентрированная азотная кислота
5) сульфат меди (II) (р-р)
Запишите в поле ответа номера выбранных веществ.
Кремний, проявляя восстановительные свойства, реагирует с бромом:
Si + 2Br2 = SiBr4
Кремний, являясь восстановителем, также взаимодействует с оксидом магния:
Si + 2MgO = SiO2 + 2Mg
Ответ: 13
Задание 6.6
Из предложенного перечня выберите два вещества, с каждым из которых реагирует хлор.
1) вода
2) концентрированная серная кислота
3) кислород
4) иодид натрия
5) фторид калия
Запишите в поле ответа номера выбранных веществ.
Хлор взаимодействует с водой:
Cl2 + H2O ⇔ HCl + HClO
Хлор реагирует с иодидом натрия, так как окислительная способность хлора выше окислительной способности иода:
Cl2 + 2NaI = 2NaCl + I2
Ответ: 14
Задание 6.7
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует кальций.
1) гидроксид калия
2) серная кислота
3) вода
4) хлорид калия
5) карбонат кальция
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Кальций реагирует с серной кислотой:
Ca + H2SO4 = CaSO4 + H2↑
Кальций взаимодействует с водой:
Ca + 2H2O = Ca(OH)2↓ + H2↑
Ответ: 23
Задание 6.8
Из предложенного перечня выберите два вещества, которые реагируют с оксидом цинка.
1) вода
2) оксид азота (II)
3) гидроксид натрия
4) оксид серы (VI)
5) сульфат калия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Оксид цинка ZnO взаимодействует с гидроксидом натрия:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Оксид цинка ZnO реагирует с оксидом серы (VI):
ZnO + SO3 = ZnSO4
Ответ: 34
Задание 6.9
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует водород.
1) оксид железа (III)
2) серная кислота
3) хлорид кальция
4) азот
5) гидроксид натрия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Водород взаимодействует с оксидом железа (III):
3H2 + Fe2O3 = 2Fe + 3H2O
Водород реагирует с азотом:
3H2 + N2 = 2NH3
Ответ: 14
Задание 6.10
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует кальций.
1) метан
2) вода
3) оксид калия
4) сера
5) сульфат натрия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Кальций взаимодействует с водой:
Ca + 2H2O = Ca(OH)2↓ + H2↑
Кальций реагирует с серой:
Ca + S = CaS
Ответ: 24
Задание 6.11
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует азот.
1) литий
2) водород
3) вода
4) соляная кислота
5) хлорид калия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Азот взаимодействует с литием с образованием нитрида лития:
N2 + 6Li = 2Li3N
Азот реагирует с водородом:
N2 + 3H2 = 2NH3
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
На приведенном рисунке
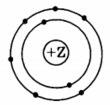
изображена модель атома
В подгруппах Периодической системы с увеличением заряда ядра атомов происходит
1) усиление неметаллических свойств элементов
2) уменьшение числа протонов в ядре
3) увеличение радиуса атомов
4) увеличение электроотрицательности
Ковалентная неполярная связь реализуется в
1) молекуле оксида углерода(IV)
3) кристаллическом льде
Степень окисления +4, а валентность IV атом углерода проявляет в соединении
В перечне веществ:
к солям относятся:
Если в бесцветный раствор хлорида ртути(II) поместить кусочек меди красного цвета, то произойдет реакция:
К сильным электролитам относится каждое из двух веществ
Практически полностью в водном растворе взаимодействуют вещества:
И кислород, и водород реагируют с
3) серной кислотой
Оксид углерода(IV) реагирует с каждым из двух веществ:
Среди веществ, формулы которых Fe, Сu, Mg, в реакцию с холодной концентрированной серной кислотой вступает(-ют)
В отличие от сульфата натрия сульфат меди реагирует с
1) гидроксидом магния
2) хлоридом бария
3) нитратом кальция
4) гидроксидом калия
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Метан образует взрывчатые смеси с воздухом.
Б. Растворять серную кислоту следует, добавляя к ней воду.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В уравнении окислительно-восстановительной реакции
коэффициент перед формулой окислителя равен
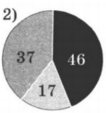
На какой диаграмме распределение массовых долей элементов соответствует составу нитрата калия?



При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
В ряду химических элементов О — S — Se
1) уменьшается радиус атомов
2) увеличивается значение высшей степени окисления
3) увеличивается сила кислот Н2Э
4) уменьшается электроотрицательность
5) увеличивается число внешних электронов
Метанол реагирует с
2) карбонатом натрия
4) гидроксидом меди(II)
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент второго столбца.
Установите соответствие между исходными веществами и продуктами реакции.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
1. Составлен электронный баланс.
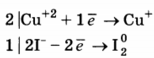
2. Расставлены коэффициенты в уравнении реакции:
3. Указано, что восстановителем является I - , а окислителем Сu +2 .
При растворении в разбавленной серной кислоты образца цинка, содержащего 4,5% нерастворимых примесей, выделилось 2,24 л (н.у.) водорода. Определите массу образца металла.
1) Уравнение реакции:
2) Рассчитываем количество вещества H2:
3) Рассчитываем массу Zn(чист.):
а) по уравнению реакции: n(Zn(чист.)) = n(H2) = 0,1 моль
б) M(Zn) = 65 г/моль, m(Zn(чист.)) = n*M = 0,1 моль * 65 г/моль = 6,5 г
4) Рассчитываем массовую долю (Zn(чист.)):
5) Рассчитываем массу образца металла:
Для проведения эксперимента предложены следующие реактивы: алюминий, карбонат натрия и растворы соляной кислоты, хлорида алюминия и гидроксида натрия. Вам также предоставлен комплект лабораторного оборудования, необходимый для проведения химических реакций.
Требуется получить гидроксид алюминия в результате проведения двух последовательных реакций. Выберите необходимые для этого реактивы из числа тех, которые вам предложены. Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для первой реакции составьте сокращённое ионное уравнение.
Составлена схема превращений, в результате которой можно получить гидроксид алюминия:
Составлены уравнения двух проведённых реакций
3) АlСl3 + 3NaOH = Аl(ОН)3 ↓ + 3NaCl

Верный ответ: 35.
Без нагревания хром реагирует с кислородом и раствором сульфата меди.
Cr + O2 → Cr2O3
Cr + CuSO4 → CrSO4 + Cu
С концентрированными серными и азотной кислотой происходит пассивирование: без нагревания реакция не идет. С водой хром реагирует только в раскаленном состоянии, с образованием гидроксида.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 157.

Верный ответ: 45.
Без нагревания алюминий реагирует с кислородом и хлором.
Al + O2 → Al2O3 (на воздухе алюминий покрывается оксидной пленкой).
Al + Cl2 → AlCl3
Без нагревания алюминий не взаимодействует со фтором, серой и азотом.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 192.

Верный ответ: 25.
Без нагревания хлор реагирует с активными металлами.
Cl2 + Li → LiCl
Cl2 + Ca → CaCl2
Хлор не способен вытеснить фтор из KF, поэтому данная реакция невозможна. С солью BaSO4 хлор также не способен прореагировать.
Платина реагирует с галогенами только при нагревании.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 228.

Верный ответ: 34.
H2S + O2 → SO2 + H2O
FeO + O2 → Fe2O3
Реакции с высшими оксидами (оксид кальция, оксид фосфора (V)) и гидроксидами для кислорода не характерны.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 764.

Верный ответ: 45.
И железо, и медь способны реагировать с концентрированной азотной кислотой (из-за пассивирования железо реагирует при нагревании).
Fe + HNO3(конц.) → (t) Fe(NO3)3 + NO2↑ + H2O
Cu + HNO3(конц.) → Cu(NO3)2 + NO2↑ + H2O
Как более активные металлы, железо и медь способны вытеснить менее активный, ртуть, из ее соли.
Cu + HgCl2 → CuCl2 + Hg
Fe + HgCl2 → FeCl2 + Hg
Медь не реагирует с разбавленной серной кислотой, однако с концентрированной реакция идет.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 765.

Верный ответ: 25.
Реакции с остальными реагентами невозможны.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 766.

Верный ответ: 35.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 767.

Верный ответ: 12.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 768.

Верный ответ: 25.
Na + H2O → NaOH + H2
Sr + H2O → Sr(OH)2 + H2
Серебро, углерод и медь с водой не взаимодействуют.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 769.

Верный ответ: 35.
P + O2 → P2O5 (при недостатке кислорода - P2O3)
P + Cl2 → PCl5 (при недостатке хлора - PCl3)
Фосфор практических не взаимодействует с водородом.
ЗАНЯТИЕ 10
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006
Окислительно-восстановительные реакции
План

1. Окислительно-восстановительные реакции (ОВР), степень окисления.
2. Процесс окисления, важнейшие восстановители.
3. Процесс восстановления, важнейшие окислители.
4. Окислительно-восстановительная двойственность.
5. Основные типы ОВР (межмолекулярные, внутримолекулярные, диспропорционирование).
7. Методы составления уравнений ОВР (электронный и электронно-ионный баланс).
Все химические реакции по признаку изменения степеней окисления участвующих в них атомов можно разделить на два типа: ОВР (протекающие с изменением степеней окисления) и не ОВР.
Степень окисления – условный заряд атома в молекуле, рассчитанный, исходя из предположения, что в молекуле существуют только ионные связи.
П р а в и л а д л я о п р е д е л е н и я с т е п е н е й о к и с л е н и я
Степень окисления атомов простых веществ равна нулю.
Сумма степеней окисления атомов в сложном веществе (в молекуле) равна нулю.
Степень окисления атомов щелочных металлов +1.
Степень окисления атомов щелочно-земельных металлов +2.
Степень окисления атомов бора, алюминия +3.
Степень окисления атомов водорода +1 (в гидридах щелочных и щелочно-земельных металлов –1).
Степень окисления атомов кислорода –2 (в пероксидах –1).
Любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называют окислением. Частицы (атомы, молекулы или ионы), отдающие электроны, называют восстановителями. В результате окисления степень окисления восстановителя увеличивается. Восстановителями могут быть частицы в низшей или промежуточной степенях окисления. Важнейшими восстановителями являются: все металлы в виде простых веществ, особенно активные; C, CO, NH3, PH3, CH4, SiH4, H2S и сульфиды, галогеноводороды и галогениды металлов, гидриды металлов, нитриды и фосфиды металлов.
Процесс присоединения электронов называют восстановлением. Частицы, принимающие электроны, называют окислителями. В результате восстановления степень окисления окислителя уменьшается. Окислителями могут быть частицы в высшей или промежуточной степенях окисления. Важнейшие окислители: простые вещества-неметаллы, обладающие высокой электроотрицательностью (F2, Cl2, O2), перманганат калия, хроматы и дихроматы, азотная кислота и нитраты, концентрированная серная кислота, хлорная кислота и перхлораты.
Вещества, содержащие частицы в промежуточной степени окисления, могут выступать как в роли окислителей, так и в роли восстановителей, т.е. проявляют окислительно-восстановительную двойственность. Это сернистая кислота и сульфиты, хлорноватистая кислота и гипохлориты, пероксиды и др.
Различают три типа окислительно-восстановительных реакций.
Межмолекулярные ОВР – окислитель и восстановитель входят в состав различных веществ, например:

Внутримолекулярные ОВР – окислитель и восстановитель входят в состав одного вещества. Это могут быть разные элементы, например:

или один химический элемент в разных степенях окисления, например:

Диспропорционирование (самоокисление-самовосстановление) – окислителем и восстановителем является один и тот же элемент, находящийся в промежуточной степени окисления, например:

ОВР имеют огромное значение, поскольку большинство реакций, протекающих в природе, относятся к этому типу (процесс фотосинтеза, горение). Кроме того, ОВР активно используются человеком в его практической деятельности (восстановление металлов, синтез аммиака):

Для составления уравнений ОВР можно использовать метод электронного баланса (электронных схем) или метод электронно-ионного баланса.
Метод электронного баланса:

Метод электронно-ионного баланса:


1. Дихромат калия обработали сернистым газом в сернокислом растворе, а затем водным раствором сульфида калия. Конечным веществом Х является:
а) хромат калия; б) оксид хрома(III);
в) гидроксид хрома(III); г) сульфид хрома(III).
2. Какой продукт реакции между перманганатом калия и бромоводородной кислотой может реагировать с сероводородом?
а) Бром; б) бромид марганца(II);
в) диоксид марганца; г) гидроксид калия.
3. При окислении йодида железа(II) азотной кислотой образуются йод и монооксид азота. Чему равно отношение коэффициента при окислителе к коэффициенту при восстановителе в уравнении этой реакции?
а) 4 : 1; б) 8 : 3; в) 1 : 1; г) 2 : 3.
4. Степень окисления атома углерода в гидрокарбонат-ионе равна:
а) +2; б) –2; в) +4; г) +5.
5. Перманганат калия в нейтральной среде восстанавливается до:
а) марганца; б) оксида марганца(II);
в) оксида марганца(IV); г) манганата калия.
6. Сумма коэффициентов в уравнении реакции диоксида марганца с концентрированной соляной кислотой равна:
а) 14; б) 10; в) 6; г) 9.
7. Из перечисленных соединений только окислительную способность проявляют:
а) серная кислота; б) сернистая кислота;
в) сероводородная кислота; г) сульфат калия.
8. Из перечисленных соединений окислительно-восстановительную двойственность проявляют:
а) пероксид водорода; б) пероксид натрия;
в) сульфит натрия; г) сульфид натрия.
9. Из перечисленных ниже типов реакций окислительно-восстановительными являются реакции:
а) нейтрализации; б) восстановления;
в) диспропорционирования; г) обмена.
10. Степень окисления атома углерода численно не совпадает с его валентностью в веществе:
а) тетрахлорид углерода; б) этан;
в) карбид кальция; г) угарный газ.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | а | а | в | в | г | а, г | а, б, в | б, в | б, в |
Упражнения по окислительно-восстановительным реакциям
(электронный и электронно-ионный баланс)

Задание 1. Составить уравнения ОВР с помощью метода электронного баланса, определить тип ОВР.
1. Цинк + дихромат калия + серная кислота = сульфат цинка + сульфат хрома(III) + сульфат калия + вода.

2. Сульфат олова(II) + перманганат калия + серная кислота = сульфат олова(IV) + сульфат марганца + сульфат калия + вода.
3. Йодид натрия + перманганат калия + гидроксид калия = йод + манганат калия + гидроксид натрия.
4. Сера + хлорат калия + вода = хлор + сульфат калия + серная кислота.
5. Йодид калия + перманганат калия + серная кислота = сульфат марганца(II) + йод + сульфат калия + вода.
6. Сульфат железа(II) + дихромат калия + серная кислота = сульфат железа(III) + сульфат хрома(III) + сульфат калия + вода.
7. Нитрат аммония = оксид азота(I) + вода.
8. Фосфор + азотная кислота = фосфорная кислота + оксид азота(IV) + вода.
9. Азотистая кислота = азотная кислота + оксид азота(II) + вода.
10. Хлорат калия + соляная кислота = хлор + хлорид калия + вода.
11. Дихромат аммония = азот + оксид хрома(III) + вода.
12. Гидроксид калия + хлор = хлорид калия + хлорат калия + вода.
13. Оксид серы(IV) + бром + вода = серная кислота + бромоводородная кислота.
14. Оксид серы(IV) + сероводород = сера + вода.
15. Сульфит натрия = сульфид натрия + сульфат натрия.
16. Перманганат калия + соляная кислота = хлорид марганца(II) + хлор + хлорид калия + вода.
17. Ацетилен + кислород = углекислый газ + вода.
18. Нитрит калия + перманганат калия + серная кислота = нитрат калия + сульфат марганца(II) + сульфат калия + вода.
19. Кремний + гидроксид калия + вода = силикат калия + водород.
20. Платина + азотная кислота + соляная кислота = хлорид платины(IV) + оксид азота(II) + вода.
21. Сульфид мышьяка + азотная кислота = мышьяковая кислота + сернистый газ + диоксид азота + вода.
22. Перманганат калия = манганат калия + оксид марганца(IV) + кислород.
23. Сульфид меди(I) + кислород + карбонат кальция = оксид меди(II) + сульфит кальция +
+ углекислый газ.
24. Хлорид железа(II) + перманганат калия + соляная кислота = хлорид железа(III) + хлор +
+ хлорид марганца(II) + хлорид калия + вода.
25. Сульфит железа(II) + перманганат калия + серная кислота = сульфат железа(III) + сульфат марганца(II) + сульфат калия + вода.
Ответы на упражнения задания 1



При использовании метода полуреакций (электронно-ионный баланс) следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается протонами с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов. Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды.
Задание 2. С помощью метода электронно-ионного баланса составить уравнения ОВР, протекающих в определенной среде.
В н е й т р а л ь н о й с р е д е
1. Сульфит натрия + перманганат калия + вода = . .
2. Гидроксид железа(II) + кислород + вода = . .
3. Бромид натрия + перманганат калия + вода = . .
4. Сероводород + бром + вода = серная кислота + . .
5. Нитрат серебра(I) + фосфин + вода = серебро + фосфорная кислота + . .
В щ е л о ч н о й с р е д е
1. Сульфит натрия + перманганат калия + гидроксид калия = . .
2. Бромид калия + хлор + гидроксид калия = бромат калия + . .
3. Сульфат марганца(II) + хлорат калия + гидроксид калия = манганат калия + . .
4. Хлорид хрома(III) + бром + гидроксид калия = хромат калия + . .
5. Оксид марганца(IV) + хлорат калия + гидроксид калия = манганат калия + . .
В к и с л о й с р е д е
1. Сульфит натрия + перманганат калия + серная кислота = . .
2. Нитрит калия + йодид калия + серная кислота = оксид азота (II) + . .
3. Перманганат калия + оксид азота(II) + серная кислота = оксид азота(IV) + . .
4. Йодид калия + бромат калия + соляная кислота = . .
5. Нитрат марганца(II) + оксид свинца(IV) + азотная кислота = марганцовая кислота +
+ . .
Ответы на упражнения задания 2
В н е й т р а л ь н о й с р е д е


Задание 3. С помощью метода электронно-ионного баланса составить уравнения ОВР.

2. Оксид марганца(IV) + кислород + гидроксид калия = манганат калия +. .
3. Сульфат железа(II) + бром + серная кислота = . .
4. Йодид калия + сульфат железа(III) = . .
5. Бромоводород + перманганат калия = . .
6. Хлороводород + оксид хрома(VI) = хлорид хрома(III) + . .
7. Аммиак + бром = . .
8. Оксид меди(I) + азотная кислота = оксид азота(II) + . .
9. Сульфид калия + манганат калия + вода = сера + . .
10. Оксид азота(IV) + перманганат калия + вода = . .
11. Йодид калия + дихромат калия + серная кислота = . .
12. Сульфид свинца(II) + пероксид водорода = . .
13. Хлорноватистая кислота + пероксид водорода = соляная кислота + . .
14. Йодид калия + пероксид водорода = . .
15. Перманганат калия + пероксид водорода = оксид марганца(IV) + . .
16. Йодид калия + нитрит калия + уксусная кислота = оксид азота(II) + . .
17. Перманганат калия + нитрит калия + серная кислота = . .
18. Сернистая кислота + хлор + вода = серная кислота + . .
19. Сернистая кислота + сероводород = сера + . .
Ответы на упражнения задания 3
Читайте также:

