Структурные формулы углеводородов с хлором
Мы приступаем к новому разделу - органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями - содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда - CnH2n+2.
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos - соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода - sp 3
- Валентный угол (между химическими связями) составляет 109°28'

Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

В промышленности алканы получают путем:
-
Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
Гидрогенизацией угля (торфа, сланца)
Гидрированием оксида углерода II
В лабораторных условиях алканы получают следующими способами:
-
Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Гидрированием ненасыщенных углеводородов
Алканы - насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
-
Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.

Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Предельные углеводороды (алканы) – химически неактивные вещества. Они не реагируют с кислотами, основаниями, большинством металлов и неметаллов.
Для алканов характерны реакции з… и р…, а реакции присоединения невозможны.
1. Алканы реагируют с хлором по типу реакции замещения. Взаимодействие протекает по цепному механизму при УФ-облучении или при температуре 250–400 °C. В реакции последовательно один за другим могут заместиться все атомы водорода. Отметим, что вытесняемый хлором водород уводится в виде HCl:
2. Углеводороды горят на воздухе. Конечные продукты горения – у… газ и в. :
Если горит хлорированный углеводород, то наряду с СО2 и Н2О образуется HCl:
3. При нагревании алканов до 450–550 °С происходит расщепление сложных молекул на более простые (по числу атомов). Причем получаются углеводороды разных классов – предельные и непредельные (алкены, см. далее урок 8). Такой процесс называют крекингом и осуществляют его либо в присутствии катализаторов (Al2O3/SiO2), либо без них. Например:
При повышении температуры до 550–650 °С происходит более глубокое расщепление – п… . В результате образуются уголь (кокс), простейшие алканы (метан СН4, этан С2Н6, пропан С3Н8), углеводороды других классов (этилен С2Н4, ацетилен С2Н2 и т. п.) и водород Н2. Один из возможных вариантов следующий:
И… – третья разновидность термического разложения линейных (нормальных) углеводородов с превращением в разветвленные углеводороды. Обычно процесс ведут в присутствии катализаторов (AlCl3, ZnCl2 и др.). Как видно, при высоких температурах из одного и того же вещества могут образовываться смеси различных продуктов:
4. Смесь оксида углерода(II) и водорода – с….-газ – получают из метана двумя способами:
а) взаимодействием СН4 с водой;
б) взаимодействием СН4 с СО2.
Реакции протекают при 800–900 °С и в присутствии катализаторов (Ni, MgO, Al2O3):
Циклоалканы в химических процессах ведут себя подобно алканам. Однако в отличие от алканов они способны к реакциям присоединения с разрывом цикла и превращением в линейные насыщенные соединения:
Для соединений с пяти- и шестичленными циклами характерны реакции замещения:
Упражнения.
1. Составьте уравнения реакций монохлорирования (введения одного атома хлора в молекулу):
а) этана (С2Н6); б) циклогексана (цикло-С6Н12).
2. Напишите три уравнения реакций нормального декана н-С10Н22:
а) горения;
б) крекинга при 500 °С с расщеплением исходной молекулы С10 пополам – на алкан С5 и алкен С5;
в) термической изомеризации н-С10Н22 (кат. AlCl3) в 2-метилнонан.
3. Какой объем кислорода израсходуется (н.у.) на сгорание 100 г гептана С7Н16?
4. При сгорании 1 л паров циклоалкана получается 6 л углекислого газа. Какая химическая формула циклоалкана?
5. Дифтордихлорметан (фреон-12), применяющийся как хладагент в холодильниках, получают действием фтороводорода на тетрахлорметан. Составьте уравнение этой реакции.
6. Хлорпроизводное предельного углеводорода имеет молекулярную массу 237. Состав этого соединения следующий: Cl – 89,9%, C– 10,1%. Найдите его молекулярную формулу.
В молекуле простейшего алкена – этилена:
Названия линейных углеводородов ряда этилена (алкенов) образуют из названий алканов путем замены суффикса -ан- на -ен- (для первых трех гомологов – С2Н4, С3Н6 и С4Н8 – возможно -илен-).
В табл. 7 приведены в сравнении молекулярные формулы и названия алканов и алкенов.
| Углеводород | Формулы, различающиеся числом атомов С и Н | |||||
|---|---|---|---|---|---|---|
| Алканы | СН4 метан | С2Н6 этан | С3Н8 пропан | С4Н10 бутан | С5Н12 пентан | С6Н14 гексан |
| Алкены | Нет | С2Н4 этен (этилен) | С3Н6 пропен (пропилен) | С4Н8 бутен (бутилен) | С5Н10 пентен | С6Н12 гексен |
1. Изомерия углеродной цепи (скелета), как у предельных углеводородов. В примерах а и б двойная связь сохраняется при С-1, а углеродный скелет изменяется:
2. Изомерия п…….. двойной связи в молекуле. Например, двойная связь расположена при С-1 (структуры а1, а2, б1, б2) и при С-2 (изомеры а3, б4, б5):
3. Пространственная изомерия. Двойная связь С=С – жесткая конструкция. Вращение вокруг нее не происходит (запрещено, т. к. приводит к разрушению молекулы):
(Заметим, что вокруг одинарной связи С–С возможно свободное вращение, а разная запись
означает одно и то же соединение – 3,4-диметилгексан.)
Если атомы углерода при двойной связи имеют разные заместители А и В, то наблюдается пространственная цистрансизомерия:
Когда одинаковые заместители находятся по одну сторону двойной
связи – это цисизомер. В противоположном случае (одинаковые или старшие заместители друг напротив друга), по разные стороны двойной связи – это трансцизомер. Например:
Обратите внимание, что из пяти изомеров б1–б5 пентена С5Н10, различающихся углеродным скелетом или положением двойной связи, пространственная изомерия возможна только у изомера б4:
Все остальные вещества содержат два одинаковых заместителя при углероде с двойной связью типа
и не имеют пространственных цистрансизомеров.
Названия разветвленных и замещенных алкенов составляют подобно названиям алканов. Сначала выбирают самую длинную, главную углеродную цепь, включающую двойную связь. Атомы углерода этой цепи нумеруют, начиная с того конца цепи, к которому ближе двойная связь. В названии вещества после перечисления всех заместителей с указанием их положения в главной углеродной цепи пишут название пронумерованного алкена. Положение двойной связи обозначают в конце названия (после суффикса -ен-) номером того атома С, от которого она начинается. Например:
Упражнения.
1. Определите принадлежность к классам углеводородов (алкан, циклоалкан, алкен, алкин) следующих веществ:
Поясните свой выбор.
3. Назовите алкены:
4. Напишите структурные формулы четырех изомеров гептена С7Н14, у которых в главной цепи 6 атомов С.
5. По названиям веществ составьте их структурные формулы:
3-этилгексен-3, 2-метилбутен-2, транс-дихлорэтилен, 5-хлор-2-метилпентен-2.
1.
2.
3. Уравнение реакции горения гептана:
V = 11•22,4 = 246,4 л О2.
Ответ. 246,4 л кислорода.
4. Согласно закону Авогадро из схемы
следует, что n = 6, т.е. молекулярная формула циклоалкана – С6Н12.
Возможные структурные формулы циклоалкана состава С6Н12:
5.
6. Хлорпроизводное предельного углеводорода не содержит атомов Н, его молекулярная формула СnCl2n+2 (в общей формуле алкана СnH2n+2 все атомы Н замещены на атомы Сl). Подставим в химическую формулу СnCl2n+2 относительные атомные массы элементов Аr (С) и Аr (Сl). Получим уравнение:
12n + 35,5(2n + 2) = 237.
Решим его относительно n и найдем, что n = 2.
Ответ. Формула хлоралкана – С2Сl6.
1.
2. В молекуле пропилена
3. Названия алкенов по химическим формулам:
4. Четыре изомера гептена С7Н14 с главной цепью С6:
5. Названия веществ и соответствующие им структурные формулы:
Ароматические соединения
Ароматические соединения (арены) – циклические соединения содержащие, как правило 5- и 6-членные циклы, имеющие замкнутую систему сопряженных связей. Боковые цепи не обязаны содержать сопряженные связи.
Ароматичность молекулы характеризует ее повышенную устойчивость, которая обусловлена делокализацией π-электронов в циклической системе.
1. Атомы углерода в состоянии sp 2 -гибридизации создают замкнутую систему.
2. Атомы углерода образуют единую плоскость.
3. Цикл из сопряженных связей включает в себя 4n + 2 π-электронов (где n – целое число). Этот принцип называется правилом Хюккеля.
В зависимости от n можно выделить следующие простейшие ароматические системы:
• Системами с 2 π-электронам являются производные катиона циклопропенилия и дикатионциклобутадиена.
• Системы с 10 π-электронами – это в первую очередь нафталин. Кроме того, широко встречается в природе конденсированные бензольные кольца. Другой представитель – азулен. Это изомер нафталина, содержащий в себе 5- и 7-членные кольца. Азулен часто встречается в эфирных маслах, но распространенность гораздо меньше, чем у бензола и нафталина. 
Сюда же относятся индол, хинолин, изохинолин, хиназолин, хиноксалин, другие системы, основанные на бензольном кольце, конденсированном с другим кольцом, в котором находится гетероатом. Широко распространены в природе.
• Системы с 14 π-электронами: антрацен, фенантрен – конденсированные бензольные кольца обоих кольцах. Широко распространены в природе. 
Для ароматических соединений часто используют тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
| С6H5–CH3 | С6H5–C2H5 | С6H5–C3H7 |
| Метилбензол (толуол) | Этилбензол | Пропиленбензол |
Если радикалов более одного, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерация организовывается таким образом, чтобы заместители имели наименьшую сумму номеров положений. Например:
 |
| 1,2-Диметилбензол 1,3-Диметилбензол 1,4-Диметилбензол |
Для дизамещенных бензолов R–C6H4–R распространен способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками:
- орто- (о-) – заместители у соседних атомов углерода кольца, т.е. 1,2-положениях к опорному;
- мета- (м-) – заместители через один атом углерода (в 1,3-положениях к опорному);
- пара- (п-) – заместители на противоположных сторонах кольца (в 1,4-положениях к опорному).
| 1,2-Диметилбензол 1,3-Диметилбензол 1,4-Диметилбензол |
 |
- положения заместителей для ди-, три- и тетра-замещенных бензолов (например, о-, м- и п-ксилолы);
- углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода:
![]()
н-Пропилбензол Изопропилбензол (кумол) - изомерия заместителей R, начиная с R=С2Н5. Например, молекулярной формуле С8Н10 соответствуют 4 изомера:
Химические свойства ароматических соединений сильно отличаются от свойств других классов соединений из-за делокализации шести π-электронов в циклической системе, которые понижают энергию молекулы. В результате в молекуле повышается устойчивость. Арены практически не вступают в реакции присоединения или окисления, приводящие к нарушению ароматичности. Для них наиболее распространены реакции с сохранением ароматической системы, т. е. замещения атомов водорода в составе цикла.
Так как в бензольном кольце за счет системы сопряженных связей с обеих сторон от плоскости кольца наблюдается повышенная электронная плотность, то бензольное кольцо является нуклеофилом и склонно взаимодействовать с электрофильным реагентом. Поэтому для ароматических соединений наиболее типичны реакции электрофильного замещения.
Замена атома водорода в бензольном кольце на какой-либо из галогенов наблюдается, как правило, в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса):
| C6H6 + Cl2 |  | C6H5Cl | + HCl. |
| Хлорбензол |
Бензол хорошо взаимодействует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
| C6H6 + HNO3 |  | C6H5NO2 | + H2O. |
| Нитробензол |
Алкильная группа замещает атом водорода в бензольном кольце при взаимодействии с алкилгалогенидами (реакция Фриделя–Крафтса) или алкенов с катализатором, например AlCl3 (кислота Льюиса):
| C6H6 + CH3Cl |  | C6H5CH3 | + HCl. |
| Толуол (метилбензол) |
Гомологи бензола, содержащие боковые цепи, активнее вступают в реакции замещения.
Например, при нитровании толуола С6Н5CH3 может происходить замещение не одного, а одновременно трех атомов водорода с образованием 2,4,6-тринитротолуола:
 | ||
| Толуол | 2,4,6-Тринитротолуол (тротил, тол) | |
В этом случае хорошо иллюстрируется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях.

Причиной именно такой ориентации при электрофильном замещении является взаимное влияние атомов в молекуле. В незамещенном бензоле С6Н6 электроны в кольце распределены равномерно, а в замещенных ароматических соединениях под влиянием заместителя происходит перераспределение электронов и образуются области повышенной и пониженной электронной плотности, что оказывает влияние направления реакций электрофильного замещения. Таким образом, атака нового заместителя определяется природой уже имеющегося заместителя.
Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т. е. оказывают ориентирующее действие.
По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода.
Орто-пара-ориентанты направляют замещение преимущественно в орто- и пара-положения.
К ним относятся электроннодонорные группы (электронные эффекты групп указаны в скобках):
+M-эффект в этих группах сильнее, чем –I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто- и пара-положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.
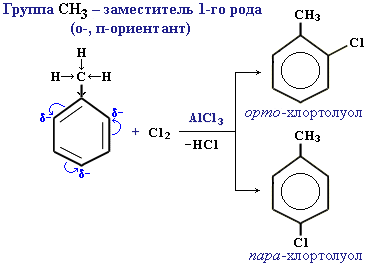
Ориентанты 1-го рода повышают в бензольном кольце электронную плотность, это приводит к повышению его активности в реакциях электрофильного замещения (по сравнению с бензолом).
Галогены занимают особое место среди ориентантов 1-го рода, проявляющие электронно-акцепторные свойства: –F (+M бензол > нитробензол.
Но нужно учитывать, что под влиянием бензольного кольца группа СH3 в толуоле становится активнее в реакциях окисления и радикального замещения по сравнению, например, с метаном СH4.
Поэтому толуол (в отличие от метана) окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):

В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.


Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т. п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений [5, 6].
Гомологи бензола, в отличие от самого бензола, окисляются легко. При обработке перманганатом калия будут окисляться только боковые цепи:
| C6H5–CH3 + 3[O] | → | C6H5–COOH | + H2O. |
| Толуол | Бензойная кислота |
Наращивание боковой насыщенной цепи (этилбензол, пропилбензол и т. д.) также дает на выходе бензойную кислоту, так как разрыв связи происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.

Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах:
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
Уголь и нефть – основной источник ароматических углеводородов.
При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения.
а) дегидроциклизация (дегидрирование и циклизация) насыщенных УВ, состоящих, как минимум из 6 атомов углерода в основной цепи. Реакция проходит при нагревании в присутствии катализатора:

б) дегидрирование циклоалканов, состоящих из шести атомов:

Алкилирование бензола галогеналканами или алкенами в присутствии безводного хлорида алюминия:

Тримеризация алкинов над активированным углем (реакция Зелинского):

Бензол С6Н6 – основа для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола и т. д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Толуол С6Н5–СН3 используется для производства лекарственных и взрывчатых веществ (тротил, тол), а также красителей.
Ксилолы С6Н4(СН3)2 в виде смеси изомеров (орто-, мета- и пара-) применяется как растворитель.
Изопропилбензол (кумол) С6Н4–СН(СН3)2 – основа для получения фенола и ацетона.
Винилбензол (стирол) C6H5–CН=СН2 используется для получения полистирола – важного для промышленности полимера.

Бензпире́н или бензапире́н – химическое соединение, относящееся к первому классу опасности. Источником его образования является сгорание углеводородного жидкого, твёрдого и (реже) газообразного топлива. Концентрируется преимущественно в почве, меньше – в воде. Из почвы мигрирует в ткани растений и продолжает своё движение дальше в пищевой цепочке.
Читайте также:


