Сторожевой лимфатический узел при раке легкого
Для того чтобы назначить эффективное лечение при онкологическом заболевании и определиться с объемом хирургического вмешательства, врачу важно понимать, насколько сильно злокачественная опухоль успела распространиться по организму. Зачастую раковые клетки распространяются через лимфатическую систему.
Лимфатические сосуды присутствуют во всех органах. Они собирают межклеточную жидкость, которая просачивается в ткани из мелких кровеносных сосудов — капилляров. В лимфатических сосудах межклеточная жидкость превращается в лимфу и оттекает в лимфатические узлы. Эти иммунные органы, разбросанные по всему телу, содержат клетки-лимфоциты, которые умеют распознавать чужеродные частицы и при необходимости вызывать иммунный ответ. В некоторых местах, например, в области шеи, подмышек, паха, находятся скопления (группы) лимфатических узлов. В конечном итоге лимфа поступает в венозное русло.
Попав в лимфатические сосуды вместе с межклеточной жидкостью, раковые клетки в первую очередь окажутся в ближайшем лимфатическом узле. Врачи-онкологи называют такие лимфоузлы сторожевыми. Иногда сторожевой узел всего один, а иногда их несколько.
В каких случаях проводят сентинель-биопсию?
Чаще всего биопсию сторожевого лимфоузла, или сентинель-биопсию, применяют при меланоме и раке молочных желез. Иногда её используют при злокачественных опухолях легких, кишечника, щитовидной железы, желудка, головы и шеи.
Подготовка к процедуре
Сентинель-биопсия может быть проведена как самостоятельная процедура или прямо во время операции по удалению опухоли.
Как и перед любым хирургическим вмешательством, за 8 часов до процедуры нельзя ничего есть и пить. Сообщите врачу заранее о том, какие лекарства вы принимаете, какими хроническими заболеваниями страдаете, на какие лекарства у вас аллергия.
Как проводят биопсию сторожевого лимфатического узла?
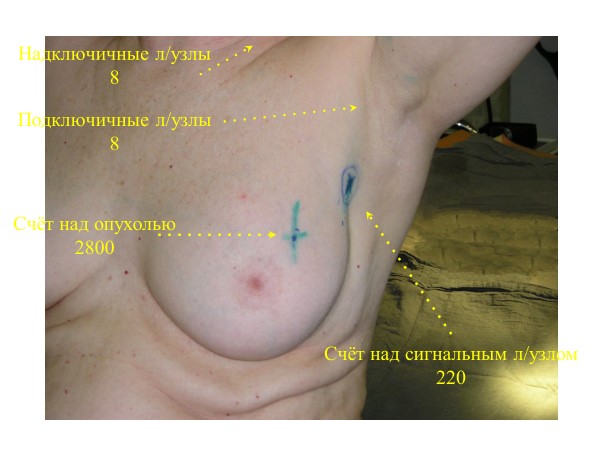
Процедуру проводят под наркозом. В первую очередь врачу нужно понять, где находится сторожевой лимфатический узел. Его можно обнаружить одним из двух способов:
- При помощи специального красителя. Непосредственно перед процедурой врач вводит рядом с опухолью специальный красящий раствор синего цвета. Он проникает в лимфатические сосуды и, вместе с лимфой, попадает в ближайший лимфоузел, отчего тот приобретает ярко-синюю окраску и становится виден.
- При помощи гамма-детектора. За несколько часов до процедуры врач вводит рядом с опухолью безопасный радиопрепарат. Он, аналогично красителю, проникает в лимфатические сосуды и сторожевой узел. Во время операции врач обнаруживает лимфоузел при помощи небольшого прибора — гамма-детектора.
Хирург удаляет все обнаруженные сторожевые лимфоузлы и отправляет их в лабораторию для изучения под микроскопом. Результат исследования может быть получен прямо во время операции. Это помогает врачу понять, нужно ли удалять регионарные лимфоузлы, или можно ограничиться только удалением опухоли.

Как изменится дальнейшее лечение, в зависимости от результата?
Если хирург не знает наверняка, распространились ли раковые клетки в близлежащие (регионарные) лимфатические узлы, без сентинель-биопсии он перестрахуется и удалит их вместе с опухолью. Из-за этого операция будет более сложной, травматичной. Из-за нарушения оттока лимфы повышается риск возникновения лимфедемы — отека.
Биопсия сторожевого лимфоузла помогает повысить точность диагностики и удалять регионарные лимфатические узлы только в случаях, когда это действительно необходимо, если достоверно известно, что в них есть раковые клетки.
Если в ходе сентинель-биопсии были обнаружены раковые клетки, есть вероятность, что они распространились не только в лимфатические узлы, но и в другие органы. Эта информация помогает врачу более точно определить стадию опухоли, правильно спланировать обследование и лечение.

Может ли сентинель-биопсия приводить к осложнениям?
Сентинель-биопсия не имеет специфических осложнений. Как и после любой операции, после неё могут беспокоить боли, отек в области вмешательства. Послеоперационная рана может кровоточить или нагноиться. Это происходит редко.
У некоторых пациентов может возникать аллергическая реакция на краситель. Очень редко, если удалено много лимфатических узлов, развивается лимфедема — отек. В большинстве же случаев сентинель-биопсия, напротив, помогает предотвратить лимфедему — после неоправданного удаления регионарных лимфоузлов риск этого осложнения намного выше.
Несмотря на то, что сентинель-биопсия обладает высокой точностью, иногда все же могут быть получены ложноотрицательные результаты. В образце не обнаруживают раковые клетки, но на самом деле они уже успели проникнуть в лимфатическую систему.
В Европейской клинике применяются современные диагностические методики, которые помогают выбрать оптимальный объем операции и правильно, в соответствии со стадией и индивидуальными особенностями опухоли, разработать план лечения. Наша цель — максимально эффективное, безопасное и комфортное лечение онкологических заболеваний. Мы знаем, как помочь.
Лимфатические узлы — биологические фильтры организма. Они не дают распространяться инфекциям и служат местом для созревания иммунных клеток. Всего в теле человека 500–600 лимфоузлов. Иногда они увеличиваются. Это может происходить по разным причинам, чаще всего инфекций.

Первичные злокачественные опухоли в лимфатических узлах составляют 3–4% от всех онкологических заболеваний и представлены лимфомами. Помимо лимфоузлов, лимфомы встречаются и в других органах, в которых представлена лимфоидная ткань: в вилочковой железе (тимусе), миндалинах, пищеварительном тракте, селезенке и др.
Злокачественные опухоли в лимфоузлах часто называют раком лимфатических узлов, но это неверно. Рак — злокачественные новообразования, которые происходят из эпителиальных тканей: кожи, слизистых оболочек, желез. Лимфомы — опухоли из лимфоидной ткани. Они бывают двух типов: ходжкинские (болезнь Ходжкина) и неходжкинские.
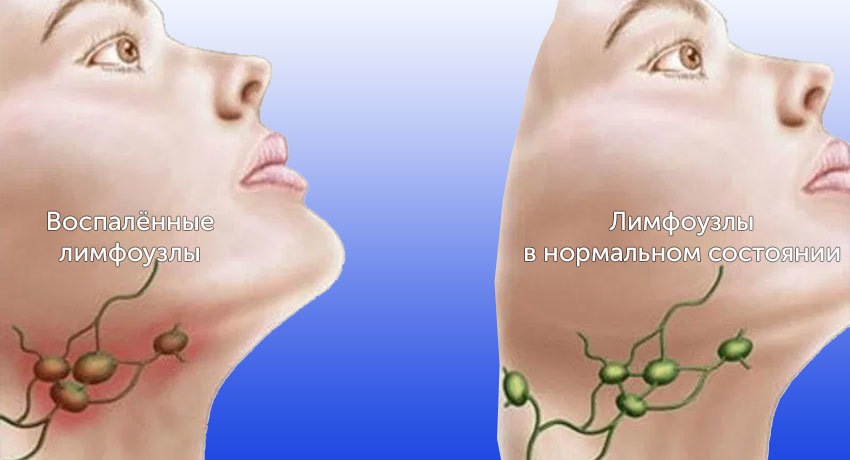
Помимо первичных опухолей, в лимфатических узлах очень часто встречаются вторичные очаги при раке в других органах. Опухолевые клетки, попавшие в лимфатические сосуды, в первую очередь достигают регионарных лимфоузлов — тех, которые принимают лимфу от области тела, где находится первичное новообразование.
Лечение лимфом
Основным методом лечения болезни Ходжкина и неходжкинских лимфом является химиотерапия. Применяются комбинации различных химиопрепаратов.
При лимфоме Ходжкина чаще всего прибегают к схеме ABVD — эта аббревиатура составлена из первых букв названий препаратов:
- Адриамицин, другое название — Доксорубицин (Adriamycin).
- Блеомицин (Bleomycin).
- Винбластин (Vinblastine).
- Дакарбазин (Dacarbazine).
Иногда применяют схемы BEACOPP (Блеомицин + Этопозид + Доксорубицин + Циклофосфамид + Винкристин + Прокарбазин + Преднизон) и Стэнфорд V (Доксорубицин + Мехлорэтамин + Винкристин + Винбластин + Блеомицин + Этопозид + Преднизон).
За 1–2 дня до введения химиопрепаратов нужно провести общий анализ крови. Если результат удовлетворительный, можно проводить лечение. Непосредственно перед процедурой пациенту вводят препараты для предупреждения побочных эффектов: противорвотные и противоаллергические. Химиотерапевтические средства вводят в определенной последовательности: Доксорубицин, затем Винбластин, в последнюю очередь Блеомицин и Дакарбазин.
При неходжкинских лимфомах чаще всего применяют две схемы химиотерапии:
- Схема CHOP включает 4 препарата. Циклофосфамид (Cyclophosphamide), Доксорубицин, или Гидроксидаунорубицин (Hydroxydaunorubicin) и Винкристин, или Онковин (Oncovin) вводят внутривенно. Преднизон (Prednisone) принимают в виде таблеток.
- CVP — схема из трех препаратов. Циклофосфамид (Cyclophosphamide) и Винкристин (Vincristine) вводят внутривенно, Преднизон (Prednisone) в таблетках.
Чаще всего химиотерапию при лимфомах проводят амбулаторно, в условиях дневного стационара. Иногда успешно проводят несколько циклов лечения комбинацией препаратов первой линии, но затем она становится менее эффективной, и приходится назначать другую.
В современных клиниках при длительном курсе химиотерапии пациенту устанавливают венозную . Она представляет собой небольшую титановую емкость с мембраной, которую помещают через небольшой разрез под кожу и соединяют тонкой трубкой (катетером) с веной. В дальнейшем, чтобы ввести раствор препарата внутривенно, достаточно лишь проколоть кожу и мембрану. Это делает процедуру более удобной для врача, позволяет пациенту избежать стресса и дискомфорта многократных уколов в вену, помогает предотвратить флебит — воспаление венозной стенки.
Оставьте свой номер телефона
Некоторые агрессивные типы неходжкинских лимфом часто метастазируют в головной мозг. Системная химиотерапия при этом неэффективна, потому что химиопрепаратам, введенным внутривенно или перорально (путем проглатывания) сложно проникнуть в спинномозговую жидкость. Проблема решается введением химиопрепаратов интратекально — непосредственно в спинномозговую жидкость. Эту процедуру можно проводить амбулаторно, как в профилактических целях, так и при уже возникших метастазах в головном мозге. Чаще всего применяют химиопрепараты Метотрексат и Цитарабин.
Иногда вместо интратекальной химиотерапии проводят системную терапию метотрексатом в высоких дозах.
Лимфомы обычно хорошо отвечают на облучение, поэтому лучевую терапию часто применяют для борьбы с этим типом опухолей. При лимфомах Ходжкина она используется, как правило, в виде дополнения к курсу химиотерапии — вместе с ним или после него.
Показания к лучевой терапии при неходжкинских лимфомах:
- При опухолях I и II стадии — в качестве самостоятельного метода лечения.
- При НХЛ на более поздних стадиях — в качестве дополнения к химиотерапии.
- Облучение всего тела в сочетании с высокодозной химиотерапией после трансплантации стволовых клеток.
- При лимфоме с метастазами в качестве симптоматического лечения.
Иммунотерапия — современное направление в лечении онкологических заболеваний. Она предполагает использование ресурсов иммунной системы для уничтожения опухолевых клеток.
При лимфомах используются моноклональные антитела, которые специфически нацелены на белок CD20, находящийся на поверхности лимфоцитов. Чаще всего при ходжкинских и неходжкинских лимфомах применяется Ритуксимаб (Ритуксан). Врач может назначить его отдельно или в сочетании лучевой терапией, химиотерапией.
Другие препараты из группы ингибиторов CD20 (применяются при неходжкинских лимфомах):
- Обинутузумаб (Газива) часто применяют в сочетании с химиопрепаратами для лечения малой лимфоцитарной лимфомы (SLL), хронического лимфоцитарного лейкоза (CLL).
- Офатумумаб (Арзерра), как правило, применяют у пациентов с SLL/CLL, которым не помогают другие виды лечения.
- Ибритумомаб тиуксетан (Зевалин) представляет собой моноклональное антитело, к которому прикреплена радиоактивная молекула.
При лимфомах Ходжкина в настоящее время также применяют Брентуксимаб ведотин (Адцетрис). Это моноклональное антитело, соединенное с молекулой химиопрепарата, нацелено на молекулу CD30.
Этот метод лечения применяют в случаях, когда заболевание не поддается излечению с помощью химиотерапии и лучевой терапии. Суть состоит в том, чтобы уничтожить патологически измененные клетки и заменить их новыми. Для этого сочетают высокодозную химиотерапию и трансплантацию собственных или донорских стволовых клеток. Это сложный вид лечения, он грозит серьезными, опасными для жизни осложнениями. Проводить его должны опытные врачи в специализированных онкологических центрах, предварительно тщательно взвесив все потенциальные преимущества и риски для конкретного пациента.
Лечение вторичных очагов в лимфатических узлах
Если злокачественная опухоль, изначально возникшая в другом органе, распространилась в лимфатические узлы, тактика лечения будет зависеть от стадии онкологического заболевания.
Радикальные операции при раке зачастую предусматривают одновременное удаление пораженного органа и определенного количества регионарных лимфатических узлов. Обычно хирургическое вмешательство дополняется курсом адъювантной химиотерапии и/или лучевой терапии.
При раке с очагами в лимфатических узлах и отдаленными метастазами, когда хирургическое лечение невозможно, проводят химиотерапию, лучевую терапию. В зависимости от типа злокачественной опухоли, могут быть назначены современные таргетные препараты, иммунопрепараты.
В клинике Медицина 24/7 работают ведущие врачи-онкологи, применяются все современные типы противоопухолевых препаратов, зарегистрированные на территории России. Мы работаем в соответствии с последними версиями международных протоколов.
Органосохраняющие операции при раке молочной железы
Ранее стандартной практикой считалось удаление всей ткани молочной железы, лимфоузлов и даже мышц.
Благодаря современным достижениям хирургической онкологии в рутинную практику вошли органосохраняющие операции, позволяющие не только сохранить орган — железу, мышцу, но и лимфоузлы с помощью внедрения метода биопсии сигнальных (сторожевых) лимфатических узлов. Сохранение подмышечных лимфоузлов позволило избежать калечащих осложнений в виде ограничения подвижности руки.
Тысячи пациенток избежали избыточной хирургической агрессии и удаление у них раковой опухоли не привело к удалению груди.
Лимфатическая система молочной железы
Как известно, злокачественные опухоли обладают способностью метастазировать. Молочная железа отличается обилием лимфатических сосудов и разнообразием путей возможного оттока лимфы, которая является одним из главных путей распространения опухолевых клеток.
Долгое время основным способом предотвращения возникновения вторичных опухолей, распространяемых по лимфотоку, считалось удаление ближайших узлов – в подмышечной впадине, под ключицей, под лопаткой.
Как же определить, какие узлы поражены метастазами и их действительно нужно удалять? В одной только подмышечной впадине их может быть от 14 до 45.
Суть методики биопсии сигнальных лимфатических узлов
Биопсия сигнальных лимфатических узлов – один из современных методов ранней диагностики метастазов. Его суть сводится к тому, чтобы определить состояние подмышечных лимфоузлов, найти и провести исследование сторожевого лимфоузла, — являющегося первым на пути лимфооттока.
Если в нем метастазы отсутствуют, то их нет с высокой долей вероятности и во всем региональном коллекторе. В этом случае, дальнейшее вмешательство не требуется.
Показания и противопоказания для проведения биопсии сигнальных узлов
В настоящее время БСЛУ проводят:
- если у пациента диагностируется ранний рак молочной железы
- отсутствуют признаки метастазирования
- для уточнения статуса лимфоузлов перед системным лечением
Противопоказаниями для данной манипуляции принято считать метастатический и воспалительный РМЖ.
Как проходит операция с БСЛУ
Методика биопсии сигнальных лимфатических узлов основана на активном накоплении сигнальными лимфатическими узлами радиоактивных коллоидных частиц, введенных в опухоль.
Как правило, перед операцией выполняется лимфосцинтиграфия — для анатомического определения нахождения сигнального лимфоузла и контроля прохождения радиоизотопа.
Для этого, чтобы найти сторожевой лимфатический узел, в молочную железу вводится радиофармпрепарат, то есть множество частиц, помеченных радиоактивным изотопом. Инъекция радиоизотопа может проводиться за 2-24 часа до операции, на практике ее обычно выполняют накануне.
Сторожевой лимфатический узел выявляется непосредственно во время операции и тогда же принимается решение о дальнейшей тактике лечения.
Меченые частицы двигаются по лимфопутям, скапливаются в первом узле на пути лимфооттока, и указывают врачам, что это и есть сигнальный лимфатическом узел. Его можно увидеть с помощью гамма-камеры, отслеживающей меченые частицы.

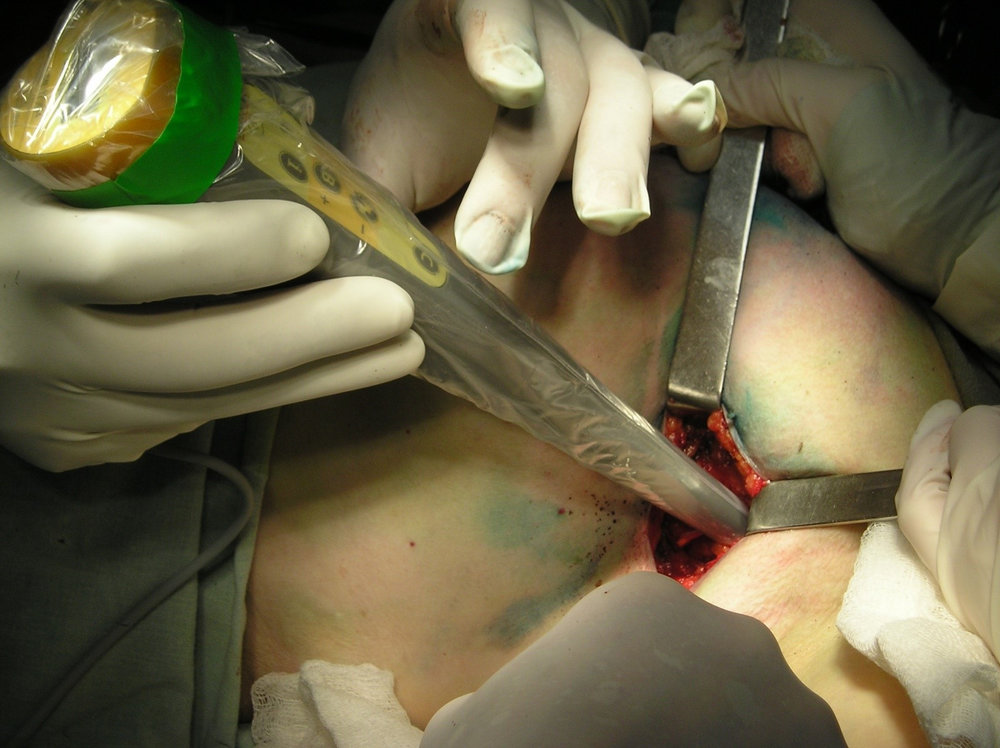
Хирург выполняет удаление этого узла через небольшой разрез на коже при помощи гамма-зонда, то есть минимально травматично для пациента.
Удаленная ткань сразу же передается для исследования морфологу. Информация, которую хирург получает во время операции, дает возможность принять решение о дальнейшем лечении.
Если гистология показывает, что в лимфатическом узле нет метастазов, то рану зашивают, на теле остаются лишь небольшие косметические рубцы.
Если в результате гистологического исследования обнаруживаются злокачественные изменения в лимфоузлах, может понадобиться расширенная операция. Она выполняется сразу же, во время одного наркоза.
Удаленные лимфатические узлы всегда отправляют также и на расширенное гистологическое исследование в лабораторию, как правило эти результаты совпадают со срочным исследованием.
В настоящее время биопсия сигнальных лимфатических узлов относится к числу базовых методов диагностики поражения регионарных лимфатических узлов при РМЖ и рекомендуется экспертами международного противоракового союза в качестве стандартного метода при определении степени распространенности процесса у больных раком молочной железы.
Возможность сохранить молочную железу и лимфоузлы в процессе лечения РМЖ является крупнейшим достижением мировой клинической онкологии.
Для уточнения характера и объема хирургического вмешательства, следует обратиться к своему лечащему врачу, в большинстве случаев при раннем раке молочной железы можно избежать калечащей операции.


Авторская публикация:
Воротников Владимир Владимирович
онколог-маммолог, кандидат медицинских наук
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
1. Акопов А. Л. Недостатки и противоречия современной системы стадирования рака легкого // Вопр. онкол. 2006. № 1. С. 107-114.
2. Акопов А. Л. Операционная диагностика степени лимфогенного метастазирования рака легкого // Вестн. хир. 2007. № 2. C. 105-109.
3. Давыдов М. И., Полоцкий Б. Е., Аллахвердиев А. К. Систематическая медиастинальная лимфатическая диссекция - стандарт в хирургическом лечении больных немелкоклеточным раком легкого I, II и IIIа стадии // Пульмонология. 2007. № 3. С. 72-76.
4. Колбанов К. И., Трахтенберг А. Х., Пикин О. В. и др. К вопросу о стандартах лечения больных немелкоклеточным раком легкого с регионарными внутригрудными метастазами // Онкология. Журн. им. П. А. Герцена. 2014. № 2. С. 3-7.
5. Abels C., Karrer S., Bäumler W. et al. Indocyanine green and laser light for the treatment of AIDS-associated cutaneous Kaposi’s sarcoma // Br. J. Cancer. 1998. Vol. 77. P. 1021-1024.
6. Alander J. T., Kaartinen I., Laakso A. et al. Review of indocyanine green fluorescent imaging in surgery // Int. J. Biomed. Imaging. 2012. Vol. 12. P. 1-26.
7. Alex J. C., Weaver D. L., Fairbank J. T. et al. Gamma-probe-guided lymph node localization in malignant melanoma // Surg. Oncol. 1993. Vol. 2. P. 303-308.
8. Baumler W., Abels C., Karrer S. et al. Photo-oxidative killing of human colonic cancer cells using indocyanine green and infrared light // Br. J. Cancer. 1999. Vol. 80. P. 360-363.
9. Bilchik A. J., Giuliano A., Essner R. et al. Universal application of intraoperative lymphatic mapping and sentinel lymphadenectomy in solid neoplasms // Cancer J. Sci. Am. 1998. Vol. 4. P. 351-358.
10. Cabañas R. M. An approach for the treatment of penile carcinoma // Cancer. 1977. Vol. 39. P. 456-466.
11. Chen Z., Zhu N., Pacheco S. et al. Single camera imaging system for color and near-infrared fluorescence image guided surgery // Biomedical optics express. 2014. Vol. 5. P. 2791-2797.
12. Christensen B., Blichert-Toft M., Siemssen O. J. Reliability of axillary lymph node scintiphotography in suspected carcinoma of the breast // Br. J. Surg. 1980. Vol. 67. P. 667-668.
13. Crane L. M., Themelis G., Arts H. J. et al. Intraoperative near-infrared fluorescence imaging for sentinel lymph node detection in vulvar cancer: first clinical results // Gynecologic Oncology. 2011. Vol. 120. P. 291-295.
14. Crane L. M., Themelis G., Pleijhuis R. G. et al. Intraoperative multispectral fluorescence imaging for the detection of the sentinel lymph node in cervical cancer: a novel concept // Mol. Imaging Biol. 2011. Vol. 13. P. 1043-1049.
15. Gilchrist R. K. Fundamental factors governing lymphatic spread of carcinoma // Ann. Surg. 1940. Vol. 111. P. 630-639.
16. Gilmore D. M., Khullar O. V., Jaklitsch M. T. et al. Identification of metastatic nodal disease in a phase 1 dose-escalation trial of intraoperative sentinel lymph node mapping in non-small cell lung cancer using near-infrared imaging // J. Thorac. Cardiovasc. Surg. 2013. Vol. 146. P. 562-570.
17. Gioux S., Choi H. S., Frangioni J. V. Image-guided surgery using invisible near-infrared light: fundamentals of clinical translation // Molecular Imaging. 2010. Vol. 9. P. 237-255.
18. Giuliano A. E., Kirgan D. M., Guenther J. M. et al. Lymphatic mapping and sentinel lymphadenectomy for breast cancer // Ann. Surg. 1994. Vol. 220. P. 391-401.
20. Gray D. C., Kim E. M., Cotero V. E. et al. Dual-mode laparoscopic fluorescence image-guided surgery using a single camera // Biomedical optics express. 2012. Vol. 3. P. 1880-1189.
21. Halsted W. S. The results of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June 1889 to January 1894 // Johns Hopkins Hosp. Bull. 1894. № 4. P. 297-323.
22. Hirche C., Dresel S., Krempien R. et al. Sentinel node biopsy by indocyanine green retention fluorescence detection for inguinal lymph node staging of anal cancer: preliminary experience // Ann. Surg. Oncol. 2010. Vol. 17. P. 2357-2362.
23. Hutteman M., Mieog J. S. D., Van der Vorst J. R. et al. Randomized, double-blind comparison of indocyanine green with or without albumin premixing for near-infrared fluorescence imaging of sentinel lymph nodes in breast cancer patients // Breast Cancer Research and Treatment. 2011. Vol. 127. P. 163-170.
24. Ichinose S., Usuda J., Maehara S. et al. Sentinel node navigation surgery (SNNS) using indocyanine green (ICG) and near infrared spectroscopy in lung cancer // J. Thorac. Oncol. 2009. № 4. P. 563 S.
25. Inoue S., Shiina H., Arichi N. et al. Identification of lymphatic pathway involved in the spreading of prostate cancer by fluorescence navigation approach with intraoperatively injected indocyanine green // J. Canad. Urolog. Ass. 2011. Vol. 5. P. 254-259.
26. Ito N., Fukuta M., Tokushima T. et al. Sentinel node navigation surgery using indocyanine green in patients with lung cancer // Surgery Today. 2004. Vol. 34. P. 581-585.
27. Jain V., Phillips B. T., Conkling N. et al. Sentinel lymph node detection using laser-assisted indocyanine green dye lymphangiography in patients with melanoma // Int. J. Surg. Oncol. 2013. Vol. 13. P. 1-4.
28. Kapteijn B. A. E., Nieweg O. E., Peterse J. L. et al. Identification and biopsy of the sentinel lymph node in breast cancer // Eur. J. Surg. Oncol. 1998. Vol. 24. P. 427-430.
29. Karrer S., Abels C., Bäumler W. et al. Photochemotherapie von kutanen Rektumkarzinom- Metastasen mit Indocyaningrun [photochemotherapy with indocyanine green in cutaneous metastases of rectal carcinoma] // Deutsche medizinische Wochenschrift. 1997. Vol. 122. P. 1111-1114.
30. Kett K., Varga G., Lukács L. Direct lymphography of the breast // Lymphology. 1970. № 1. P. 3-12.
31. Khullar O. V., Griset A. P., Gibbs-Strauss S. L. et al. Nanoparticle migration and delivery of Paclitaxel to regional lymph nodes in a large animal model // J. Am. Coll. Surg. 2012. Vol. 214. P. 328-337.
32. Krag D. N., Weaver D. L., Alex J. C. et al. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe // Surg. Oncol. 1993. Vol. 2. P. 335-339.
33. Kubota K., Yoshida M., Kuroda J. et al. Application of the HyperEye Medical System for esophageal cancer surgery: a preliminary report // Surg. Today. 2013. Vol. 43. P. 215-220.
34. Kubuschok B., Passlick B., Izbicki J. R. et al. Disseminated tumor cells in lymph nodes as a determinant for survival in surgically resected non-small cell lung cancer // J. Clin. Oncol. 1999. Vol. 17. P. 19-24.
35. Lardinois D., Brack T., Gaspert A. et al. Bronchoscopic radioisotope injection for sentinel lymph-node mapping in potentially resectable non-small-cell lung cancer // Eur. J. Cardiothorac. Surg. 2003. Vol. 23. P. 824-827.
36. Lim H. W., Soter N. A. Clinical Photomedicine. New York, NY, USA: Dekker Inc., 1993. P. 485.
37. Liptay M. J., D’Amico T.A., Nwogu C. et al. Intraoperative sentinel node mapping with technitium-99 in lung cancer: results of CALGB 140203 multicenter phase II trial // J. Thorac. Oncol. 2009. Vol. 4. P. 198-202.
38. Liptay M. J., Master G. A., Winchester D. J. et al. Intraoperative radioisotope sentinel lymph node mapping in non-small cell lung cancer // Ann. Thorac. Surg. 2000. Vol. 70. P. 384-389.
39. Little A., DeHoyos A., Kirgan D. M. et al. Intraoperative lymphatic mapping for non-small cell lung cancer: the sentinel node technique // J. Thorac. Cardiovasc. Surg. 1999. Vol. 117. P. 220-224.
40. Matsuoka H., Kondo K., Takizawa H. et al. Sentinel lymph nodes detection using indocyanine green in patients with lung cancer // J. Thorac. Oncol. 2009. Vol. 4. P. S562-563.
41. McGreevy J. M., Cannon M. J., Grissom C. B. Minimally invasive lymphatic mapping using fluorescently labeled vitamin B12 // J. Surg. Res. 2003. Vol. 111. P. 38-44.
42. Miyashiro I., Miyoshi N., Hiratsuka M. et al. Detection of sentinel node in gastric cancer surgery by indocyanine green fluorescence imaging: comparison with infrared imaging // Ann. Surg. Oncol. 2008. Vol. 15. P. 1640-1643.
43. Mizukami T., Fujiwara M., Suzuki A. et al. Sentinel lymph node detection by indocyanine green fluorescence imaging in skin cancer patients: technical refinement // The Open Surg. Oncol. J. 2010. Vol. 2. P. 57-61.
44. Morton D. L., Wen D. R., Wong J. H. et al. Technical details of intraoperative lymphatic mapping for early stage melanoma // Arch. Surg. 1992. Vol. 127. P. 392-399.
45. Nakagawa T., Minamiya Y., Katayose Y. et al. A novel method for sentinel lymph node mapping using magnetite in patients with non-small cell lung cancer // J. Thorac. Cardiovasc. Surg. 2003. Vol. 126. P. 563-567.
46. Noromi H. Sentinel lymph node mapping in lung cancer: the Japanese experience // Semin. Thorac. Cardiovasc. Surg. 2009. Vol. 21. P. 316-322.
47. Reintgen D. S., Cruse C. W., Wells K. E. et al. The orderly progression of melanoma nodal metastases // Ann. Surg. 1994. Vol. 220. P. 759-767.
48. Riquet M., Hidden G., Debesse B. Direct lymphatic drainage of lung segments to the mediastinal nodes. An anatomic study on 260 adults // J. Thorac. Cardiovasc. Surg. 1989. Vol. 97. P. 623-632.
49. Schmidt F.E., Woltering E. A., Webb W.R. et al. Sentinel nodal assessment in patients with carcinoma of the lung // Ann. Thorac. Surg. 2002. Vol. 74. P. 870-875.
50. Sugi K., Fukuda M., Nakamura H. et al. Comparison of three tracers for detecting sentinel lymph nodes in patients with clinical N0 lung cancer // Lung Cancer. 2003. Vol. 39. P. 37-40.
51. Taghizadeh Kermania A., Bagheri R., Tehranian S. et al. Accuracy of sentinel node biopsy in the staging of non-small cell lung carcinomas: Systematic review and meta-analysis of the literature // Lung Cancer. 2013. Vol. 80. P. 5-14.
52. Takizawa T., Terashima M., Koike T. et al. Lymph node metastasis in small peripheral adenocarcinoma of the lung // Thorac. Cardiovasc. Surg. 1998. Vol. 116. P. 276-280.
53. Tanaka E., Choi H. S., Fujii H. et al. Image-guided oncologic surgery using invisible light: completed pre-clinical development for sentinel lymph node mapping // Ann. Surg. Oncol. 2006. Vol. 13. Vol. 12. P. 1671-1681.
54. Tiffet O., Nicholson A. G., Khaddage A. et al. Feasibility of the detection of the sentinel lymph node in peripheral non-small cell lung cancer with radio isotopic and blue dye techniques // Chest. 2005. Vol. 127. P. 443-448.
55. Tsujino Y., Mizumoto K., Matsuzaka Y. et al. Fluorescence na vigation with indocyanine green for detecting sentinel nodes in extra-mammary Paget’s disease and squamous cell carcinoma // J. Dermatol. 2009. Vol. 36. P. 90-94.
56. Van der Poel H. G., Buckle T., Brouwer O. R. et al. Intraoperative laparoscopic fluorescence guidance to the sentinel lymph node in prostate cancer patients: clinical proof of concept of an integrated functional imaging approach using a multimodal tracer // Eur. Urol. 2011. Vol. 60. P. 826-833
57. Weissbach L., Boedefeld E. A. Localization of solitary and multiple metastases in stage II nonseminomatous testis tumor as basis for a modified staging lymph node dissection in stage I // J. Urol. 1987. Vol. 138. P. 77-82.
58. Yamashita S. I., Tokuishi K., Miyawaki M. et al. Sentinel node navigation surgery by thoracoscopic fluorescence imaging system and molecular examination in non-small cell lung cancer // Ann. Surg. Oncol. 2012. Vol. 19. P. 728-733.
59. Zeidman I., Buss J. M. Experimental studies of the spread of cancer in the lymphatic system // Cancer Res. 1954. Vol. 14. P. 403-405.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:





