Стероидные препараты от опухоли
Ведущие симптомы дегенеративно-дистрофических и воспалительных патологий опорно-двигательного аппарата — острые боли, сильная отечность, тугоподвижность. Если с этими клиническими проявлениями не справляются НПВС и анальгетики, то пациентам назначаются стероидные противовоспалительные препараты для суставов (глюкокортикостероиды). Они быстро устраняют клинические проявления остеоартрозов, корректируют иммунный ответ у больных артритами.
Терапевтическая эффективность глюкокортикостероидов иногда нивелируется их выраженными побочными местными и системными реакциями. Лекарственные средства негативно воздействуют при пероральном приеме на ЖКТ, органы мочевыделения, снижают костную массу. Поэтому при назначении стероидных средства врач тщательно рассчитывает разовые и суточные дозировки.
Что такое глюкокортикостероиды
Важно знать! Врачи в шоке: "Эффективное и доступное средство от боли в суставах существует. " Читать далее.
Слаженную работу всех систем жизнедеятельности и отдельных органов обеспечивают гормоны — биологически активные вещества, вырабатывающиеся в железах внутренней секреции. Они поступают в кровеносное русло, а затем связываются с рецепторами клеток-мишеней. Гормоны регулируют различные процессы в организме человека, в том числе метаболические. Глюкокортикостероиды — аналоги гормонов, продуцируемых железистыми клетками надпочечников. Повышение или понижение их уровня в системном кровотоке серьезно ухудшает самочувствие человека, становится причиной развития патологий.

В состав стероидных противовоспалительных препаратов для лечения суставов входят активные ингредиенты, оказывающие разноплановое воздействие на организм. После внутрисуставного введения или приема таблетки снижается интенсивность болей, повышается объем движений. Глюкокортикоиды способны нормализовать микроциркуляцию и купировать острые воспалительные процессы.
Классификация
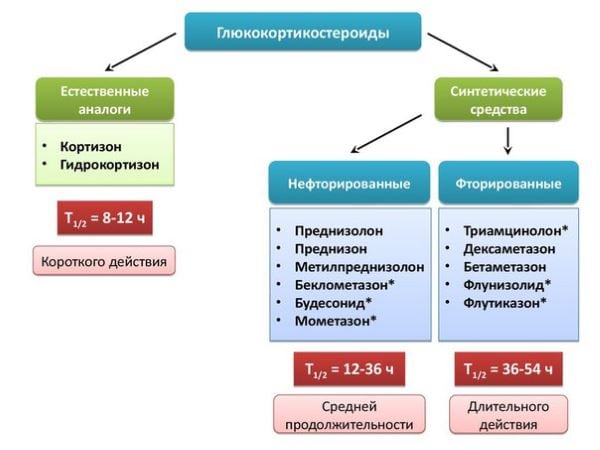
В клинико-фармакологическую группу стероидов входят препараты с основными компонентами, обладающими биологической активностью. Кортизон и Гидрокортизон относятся к глюкокортикостероидам природного происхождения. Остальные средства — их синтетические аналоги, производные гидрокортизона, полученные в результате фторирования или других химических реакций. Для искусственных стероидов характерна более высокая терапевтическая эффективность, низкая кратность применения, менее выраженные побочные реакции. В медицинской практике принята классификация гормональных препаратов в зависимости от времени их лечебного воздействия:
- период полувыведения стероидов короткого действия (кортизона, гидрокортизона) — от 8 до 12 часов. Обычно входят в состав наружных средств, редко использующихся в терапии суставных патологий. Предназначены в основном для лечения воспалительных поражений кожи. С помощью таблеток и инъекций проводится гормональная заместительная терапия при дефиците естественных гормонов в организме;
- период полувыведения стероидов средней продолжительности действия (метилпреднизолона, преднизолона, триамцинолона) — от 18 до 36 часов. Наиболее часто используются в ортопедии, ревматологии, травматологии. В несколько раз превосходят по клинической эффективности средства короткого действия, но меньше влияют на водно-электролитный баланс. Значительно реже провоцируют побочные системные реакции;
- период выведения пролонгированных стероидов (бетаметазона, дексаметазона) составляет от 36 до 54 часов. Препараты не предназначены для длительного курсового лечения из-за выраженных побочных проявлений, токсичного воздействия на организм.
Глюкокортикостероиды классифицируются и в зависимости от способа введения. Для лечения суставных патологий применяются таблетки и инъекционные препараты. Последние вводятся внутримышечно, внутривенно, в полость сустава, иногда сразу в воспаленное сухожилие. Гормональные средства выпускаются в виде лиофилизатов для приготовления растворов, суспензий. Наиболее часто в терапии дегенеративно-дистрофических и воспалительных суставных патологий используются такие стероидные препараты:
- Дексаметазон;
- Депо-Медрол;
- Триамцинолон (Кеналог);
- Гидрокортизон;
- Бетаметазон (Дипроспан, Целестон, Флостерон);
- Преднизолон.
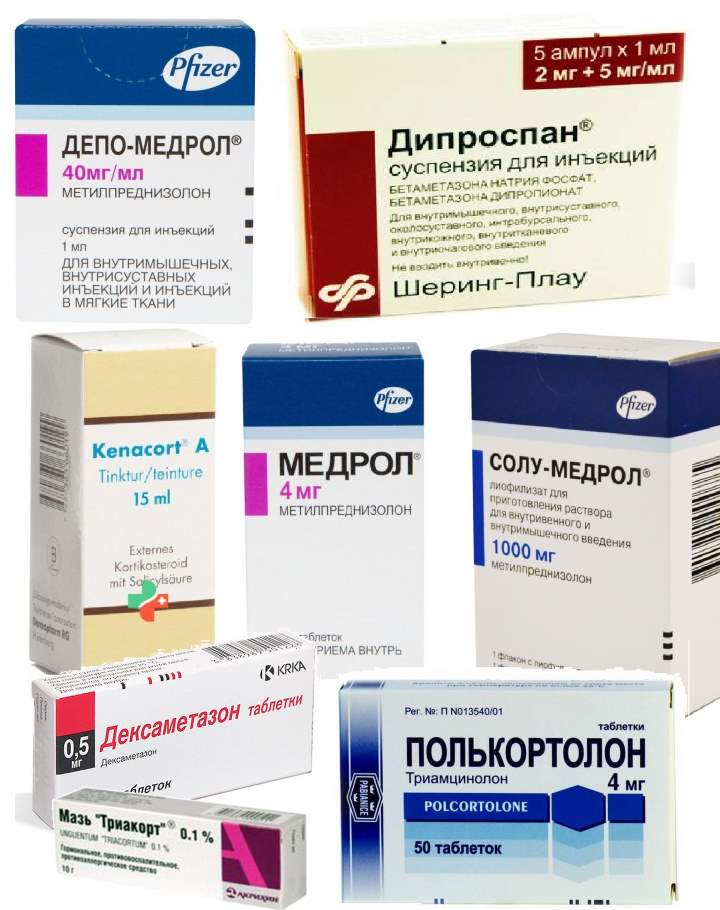
Для этих гормональных средств характерна выраженная противовоспалительная, противоаллергическая и иммунодепрессивная активность. Также они влияют на обмен веществ: липидов, протеинов, углеводов.
Фармакологическое действие
Стероидные препараты содержат ингредиенты, которые быстро проникают через клеточные мембраны и воздействуют на цитоплазматические рецепторы. В процессе связывания формируются активные комплексы, попадающие в ядра и влияющие на биосинтез особых белков. Изменяется иммунный ответ, происходит прямое или опосредованное воздействие на выработку медиаторов боли, воспаления, лихорадки — простагландинов, лейкотриенов, брадикининов. Клинически доказана способность стероидных препаратов ингибировать фосфолипидные медиаторы, предупреждая агрегацию тромбоцитов. Для глюкокортикостероидов характерны и другие фармакологические свойства:
- угнетение активности фосфолипазы и гиалуронидазы, стимулирующих биосинтез простагландинов;
- стабилизация клеточных мембран, торможение высвобождения из тучных клеток гистамина, тромбоксана, лейкотриенов, провоцирующих воспалительные процессы;
- замедление синтеза из арахидоновой кислоты специфических белков цитокинов, регулирующих иммунный ответ;
- усиление синтеза глюкозы в гепатоцитах и катаболизма белков, обеспечение организма высокоэнергетическими веществами;
- иммунодепрессивное воздействие — подавление чрезмерной активности иммунной системы в отношении собственных клеток организма.
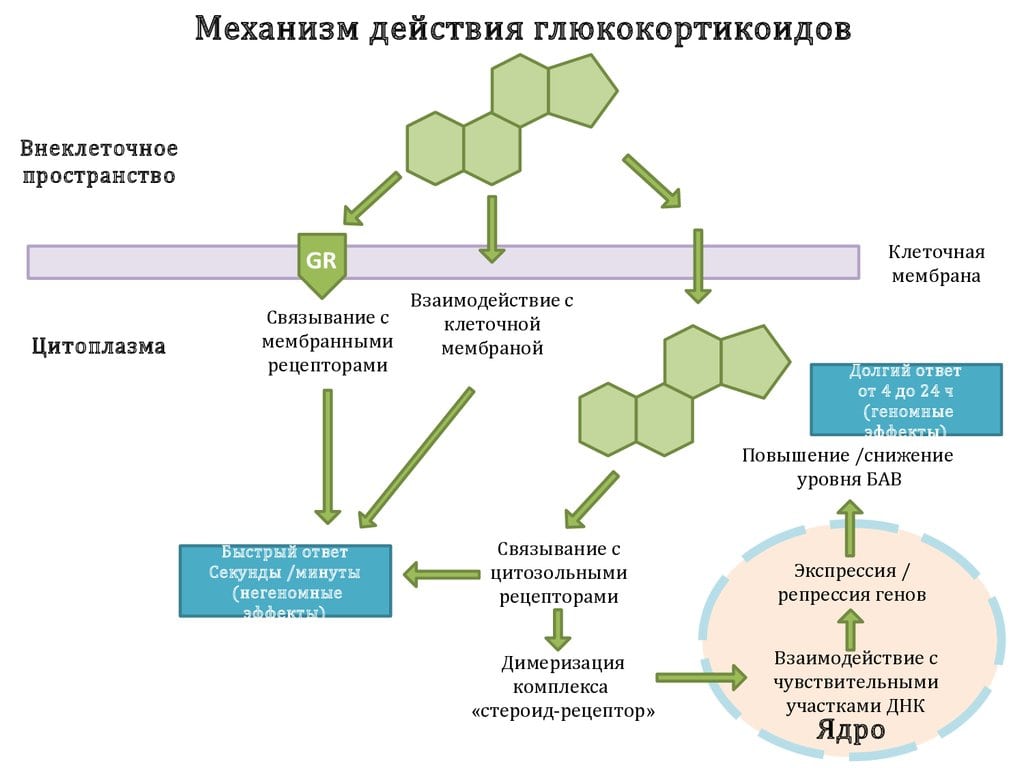
Прием стероидных препаратов предупреждает взаимодействие лимфоцитов и их миграцию в воспалительные очаги. При гормональной терапии увеличивается высвобождение в кровеносное русло адреналина, восстанавливается чувствительность к этому биоактивному веществу определенных рецепторов. Одновременно происходит сужение кровеносных сосудов, снижение их проницаемости. Сочетание таких эффектов объясняет одно из побочных проявлений глюкокортикостероидов — подъем артериального давления. Но это свойство часто используется для устранения шокового состояния в критической, опасной для жизни человека ситуации.
Даже "запущенные" проблемы с суставами можно вылечить дома! Просто не забывайте раз в день мазать этим.
Показания к применению
В терапии аутоиммунных заболеваний, например, ревматоидного артрита, стероидные препараты используются в малых дозах для проведения патогенетического лечения. Они назначаются пациентам не столько для купирования симптоматики, сколько для коррекции иммунного ответа. Гормональные средства включаются в терапевтические схемы при диагностировании ювенильного, псориатического и подагрического артритов. Препараты применяются и в лечении заболеваний, не сопровождающихся воспалительным процессом в суставах.
Если НПВС (нестероидные противовоспалительные средства), анальгетики не способны справиться с болевым синдромом и сильной отечностью, то используются глюкокортикостероиды.
Показаниями являются следующие патологии:
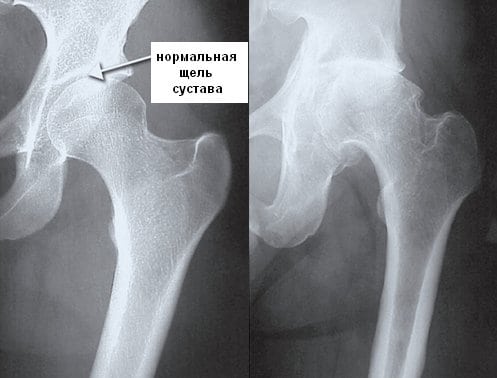
- остеоартрозы крупных и мелких суставов, протекающие на фоне сдавливания и повреждения костными наростами мягких тканей;
![]()
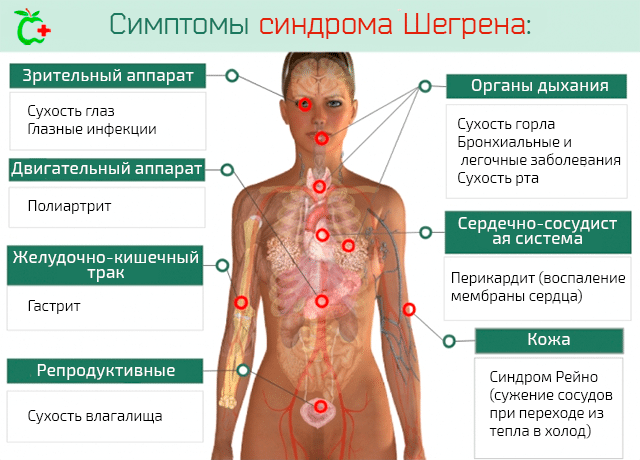
- воспаление соединительнотканных структур в результате обострения аутоиммунного или ревматического заболевания (системной красной волчанки, склеродермии, синдрома Шегрена, ревматической полимиалгии, дерматомиозита, васкулитов), травмирования;
![]()
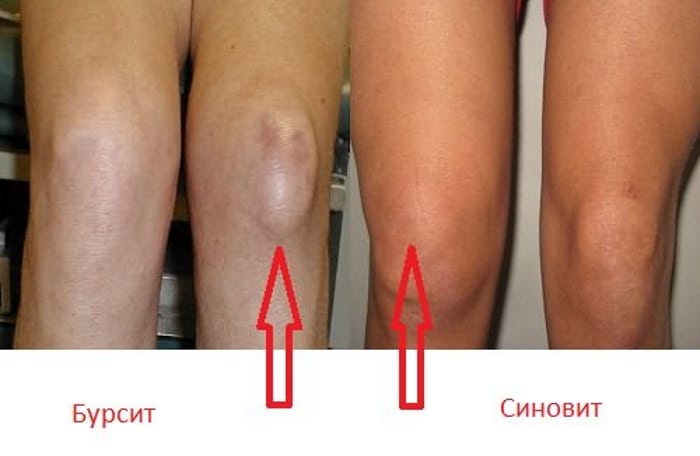
- неинфекционные острые воспалительные процессы, протекающие в суставной сумке, синовиальной оболочке (синовит, бурсит);
![]()
- болезнь Бехтерева, или анкилозирующий спондилоартрит, провоцирующий сращение межпозвонковых суставов.
Стероидные препараты применяются в травматологии для купирования острых болей и воспаления после переломов. Благодаря иммунодепрессивному действию гормональных средств они помогают подавить реакции отторжения при трансплантации тканей.
Противопоказания
Лечение стероидными препаратами проводится только после тщательной диагностики пациента и изучения анамнеза. На протяжении всей терапии врач контролирует состояние больного по результатам биохимических анализов. Но, несмотря на выраженные побочные проявления гормональных средств, все противопоказания к их разовому использованиюотносительны. Если пациенту необходимо срочное введение инъекционных растворов, то единственным противопоказанием становится гиперчувствительность к активным вспомогательным ингредиентам. При назначении длительного курсового лечения врач учитывает его возможные последствия. Продолжительный прием гормональных средств противопоказан при следующих патологиях:
- болезни Иценко-Кушинга (первичного гиперкортицизма);
- активных форм туберкулеза любой локализации;
- тяжелой артериальной гипертензии;
- язвенных поражений ЖКТ;
- тяжелой недостаточности кровообращения;
- сахарного диабета;
- острых и хронических патологиях органов мочевыделения.

Стероидный препарат не используется в терапии, если у больного ранее возникали аллергические реакции после приема глюкокортикостероидов.
Категорически запрещены средства во время вынашивания ребенка из-за высокой вероятности развития врожденных аномалий надпочечников у плода. Стероиды назначаются детям только по жизненным показаниям, так как провоцируют задержку роста.
Побочные эффекты
Спрогнозировать появление побочного действия стероидных препаратов у конкретного больного невозможно. Минимизировать вероятность местных и системных побочных реакций помогает изучение анамнеза и минимальные дозировки глюкокортикостероидов. Но при длительном курсовом лечении нередко возникают следующие негативные последствия:
- симптоматический комплекс Иценко-Кушинга: из-за задержки натрия и воды формируются отеки, возникает дефицит калия, повышается артериальное давление, возможно развитие стероидного сахарного диабета;
- замедляются регенерационные процессы в тканях;
- изъязвляются слизистые оболочки пищеварительного тракта, обостряются гастриты, язвы желудка и двенадцатиперстной кишки;
- перерождаются ткани поджелудочной железы на фоне развития некроза, пропитывания паренхимы кровью, возникновения кровотечений;
- снижается иммунитет, учащаются респираторные, кишечные инфекции;
- повышается масса тела, появляется или обостряется акне, нарушается менструальный цикл.
Большая часть возникших осложнений обратима, то есть исчезает по окончании лечения. К необратимым последствиям относится задержка роста у детей, субкапсулярная катаракта, стероидный диабет.
Особые указания
Режим дозирования зависит от характера патологии, реакции пациента на применяемый стероидный препарат, возраста и веса. Но даже при результативном проведении терапии без серьезных проявлений следует учитывать характерный для гормональных средств синдром отмены. Он заключается в обострении дегенеративного или воспалительного процесса после резкого прекращения лечения. Также могут возникать следующие патологические состояния:
- повышение температуры тела;
- боли в мышцах и суставах;
- слабость, утомляемость, сонливость.
Иногда (обычно при стрессе) происходит аддисонический криз — рвота, коллапс, судороги. Чтобы не допустить развития синдрома отмены, на последней стадии лечения дозировки постепенно снижаются, как и кратность их приема.
Основным принципом лечения заболеваний суставов глюкокортикостероидами становится обеспечение максимального терапевтического воздействия при использовании минимальных доз. Недопустимо применение любых гормональных средств без назначения врача.
Описание
В качестве противоопухолевых средств в клинической практике применяют ряд гормональных препаратов — агонистов и антагонистов андрогенов, эстрогенов, гестагенов и других гормонов. Эти средства показаны преимущественно при гормональнозависимых опухолях. Гормональная противоопухолевая терапия имеет важное значение при лечении рака молочной железы, эндометрия, предстательной железы. Применяют гормональные средства также для лечения рака почки, карциноида, некоторых опухолей поджелудочной железы, меланомы и др.
Взаимодействие между гормонами и гормональнозависимыми опухолями было выявлено впервые в 1896 г., когда хирург из Глазго J. Beatson опубликовал данные успешного лечения трех женщин с прогрессирующим раком молочной железы, которым была произведена двусторонняя овариэктомия.
По механизму действия гормональные препараты отличаются от цитотоксических противоопухолевых средств. Основная их роль — восстановление нарушенной гуморальной регуляции функции клеток. Вместе с тем не исключается и специфическое влияние на опухолевые клетки: они в определенной степени тормозят деление клеток и способствуют их дифференцировке.
Эстрогены назначают для подавления действия в организме андрогенов (например, при раке предстательной железы), андрогены, напротив, — для уменьшения активности эстрогенов (при раке молочной железы и др.). При раке молочной железы и матки используют также прогестины (медроксипрогестерон).
К противоопухолевым гормональным средствам и антагонистам гормонов относят:
1. Андрогенные средства — тестостерон, метилтестостерон, дростанолон (медротестрона пропионат), пролотестон.
2. Эстрогенные средства — фосфэстрол, диэтилстильбэстрол, полиэстрадиола фосфат, эстрамустин, этинилэстрадиол, хлоротрианизен, полиэстрадиола фосфат, гексэстрол.
3. Гестагенные средства (прогестины) — гестонорона капроат, медроксипрогестерон, мегестрол и др.
4. Антагонисты эстрогенов (антиэстрогены) — тамоксифен, торемифен.
5. Антагонисты андрогенов (антиандрогены): бикалутамид, флутамид, ципротерон и др.
7. Ингибиторы ароматазы (аминоглутетимид, анастрозол, эксеместан, летрозол).
8. Ингибиторы биосинтеза гормонов надпочечников (аминоглутетимид, митотан).
9. Глюкокортикоиды (преднизолон, дексаметазон и др.).
10. Аналоги соматостатина (октреотид, ланреотид).
Андрогены (см. Андрогены, антиандрогены) иногда применяют при метастатическом раке молочной железы. Назначают их женщинам с сохраненным менструальным циклом и в том случае, когда продолжительность менопаузы не превышает 5 лет. Нежелательными эффектами андрогенов, особенно при применении больших доз, являются вирилизация у женщин (огрубение голоса, чрезмерный рост волос на лице), задержка воды и солей в организме и др. Начало применения андрогенов (в частности тестостерона) для лечения рака молочной железы относят к 40-м гг. XX в.
Начиная с 1951 г. при лечении рака молочной железы широко используются прогестины (см. Эстрогены, гестагены; их гомологи и антагонисты). Гестагенные препараты применяют также для лечения рака эндометрия и рака почек, но мало используют для лечения рака простаты.
Основным показанием к назначению эстрогенов, начало использования которых в онкологической практике также относится к 40-м гг. XX в., является рак предстательной железы. При раке молочной железы их теперь назначают очень редко.
Важную роль в механизме действия гормональных препаратов играет их связывание со специфическими рецепторами, обнаруженными в тканях и некоторых опухолях.
Антиэстрогены конкурентно связываются с эстрогеновыми рецепторами в органах-мишенях и препятствуют образованию эстрогенрецепторного комплекса с эндогенным лигандом — 17-бета-эстрадиолом. В результате они тормозят стимулируемый эстрогенами рост опухоли. Чем больше эстрогенных рецепторов в опухоли — тем благоприятнее результат лечения антиэстрогенами.
Эффективным антиэстрогеном является тамоксифен — эталонный препарат для лечения рака молочной железы (особенно у женщин в менопаузе). Клиническое использование тамоксифена было начато в 1973 г. В настоящее время тамоксифен является широко используемым препаратом как для проведения адъювантной терапии, так и при лечении больных с диссеминированным процессом. Показано, что тамоксифен эффективен при всех стадиях заболевания, хорошо переносится при приеме в терапевтических дозах. Кроме основного показания — рак молочной железы у женщин — тамоксифен применяют при лечении рака грудной железы у мужчин, рака эндометрия, рака предстательной железы и др.
К антиандрогенам относят ряд соединений стероидной и нестероидной структур, способных подавлять физиологическую активность эндогенных андрогенов. Их действие связано с конкурентным блокированием рецепторов андрогенов в тканях-мишенях, биосинтез и секрецию андрогенов они не нарушают. Антиандрогенное действие свойственно в той или иной степени ряду эндогенных стероидных соединений, в т.ч. прогестинам, эстрогенам и их синтетическим производным, а также некоторым производным самих андрогенов. Из стероидных антиандрогенов наиболее известен ципротерон. В 70-х гг. XX в. появились сообщения о высокой антиандрогенной активности нестероидных соединений — производных карбоксианилида (флутамид и др.). Применяют антиандрогены в основном при раке предстательной железы. Область их использования включает также гиперандрогенные состояния у женщин (гирсутизм, облысение и др.), раннее половое созревание у детей.
Среди антиандрогенов выделяют вещества, которые только блокируют андрогенные рецепторы (т.н. чистые андрогены) — бикалутамид, флутамид, и вещества, которые, кроме способности блокировать рецепторы, имеют гонадотропную активность (т.н. антиандрогены двойного действия) — ципротерон.
Флутамид и бикалутамид блокируют связывание андрогенов с клеточными рецепторами, вследствие чего препятствуют проявлению биологических эффектов андрогенов в андрогенчувствительных органах, в т.ч. в клетках предстательной железы, и таким образом препятствуют росту опухоли. После приема флутамида отмечается повышение плазменных уровней тестостерона и эстрадиола.
Ципротерон обладает более выраженным андрогенным действием, т.к. помимо блокирования действия дигидротестостерона на уровне рецепторов, подавляет высвобождение гонадотропинов и, следовательно, синтез андрогенов. Одновременно с тестостероном в крови снижается содержание ЛГ и ФСГ .
Особым видом антиандрогенной активности обладают соединения, ингибирующие 5-альфа-редуктазу — внутриклеточный фермент предстательной железы, способствующий превращению тестостерона в более активный андроген — дигидротестостерон (ДГТ). Одним из ингибиторов 5-альфа-редуктазы является финастерид, применяющийся при лечении доброкачественной гиперплазии предстательной железы (см. Средства, влияющие на обмен веществ в предстательной железе, и корректоры уродинамики).
Гипоталамические рилизинг-факторы — эндогенные пептидные соединения, оказывающие влияние на высвобождение гипофизом гонадотропных гормонов ( в т.ч. лютеинизирующего и фолликулостимулирующего). В настоящее время в медицинских целях используют не естественные рилизинг-факторы из гипоталамуса животных (овец, свиней), а их синтетические аналоги. Аналоги (как агонисты, так и антагонисты) полипептидных гормонов создают путем присоединения, выделения, замещения или изменения некоторых аминокислот в полипептидной цепочке природного гормона. Гонадотропин-рилизинг-гормон ( ГнРГ ) — гонадорелин, гонадолиберин, гонадотропин-рилизинг фактор — один из представителей класса рилизинг-гормонов гипоталамуса. ГнРГ в большей степени влияет на секрецию ЛГ , нежели ФСГ , поэтому часто его называют также рилизинг-гормоном лютеинизирующего гормона ( ЛГРГ ) .
ГнРГ представляет собой декапептид, состоящий из 10 аминокислот. Установлено, что аминокислоты в положении 2 и 3 ответственны за биологическую активность ГнРГ . Аминокислоты в положении 1, 6, 10 имеют структурную конфигурацию, необходимую для связывания с рецепторами клеток гипофиза. Замещение молекулы ГнРГ в положении 6 и 10 позволило создать агонисты рилизинг-гормона.
Синтетические гонадолиберины — нафарелин, гозерелин, гистрелин, лейпрорелин — аналоги гонадотропин-рилизинг-гормона — содержат D-аминокислоты в положении 6 и этиламидзамещающий глицин в положении 10. Результатом замены аминокислотных остатков в молекуле природного гормона является более выраженное сродство к рецепторам ГнРГ и более продолжительный период полураспада, поэтому аналоги имеют более сильное и более длительное действие, чем нативный гонадотропин-рилизинг-гормон. Так, активность гозерелина превышает активность нативного ГнРГ в 100 раз, трипторелина — в 36 раз, бусерелина — в 50 раз, а T1/2 синтетических гонадотропинов — 90–120 мин — намного превышает T1/2 нативного ГнРГ .
В мировой клинической практике известно более 12 лекарственных препаратов-аналогов ГнРГ : бусерелин, гистрелин, гозерелин, лейпрорелин, лутрелин, нафарелин, трипторелин, фертирелин и др. В России зарегистрированы лишь некоторые из них. Применяемые в России противоопухолевые средства — аналоги ГнРГ (гозерелин, лейпрорелин, трипторелин, бусерелин) сходны по структуре, механизму действия, основным фармакокинетическим и фармакодинамическим характеристикам, а также клинической эффективности и безопасности.
Гонадорелин секретируется гипоталамусом не постоянно, а в импульсном режиме, при этом пики следуют друг за другом с определенными интервалами, различными у мужчин и женщин: у женщин ГнРГ выделяется каждые 15 мин (фолликулярная фаза цикла) или 45 мин (лютеиновая фаза цикла и период беременности), у мужчин — 90 мин. ГнРГ обнаружен у всех млекопитающих. Пульсирующее выделение ГнРГ из гипоталамуса поддерживает выработку гонадотропинов в гипофизе.
Применяют аналоги ГнРГ при раке предстательной железы — они способствуют регрессу опухоли простаты. Женщинам назначают при гормонозависимых опухолях молочной железы, эндометриозе, фиброме матки, т. к. они вызывают истончение эндометрия, уменьшение симптоматики и размеров объемных образований. Кроме того, аналоги ГнРГ применяют при лечении бесплодия (в программах экстракорпорального оплодотворения).
Побочные эффекты этих ЛС , возникающие в начале лечения и обусловленные временной стимуляцией гипофиза, проявляются в усилении симптомов, либо появлении дополнительных симптомов основного заболевания. Эти явления не требуют отмены препарата. Избежать их при лечении рака предстательной железы позволяет одновременное назначение на 2–4 неделе антиандрогена.
Аналоги ГнРГ выпускаются в различных лекарственных формах — для п/к , в/м , интраназального применения. Внутрь эти ЛС не назначаются, т.к. декапептиды легко расщепляются и инактивируются в ЖКТ . Учитывая необходимость длительного лечения, аналоги ГнРГ выпускаются также в виде лекформ пролонгированного действия, в т.ч. микрокапсул, микросфер.
Большая скорость разрушения ГнРГ (2–8 мин) не позволяет использовать его в клинической практике для длительного применения. Для ГнРГ величина T1/2 из крови составляет 4 мин, при п/к или интраназальном введении его аналогов — примерно 3 ч. Биотрансформация осуществляется в гипоталамусе и гипофизе. При почечной или печеночной недостаточности коррекции режима дозирования, как правило, не требуется.
Ингибиторы ароматазы начали применяться в онкологической практике в 70–80-е гг. XX в. Ароматаза — цитохром Р450-зависимый фермент, отвечающий за превращение синтезирующихся в коре надпочечников андрогенов в эстрогены. Ароматаза присутствует в различных тканях и органах, включая яичники, жировую ткань, скелетные мышцы, печень, а также ткань опухоли молочной железы. У женщин в пременопаузе основным источником циркулирующих эстрогенов являются яичники, тогда как в постменопаузе эстрогены образуются главным образом вне яичников. Ингибирование ароматазы приводит к уменьшению образования эстрогенов у женщин как в пременопаузе, так и в постменопаузе. Однако в пременопаузе снижение биосинтеза эстрогенов компенсируется усилением синтеза гонадотропинов по принципу обратной связи — снижение синтеза эстрогенов в яичниках стимулирует выработку гипофизом гонадотропинов, которые, в свою очередь, усиливают синтез андростендиона, и уровень эстрогенов вновь повышается. В связи с этим ингибиторы ароматазы неэффективны у женщин в пременопаузе. В постменопаузе, когда яичники перестают функционировать, ось гипоталамус — гипофиз — надпочечники разорвана, и ингибирование ароматазы приводит к значительному подавлению биосинтеза эстрогенов в периферических тканях, а также в ткани опухоли молочной железы.
Первым и фактически единственным представителем ингибиторов ароматазы I поколения является аминоглутетимид — неселективный ингибитор ароматазы. Поскольку аминоглутетимид ингибирует целый ряд ферментов, участвующих в стероидогенезе (подавляет секрецию надпочечниками глюкокортикоидов (кортизола) и используется поэтому при болезни Иценко — Кушинга и др.), при его применении необходимо следить за функциональным состоянием коры надпочечников (может развиться ее гипофункция).
Поиски новых средств, обладающих большей селективностью, лучшей переносимостью и более удобным режимом дозирования, привели к появлению ингибиторов ароматазы II и III поколений. К настоящему времени созданы новые нестероидные (летрозол, анастрозол и др.) и стероидные (эксеместан) соединения этой группы.
Основным показанием для ингибиторов ароматаз является рак молочной железы у женщин в постменопаузе, в т.ч. при резистентности к терапии антиэстрогенами.
К группе ингибиторов биосинтеза гормонов надпочечников, используемых в онкологии, относят митотан и аминоглутетимид. Они подавляют секрецию глюкокортикоидов и могут вызывать деструкцию нормальной и опухолевой ткани коры надпочечников.
Глюкокортикоиды — преднизолон, дексаметазон (см. Глюкокортикостероиды) в связи с их лимфолитическим действием и способностью угнетать митоз лимфоцитов применяют при острых лейкозах (главным образом у детей) и злокачественных лимфомах.
В качестве противоопухолевых средств применяют также некоторые аналоги соматостатина. Например, октреотид и ланреотид используют для симптоматической терапии эндокринных опухолей гастроэнтеропанкреатической системы.

Противоопухолевые препараты пугают онкологических пациентов непредсказуемостью позитивного и частого негативного действия. Большинство пациентов предпочло бы остановиться на хирургическом лечении или облучении, но эти строго локальные методы не всегда технически возможны. На все опухолевые очаги системно удается воздействовать только лекарственными препаратами, поскольку они проникают всюду, где есть кровь вне зависимости от способа введения.
- Что такое противоопухолевые препараты и как они работают?
- Классификация и виды противоопухолевых средств
- Алкилирующие средства
- Противоопухолевые препараты растительного происхождения
- Противораковые препараты нового поколения
- Препараты на гормональной основе
- Побочные явления
Что такое противоопухолевые препараты и как они работают?
Все убивающие злокачественные клетки препараты можно называть противоопухолевыми, не смотря на существенную разнородность лекарственных молекул и механизм повреждающего действия. Большинство противоопухолевых препаратов влияет на деление клеток, нарушая структуру их ДНК или веретена, помогающего развести хромосомы в образующиеся дочерние клетки. Вероятно, цитостатики повреждают не только геном, лучше всего изучено их действие образование сшивок между частями одной нити ДНК и двумя параллельными нитями, заплетенными в спираль. У клетки есть способы для восстановления малого повреждения генетического аппарата, но при существенном нарушении она вынуждена уйти в сторону апоптоза — смерти.
Клеточные популяции в опухолевом узле очень разнородны: какие-то клетки только собираются делиться, другие уже вошли в процесс и активно синтезируют две копии структур для дочерней клеточки, некоторые находятся в покое, а часть после завершения жизненной программы устремилась к гибели. Считается, что находящиеся в состоянии покоя клеточные популяции устойчивы к агрессии противоопухолевых лекарств, зато делящиеся и планирующие войти в эту фазу — самые чувствительные к химиопрепаратам. Делящиеся клетки составляют фракцию опухолевого роста, чем она крупнее, тем агрессивнее рак и одновременно более чувствителен к противоопухолевому воздействию.
Классификация и виды противоопухолевых средств
Противоопухолевые лекарства представлены химиотерапевтическими препаратами, то есть цитостатиками, эндокринными или гормональными средствами, таргетными препаратами. Все они различаются механизмом инициации клеточной смерти.
Цитостатики используются с 1946 года и представлены несколькими группами лекарственных средств:
- алкилирущие получили свое название от химической реакции, реализующей ведущий механизм повреждения — алкилирование, то есть замену атома водорода нуклеиновых кислот нитей ДНК на алкильную группу лекарства с образованием связок и деформацией структуры;
- антиметаболиты прекращают жизнедеятельность клетки, вмешиваясь в её метаболизм и подменяя собой структурные компоненты нуклеиновых оснований ДНК и РНК или блокируя участвующие в синтезе этих оснований ферменты;
- противоопухолевые антибиотики тоже формируют ДНК-сшивки, а традиционное для антибактериальных препаратов противовоспалительное и противомикробное действие у них практически равно нулю;
- препараты растительного происхождения очень разнородны, преимущественный механизм действия — нарушение клеточного деления, общее у них одно — их выделили из растительного сырья, а позже стали синтезировать химическим способом, удешевляя и облегчая процесс производства;
- различные препараты невозможно было отнести к четырём основным группам ни по одному объединяющему критерию.
Алкилирующие средства
Это самые первые противораковые лекарства, начавшие историю химиотерапии. Ярчайшие представители группы — циклофосфамид, нитрозометилмочевина и производные платины.
Алкилирование противоопухолевыми агентами ДНК приводит к разрывам её цепи и сшиванию с закрученной в параллельную спираль второй нитью, образуемые сшивки не хаотичны — в определенном месте и с конкретным нуклеотидом. В конечном итоге предотвращается репликация, то есть сборка второго комплекта структур для разделения клетки. Принципиально алкилирование возможно в любую фазу клеточного цикла, но особенно активно осуществляется во время синтеза.
Препараты этой группы обладают широким противоопухолевым спектром, используются в терапии рака, в том числе сарком и онкогематологических процессов.
Циклофосфамид, более привычное торговое наименование циклофосфан, применяется более 60 лет в качестве компонента полихимиотерапии, в одиночку используется при злокачественных заболеваниях крови и лимфатической ткани. Вводится разными способами: в таблетках, внутривенно и внутримышечно. Для местного применения бесполезен, потому что активируется исключительно в ткани печени, куда попадает с кровью.
Редкая особенность препарата ифосфамида — наличие антидота уромитексана, защищающего слизистую мочевого пузыря от повреждений.
Первое производное платины — цисплатин было синтезировано в середине XIX века, а в клинику пришло в последней четверти прошлого века. Препарат легко проникает в клетки, потому что его молекула не заряжена ни положительно, ни отрицательно, чем и обусловлена его высокая агрессивность в отношении множества злокачественных процессов. Сегодня применяются уже три поколения платиновых производных, при неизменно высокой активности существенно различаются побочные эффекты.
Препараты нитрозометилмочевины преимущественно используются при злокачественных новообразованиях ЦНС и в онкогематологии.
Противоопухолевые препараты растительного происхождения
Вещества растительного происхождения представлены несколькими группами:
- винкаалкалоиды выделены из растения барвинок, у всех четырёх лекарственных средств идентичный механизм противоопухолевого действия — нарушение белка тубулина и вследствие этого остановка клеточного митоза;
- таксаны немногочисленны, первоначально был выделен из коры тихоокеанского тисового кустарника паклитаксел, а через 15 лет уже из игл европейского тиса добыли доцетаксел, сегодня таксаны наполовину синтетические, кроме высокой эффективности они стали первенцами среди слишком дорогих химиопрепаратов;
- камптотецины добывают из южно-китайского ниссового кустарника, препарат нарушает фермент топоизомеразу, не позволяя раскрутиться суперспирали ДНК, сегодняшние полусинтетические аналоги камптотецина топотекан используются при опухолях ЦНС, иринотекан незаменим в схемах химиотерапии карцином толстой кишки, легкого и яичников;
- эпиподофиллотоксины — полусинтетические аналоги смолы из корней американской мадрагоры и самый яркий представитель подгруппы — этопозид оказался эффективнее природного аналога.
Противораковые препараты нового поколения

Иммуноонкологические средства способствуют восстановлению естественной иммунной защиты организма, подавленной злокачественной опухолью. Средства отличаются от стандартных иммунных препаратов, аналогом которых были вырабатываемые организмом цитокины — интерферон и интерлейкин. Лекарства, как и таргетные, создаются целенаправленно на основе фундаментальных достижений науки. Иммунотерапия сдвинула с мертвой точки лечение меланомы, устойчивой к цитостатикам, мало чувствительный рак легкого и желудка, почечноклеточную карциному и рак печени.
Препараты на гормональной основе
Эндокринная терапия призвана снизить выработку половых гормонов или не допустить их внутрь опухолевой клетки, дабы исключить стимуляцию роста чувствительного к уровню гормонов злокачественного процесса.
Классификация эндокринных препаратов по механизму действия:
- центральные, подавляющие выработку гормонов гипофиза, регулирующих синтез эндокринных веществ половыми клетками, и главные представители группы — агонисты ЛГРГ;
- периферические — снижают функцию половых желез или нарушают в жировой ткани работу фермента ароматазы, отвечающего за трансформацию тестостерона в эстроген — группа ингибиторов ароматазы;
- клеточные — связывающиеся на мембране с рецептором и не пропускающие гормоны внутрь клетки и по своей сути антигормоны, как антиэстроген тамоксифен.
Применяются гормональные противоопухолевые лекарства при карциномах молочной и предстательной железы, а также некоторых вариантах рака тела матки, несущие на своей клеточной поверхности специальные рецепторы гормонов. Как правило, лечение рассчитано на несколько лет, поскольку реализация противоопухолевого эффекта очень медленная.
Побочные явления
Точка приложения противоопухолевых препаратов — клетка, причём не только опухолевая, но и нормальная, поэтому при противоопухолевой терапии закономерны осложнения. Спектр побочных эффектов каждого препарата изучен, но токсические проявления у отдельного пациента строго индивидуальны и непредсказуемы по интенсивности.
Даже препараты одной подгруппы при общем механизме действия имеют разные точки приложения, к примеру, очень небольшие отличия в строении алкалоидов барвинка винкристин и винбластин обернулись существенными различиями в спектре активности и токсичности, их применяют при разных болезнях. Скопированный с натурального растительного винбластина синтетический аналог виндезин, по биологическому действию и осложнениям больше походит на винкристин. Структурно схожий с природными винкаалкалоидами и полностью синтетический винорелбин по спектру действия и токсичности совсем не походит на натуральные аналоги.
Противоопухолевые лекарства не гарантируют 100% результата, раковые клетки уникальны в способности самовосстановления и скорости воспроизводства популяции.
Искусство химиотерапии — это не только умелый подбор оптимальной комбинации, обещающей максимально возможный результат, но и минимизация программных осложнений лекарственного лечения. В нашей Клинике не только помогают каждому пациенту легче перенести химиотерапию, но заблаговременно по индивидуальной программе, учитывающей все особенности организма, готовят к курсу лечения.
Читайте также: