Степень регрессии опухоли по шкале mandard или dworak
Академический редактор: Фрэнк А. Фризель
Задний план. Оценка влияния оценки регрессии опухоли при прогнозе пациентов с локально развитым ректальным раком (LARC). Материалы и методы. Мы идентифицировали из нашей базы данных о колоректальном раке 168 пациентов с ЛАРК, которые получали неоадъювантную терапию, а затем полную хирургическую операцию по удалению мезоректа в период между 2003 и 2011 годами: 157 получили химиолучевую терапию на основе 5-ФУ (CRT) и 11 кратковременных RT. Мы исключали 29 пациентов, остальные 139 были переоценены для рецидива и выживаемости; слайды хирургических образцов были пересмотрены и классифицированы в соответствии с оценками регрессии опухолей Mandard (TRG). Мы сравнивали пациентов с хорошим ответом (Mandard TRG1 или TRG2) по сравнению с пациентами с плохим ответом (Mandard TRG3, TRG4 или TRG5). Исходными результатами были 5-летняя общая выживаемость (ОС), безрецидивная выживаемость (DFS), локальная, отдаленная и смешанная рецидив. Результаты. Средний возраст составил 64,2 года, а медианное наблюдение — 56 месяцев. Статистически значимой разницы в выживаемости не было обнаружено при сравнении пациентов с Mandard TRG1 и Mandard TRG2 (p = .77). Хорошие ответчики Mandard (TRG1 + 2) имеют значительно лучшую ОС и DFS, чем плохие респонденты Mandard (TRG3 + 4 + 5) (OS p = .013; DFS p = .007). Выводы. Хорошие респонденты Мандара имели благоприятный прогноз. Опухолевую реакцию (TRG) на неоадъювантную химиолучевую терапию следует принимать во внимание при определении оптимальной схемы адъювантной химиотерапии для пациентов с LARC.
Колоректальный рак является третьим наиболее распространенным раком в развитых странах. Он занимает второе место в Португалии, и, по оценкам, каждый год более 7 000 новых случаев возникают у 8 португальских пациентов с колоректальным раком, умирающим в день, в среднем [1, 2]. Хирургия остается основным терапевтическим инструментом при лечении рака прямой кишки, а с появлением полного иссечения мезоректума (ТМЕ) при раковых заболеваниях средней и нижней прямой кишки удалось уменьшить локальный рецидив 4. Однако, что касается локально распространенного рака прямой кишки (LARC), этот подход оказался недостаточным для поддержания уровня локального рецидива между 4 и 6% [7, 8].
Неоадъювантная ЭЛТ позволяет уменьшить региональные рецидивы, а когда имеется полный патологический ответ (ypCR), подтверждается увеличение выживаемости [9].
Частота ответа лучше в неоадъювантном ЭЛТ по сравнению с длительным RT и, возможно, отсутствует в коротком курсе RT с немедленной хирургией. Фактически максимальный отклик излучения происходит только через несколько недель после его окончания [10]. По этой причине операция была отложена до 8-12 недель после неоадъювантного ЭЛТ 12.
Использование неоадъювантного ЭЛТ может привести к усадке опухоли, повышает вероятность выполнения операции по сохранению сфинктера, а в хирургическом образце увеличивается периферический и дистальный края, с уменьшением лимфатической и сосудистой инвазии 19.
Однако тип и скорость ремиссии до неоадъювантного ЭЛТ остаются значительно переменными. В то время как некоторые пациенты не могут реагировать, другие пациенты испытывают замедление, а 15-25% имеют хирургические образцы без каких-либо жизнеспособных опухолевых клеток, состояние, называемое патологическим полным ответом (ypCR) [20, 21].
Чтобы количественно оценить реакцию на неоадъювантный ЭЛТ, можно использовать различные системы, которые особенно важны в ситуациях, когда патологический ответ не завершен. Большинство из них имеют 5 классов, что позволяет создавать группы в соответствии с ответом [20, 32, 33].
Это исследование оценивает степень регрессии опухоли в соответствии с классификацией Мандара у пациентов с LARC, которые прошли неоадъювантный ЭЛТ с последующей хирургической резекцией с TME.
Была запрошена база данных с одним учреждением для последовательных пациентов с ЛАРК и подтвержденной биопсией ректальной аденокарциномой, у которых была неоадъювантная ЭЛТ с последующей плацебо-радикальной хирургией с ТМЕ с целебным назначением с 1 января 2003 года по 31 декабря 2011 года.
Критерии приема — пациенты с ректальным раком, расположенным на расстоянии менее 12 см от анального края и клинической стадии T2N + M0 или cT3 / 4 N0 / + M0.
Критериями исключения были пациенты с другой диагностированной неоплазией, кратковременным RT, IV стадии IV, операцией R1 / R2 и смертью в течение 60 дней после операции.
Все пациенты, получавшие неоадъювантный ЭЛТ, получали в среднем 8 недель после окончания лучевой терапии и были включены в этот анализ. Пациенты, получавшие облучение с коротким курсом, были исключены, так как при проведении немедленной операции не происходит ниспроверки.
Оценка стадирования включала в себя жесткую проктоскопию, общую колоноскопию, кожную, брюшную и тазовую КТ, эндоректальное ультразвуковое исследование (ERUS), изображение тазового магнитного резонанса (МРТ) (с 2008 года) и уровни карциноэмбрионального антигена в сыворотке.
Неоадъювантный CRT-протокол включал полное облучение 50,4 Гр в 28 фракциях и 5-фторурациле инфузионным насосом.
Радикальная хирургия состояла в основном из сфинктера, сохраняющего ректальную резекцию (SSRE) или абдоминоперинной резекции (APR) с TME. При выборе оперативной процедуры мы рассматривали расстояние поражения до ануса, сопутствующие заболевания пациента и состояние анального сфинктера.
Эксплуатируемые пациенты подвергались протоколу адъювантной химиотерапии в течение 6 месяцев, предпочтительно с 5-фторурацилом (5-ФУ) или комбинацией 5-ФУ и оксалиплатина.
Стандартная патологическая опухолевая постановка резецированного образца проводилась в соответствии с рекомендациями Американского объединенного комитета по раку. Граница периферической резекции (CRM) оценивалась как положительная, когда раковые клетки находились в пределах 1 мм от поля. Доказательства ypCR определяли как отсутствие жизнеспособной аденокарциномы в хирургическом образце или наличие озер слизи без опухолевых клеток. Гистология всех хирургических образцов была проверена и подтверждена независимым элементом и была классифицирована на основе системы оценки регрессии опухолей Mandard (таблица 1).
Мы разделили популяцию пациентов на основе TRG Mandard на две группы: хорошие респонденты, определенные как Mandard TRG1 / TRG2, и плохие респонденты, определенные как Mandard TRG3 / 4/5. Эти две группы были использованы для оценки результатов результатов.
Рецидив заболевания оценивали по локализации: локализованному (LR), системному (DR) или смешанному.
Ни один из пациентов не был потерян после наблюдения.
Все оставшиеся в живых пациенты наблюдались в нашем запросе за последние три месяца.
Время выживания определяли как интервал между началом неоадъювантной терапии и датой последнего наблюдения.
Онкологические результаты оценивались на 5-летнюю общую выживаемость (ОС), 5-летнюю выживаемость без заболевания (DFS), общий рецидив (OR), местный рецидив (LR) и отдаленный рецидив (DR).
Кривые выживания выполняли с использованием метода Каплана-Мейера и сравнивали по критерию логарифмического ранга.
Гистологическая дифференцировка рака молочной железы
Гистологическую градацию рака молочной железы (РМЖ) впервые ввел R.B. Greenough из Бостона, который в 1925 г. опубликовал анализ 73 случаев РМЖ.
Несмотря на то что прошло много времени и опубликовано большое количество работ о применении гистологической градации рака молочной железы, ничего существенного не добавлено в перечень морфологических критериев, которые определяют группы РМЖ, имеющие клиническое значение.
Работа R.B. Greenough актуальна и сегодня, он сформулировал прогностически значимые категории инвазивного рака молочной железы низкой, средней и высокой степени злокачественности.
Это деление базируется на 5 признаках:
1) тканевой (гистологической) организации опухоли, то есть способности образовывать дольки, протоки и железистоподобные структуры;
2) степени секреторной активности, которая подтверждается цитоплазматическими вакуолями, капельками муцина в просвете желез;
3) клеточной атипии, то есть единообразии или вариации размеров и формы клеток, соотношении размеров ядра и цитоплазмы;
4) наличии гиперхромных ядер;
5) наличии ядерной атипии и количества митотических фигур.
В соответствии с градациями по Greenough типы рака высокой степени злокачественности имеют клетки и ядра неправильной формы и различного размера, без секреторной функции, клетки расположены столбцами, отмечают гиперхроматоз ядер и большое количество атипичных митозов.
И наоборот, опухоли, состоящие из желез, построенных из единообразных по размеру и строению клеток без гиперхроматоза, с малым количеством митозов, следует относить к РМЖ низкой степени злокачественности.
По данным R.B. Greenough, после радикальной мастэктомии пациентки с раком низкой степени злокачественности были излечены в 68%, умеренной — в 33% случаев и нулевым был результат при высокой.
В 1928 г. Patey и Scarff из Лондона опубликовали анализ 50 случаев рака молочной железы. Они изучили корреляцию между гистологической градацией по Greenough, статусом лимфатических узлов и выживаемостью пациенток. Выявлено, что пациентки с раком низкой степени злокачественности после радикальной мастэктомии излечивались в 85%, средней степени — в 45% и высокой — в 23% случаев.
Кроме того, авторы отметили, что прогноз течения заболевания всегда хороший при отсутствии метастазов в лимфатических узлах, изъязвления опухоли и распространения ее на фасции независимо от гистологической степени злокачественности по Greenough.
Они также сделали заключение, что в случаях нераспространенного РМЖ более продолжительный период ремиссии, то есть период до появления метастазов или рецидивов после радикальной мастэктомии, у пациенток с опухолью низкой степени злокачественности по Greenough, а в случаях распространенного рака — более эффективна паллиативная терапия.
Последующая работа H.J.C. Bloom из Лондона, опубликованная в 1950 г., подтвердила выводы Patey и Scarff. В классическом труде Bloom-Richardson, опубликованном в 1957 г., окончательно сформулированы критерии гистологической градации РМЖ. В своей работе они проанализировали течение болезни 1409 пациенток, из которых 359 прожили более 15 лет.
Подобно R.B. Greenough, исследователи разделили рак молочной железы (РМЖ) на 3 категории, базируясь на трех показателях:
1) относительном количестве тубулярных структур;
2) наличии вариаций размеров клеток рака;
3) количестве гиперхромных ядер и фигур митоза.
Каждый из этих показателей авторы оценили в баллах (1, 2 или 3 балла). Суммируя количество баллов, получим возможные комбинации от 3 до 9. Наименьшее количество баллов соответствует наиболее низкой степени злокачественности рака молочной железы.
Авторы разделили шкалу злокачественности на три части: 3, 4 или 5 суммарных баллов — низкая степень злокачественности (grade 1); 6 или 7 суммарных баллов — средняя (grade 2); 8 или 9 — высокая (grade 3). Эта схема стала наиболее популярной в мире и называется схема градации РМЖ по Bloom-Richardson или технология Scarff-Bloom-Richardson, хотя должна была называться техникой градации по Greenough, в честь человека, впервые опубликовавшего эту градацию в 1925 г.
Bloom и Richardson установили, что 26% из 1409 исследованных случаев РМЖ имели 1-ю степень гистологической злокачественности, 45% — 2-ю, 29% — 3-ю. Результаты сравнения гистологических степеней злокачественности первичной опухоли и метастазов в аксиллярных лимфатических узлах показали, что в 82% степени совпадали.
В 12% случаев степень злокачественности была выше, а в 6% — ниже в метастазе, чем в первичной опухоли. Авторы выявили, что степень гистологической злокачественности, как и статус регионарных лимфатических узлов, дает независимую прогностическую информацию (табл. 2).
Таблица 2. Выживаемость пациенток с РМЖ в соответствии с градационной схемой Bloom-Richardson (исследованы 1409 пациенток). 
Bloom и Richardson пришли к выводу, что степень гистологической злокачественности рака молочной железы отражает предполагаемое клиническое течение заболевания и вероятность развития метастазов в дальнейшем, что стало в свое время очень прогрессивным учением.
Очевидно, что степень гистологической дифференцировки имеет корреляцию с темпами роста опухоли и соответственно показателями S-фазы митотического цикла (ЗН-тимидина, Ki67), показателями анеуплоидии, экспрессией С-егВ-2, рецепторов эстрогена и прогестерона.
Важность этого показателя очевидна, однако в ряде публикаций гистологическое стадирование подвергается жесткой критике из-за трудности, возникающей при его воспроизводимости. Отмечают, что процент расхождения в оценке гистологической дифференцировки иногда составляет 50-60%.
Однако когда критерии оценки гистологической степени злокачественности оценивают профессионально и тщательно, совпадение результатов этой оценки составляет 90%.
H.F. Frierson и соавторы прорецензировали патологоанатомические заключения 7 патологоанатомов, проводивших исследование 75 случаев инвазивного протокового РМЖ. Совпадение при оценке гистологической структуры составило 71%, тубулярных структур — 81%, полиморфизма ядер — 64%, митозов — 67%.
C.W. Elston рекомендует проводить двойное исслeдoвание. Это возможно при проведении исследования двумя патологами или одним патологом дважды на разных образцах.
Следующим недостатком предложенной Bloom и Richardson системы градаций РМЖ стало то, что большая часть пациентов относится к 2-й и 3-й степени градации. С .W. Elston, используя модифицированную систему гистологической градации Bloom и Richardson, исследовал рак молочной железы у 1831 пациентки с периодом наблюдения 16 лет и диагностировал 1-ю степень гистологической дифференцировки рака в 18%, 2-ю — в 34%, 3-ю — в 47% случаев.
Автором отмечена очень выраженная корреляция с клиническим прогнозом. У пациенток с раком 1-й степени злокачественности значительно лучшая выживаемость, чем со 2-й и 3-й степенью (р
План лечения составляют с учётом стадии опухолевого процесса, морфологической структуры опухоли, возраста больной, сопутствующих заболеваний, общего состояния пациентки. Применяют следующие методы лечения: хирургический, комбинированный (сочетание операции с лучевой или лекарственной терапией) и ком.
По данным многочисленных публикаций, этиология и патогенез РМЖ сложны и определяются сочетанием многих факторов. Гормональная регуляция функции молочных желез значительно сложнее, чем эндометрия. Помимо эстрогенов и прогесторона, развитие молочных желез в пубертатном периоде, их функция во время бер.
Гистологическую градацию рака молочной железы впервые ввел R.B. Greenough из Бостона, который в 1925 г. опубликовал анализ 73 случаев рака молочной железы. Несмотря на то что прошло много времени и опубликовано большое количество работ о применении гистологической градации рака молочной железы, ниче.
При анализе данных, получаемых с помощью ультразвукового исследования, целесообразно выделить ряд диагностических задач, решение которых позволит получить полный комплекс эхографических признаков рака молочной железы и метастатических лимфатических узлов, по которым в дальнейшем будет производиться .
Патологические процессы в молочной железе отличаются многообразными клиническими проявлениями, что норой создает серьезные дифференциально-диагностические трудности. Для гипеколога важнее всего заметить (не пропустить!) патологию молочных желез, что приведет в движение систему методов уточня.
Доброкачественные изменения молочных желез относятся к наиболее распространенным заболеваниям и включают различные по клиническим, морфологическим и этиологическим признакам процессы. Отличительной особенностью молочной железы является сложность четкой дифференцировки физиологических и патологически.
Рак молочной железы развивается из эпителия млечных протоков и альвеол. Патоморофологическая характеристика рака молочной железы включает такие параметры, как размер первичного очага, его локализацию в молочной железе, тип роста, морфологическое строение, степень дифференцировки, наличие регионарных.

В гистологическом заключении содержится подробная информация об опухоли. Одним из важных параметров опухоли, который можно найти в вашем гистологическом заключение, — это степень ее злокачественности. По сути, это описание того, как клетки злокачественной опухоли выглядят под микроскопом, насколько они отличаются от нормальных клеток (уровень клеточной дифференцировки).
Гистологическая степень злокачественности (Grade, G) рака молочной железы определяет агрессивность опухоли, её потенциал к прогрессированию и метастазированию. Этот критерий порой играет ключевую роль в определении оптимального варианта лечения.
Ноттингемская модификация системы Скарфа-Блума-Ричардсона используется в настоящее время для определения гистологической степени злокачественности рака молочной железы. Ноттингемская градирующая система рекомендована различными профессиональными организациями на международном уровне (ВОЗ, AJCC, EU).
Зачем необходимо гистологическое градирование рака молочной железы?
Выполнена биопсия, у вас подтвердился диагноз — карцинома молочной железы. И теперь вам интересно знать, какое лечение лучше всего для вас подходит и каков прогноз.
Прежде всего, чтобы это узнать, необходимо определить стадию онкологического заболевание. Многие ошибочно думают, что степень злокачественности и стадия рака молочной железы это одно и тоже.
Стадия рака (карциномы) указывает на размер первичной опухоли и ее распространённость (уровень поражения регионарных лимфатических узлах, наличие или отсутствие отдалённых метастазов). Кроме того, учитываются и другие критерии. Стадия определяет насколько серьезен ваш рак, и какое лечение лучше всего вам подходит.
Степень злокачественности карциномы — это одним из критериев, которые используются при стадировании рака молочной железы. Это показатель оценивает характеристики раковых клеток, с его помощью можно предсказать дальнейшее поведение онкологического заболевания.
Степень злокачественности является лишь одним из параметров, которые используются для определения стадии опухоли молочной железы. Другими являются размер и местоположение опухоли, инвазия в сосуды и нервы, количество пораженных лимфатических узлов и степень отдалённого метастазирования.
Как определяется степень злокачественности рака молочной железы?
Ноттингемская градирующая система является обновлением предыдущей системы Скарфа-БлумаРичардсона. Последняя была впервые принята в 1957 году. Ноттингемская градирующая система основана на полуколичественной оценке морфологических характеристик опухоли. С ее помощью можно определить, насколько агрессивным будет злокачественное новообразование.
Опухоли низкой степени злокачественности, у которых злокачественные клетки практически ничем не отличаются от нормальных, имеют тенденцию к медленному росту. В свою очередь, опухоли с высокой степени злокачественности быстро растут и рано дают метастазы. Их клетки сильно отличаются от нормальных.
Градирование рака молочной железы (определение степени злокачественности) подразумевает оценку 3 компонентов, каждый из которых оценивается от 1 до 3 баллов: железистая дифференцировка (соотношение тубулярных/ацинарных/железистых структур), ядерная атипия/полиморфизм и количество митозов.
Этот компонент оценивается соотношения нормальной ткани молочной железы и изменённой. Это так называемая железистая дифференцировка, которая гарантируется следующим образом:
Количество делящихся (митотических) клеток, видимых под микроскопом при увеличении в 400 раз, градируется следующим образом:
| 1 балл | менее 10 митотических клеток |
| 2 балла | от 10 до 19 клеток |
| 3 балла | более 20 клеток |
Оценивается размер и форма ядра в злокачественных клетках.
| 1 балл | ядра маленькие, немного увеличены по сравнению с эпителием нормальных структур, с правильными очертаниями, моноформным ядерным хроматином, небольшой вариацией в размерах |
| 2 балла | клетки больше, чем нормальные эпителиальные клетки, с везикулярными ядрами, заметными ядрышками, умеренными различиями в размерах и форме |
| 3 балла | везикулярные ядра, часто с заметными ядрышками, выраженные различия по форме и размеру, иногда с очень крупными и причудливыми формами |
Три выше перечисленных компонента объединяются для определения степени злокачественности опухолии. Чем выше степень злокачественности, тем рак молочной железы более агрессивен, обладает большим потенциалом к метастазированию.
| Общая градация | Степени злокачественности | Внешний вид клеток |
| От 3 до 5 | G1, I степень злокачественности | Хорошо дифференцированы (выглядят нормально, медленно делятся, не агрессивны) |
| От 6 до 7 | G2, II степень злокачественности | Умеренно дифференцированы (полунормальные) |
| От 8 до 9 | G3, III степень злокачественности | Плохо дифференцированы (ненормально, агрессивны) |
Статья по теме: Как быстро растет и распространяется рак молочной железы?
Степень злокачественности и стадия опухоли
Степень рака будет использоваться для постановки вашего рака, то есть, насколько прогрессировал ваш рак.
Постановка поможет вашему врачу решить, какое лечение может полностью искоренить злокачественную опухоль с наименьшим количеством вреда. Например, рак на ранней стадии может потребовать хирургического вмешательства или облучения, в то время как рак на поздней стадии может нуждаться в лечении химиотерапией.
Постановка диагноза рака молочной железы подразумевает методологии:
- Клиническая стадия основана на всей доступной информации, полученной до операции, включая результаты ваших физических обследований и визуальных исследований (таких как рентген и компьютерная томография или компьютерная томография).
- Патологическая стадия использует те же тесты, но также включает оценку патологом опухолевой ткани и лимфатических узлов, удаленных в ходе операции.
Патологическая стадия считается более точной, поскольку она включает в себя прямое исследование опухоли. Тем не менее, клиническая стадия может быть целесообразной в некоторых ситуациях, учитывая, что не все виды рака требуют хирургического вмешательства.
TNM классификация
Что касается рака молочной железы, классификация злокачественных опухолей (TNM) TNM является системой, наиболее часто используемой для постановки. Он широко используется для постановки многих видов рака (за исключением случаев рака крови или злокачественных новообразований центральной нервной системы). Наиболее распространенные опухоли имеют собственную систему классификации TNM.
TNM обозначает опухоль, узлы и метастазы, в частности, размер опухоли (T), количество лимфатических узлов, пораженных раком (N), и степень метастазирования (M).
Узнайте больше: Система TNM для классификации рака молочной железы
Когда ваш врач получит отчет о патологии, будут учтены как степень, так и стадия рака — по шкале от 0 (неинвазивный) до 4 (метастатический).
В отчете о патологии также будет подробно:
- Есть ли у вас одна или несколько опухолей в пораженной груди
- В какой степени злокачественная опухоль ограничивается грудью
- Обнаружен ли рак в лимфатических узлах под рукой
- Если рак распространился на сосок и кожу
- При наличии свободных от рака полей вокруг удаленной опухоли
- Если рак является эстроген-позитивным или эстроген-негативным (показатель того, может ли гормон влиять на рост опухоли)
Основываясь на этих выводах и особенностях, ваш врач разработает план лечения, который вы сможете рассмотреть и обсудить. Если есть что-то, что вы не понимаете, спросите своего врача об этом и как это влияет на решение о лечении.
Список использованных источников:
Градация (Grade) — категория степени гистологической злокачественности, основанная на том, как атипичные клетки и опухолевая ткань в целом выглядят при световой микроскопии.
Степень злокачественности опухоли не совпадает со стадией. Стадия определяется комбинацией значений T, N, M, описывающих размер первичной опухоли, поражение регионарных лимфатических узлов и наличие метастазов и их характеристику. Валидные гистологические системы классификации достаточно длительно используются при верификации рака молочной железы [1], предстательной железы [2], эндометрия [3], сарком мягких тканей [4] и опухолей почек [5].
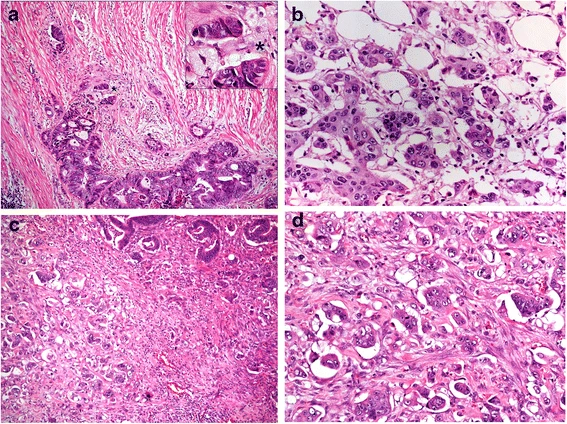
Для некоторых опухолей для определения градации используют уникальные по гистологическому строению участки. Например, низкодифференцированные кластеры (poorly differentiated clusters, PDCs) рассматриваются в качестве гистопатологического предиктора рака прямой кишки. PDCs состоит из пяти и более раковых клеток, которые формируют инвазивный компонент при отсутствии железистой паренхимы опухоли (рис.1) [6].
.
Рассмотрим для примера определение гистологической градации при раке молочной железы. Для объективизации процесса и унификации используется полуколичественная оценка морфологических характеристик опухоли. В настоящее время она представлена Ноттингемской модификацией системы Скарфа-Блума-Ричардсона или Ноттингемской градирующей системой, принятой во всем мире. Кратко ее пункты отражены в таблице 1 (и пусть вас не запутает мнемоника, основанная на аналогии с Tumor/Nodulus/Metastasis).
.

Разберем составляющие ингредиенты гистологической градации.
Оценка железистых структур проводится во всех участках доставленного материала. В зависимости от доли фрагментов с наличием таких элементов выставляется определенное число баллов:
- 1 балл – более 75 % опухолевого поля формируют железистые/тубулярные структуры
- 2 балла — от 10 % до 75 % опухолевого образца
- 3 балла – менее 10 % опухолевого образца.
Не всякая щель в препарате – железа, могут быть и артифициальные повреждения материала. Нам нужны только структуры с четко определяемым центральным просветом, окруженным поляризованными злокачественно трансформированными клетками.
Ядерный полиморфизм – морфологическое проявление опухолевой дифференцировки на цитологическом (клеточном) уровне. Это визуальный паттерн генетических поломок в опухолевой клетке: анеуплоидии, генетической нестабильности и изменения транскрипции.
Индивидуальность во взглядах делает нас особенными личностями, но, к сожалению, в морфологической оценке выражается в субъективизме, особенно при рассмотрении ядер клеток.
Ядерный полиморфизм оценивается по балльной системе:
- 1 балл — ядра маленькие, незначительно увеличены по сравнению с клетками эпителия нормальных структур, с правильными очертаниями, моноформным ядерным хроматином, невыраженной разницей в размерах
- 2 балла — клетки больше, чем нормальные эпителиоциты, с везикулярными ядрами, выраженными ядрышками, умеренными различиями в размерах и форме.
- 3 балла — везикулярные ядра, часто с заметными ядрышками, значимые различия по форме и размеру, зачастую с причудливыми формами.
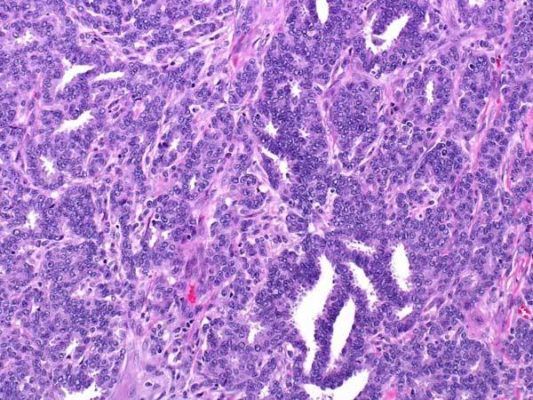
Рисунок 2. Grade 1: инвазивная протоковая карцинома состоит из небольших желез с достаточно однотипными ядрами. Карциномы G1 менее агрессивны и имеют лучший прогноз, чем менее дифференцированные. Они также чаще ER-положительные (иммуногистохимический показатель — экспрессия рецепторов эстрогена на опухолевых клетках), что является еще одной особенностью, связанной с более благоприятным прогно зом.
.
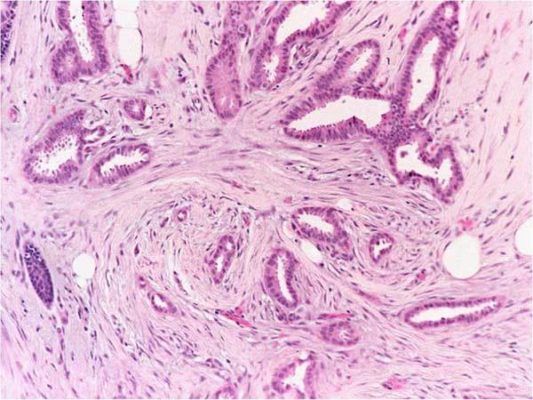
Рисунок 3. Grade 2: некоторые участки этой инвазивной протоковой карциномы образуют структуры наподобие трубчатых желез, но другие области представлены плохо сформированными железами с гнездными скоплениями клеток, содержащих умеренно атипичные ядра. Карциномы G2 имеют промежуточный прогноз.
.
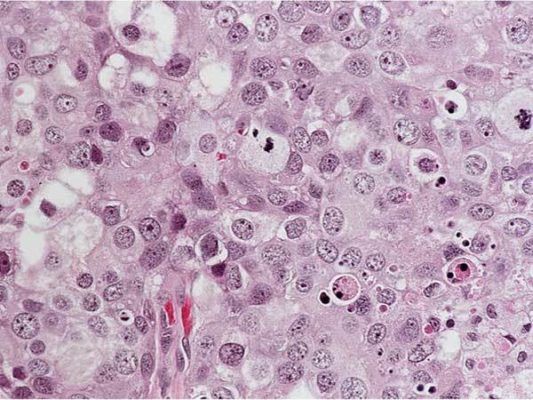
Рисунок 4. Grade 2: эта инвазивная протоковая карцинома состоит из отдельных и гнездно расположенных атипичных клеток с выраженным ядерным полиморфизмом и высокой митотической активностью. Карциномы G3 имеют максимально неблагоприятный прогноз. Молекулярный подтип таких опухолей чаще трижды негативный (отсутствует экспрессия рецепторов эстрогена, прогестерона, отрицательный HER2), что ассоциировано с агрессивным поведением опухоли и худшим прогнозом.

А — объектив Nikon или Labophot с кратностью увеличения в 40 раз (40x) или сопоставимый с диаметром поля 0,44 мм;
В — объектив Leitz или Ortholux 25x или сопоставимый с диаметром поля 0,59 мм;
С — объектив Leitz или Diaplan 40x или сопоставимый с диаметром поля 0,63 мм.
Итоговая оценка Grade основана на подсчете суммы 3 вышеуказанных компонентов:
- I степень злокачественности (Grade 1, G1) = от 3 до 5 баллов
- II степень злокачественности (Grade 2, G2) = 6–7 баллов
- III степень злокачественности (Grade 3, G3) = 8–9 баллов
Читайте также:

