Стентирование кисты поджелудочной железы
Стентирование желчных протоков — это малоинвазивное хирургическое вмешательство, которое применяется для восстановления проходимости желчных протоков (ЖП) и предотвращения его повторной обтурации (закупорки).
Непроходимость желчного протока могут вызвать различные заболевания, но чаще всего это злокачественные новообразования гепато-билиарной системы, желчно-каменная болезнь, пороки развития. При невозможности нормального выделения желчи, развивается механическая желтуха — грозное состояние, которое оказывает влияние на весь организм и при отсутствии лечения может привести к летальному исходу.
Главными методами устранения непроходимости ЖП является установка стента (металлического каркасного устройства) в место сужения протока. Он поддержит стенки в расправленном состоянии и обеспечит нормальный дренаж желчи.
В настоящее время используются самораскрывающиеся металлические и пластиковые стенты. Пластиковые конструкции менее долговечные и надежные, средний срок их эксплуатации составляет около 3-х месяцев. В онкологии получили широкое распространение элютированные стенты, которые имеют лекарственное покрытие, предотвращающее прорастание в его просвет опухоли.
- Показания
- Противопоказания к стентированию желчных протоков
- Подготовка к процедуре
- Разновидности стентирования
- Результат
- Возможные осложнения
- Альтернативы
Показания
- Злокачественные опухоли гепато-билиарной системы:
- Рак печени.
- Рак 12-перстной кишки.
- Рак фатерова сосочка.
- Рак поджелудочной железы.
- Метастазы в печень и гепато-дуоденальную связку.
- Стенозы и стрикруры желчевыводящего протока, возникшие в результате пороков развития или предыдущих хирургических вмешательство на органах гепато-билиарной системы.
- Синдром Мириззи.
Противопоказания к стентированию желчных протоков
- Распад опухоли с развитием кровотечения.
- Выраженный стеноз желчного протока, при котором к нему невозможно подвести эндоскопические хирургические инструменты.
- Наличие кишечной непроходимости (операции проводятся после купирования данного состояния).
Подготовка к процедуре
В рамках подготовки к стентированию ЖП пациент проходит комплексное обследование, которое включает ряд лабораторных анализов и инструментальных методов исследования:
- Общий и биохимический анализы крови.
- Коагулограмма — анализ, который отражает работу кровесвертывающей системы.
- Ультразвуковое исследование печени и желчевыводящих протоков.
- Ретроградная холангиография — исследование проходимости ЖП.
При необходимости проводится КТ и/или МРТ, которые позволят уточнить продолжительность стеноза и лучше спланировать проведение операции.
Разновидности стентирования
В настоящее время существует несколько техник стентирования ЖП. Одни предполагают проведение всех манипуляций через просвет 12-перстной кишки. Такое вмешательство называется эндоскопическое стентирование, поскольку предполагает использование эндоскопической техники. Также стент может устанавливаться с помощью чрескожной пункции желчного протока под контролем УЗИ.
Эндоскопическое стентирование выполняется во время проведения фиброгастродуоденоскопии (ФГДС). Сначала производится осмотр поверхности 12-перстной кишки и фатерова сосочка (места выхода общего желчного протока). После чего, в просвет протока вводится проводник, внутри которого находится стент в сложенном состоянии. Он доставляется непосредственно к месту стеноза и только после контроля правильности установки, его расправляют. Контроль осуществляют с помощью рентгена. Если имеется очень сильный стеноз, проводят балонную дилятацию протока, это позволит расширить его просвет и правильно установить стент.
Сначала под контролем УЗИ производится пунктирование желчного протока. УЗИ поможет определить расширенные желчные протоки и безопасно ввести иглу в их просвет.
Далее производят дренирование и санацию протока. Затем к месту стеноза подводят специальный инструмент — интродьюсер. Он расширит проток и будет поддерживать его в таком состоянии, пока не установят стент. Стентирование производится обычным способом. В сложенном состоянии его подводят к месту стеноза, проверяют правильность расположения и только после этого производят его раздувание и фиксацию.
Результат
После проведения стентирования ЖП, восстанавливается пассаж желчи по желчным путям, и она может опять поступать в просвет кишечника. Постепенно будут уходить симптомы желтухи, снизится уровень билирубина, нормализуется пищеварение.
Возможные осложнения
- Кровотечения. Причиной развития кровотечения может быть нарушение функции свертывания крови из-за длительной желтухи, повреждение измененной опухолью стенки протока, смещение стента во время или после установки, повреждение кровеносных сосудов во время чрескожной пункции.
- Инфекционные осложнения. Из-за застоя желчи происходит активное размножение патогенной флоры, в частности анаэробной микрофлоры. Благодаря высокому давлению в желчных протоках, развивается холангио-венозный рефлюкс, при котором инфицированная желчь попадает в кровоток. Ситуация усугубляется иммунологическими нарушениями, которые возникают на фоне желтухи. В целом, чем дольше существует холестаз, тем выше инфекционные риски.
- Образование желчного затека — попадания желчи в брюшную полость. Причинами тому может быть высокое давление и нарушение целостности желчных протоков, нарушение целостности капсулы печени при проведении многократных поисковых пункций. Поскольку при механической желтухе желчь со временем инфицируется, при ее попадании в брюшную полость развивается такое грозное осложнение, как перитонит.
- Нарушение проходимости стента. Такие ситуации могут возникнуть при смещении стента, его инкрустрации желчными конкрементами, а также при прорастании опухоли внутрь его просвета. В любом из этих случаев требуется повторная операция.
Альтернативы
Как правило, стентирование желчных протоков при онкологии является временной процедурой. В большинстве случаев опухоль продолжает расти и ситуация обтурации возникает вновь. Это приводит к необходимости рестентирования и/или проведения полноценных операций на гепатобилиарной системе с удалением новообразования или наложением обходных анастамозов для желчеотведения.

Рубрика: Медицина
Дата публикации: 25.05.2015 2015-05-25
Статья просмотрена: 725 раз
Актуальность. Наиболее частым осложнением острого панкреатита, развивающимся у 20–60 % пациентов, перенесших деструктивный панкреатит, являются псевдокисты поджелудочной железы (ПЖ) [4, 8, 10]. При деструктивных формах острого панкреатита и травме ПЖ кисты формируются в 50–92 % наблюдений [6]. Хронический панкреатит осложняется формированием кистозных образований в 20–40 % случаев [1, 2].
Частота осложнений и летальность при псевдокистах ПЖ сохраняется на высоком уровне. Инфицирование содержимого кист в среднем составляет 20 %, при этом послеоперационная летальность варьирует от 28 до 67 %. Частота аррозивного кровотечения в полость кисты, брюшную полость или желудочно-кишечный тракт составляет 1,6–20 %. Перфорация кист в свободную брюшную полость, сальниковую сумку или полый орган достигает 20 % от числа всех осложнений. Наиболее опасной формой этого осложнения является прорыв кисты в брюшную полость с развитием перитонита, что наблюдают у 5–15 % больных. Сдавление различных отделов желудочно-кишечного тракта кистами ПЖ возникает в 3–4 % случаев [3, 6, 7].
Выделяют три основных варианта хирургического лечения кист ПЖ: резекция с удалением части поджелудочной железы или цистэктомия в изолированном варианте, наружное или внутреннее дренирование [9]. Все эти опреации достаточно травматичны, сопряжаны с риском возникновения интра- и послеоперационных осложнений, продолжительным периодом стационарного и поликлинического периодов лечения. Формированием длительно функционирующего наружного панкреатического свища [5, 6, 9].
В настоящее время все большую актуальность приобретают методы малонвазивных вмешательств при кистах ПЖ: чрезкожные пункции с установкой катетера в полость кисты под контролем УЗИ или КТ, а также выполнение внутреннего эндоскопического (транслюминального) дренирования. [2, 10, 11].
При псевдокистах, локализующихся в области головки поджелудочной железы и диаметре до 5 см, имеющих связь с протоковой системой органа возможна транспапиллярная эндоскопическая установка дренажа в полость кисты. По данным различных авторов пункционно-дренирующие вмешательства под контролем лучевых методов диагностики и эндоcкопии приводят к окончательному выздоровлению от 11,8 до 69,6 %. [2, 5, 6, 8, 9,10]
В России эндоскопическая цистогастростомия впервые была выполнена 2 февраля 1986 г. [11]. В настоящее время транслюминальное дренирование рекомендовано в качестве терапии первой линии для неосложненных кист, доступных для эндоскопических манипуляций. Применение этой технологии для лечения осложненных кист ПЖ, в том числе инфицированных является весьма актуальным и перспективным.
В зависимости от размера псевдокисты (По данным УЗИ и МСКТ) пациенты распределились следующи образом: гигантские (более 15 см) — 2, большие (от 10 до 15 см) — 7, средние (от 5 до 10 см) — 4. У 2 пациентов с гигантскими псевдокистами имело мест сдавление окружающих органов и тканей (желудок, ДПК, гепатоудоденальная связка), при этом явлений механической желтухи и признаков стеноза выходного отдела желудка не отмечалось. По характеру содежимого кисты: у 8 пациентов кисты были инфицированными (в полости гной, у нескольких пациентов с элементами секвестрации ПЖ), у 5 пациентов -неинфицированные. У 12 пацентов связи полости псевдокисты с вирсунговым протоком выявлено не было, у 1 пациента (после резекции ПЖ) вирсунгов проток сообщался с полостью псевдокисты.
Выбор метода стентирования постнекротических кист определялся непосредственно при эндоскопическом исследовании и зависел от расположения кистозного образования, стоения стенок, взаимоотношения с соседними органами и характера содержимого кисты.
Показанием к выбору пластиковых стентов было гомогенное содержимое кисты. Для выбора металлических самораспраляющихся стентов показаниями служили: отсутствие четкой стенки образования, наличие секвестров, инфицирование образования, киста более 6 см в диаметре, толщина ткани между стенкой ЖКТ и образованием не более 1 см, наличие бессодудистой зоны.
Первым этапом в условиях общей внутривенной анестезии проводили осмотр стенок желудка и ДПК, выявляли выбухание стенки желудка к которой предположительно предлежит кистозное образование, окончательная верификация кисты выполнялась с помощью эндоскопической ультрасонографии (Эндо-УЗИ) (рис. 1). Эндо-УЗИ позволяет точно лоцировать псевдокисту, определить расстояние между стенками псевдокисты и верхних отделов ЖКТ, характер содерижимого кисты, выявить бессосудистую области для безопасной установки дренажного устройства (Рис.2)
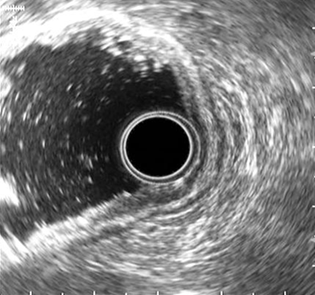
Рис. 1. Эндоскопическая ультрасонография (ЭУС): Определяем расстояние между стенкой желудка и стенкой псевдокисты, эхо-характер содежимого
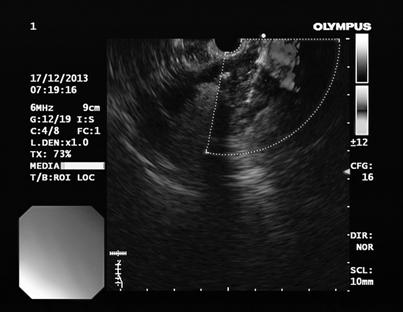
Рис. 2. Эндо-ультрасонография с доплерографией для выявления бессосудистой области стенки желудка
Далее через бессосудистую зону стенки желудка в полость кисты вводится струна-проводник. С помощью С-дуги производится рентген-контроль введения проводника в полость кисты (Рис. 3). Выполняется контрастирование полости кисты для установления разгермитизации протоков поджелудочной железы. У всех 13 пациентов сообщения полости образования с панкреатическим протоком ывявлено не было. По струне проводнику в полость кисты устанавливается пластиковый или металлический стент. Инструменты извлекаются, и проводится визуальный осмотр стента (Рис. 4).
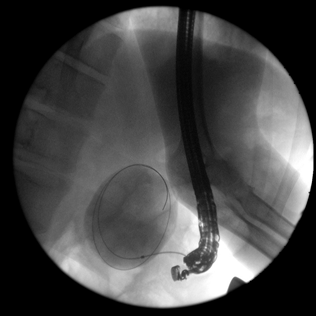
Рис. 3. Рентген-контроль введения струны-проводника в полость кисты
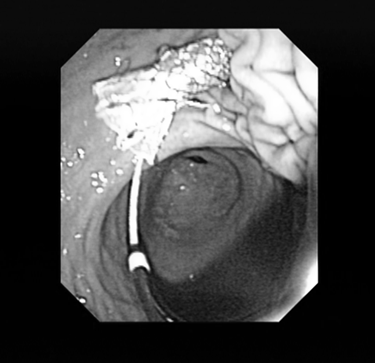
Рис. 4. Визуальный осмотр установленного стента
Пациентам с гигантскими псевдокистами в дополнение к транслюминальному дренированию было выполено наружное дренирование псевдокист под УЗИ-контролем, 1 паценту с послеоперационной псевдокистой после резекции хвоста ПЖ — выполнено ЭРХПГ, ЭПСТ, стентирование вирсунгового протока, 7 пациентам только трансгастральное дренирование.
Всем пациентам было выполнено трансгастральное дренирование с использованием пластиковых и металлических саморасправляющихся стентов.
После проведенного транслюминального дренирования псевдокист ПЖ для оценки динамики полости кисты мы использовали УЗИ и МСКТ.
Результаты. Пациент Ч., 25 лет, поступил с клиникой гигансткой псевдокисты ПЖ. Давность панкреонекроза 6 месяцев. По данным УЗИ брюшной полости при поступлении: в проекции хвоста поджелудочной железы объемное жидкостное образование 9,5*8,6см, кпереди от него аналогичное образование 7,3*4,9см, в области эпигастрия, по передней брюшной стенке -- жидкостное образование неоднородной структуры 4,9*2,2см (вероятно это одно многокамерное обр-е, общим размером 12,6*7,8см). По данным МСКТ: в области хвоста поджелудочной железы по передней поверхности, крупное неправильной формы жидкостное образования с наличием перетяжек, четко отграниченная капсула, общие размеры 12,8х8,7х21,2 см., расположенного между задней стенкой желудка, селезенкой и левой почкой, распространяется вдоль переднего листка фасции Герота до левой подвздошной области. (Рис. 5, 6)
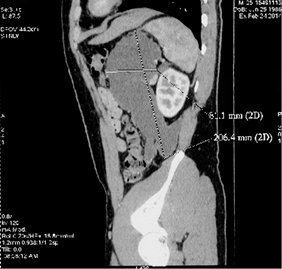
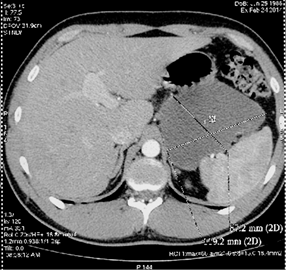
Рис. 5, 6. МСКТ брюшной полости с конратированием пациента Ч.
Учитывая клинику и данные обслдедований, пациенту Ч. проведено трансгастральное дренирование псевдокисты под ЭУС-наведением. (Рис. 7, 8)
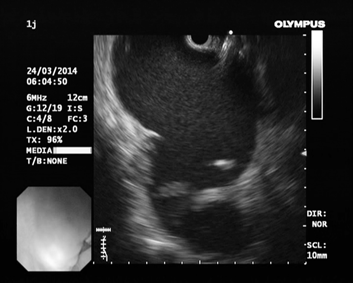
Рис. 7 Эндосонография (ЭУС)
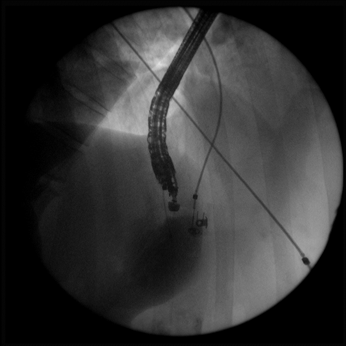
Рис. 8 Рентген-контроль установки проводника
В послеоперационном периоде у пациента Ч. возникла лихорадка до 39 гр С, обусловлена резорбцией содержимого псевдокисты. Пациенту проводилась консервативная системная антибактериальная, противовоспалительная терапия. Температура тела нормализовалась через 3 дня. Пациент был выписан в удовлетворительном состоянии. На контрольном УЗИ брюшной полости через месяц после вмешательства: остаточная полость до 1,23*1,0 см.
У одного пациента по время манипуляци произошел прорыв содержимого псевдокисты в сальниковую сумку, в связи с чем пациент был экстренно оперирован. У одного пациента на контрольном осмотре произошла дислокация стента в полость кисты, повторное стентирование также привело к дислокации стента, в связи с чем пациент был оперирован открыто. У 6 пациентов с инфицированными кистам в раннем послеоперационном периоде наблюдался субфибриллитет, жалобы на боль в эпигастрии, лабораторно умеренный лейкоцитоз, пациентам проводилась системная антибактериальная, противовоспалительная терапия, на фоне которой температура тела и лабораторные показатели нормализовались, болевой синдром полностью купирован. У 5 пациентов с неинфицированными кистами в раннем послеоперационном периоде были жалобы на боли в эпигастрии в течение 2 дней после операции, подъемов температуры тела не наблюдалось, лейкоцитоза за весь период наблюдения не было, пациентам с профилактической целью проводилась системная антибактериальная терапия. Все 11 пациентов были выписаны в удовлетворительном состоянии.
По данным контрольных исследований (УЗИ, МСКТ) остаточная полость кисты значительно уменьшилась: при гигантских кистах с 19 ± 2.8 см до 5.4 ± 5.9 см, при больших кистах с 11.4 ± 1.2 см до 5.9 ± 1.6 см (р
Похожие статьи
кисты поджелудочной железы. 3. солитарные кисты почек.
Дифференциальная диагностика болей в животе предполагает в первую очередь проведение ультразвукового обследования органов брюшной полости и малого таза.
При наличии косвенных признаков кишечной непроходимости всем пациентам выполнялся пассаж бариевой взвеси по желудочно-кишечному тракту, а при положительных
Ревизия органов брюшной полости начиналась с осмотра правой доли печени, желчного пузыря.
Целью нашего исследования является статистический анализ заболеваний желудочно-кишечного тракта в ГАУЗ
После 40 лет рекомендовано ежегодно проводить ультразвуковое исследование органов брюшной полости и эзофагогастродуоденоскопию.
Ключевые слова: спаечная болезнь брюшной полости, кишечная непроходимость.
железы (острый, хронический панкреатит), гипотиреоз. Частота их встречаемости представлена на рисунке 3.
Хронический панкреатит, осложненный панкреатической псевдокистой (ППК) мы наблюдали у 6 пациентов.
Гришин И. Н., Гриц В. Н., Лагодич С. Н. Кисты, свищи поджелудочной железы и их осложнения.
. диагноз: Киста желчевыводящих путей, в связи с чем были направлены для дальнейшего
Брюшная полость промыта антисептиками, осушена, дренирована подпеченочная область.
Влияние синдрома обструктивного апноэ сна на развитие сердечных аритмий.
Целью нашего исследования является статистический анализ заболеваний желудочно-кишечного тракта в ГАУЗ Оренбургская РБ.
После 40 лет рекомендовано ежегодно проводить ультразвуковое исследование органов брюшной полости и.
Компрессия спинного мозга у больных туберкулезным спондилитом и положение пациента “постельный режим” приводить к дефициту мышечной деятельности и развитию нарушений функции желудочно-кишечного тракта.
кисты поджелудочной железы. 3. солитарные кисты почек.
Дифференциальная диагностика болей в животе предполагает в первую очередь проведение ультразвукового обследования органов брюшной полости и малого таза.
При наличии косвенных признаков кишечной непроходимости всем пациентам выполнялся пассаж бариевой взвеси по желудочно-кишечному тракту, а при положительных
Ревизия органов брюшной полости начиналась с осмотра правой доли печени, желчного пузыря.
Целью нашего исследования является статистический анализ заболеваний желудочно-кишечного тракта в ГАУЗ
После 40 лет рекомендовано ежегодно проводить ультразвуковое исследование органов брюшной полости и эзофагогастродуоденоскопию.
Ключевые слова: спаечная болезнь брюшной полости, кишечная непроходимость.
железы (острый, хронический панкреатит), гипотиреоз. Частота их встречаемости представлена на рисунке 3.
Хронический панкреатит, осложненный панкреатической псевдокистой (ППК) мы наблюдали у 6 пациентов.
Гришин И. Н., Гриц В. Н., Лагодич С. Н. Кисты, свищи поджелудочной железы и их осложнения.
. диагноз: Киста желчевыводящих путей, в связи с чем были направлены для дальнейшего
Брюшная полость промыта антисептиками, осушена, дренирована подпеченочная область.
Влияние синдрома обструктивного апноэ сна на развитие сердечных аритмий.
Целью нашего исследования является статистический анализ заболеваний желудочно-кишечного тракта в ГАУЗ Оренбургская РБ.
После 40 лет рекомендовано ежегодно проводить ультразвуковое исследование органов брюшной полости и.
Компрессия спинного мозга у больных туберкулезным спондилитом и положение пациента “постельный режим” приводить к дефициту мышечной деятельности и развитию нарушений функции желудочно-кишечного тракта.
Проф., д. м. н. Шаповальянц С. Г.,
ст. н. с., к. м. н. Будзинский С. А.,
проф., д. м. н. Федоров Е. Д.,
доц., к. м. н. Мыльников А. Г.,
орд. Котиева А. Ю.
Российский национальный исследовательский медицинский университет имени Н. И. Пирогова: кафедра госпитальной хиругии № 2 ЛФ, НИЛ хирургической гастроэнтерологии и эндоскопии (зав. — проф. С. Г. Шаповальянц)
ГКБ № 31 (гл. врач — Р. А. Маслова)
Москва
Эндоскопические ретроградные транспапиллярные вмешательства заняли прочное место в структуре лечения пациентов с заболеваниями желчных путей и протоковой системы поджелудочной железы (ПЖ).
Обладая высокой клинической эффективностью, эти, широко применяемые вмешательства, несмотря на многократно подтверждённую малую травматичность, всё — таки имеют целый ряд серьезных, а иногда и фатальных осложнений, которые встречаются по данным литературы в 1–10 % случаев. К ним относятся: кровотечение из области эндоскопической папиллосфинктеротомии (ЭПСТ) или вирсунготомии (ВТ), перфорация стенки двенадцатиперстной кишки (ДПК), острый холецистит, восходящий холангит, проксимальная и дистальная миграция стентов и ряд других патологических состояний.
Однако, одним из самых грозных и, к сожалению, часто встречающихся осложнений, является развитие острого постманипуляционного панкреатита, который возникает в 1–3 % случаев при операциях по поводу холедохолитиаза и в 5–30 % случаев при выполнении эндоскопических ретроградных вмешательств на фоне папиллостеноза. В этих случаях основным патофизиологическим фактором развития острого панкреатита (ОП) является возникновение отека области вмешательства в проекции устья главного панкреатического протока (ГПП), что затрудняет отток панкреатического сока и является пусковым моментом развития ОП. Лечение данной категории пациентов является трудоемким, длительным и дорогостоящим. Вот почему стентирование ГПП в завершение ретроградного вмешательства на большом дуоденальном сосочке (БДС) активно используется во всём мире для профилактики ОП у пациентов входящих в группу высокого риска его развития. По общепринятым представлениям, риск развития острого постманипуляционного панкреатита повышается при наличии ряда факторов или их совокупности. При этом разделяют факторы, связанные непосредственно с эндоскопическим вмешательством и не связанные с ним. К первой группе принято относить выполнение баллонной папиллодилатации, атипичный (неканюляционный) характер ЭПСТ, большое количество попыток канюляции БДС и ряд других. Ко второй группе относят наличие у пациентов папиллостеноза или дисфункции сфинктера Одди, женский пол, нерасширенный желчный проток, молодой возраст и неизмененные показатели по данным биохимического анализа крови.
Отношение же к неотложным эндоскопическим ретроградным вмешательствам, позволяющим разрешить проблему нарушения оттока панкреатического секрета и прервать дальнейшую манифестацию клинических и лабораторно-инструментальных проявлений острого постманипуляционного панкреатита на ранних стадиях его возникновения, далеко не однозначное. Большинство западных специалистов выступают против повторного эндоскопического вмешательства в условиях развивающегося острого артифициального панкреатита, хотя это мнение не подтверждено результатами серьёзных клинических исследований.
Цель исследования
Ретроспективно оценить результаты эндоскопического ретроградного стентирования ГПП в лечении ОП, возникшего после эндоскопических транспапиллярных вмешательств.
Материалы и методы С 01.01.2009 по 01.01.2013 в нашей клинике было выполнено 1948 ретроградных эндоскопических вмешательств на желчном дереве и протоковой системе поджелудочной железы. При этом общее количество осложнений составило 23 (1,18 %), среди которых послеоперационное кровотечение из области ЭПСТ или ВТ встретилось в 4 (0,2 %) случаях, ретродуоденальная перфорация — в 3 (0,15 %), а ОП возник у 16 (0,8 %) больных.
При этом летальные исходы, имели место в 3 наблюдениях (0.15 %) Среди пациентов с развившимся постманипуляционным панкреатитом было 15 (93,75 %) женщин и 1 (6,25 %) мужчина. Средний возраст составлял 60,25 ± 12,57 лет. Показанием к эндоскопическим вмешательствам у данной группы больных во всех наблюдениях явилась механическая желтуха, причиной которой оказались: папиллостеноз в 8 (50 %) случаях, (в том числе в сочетании с холедохолитиазом в 2 наблюдениях), изолированный холедохолитиаз в 3 (18,75 %) случаях, парапапиллярные дитвертикулы — так же в 3 (18,75 %) наблюдениях (в том числе в сочетании с холедохолитиазом и папиллостенозом по 1 наблюдению), и рестеноз области ранее выполненной ЭПСТ у 1 (6,25 %) больной.
Острый панкреатит развился после изолированной ЭПСТ в 7 (43,75 %) случаях, после ЭПСТ с последующей литоэкстракцией в 5 (31,25 %) наблюдениях, а также после ЭПСТ с дополнительной ВТ у 3 (18,8 %) больных. При этом атипичная ЭПСТ была выполнена у 5 пациентов (33,3 %). Еще в 1 (6,25 %) случае острый панкреатит возник на фоне неудачной попытки канюляциии БДС с целью ЭРХПГ.
Острый панкреатит, у большинства больных из исследуемой группы, развивался в первые 12 часов после первичных эндоскопических ретроградных вмешательств — в 11 (68,75 %) случаях. В то же время, клиническая картина острого панкреатита появлялась через 12–24 часа в 3 (18,75 %) наблюдениях, а на 2-е сутки после первичной ЭПСТ — лишь у 2 (12,5 %) больных.
Основными клиническими проявлениями, заставившими заподозрить развитие острого панкреатита в ближайшем послеоперационном периоде, являлись: выраженный болевой синдром в эпигастральной области и правом подреберье с иррадиацией в спину, многократная рвота, гипертермия. Диагноз острого панкреатита был подтвержден лабораторными и инструментальными методами исследования (достоверно высокое повышение уровня амилазы от 882 до 12036 ед/л — у всех 16 (100 %) пациентов, характерные изменения при УЗИ брюшной полости — у 13 (81,3 %) (Рис. 1), КТ брюшной полости — у 8 (50 %) пациентов (Рис. 2).
Результаты:
В максимально ранние сроки после появления клинической картины острого постманипуляционного панкреатита (до 18 часов от манифестации клиники, но не более 1–1.5 суток от первичного ретроградного вмешательства) в 11 (68,8 %) случаях мы предприняли попытку эндоскопического стентирования ГПП. В 4 (25,0 %) случаях в виду легкой степени выраженности клинических проявлений ОП, от выполнения повторного эндоскопического вмешательства было решено воздержаться и больным проводилось консервативное лечение в объеме: инфузионной, антибактериальной, антисекреторной, спазмолитической, симптоматической терапии.
Еще в 1 (6,3 %) случае, учитывая молниеносный характер развившегося острого панкреатита и крайнюю степень тяжести пациента, от выполнения ретроградного панкреатического стентирования было решено воздержаться в пользу интенсивной консервативной терапии с последующим хирургическим вмешательством.
Техника панкреатического стентирования заключалась в следующем. При выполнении дуоденоскопии, мы оценивали состояние области ЭПСТ или БДС после ранее произведенного эндоскопического ретроградного вмешательства (Рис. 3).
После этого стремились селективно выполнить катетеризацию устья ГПП. Данная манипуляция была обычно осложнена наличием выраженного отека данной зоны. Мы ориентировались на типовое расположение устья ГПП в проекции пост-папиллотомической площадки. Как правило, устье Вирсунгова протока локализовано ниже и правее устья холедоха, которое после выполнения ЭПСТ определить обычно не составляет труда.
Канюляция во всех случаях осуществлялась по пластиковой струне-проводнику (рис. 4).
В случае успешного выполнения катетеризации ГПП с целью избежать контрастирования ГПП на фоне развивающегося острого панкреатита, в ряде наблюдений — 4 больных — верификация расположения инструментов осуществлялась под рентгенологическим контролем (РГ) в зависимости от характерного направления струны-проводника. Однако, в 5 наблюдениях для точного определения расположения проводника, мы прибегали к проведению панкреатикографии посредством введения в просвет ГПП небольшого количества контрастного вещества (1,5–2 мл), разбавленного раствором диоксидина в соотношении 3:1. При этом во всех случаях на панкреатикограмме определялось наличие умеренной панкреатической гипертензии (рис. 5).
После этого по струне с помощью толкателя выполнялась установка пластикового стента с целью возобновления адекватного оттока панкреатического сока, таким образом, чтобы проксимальный конец стента находился на 20–25 мм выше устья ГПП, а дистальный на 10–15 мм выступал в просвет 12 перстной кишки (рис. 6 А, Б). После адекватной установки панкреатического стента во всех случае по нему отмечалось обильное поступление вязкого панкреатического сока.

Рис. 6. Завершение установки панкреатического стента (А — РГ- картина, Б — эндофото). При выполнении панкреатикодуоденального протезирования мы использовали панкреатические стенты фирм Olimpus и WilsonCook диаметром 5 и 7 Фр и длиной от 3 до 5 см.
Выполнить протезирование Вирсунгова протока удалось в 9 (81,8 %) из 11 наблюдений, что позволило достичь восстановления адекватного оттока панкреатического сока и привело к выздоровлению пациентов во всех случаях. В остальных 7 наблюдениях, (в том числе в 2 случаях у больных с неудачной попыткой панкреатического стентирования), пациентам проводилась консервативная терапия. При этом в 2 наблюдениях в связи с неэффективностью консервативного лечения и прогрессирующим течением заболевания были проведены хирургические вмешательства в объеме некрсеквестрэктомии. Летальность в группе больных, которым панкреатическое стентирование выполнено не было, либо не удалось, составила 28,6 % (2 случая из 7).
Панкреатические стенты удалялись у пациентов в сроки от 5 до 12 суток после их установки. После извлечения стентов осложнений выявлено не было.
Заключение
По нашим данным, эндоскопическое стентирование ГПП, предпринятое в максимально ранние сроки от развития клиники острого постмапипуляционного панкреатита технически выполнимо в 81,8 % случаев. Панкреатическое стентирование является эффективным компонентом комплексного лечения — во всех наблюдениях после выполнения стентирования ГПП имел место выраженный положительный клинический эффект с последующим выздоровлением пациентов. В то же время летальность в группе больных, которым панкреатическое стентирование выполнено не было, либо не удалось составила 28,6 %. Полученные результаты заставляют более углублённо проанализировать применение раннего неотложного стентирования ГПП не только для профилактики, но и для лечения острого панкреатита, возникшего после эндоскопических ретроградных вмешательств.
Читайте также:

