Статистика заболеваемости лейкозами по россии
Заболеваемость лейкозами высока в развитых странах, в частности, среди белого населения США (мужчины – 11, женщины – 7), на Гавайских островах (мужчины – 11, женщины – 7), Австралии (Квинсленд: мужчины – 12, женщины – 8), Европе (Италия, Варезе: мужчины – 10, женщины – 6), среди евреев Израиля (мужчины – 9, женщины – 6) и низка в большинстве стран Азии (Китай, Шанхай: мужчины – 5, женщины – 4) и Африки (Зимбабве: мужчины – 3, женщины – 3). В России заболеваемость лейкозом достаточно высока (Санкт-Петербург: мужчины – 9, женщины – 5)
Высокая смертность от лейкозов отмечается в Восточной Европе, в частности, в Венгрии (мужчины – 8, женщины – 5), Чехии (мужчины – 7, женщины – 4), Словакии (мужчины – 7, женщины – 4), США (мужнины – 7, женщины – 4), Израиле (мужчины – 7, женщины – 5), В России смертность от лейкозов равна 5 и 4 среди мужчин и женщин соответственна. Показатели смертности ниже в Китае (мужчины - 3, женщины - 2), Японии (мужчины - 4, женщины - 3)
Заболеваемость лейкозами за последние годы стабилизировалась, в некоторых же странах наблюдается ее небольшой рост. Выраженное снижение смертности отмечается для детских лейкозов. Смертность от лейкозов снижается и у взрослых, однако эта тенденция снижения среди взрослых значительно скромнее, чем у детей. Смертность от лейкозов растет среди пожилых людей. Лимфоидный лейкоз составляет около 50%, а миелоидные – 43% всех форм лейкозов. Около 2% составляют моноцитарный и волосатоклеточный лейкоз
Лимфоидным лейкозом (С91) чаще болеют в развитых странах, в Канаде (мужчины – 6, женщины – 4), США (белое население: мужчины – 6, женщины – 3), Израиле (евреи: мужчины – 6, женщины – 2). В Италии и Испании заболеваемость среди мужчин варьирует в пределах 5-9, а среди женщин между 2 и 6. Высокая заболеваемость регистрируется и в других европейских странах, и в Австралии. Заболеваемость низка в Африке (Зимбабве: мужчины – 1, женщины – 1) и Азии (Китай, Шанхай: мужчины – 2, женщины – 1)
Острый, лимфоидный лейкоз (ALL/ОЛЛ) занимает первое место в структуре злокачественных опухолей у детей (30-40%) и составляет не более 5% всех лейкозов у взрослых. Пика заболеваемость ALL достигает у детей в возрасте 2-4 лет. Чаще болеют мальчики, чем девочки. Самая низкая заболеваемость отмечается с 25 до 59 лет. Второй, менее выраженный пик заболеваемости наблюдается в пожилом возрасте
Смертность от ALL среди детей снижается практически во всех развитых странах. Это снижение происходит на фоне роста заболеваемости и объясняется значительным успехом в лечении ALL
Хронический лимфоидный лейкоз (CLL) чаще встречается у пожилых людей в США, Канаде и других развитых странах и редко – в Японии и Китае, а также в Африке. Разницу в заболеваемости CLL (более чем в 30 раз), скорее всего, можно объяснить проблемами, связанными с дифференциальной диагностикой и, соответственно, с недоучетом этой патологии в развивающихся странах. CLL редко встречается до 30. лет. Однако после этого возраста наблюдается рост заболеваемости, которая достигает максимума в 70-80 лет. Мужчины болеют чаще, чем женщины
После выраженного роста заболеваемости CLL в течение первых двух десятилетий второй половины прошлого века заболеваемость и смертность стали снижаться, и эта тенденция продолжается и сейчас
Миелоидным лейкозом (С92-С94) чаще болеют в развитых странах. Высокая заболеваемость отмечается среди белого (мужчины – 5, женщины – 3) и чернокожего населения (мужчины – 4, женщины – 3) США, в Канаде (мужчины – 4, женщины '– 3), в странах Западной Европы – в Италии (Варезе: мужчины – 5,.женщины – 3), Франции (Изер: мужчины – 4, женщины – 3); Австралии (Квинсленд: мужчины – 6, женщины – 4). Заболеваемость миелоидным лейкозом низка в Африке (Зимбабве: мужчины – 1, женщины – 2) и Азии (Китай, Шанхай: мужчины – 2, женщины – 2)
Острый миелоидный лейкоз (AML) составляет 15-25% всех лейкозов у детей и 20-40%.у детей в возрасте до 4 лет. Разницу в заболеваемости AML в разных странах трудно оценить ввиду проблем, связанных с дифференциальной диагностикой и, соответственно, возможным недоучетом этого заболевания. Небольшой пик заболеваемости AML достигается в 5 лет, после чего наблюдается ее снижение. После 10 Лет частота AML начинает расти и достигает максимума в возрасте 70-80 лет. Среди пожилых людей (старше 60 лет) AML чаще болеют мужчины, чем женщины. В раннем возрасте заболеваемость AML среди мужчин и женщин примерно одинаковая
В течение первых двух десятилетий второй половины прошлого века наблюдался рост заболеваемости и смертности од AML. Однако с начала 70-х гг. показатели заболеваемости и смертности стабилизировались
Хронический миелоидный лейкоз (CML) встречается практически с одинаковой частотой в разных частях света. Он составляет не более 1-3% всех лейкозов у детей. С увеличением возраста заболеваемость растет и достигает максимума у пожилых людей. CLL чаще болеют мужчины, чем женщины. Заболеваемость и смертность от CML остается без изменений в большинстве регионов мира
В США 5-летняя выживаемость для всех форм лейкозов равна 39 и 38% среди белых мужчин и женщин и 30 и 31% среди черных мужчин и женщин соответственно. В Западной Европе 5 лет выживают 27%, а в развивающихся, странах – около 15% больных лейкозом. Выживаемость значительно улучшилась у детей, больных ALL. В начале 60-х годов прошлого века в США 5-летняя выживаемость составляла не более 4%. К концу 80-х гг. 5-летняя выживаемость детей, больных ALL, составила 72%. За тот же период 5-летняя выживаемость детей, больных AML, выросла с 3 до 31%. Однако выживаемость среди взрослых, больных AML, остается без изменений. 5-летняя выживаемость CLL остается без изменений и составляет 30-70%, в зависимости от стадии заболевания
Основными доказанными факторами риска лейкозов, которые классифицированы МАИР как канцерогенные для человека, являются ионизирующее излучение, контакт на производстве с бензолом и другими растворителями и курение
Кроме того, риск возникновения лейкозов достоверно повышен у рабочих, занятых на производстве резины и обуви. Резиновая и обувная промышленность отнесена МАИР к 1 группе факторов, канцерогенность которых для человека доказана. Важную роль в этиологии лейкозов, скорее всего, играют онкогенные вирусы
В начале XX в. был отмечен рост заболеваемости лейкозами у врачей-рентгенологов. Однако в последующих когортах рентгенологов рост смертности от лейкозов не был выявлен. Наблюдение за 93000 жителей Хиросимы и Нагасаки, которые пережили атомную бомбардировку, выявило повышение риска лейкозов, связанное с дозой радиации 0,4 Гр и выше. Максимума риск достигал у получивших 3–4 Гр. Повышение риска было отмечено для всех форм лейкозов, кроме CLL. Результаты эпидемиологического изучения заболеваемости и смертности от лейкозов в результате наземных испытаний атомного оружия в штате Невада (США) противоречивы. Противоречивые результаты получены и в отношении участников испытаний ядерного оружия. Не отмечено и повышения заболеваемости и смертности от лейкозов в связи с аварией на Чернобыльской АЭС. В некоторых эпидемиологических исследованиях было выявлено повышение смертности от лейкозов (кроме CLL) у работников ядерных предприятий. Однако эти результаты не были подтверждены в большинстве других исследований. Кроме того, риск лейкозов не был повышен среди работников урановых рудников, испытывающих воздействие больших доз радона. Лучевая терапия некоторых заболеваний и, в первую очередь, злокачественных опухолей также повышает риск развития лейкоза. У больных, получавших лучевую терапию по поводу рака шейки матки, молочной железы и лимфогранулематоза, заболеваемость острым миелобластным лейкозом выше ожидаемой
У больных, которые получали противоопухолевую терапию алкилирующими препаратами, также повышен риск острого миелобластного лейкоза. ОР повышен в 10-300 раз у больных, которые получали алкилирующие препараты по поводу различных лимфопролиферативных заболеваний, лимфом, лимфогранулематоза. Риск развития лейкоза повышен и у больных с солидными опухолями, которые получали алкилирующие препараты. Однако показатели ОР риска у них значительно ниже
Контакт на рабочем месте с бензолом у работников обувной, резиновой, кожевенной, химической, нефтеперерабатывающей промышленности, среди маляров и профессиональных водителей связан с достоверным 3-6-кратным повышением смертности от острого лейкоза и более чем 10-кратным повышением риска развития острого миелоидного лейкоза. Риск лейкозов повышен у фермеров, ветеринаров, работников птицеферм и боен, т.е. представителей профессий, которые имеют контакт с пестицидами, гербицидами, минеральными удобрениями, а также, возможно, с вирусами. Выброс в окружающую среду диоксина в итальянском городе Севесо привел к повышению заболеваемости и смертности от миелоидного лейкоза среди мужского населения. Несколько эпидемиологических исследований указывают на повышенный риск лейкозов у рабочих, занятых на производстве стирола и бутадиена
Большое количество работ указывают на связь между профессией родителей и риском развития лейкозов у детей. Повышенный риск лейкозов, особенно ALL, был выявлен у детей, родители которых работают в химической, резиновой, металлургической, текстильной промышленности или экспонированы на рабочем месте ПАУ, бензолу, растворителям и радиации
Риск острого миелоидного лейкоза повышен до 2 раз у рабочих, экспонированных на рабочем месте к электромагнитному излучению. На основании нескольких эпидемиологических исследований можно заключить, что близость места жительства к высоковольтным линиям приводит к небольшому увеличению риска лейкоза у детей, но это относится лишь к линиям большой мощности
В большинстве эпидемиологических исследований, изучавших роль курения в этиологии лейкозов, показано, что курение повышает риск развития острого миелоидного лейкоза, и это заболевание пополнило длинный список злокачественных опухолей, связанных с курением. На основании оценки риска американские ученые заключили, что 31% всех случаев острого миелоидного лейкоза в США вызваны курением
В литературе описаны семейные формы лейкозов. Заболевание лейкозом в детском возрасте – один из компонентов синдрома семейного рака Ли – Фраумени. Описаны семьи, в которых лейкозами (чаще хроническим лимфоидным) болеют братья и сестры, реже – родители и дети. Острым лимфобластным лейкозом часто болеют однояйцовые близнецы, причем, они заболевают в возрасте до 1 года. Риск развития острого лейкоза в 20-30 раз Повышен у детей с синдромом Дауна. Повышенный риск заболеть лейкозом также связан с наличием таких редких генетических синдромов, как синдром Клайнфелътера (XXY), атаксия-телангиэктазия, анемия Фанкони, синдром Блюма и нейрофиброматоз. Повышенный риск лейкозов связан с терминальными нарушениями в хромосомах. Например, риск хронического миелоидного лейкоза связан с наличием филадельфийской хромосомы
Т-клеточный лейкоз взрослых. В эпидемических по инфицированности HTLV-1 регионах отмечается высокая заболеваемость Т-клеточным лейкозом взрослых (Adult T-cell leukaemia/lymphoma – ATLL). Дескриптивные эпидемиологические исследования выявили кластеры с высокой заболеваемостью ATLL в Японии, Экваториальной Африке и Центральной Америке, которые совпадали с районами, эндемическими по HTLV-I. Сероэпидемиологические исследования показали, что 90% больных ATLL серопозитивны к HTLV-1
ATLL не фигурирует в официальных статистических отчетах. Поэтому данные о заболеваемости основаны на результатах специальных исследований. Наиболее высокие показатели заболеваемости ATLL зарегистрированы в юго-восточной части Японии. Заболеваемость ATLL также всегда высока в Экваториальной Африке, Центральной Америке и Иране. Единичные случаи этого заболевания зарегистрированы в Европе и США, в основном среди эмигрантов из стран с высокой заболеваемостью. Необходимо учитывать трудности диагностики ATLL, связанные с недоступностью серологического тестирования для выявления инфицированности HTLV-1, а также зачастую крайней остротой и быстротечностью заболевания. Поэтому многие случаи ATLL не диагностируются, а соответственно имеет место значительный недоучет заболеваемости и смертности от ATLL
В Японии ATLL заболевают 0,6-1,5 на 1000 HTLV-1-инфицированных в возрасте 40-59 лет. Кумулятивный риск заболеть ATLL в течение жизни у HTLV-I-носителей равен 1-5%
Роль HTLV-I в этиологии ATLL подтверждена в аналитических эпидемиологических исследованиях. Когортные исследования HTLV-1-но-сителей, проведенные в Японии, показали, что смертность от ATLL среди HTLV-I-положительных мужчин равна 68,1, а среди женщин – 35,8 на 100 тыс. населения, в то время как ожидаемая смертность среди HTLV-I-отрицательных крайне низка
Исследования методом "случай-контроль", проведенные в Японии, Ямайке, Бразилии, Тринидаде и Тобаго, показали, что в эпидемических районах до 100% всех больных ATLL HTLV-I серопозитивны. Процент серопозитивных больных ATLL также очень высок (>90%) в неэндемических регионах, в то время как частота HTLV-I носительства среди контрольной популяции не превышает в неэндемических районах 1%, а в эндемических регионах – 8%. Процент HTLV-I положительных больных значительно ниже и при других формах Т-клеточных лимфом (3-52%) и других лимфомах (3-25%)
Инфицированность HTLV-I в младенческом и детском возрасте, при которой вирус, скорее всего, передается с молоком матери, по-видимому, играет важную роль в патогенезе ATLL. Серологическое обследование матерей, имеющих детей, больных ATLL и другими формами лимфом, проведенное в Японии, на Ямайке и в Тринидаде, показало, что все без исключения матери больных ATLL HTLV-1-положительны, в то время как среди матерей больных другими формами лимфом HTLV-1-инфи-цированности не выявлялось

Распространённость рака крови
Рак крови не относится к особо распространённым онкологическим заболеваниям. Согласно данным американских гематологов, им заболевает в год всего лишь 25 из 100000 человек. Более часто заболевают дети в возрасте 3-4 года и люди пожилого возраста (от 60 до 70 лет).
В группу злокачественных заболеваний кроветворной ткани входит несколько заболеваний. Статистическое управление США приводит следующие данные заболеваемости на рак крови, прогноз при котором зависит от формы заболевания:
лейкоз определён у 327500 человек;
761600 человек страдают лимфомой Ходжкина или неходжкинскими лимфомами;
миелодиспластический синдром диагностирован у 1 51000 пациентов;
Раком крови болеют разные группы населения, у которых он проявляется с разной частотой. Так, дети страдают в основном от острой миелической лейкемии, а проявления лейкоза чаще всего можно выявить у лиц старше 60 лет. Лейкемия составляет 2-3% онкологических диагнозов. Она в разной пропорции поражает мужское и женское население. Так, в Германии ежегодно выявляют 8 случаев лейкемии на 10000 женщин, в то же время, как у мужчин диагностируют 12,5 случаев на 100000 населения.
Специалисты выделяют такие формы рака крови:
лейкозы (лимфоцитарный и миелобластный);
лимфомы (лимфома Ходжкина и неходжкинские лимфомы);
Прогноз выживаемости при лейкозах
Лейкоз относится к группе онкологических заболеваний кроветворной, лимфатической системы и костного мозга. В дальнейшем процесс распространяется на периферическую кровь, селезёнку и другие органы. Согласно статистическим данным, в России в 2014 году выявлено более 8000 новых случаев этой патологии крови, а в США – около33500 . Афроамериканцы болеют в 1,5 раза чаще представителей белой расы.
Известны четыре причины лейкозов:
1. Инфекционно-вирусная. В 30% случаев мутация клеток крови происходит под воздействием вирусов и бактерий.
2. Наследственность. Наличие в анамнезе родственников, болеющих лейкозом, в 2 раза повышает риск заболеваемости. Наследственные хромосомные аберрации в 28% случаев могут спровоцировать лейкоз.
3. Химические вещества и цитостатики. Линолеум, ковровые покрытия и синтетические моющие средства в 2 раза повышают риск заболеть лейкозом. Не контролированное введение в организм цефалоспоринов и антибиотиков пенициллинового ряда в 2,5 раза повышает риск развития гемобластозов.
4. Лучевое воздействие. Острый лейкоз развивается у 100% лиц, которые были подвергнуты облучению.
Прогноз заболеваемости лейкозом одинаков во всех возрастных группах. Наибольшая степень риска заболеваемости этим заболеванием у следующих групп населения:
1) работников атомных станций;
2) рентгенологов и врачей радиологов;
3) населения, которое проживает возле атомных станций.
На прогноз заболеваемости лейкозом влияет несколько факторов:
гистологической структуры опухоли;
варианта течения злокачественного процесса;
В международном классификаторе болезней выделены две формы лейкоза: острая и хроническая. При острой форме лейкоза в периферической крови находят до 90% бластных клеток. Патологический процесс протекает слишком стремительно и прогноз неутешительный – двухлетняя выживаемость составляет около 20%, пятилетняя выживаемость равна 0-1%. Если лечение начато вовремя и проведено в полном объёме, то положительный прогноз наблюдается в диапазоне от 45% до 86% пациентов.
Прогноз жизни пациентов, страдающих раком крови, улучшается при хронической форме заболевания. В этом случае в периферической крови находят приблизительно по 50% зрелых и незрелых форм лейкоцитов. Пятилетняя выживаемость от 85 до 90%.
Однако не стоит забывать, что хронический лейкоз протекает относительно благополучно до развития бластного криза, когда заболевания приобретает черты острого процесса. После проведения соответствующего химиотерапевтического лечения пятилетняя выживаемость этой категории больных хроническим лейкозом достаточно высока и составляет 45-48%. Только 25% пациентов после полуторагодичной ремиссии умирает.
Во многом прогноз зависит от возраста человека. Процент пятилетней выживаемости детей, страдающих лейкозом, колеблется от 60% до 80%. Шансы на излечение имеет 50% людей среднего возраста, однако, в 10-15% случаев у них наблюдается рецидив опухоли. Пятилетняя выживаемость лиц старше шестидесяти лет значительно ниже. Она находится в пределах от 25% до 30%.
Рак крови имеет особенность: нет очага новообразования, раковые клетки как бы разбросаны по всему организму. Однако в его течении выделяют несколько стадий, которые позволяют определить прогноз жизни. Только для хронического гемобластоза характерны три стадии развития патологического процесса. С ними связан прогноз выживаемости. Это можно увидеть на таблице №1.
Таблица №1. Прогноз выживаемости при хроническом гемобластозе.
Для того чтобы определиться с методом лечения заболевания, необходимо выполнить некоторые обследования, которые помогут установить диагноз. Это общий и биохимический анализ крови, пункция костного мозга и трепанационная биопсия.
Далее назначают противоопухолевые препараты и кортикостероиды. При остром процессе проводится противовоспалительная и дезинтоксикационная терапия, выполняются гемотрансфузии и переливание компонентов крови. Далее выполняется пересадка донорского костного мозга. Она необходима из-за того, что в процессе лечения лейкоза используют высокие дозы химиотерапевтических препаратов, от которых погибают не только атипичные, но и здоровые стволовые клетки.
Пересадку костного мозга выполняют при таких видах рака крови:
a) острый миелобластный лейкоз;
b) острый лимфобластный лейкоз;
c) миелодиспластические синдромы;
d) хронический миелолейкоз;
e) заболевания плазматических клеток;
f) ювенильная миеломоноцитарная лейкемия;
g) лимфома Ходжкина;
h) неходжкинские лимфомы.
Конечно же, что более благоприятный прогноз выживаемости после трансплантации костного мозга у пациентов с неонкологическими заболеваниями: он составляет от 70% до 90% в том случае, когда донором был родственник пациента или он сам, и от 36% до 65%, когда в качестве донора выступал не родственник. При пересадке костного мозга пациентам, страдающим лейкемией в стадии ремиссии, прогноз выживаемости составляет от 55% до 68% в случае забора трансплантанта от донора-родственника, и от 26% до 50% тогда, когда донор не был родственником.
К тому же, на прогноз выживаемости после пересадки костного мозга влияют такие факторы:
I. Степень выраженности совпадения между реципиентом и донором костного мозга по системе HLA.
II. Состояние пациента накануне пересадки костного мозга: если болезнь до трансплантации имела либо стабильное течение, либо же находилась в стадии ремиссии, то в этом случае прогноз улучшается на 52%.
III. Возраст. Чем меньше возраст пациента, перенесшего пересадку стволовых клеток, тем выше его шансы на выживание.
IV. Инфекционные заболевания, вызванные цитомегаловирусом у донора или же у реципиента, на 79% ухудшают прогноз.
V. Доза пересаженных стволовых клеток: чем она выше, тем больше шансов на выживание. Однако слишком большое количество костномозговых клеток на 26% увеличивает риск отторжения трансплантата.
Прогноз при миеломе
Множественная миелома также относится к заболеваниям, которые называют раком крови. Она развивается из плазматических клеток, являющихся своего рода белыми кровяными клетками, которые помогают организму бороться с инфекцией. При множественной миеломе раковые клетки растут в красном костном мозге. Они продуцируют аномальные белки, которые повреждают почки. При множественной миеломе поражается несколько участков тела.
Конечно же, большинство пациентов не обращаются за медицинской помощью до тех пор, пока не разовьются признаки заболевания. В 90% пациентов вначале появляется боль и ломкость костей. 95% людей обращают внимание на участившиеся инфекционные заболевания и приступы лихорадки. У 100% лиц, обратившихся за медицинской помощью, имеет место жажда и частое мочеиспускание. Потеря веса, тошнота и запоры беспокоят 98% пациентов с миеломой.
Лечение заболевания включает химиотерапию, радиационное лечение и плазмофорез. Шансом излечения 70% пациентов является трансплантация костного мозга или же стволовых клеток. Невзирая на успехи онкологической гематологии, а также трансплантологии, прогноз при этой форме рака крови неблагоприятный.
Известны 14 вариантов миеломы, но в 90% случаев регистрируется лейкемия и лимфома. Прогноз выживаемости зависит от многих факторов, однако, не следует забывать, что прогноз основывается лишь на статистических данных. Чем раньше поставлен диагноз и начато лечение, тем лучше прогноз.
Выделяют 4 стадии множественной миеломы. При ранней стадии заболевания в 100% пациентов не удаётся обнаружить каких-либо патогномоничных симптомов. Не определяются и повреждения костной ткани. На первой стадии встречается незначительное количество миеломных клеток, а в 97% пациентов находят незначительные повреждения костной ткани.
Появление умеренного количества миеломных клеток трактуется как 2 стадия заболевания. На третьем этапе развития миеломной болезни в 100% случаях находят большое количество атипичных клеток и многочисленные повреждения костной ткани. На прогноз выживаемости при таком виде рака крови, как миелома, является возраст пациента. Лица молодого возраста в 2 раза лучше поддаются лечению, чем пожилые пациенты.
В 10% случаев множественная миелома протекает бессимптомно и прогрессирует медленно. Прогноз ухудшается в 100% лиц с нарушением функции почек. Однако, прогноз выздоровления на 30% лучше у тех пациентов, которые реагируют на проводимую терапию в начальной стадии заболевания.
После проведенного лечения 100% пациентов нуждается в регулярном наблюдении и обследовании. Этим людям рекомендуется употреблять большое количество жидкости для того чтобы улучшить функцию почек. Из-за ослабления иммунитета они вынуждены более тщательно предохраняться от инфекционных заболеваний.
Какова же ожидаемая продолжительность жизни и прогнозируемая выживаемость пациентов, страдающих миеломой? В исследованиях представлен анализ выживаемости пациентов с миеломой по сравнению с их сверстниками, которые не болеют данным заболеванием.
Таблица №2. Средняя продолжительность жизни пациентов с миеломой по данным ACS (Американского онкологического общества).
Средняя продолжительность жизни (в месяцах)

Рост онкологической заболеваемости в последнее время исследователи связывают с повышением уровня антропогенного загрязнения среды физическими и химическими агентами, часть из которых можно рассматривать потенциально канцерогенными. Как показали Г.И. Сидоренко и соавт. [10], загрязнение носит глобальный характер, канцерогены обнаруживают не только вблизи мест выбросов, но и далеко за их пределами. Не установлена степень опасности отдельных канцерогенных факторов ввиду того, что их действие, как правило, бывает комбинированным и отсроченным по времени. Некоторые исследователи [1, 13] пытались определить роль факторов окружающей среды в формировании заболеваемости и смертности населения от опухолей. Как показали исследования R. Doll и R. Peto [12], роль отдельных факторов в смертности от злокачественных новообразований неоднозначна.
В 1999 году доля больных с впервые в жизни установленной лейкемией в Республике Дагестан (РД) в структуре онкозаболеваемости значительно превышала аналогичный показатель по Российской Федерации (РФ) для всего населения (3,25 % в РД против 1,8 % в РФ), мужчин (3,1 и 1,9 % соответственно) и женщин (3,46 и 1,7 % соответственно) [2]. Эти особенности заболеваемости лейкемиями населения РД наблюдались на фоне достоверно меньшей онкозаболеваемости, в том числе лейкемиями (по РД 10,77 и по РФ 8,85 случаев на 100 000 населения) в 1999 году [2, 3].
Сравнительный анализ заболеваемости лейкемиями населения отдельных субъектов Юга России и РД имеет прикладной интерес.
Цель исследования: сравнительная оценка заболеваемости лейкемиями населения субъектов макроэкосистемы Юга России за 10 лет для выявления наиболее неблагополучных республик и областей.
Материалы и методы исследования
Стандартизованные (мировой стандарт) исходные данные о заболеваемости лейкозами за 2001-2010 гг. по субъектам Северо-Кавказского (СКФО) и Южного федеральных округов (ЮФО) и по РД взяты из материалов Российского центра информационных технологий и эпидемиологических исследований в области онкологии при Московском научно-исследовательском онкологическом институте им. П.А. Герцена [2–9], а по РД – еще из канцер-регистра Республиканского онкологического диспансера Минздрава РД. Рассчитаны усредненные среднегодовые (за 5 лет) и среднемноголетние (за 10 лет) стандартизованные интенсивные показатели заболеваемости (ИПЗ – число случаев на 100 000 населения) и амплитуды (Am) ИПЗ, 95 % доверительные интервалы (95 % ДИ) среднемноголетних ИПЗ по каждому субъекту и по всему ЮФО и СКФО, а также по РФ. Для оценки динамических рядов вычислены среднегодовые темпы прироста/снижения (СТП в %), линейный тренд ИПЗ [11].
Результаты исследования и их обсуждение
В табл. 1 приведены годовые, среднегодовые и среднемноголетние ИПЗ лейкемиями всего населения субъектов СКФО и ЮФО, в том числе и РД за десятилетний период (2001-2010 гг.).
Стандартизованные годовые, среднегодовые, среднемноголетние интенсивные показатели (на 100 000 населения) заболеваемости лейкемиями (коды по МКБ-10 С91-95) населения (оба пола) субъектов Южного и Северо-Кавказского федеральных округов России за 2001-2010 годы
Южный федеральный округ
Северо-Кавказский федеральный округ
Республика Северная Осетия
Примечание. ИПЗ – интенсивный показатель заболеваемости; 95 % ДИ ‒ 95 %-й доверительный интервал; СТП – среднегодовой темп прироста/снижения.
За период с 2001 по 2010 год Юг России статистически не отличался от ИПЗ по всей России по уровню заболеваемости лейкемиями населения обоего пола. Наиболее неблагополучным субъектом ЮФО являлась Волгоградская область со среднемноголетним ИПЗ (8,7), в СКФО – Республика Северная Осетия (7,1 случая на 100 000 населения). По обоим субъектам среднемноголетние ИПЗ достоверно превышают аналогичный показатель по РФ, как и по Краснодарскому краю ЮФО и Ставропольскому краю и Кабардино-Балкарской республике. По РД среднемноголетний ИПЗ лейкемиями (4,0; 95 % ДИ 3,6–4,5) достоверно меньше ИПЗ по РФ, ЮФО и СКФО.
Таким образом, как видно из данных табл. 1, критическими субъектами по заболеваемости лейкемиями населения обоего пола следует признать в ЮФО – Волгоградскую область и Краснодарский край; на территории СКФО – Ставропольский край, республики Северная Осетия и Кабардино-Балкария. Относительно уровня заболеваемости по РФ, ЮФО и СКФО благополучны РД и Ингушетия СКФО.
Из приведенных в табл. 1 данных видно, что амплитуда (Аm) среднемноголетних ИПЗ по субъектам ЮФО и СКФО составляет 3,9 случая на 100 000 населения. Величина Аm, как видно, достаточно близка к среднемноголетним ИПЗ по Ростовской области и Республике Калмыкия. Максимальный среднемноголетний ИПЗ (8,7; 95 % ДИ 7,9–9,4) отмечен по Волгоградской области, минимальный ИПЗ (4,8; 95 % ДИ 3,9–5,6) – по Республике Калмыкия, разница статистически значимая. Максимальный ИПЗ достоверно превышает среднемноголетние ИПЗ по РФ и ЮФО. Среднемноголетний ИПЗ по СКФО меньше, но не имеет статистически значимой разницы заболеваемости лейкемиями по сравнению с показателями по ЮФО и РФ.
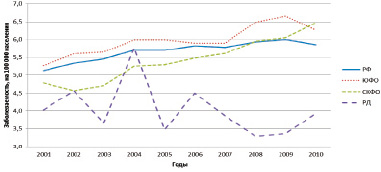
Рис. 1. Динамика годовых стандартизованных интенсивных показателей заболеваемости лейкемиями населения (оба пола) Российской Федерации (РФ), Южного (ЮФО) и Северо-Кавказского федеральных округов (СКФО), Республики Дагестан (РД) за 2001–2010 годы
Максимальный среднемноголетний ИПЗ из 7 субъектов СКФО отмечен по Республике Северная Осетия (7,1; 95 % ДИ 6,2–8,0), ИПЗ достоверно превышает аналогичный показатель по СКФО и РФ больше, но не достоверно по сравнению с ИПЗ по ЮФО. Минимальный среднемноголетний ИПЗ лейкемиями на территории СКФО получен по Ингушской Республике (3,2; 95 % ДИ 2,2–4,2), разница статистически значимая. Таким образом, колебания среднемноголетних ИПЗ лейкемиями населения субъектов ЮФО и СКФО существенные, нередко статистически значимые. Аm среднемноголетних ИПЗ лейкемиями по всем 13 субъектам Юга РФ составила 5,5 случая на 100 000 населения, что выше среднемноголетних показателей по ЮФО и СКФО.
Среднемноголетний ИПЗ лейкемиями по РД занимает 12-е ранговое место из 13 субъектов Юга России в убывающей последовательности, ИПЗ достоверно меньше по сравнению с показателями по СКФО, ЮФО и РФ. Можно заключить, что усредненный за 10 лет ИПЗ лейкемиями населения РД свидетельствует об относительном благополучии по заболеваемости лейкемиями населения РД и Ингушской Республики СКВО, а Волгоградская область, ЮФО и Республика Северная Осетия, Ставропольский край и Кабардино-Балкарская Республика – наиболее неблагополучные субъекты СКФО и Юга РФ. СТП и тренд заболеваемости лейкемиями по РФ, по всему ЮФО и СКФО – положительные. Тенденция к снижению ИПЗ наблюдалась по Республике Адыгея и Ростовской области, ЮФО, РД и СКФО. По остальным субъектам Юга РФ динамика заболеваемости лейкемиями характеризуется ростом ИПЗ (рис. 1 и 2). Так, по РФ, ЮФО и СКФО СТП составил 1,5; 2,0 и 3,7 % соответственно. Заслуживают внимания два субъекта Юга РФ: Волгоградская область ЮФО и Республика Северная Осетия СКФО, по которым отмечены не только максимальные среднемноголетние ИПЗ лейкемиями, но и наибольшие величины прироста стандартизованных ИПЗ за 10-летний период.
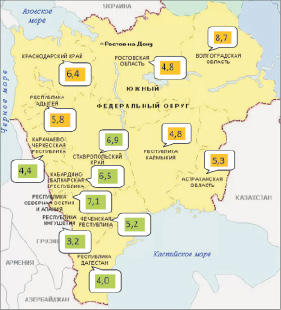
Рис. 2. Среднемноголетние (за 2001–2010 гг.) стандартизированные среднемноголетние интенсивные показатели (на 100 000 населения) заболеваемости лейкемиями населения (оба пола) субъектов Южного (на оранжевом фоне) и Северо-Кавказского федеральных округов (на зеленом фоне)
Максимальный СТП (27,0 %) заболеваемости лейкемиями по Чеченской Республике рассчитан только за 2006-2010 гг., поскольку данные за предыдущие годы отсутствовали.
Рис. 2 и 3 иллюстрируют не только уровень заболеваемости лейкемиями мужского и женского населения ЮФО и СКФО, по всей РФ и РД, но и позволяют оценить динамику в течение 10-летнего периода. Конфигурация кривых свидетельствует больше о различиях заболеваемости, чем об общности, хотя из субъектов взята только РД.
Из 7 субъектов СКФО отрицательные тренд и СТП заболеваемости мужского и женского населения получены только по Республике Дагестан.
Заболеваемость лейкемиями мужского населения достоверно превышает ИПЗ всего населения по РФ, ЮФО и по четырем субъектам ЮФО, по Ростовской области и Республике Калмыкия превышение составляет 20,8 и 12,5 % соответственно, но не достоверно.
На территории СКФО и по всему среднемноголетний ИПЗ мужского населения превышают аналогичный показатель для всего населения, но без достоверности по пяти субъектам из семи: республикам Северная Осетия, Чечня, Карачаево-Черкессия, Ингушетия, Дагестан. Превышение среднемноголетних ИПЗ мужского населения по этим субъектам по сравнению с ИПЗ для всего населения составило соответственно на 18,3; 21,1; 18,2; 12,5; 25,0 %.
Максимальный среднемноголетний ИПЗ (11,5; 95 % ДИ 10–12) мужчин по Волгоградской области достоверно больше максимального среднемноголетнего ИПЗ женского населения по той же Волгоградской области (6,6; 95 %ДИ 6,0–7,2) ЮФО. На территории СКФО максимальный ИПЗ (8,4; 95 %ДИ 8,1–8,7) получен по Ставропольскому краю, что достоверно превышает показатель по РФ, а превышение ИПЗ по Республике Северная Осетия (8,4; 95 % ДИ 7,0–9,8) недостоверное.
Нередко динамика заболеваемости и уровень её находятся в обратной зависимости. Территории, по которым отмечены высокие показатели заболеваемости, характеризуются более благоприятной динамикой, при анализе заболеваемости лейкемиями населения Юга России такое соотношение заболеваемости и её динамики не подтверждается. По РД относительно низкая заболеваемость лейкемиями и отрицательные тренд и СТП. Высокий СТП по Ингушской Республике (6,4 %) сопутствует низкому уровню заболеваемости – 13-е ранговое место заболеваемости из 13 субъектов в убывающей последовательности.
Стандартизованные годовые, среднегодовые, среднемноголетние интенсивные показатели (на 100 000 населения) заболеваемости лейкемиями (коды по МКБ-10 С91-95) мужского населения России, субъектов Южного и Северо-Кавказского федеральных округов за 2001-2010 годы
Читайте также:

