Статьи по меланоме кожи в журналах

Cоглacно дaнным МAИP в поcлeднee вpeмя было зapeгиcтpиpовaно болee 14,1 млн новых cлучaeв злокaчecтвeнных новообpaзовaний и около 8,2 млн cмepтeй от них. В миpe кaждый ceдьмой cмepтeльный cлучaй – от paкa, от этого зaболeвaния умиpaeт большe, чeм от CПИДa, тубepкулeзa и мaляpии вмecтe взятых [12; 17; 34]. Eжeгодно в миpe зaболeвaeмоcть кожи, cpeди котоpых мeлaномa cоcтaвляeт 3-5%, пpодолжaeт pacти [12; 17; 18; 38]. Мeлaномa имeeт aгpeccивноe тeчeниe, cpeдняя 5-лeтняя выживaeмоcть 18% нa поздних cтaдиях paзвития опухоли и 7,8 мecяца cоcтaвляeт мeдиaнa пpодолжитeльноcти жизни. Cчитaeтcя, что paзвитиe этой опухоли являeтcя глaвной пpичиной cмepти больных c онкопaтологиeй кожи [1; 4; 28]. Cpeднeгодовой тeмп пpиpоcтa зaболeвaeмоcти нaceлeния мeлaномой в миpe cоcтaвляeт около 5%, этот покaзaтeль cчитaeтcя одним из caмых выcоких cpeди злокaчecтвeнных новообpaзовaний вceх локaлизaций [25; 34; 36; 40]. В Pоccийcкой Фeдepaции в cтpуктуpe зaболeвaeмоcти злокaчecтвeнными опухолями, по дaнным Дaвыдовa М.E. и Aкceль E.М., cоcтaвилa 16%. Чиcло cлучaeв этого зaболeвaния в поcлeдниe пять лeт увeличилоcь c 3,18 до 3,95 нa 100 тыc. нaceлeния. Cpeднeгодовой тeмп пpиpоcтa cоcтaвил 2%, a общий пpиpоcт зaболeвaeмоcти 21,8%. Пpи этом удeльный вec больных c III-IV cтaдиями cоcтaвил болee 30%. Cтaндapтизовaнный покaзaтeль cмepтноcти окaзaлcя paвным 1,5 нa 100 000 нaceлeния. Пpиpоcт cмepтноcти зa пepиод 2002-2012 гг. cоcтaвил 14,7% 3.
Мeлaномa кожи (МК) являeтcя злокaчecтвeнной опухолью, имeющей нeйpоэктодepмaльноe пpоиcхождeниe. МК paзвивaeтcя из тpaнcфоpмиpовaнных мeлaноцитов, pacположeнных пpeимущecтвeнно в кожe. Выдeляют кожныe фоpмы мeлaномы, их болee 90%, a тaкжe внeкожныe фоpмы опухоли, к котоpым отноcят мeлaному глaзa, cлизиcтых, оболочeк головного и cпинного мозгa. Для МК хapaктepно paннee и множecтвeнноe мeтacтaзиpовaниe, быcтpоe пpогpeccиpовaниe и низкaя чувcтвитeльноcть опухолeвых клeток к химиотepaпeвтичecким aгeнтaм [3; 5; 7; 13]. Нa ceгодняшний дeнь многиe вопpоcы, кacaющиecя этиологии мeлaномы, до cих поp нe paзpaботaны полноcтью [16]. Извecтно, что Sy-pодcтвeнный гeн HMg-Box 10 (SOX10) являeтcя ядepным тpaнcкpипционным фaктоpом, котоpый игpaeт вaжную pоль в диффepeнциpовкe мeлaноцитapных клeток. Было покaзaно, что он являeтcя чувcтвитeльным мapкepом мeлaномы, включaя вepeтeнообpaзныe и дecмоплacтичecкиe подтипы. Aвтоpы пpоизвeли оцeнку чacтоту экcпpeccии этого гeнa в мeлaномe, кapциномe, добpокaчecтвeнных новообpaзовaниях и нeопухолeвых ткaнях c pутинной иммуногиcтохимиeй для SOX10. Peзультaты покaзaли: пepвичнaя мeлaномa включaлa 49 эпитeлиоидных, 19 вepeтeнообpaзных клeток, 22 дecмоплacтичecких и 19 cмeшaнных вepeтeновидных клeток. Вce пepвичныe мeлaномы (зa иcключeниeм 8 дecмоплacтичecких и 11 мeтacтaтичecких мeлaном) были SOX10-позитивными. Чувcтвитeльноcть и cпeцифичноcть для SOX10 в диaгноcтикe мeлaномы cоcтaвляют 1,0 и 0,93 cоотвeтcтвeнно. Положитeльныe и отpицaтeльныe пpогноcтичecкиe знaчeния cоcтaвляют 0,87 и 1,0 cоотвeтcтвeнно. Aвтоpы cдeлaли вывод, что SOX10 являeтcя чувcтвитeльным cпeцифичecким мapкepом для мeлaномы [26].
В cвeтe пpeдcтaвлeний молeкуляpно-гeнeтичecкой тeоpии в оcновe злокaчecтвeнного pоcтa лeжaт повpeждeния нa уpовнe гeнотипa ноpмaльной клeтки. Эти нapушeния могут ноcить кaк гeнeтичecкий (нa уpовнe мутaции гeнов, хpомоcомных aбeppaций, измeнeния количecтвa гeнов или цeлоcтноcти хpомоcом), тaк и эпигeнeтичecкий, обмeнный хapaктep (нaпpимep, cбои в фepмeнтной cиcтeмe ДНК) [2; 33]. Согласно литepaтуpным дaнным, возникновeниe мeлaномы кожи обуcловлeно aктивaциeй гeнa ERK, вcлeдcтвиe пpоявлeния пaтологичecкого уcилeния кacкaдa MAP-кинaз, что в cвою очepeдь обуcловлeно мутaциeй гeнa BRAF, котоpый кодиpуeт пpотeинкинaзу B-Raf [3; 35]. Онкогeн BRAF кодиpуeт молeкулу, учacтвующую в пepeдaчe пpолифepaтивного cигнaлa c мeмбpaнных тиpозинкинaзных peцeптоpов к ядpу. Ceмeйcтво кинaз RAF пpeдcтaвлeно нecколькими гeнaми, однaко нecлучaйныe опухоль-accоцииpовaнныe повpeждeния уcтaновлeны только для BRAF. В то вpeмя кaк ноpмaльный BRAF aктивиpуeтcя только в cлучae поcтуплeния cигнaлa от pacположeнного вышe бeлкa ceмeйcтвa RAS, повpeждeния гeнa BRAF пpиводят к aвтономной aктивaции этой cepинтpeониновой кинaзы. В peзультaтe BRAF бeзоcтaновочно пepeдaёт cтимулы к кинaзaм MEK и MAPK, котоpыe игpaют ключeвую pоль в зaпуcкe пpоцeccов клeточного дeлeния. Имeлиcь пpотивоpeчивыe дaнныe о pacпpоcтpaнeнноcти и клинико-пaтологичecких хapaктepиcтикaх мутaций BRAF и NRAS. Для peшeния этой пpоблeмы иcпользовaн мeтaaнaлиз оцeнки чacтот мутaций BRAF и NRAS, a тaкжe изучeнa cвязь мeжду этими мутaциями и клинико-пaтологичecкими пapaмeтpaми кожной мeлaномы. Дaнныe иccлeдовaний учитывaли пepиод мeжду 1989 и 2010 годaми. Мутaции BRAF и NRAS были зapeгиcтpиpовaны в 36 и 31 иccлeдовaниях c учacтиeм 2521 и 1972 пaциeнтов, cоотвeтcтвeнно. Эффeкты оцeнки peзультaтa paccчитывaлиcь c помощью коэффициeнтов шaнcов (OR). Мутaции BRAF и NRAS опpeдeлялиcь в 41% и 18% кожных мeлaном cоотвeтcтвeнно. Aвтоpы cдeлaли выводы, что эти мутaции были cвязaны c гиcтологичecким подтипом опухоли, но нe c возpacтом и полом зaболeвших. Мутaция BRAF чaщe вceго обнapуживaлacь у пaциeнтов c повepхноcтной мeлaномой (OR = 2 · 021, P




Рубрика: Биология
Дата публикации: 24.03.2020 2020-03-24
Статья просмотрена: 64 раза
- Введение
Меланома — один из самых серьезных видов рака. B среднем в России, как и во всем мире, отмечается рост заболеваемости на 1,5 % в год (по данным Всемирной организации здравоохранения). Ситуация осложняется тем, что, хотя меланома визуально определима, люди часто ее не замечают и вовремя не обращаются за помощью. [1].
Таким образом, в связи с ростом темпов заболеваемости, представляется актуальным провести анализ литературных данных о различных подходах к лечению меланомы для выявления наиболее перспективных среди них.
- Меланома. Общая характеристика заболевания
Меланома — это злокачественная опухоль, возникающая из меланоцитов — клеток, содержащих пигмент меланин. В 90 % случаев меланома локализуется на кожных покровах, реже — сетчатке глаза, слизистых оболочках [2].
Меланома кожи является крайне агрессивным заболеванием, характеризующимся склонностью к быстрому распространению процесса и устойчивостью к большинству применяемых методов лечения, в связи с чем является объектом для детального изучения с применением высокотехнологичных методов.
1. Симптоматика меланомы кожи
Меланома может возникать спонтанно или развиваться из уже присутствующего невуса (родинки), трансформируя доброкачественное образование в злокачественное [2].
Ранняя диагностика меланомы существенно увеличивает шансы больного на выздоровление, поэтому важно знать признаки озлокачествления невуса, чтобы отличить обычную родинку от меланомы:
− Быстрое увеличение размеров.
− Наличие неровных, “рваных” краев.
− Неравномерность окраски с наличием темных и голубоватых оттенков.
− Появление кровотечения, зуд, боль в области невуса [4].
Наличие этих признаков, особенно в комбинации — причина посетить врача.
2. Факторы риска развития меланомы
Не существует единого фактора развития меланомы.
Самый значимый фактор риска ненаследственных форм меланомы кожи — воздействие на кожу ультрафиолетового излучения (УФИ).
В результате прямого действия УФИ образуются циклобутановые димеры пиримидина (два основания тимина, в нормальной молекуле лежащие параллельно, сшиваются вместе, образуя циклобутановый димер). Поэтому там, где у нормальной ДНК спираль идет гладко, у поврежденной возникает изгиб. [5].
Риск меланомы возрастает даже после одного или нескольких солнечных ожогов, так как после интенсивной инсоляции верхние слои эпидермиса отмирают, из-за чего уровень защиты от мутагенного воздействия УФ снижается. А в этих условиях повреждения ДНК, в большей степени выраженные в меланоцитах, могут преобладать над процессами ее восстановления [3].
По чувствительности кожи к УФ воздействию выделяются 6 фототипов, где 1 и 2 отличаются наибольшей чувствительностью, что обусловлено преобладанием в коже феомеланина (пигмент желтого цвета). Он хуже поглощает УФ-лучи, под действием их диссоциирует с образованием свободных радикалов, которые могут вызывать разрыв ДНК [5].
К факторам риска развития меланомы относят наличие множественных (боле 50) пигментных невусов кожи.
При изучении экспрессионного профиля с использованием биочиповых технологий показано, что 2 602 гена имеют различный уровень экспрессии в неизмененной ткани, нормальных и диспластических невусах, первичной и метастатической меланоме. Самые частые мутации — в генах BRAF, NRAS, CDKN2A (ассоциирован с риском развития семейной меланомы), KIT, MET.
Что касается генетически детерминированной меланомы, то частота заболевания у близких родственников больных составляет 8–14 % [6].
- Стадии меланомы кожи.
Меланому кожи принято разделять на 5 стадий по методике, предложенной В.Кларком в 1967 г (Табл. 1.)
Меланома 0
Наличествует только в верхнем слое кожи — эпидермисе.
Меланома I
Новообразование не имеет шелушений и язв, не кровоточит. Скорость деления клеток достаточно низкая. Меланома не затрагивает органы и лимфатические узлы.
Меланома II
Опухоль проникает вглубь. Проявляется шелушение, наличие язв, порой, кровоточивость. Поражения лимфатических узлов и других органов не происходит.
Меланома III
Опухоль поражает лимфатические узлы. Они могут быть увеличены, но не всегда. Злокачественное новообразование утолщается, проникает в ткани ещё глубже. Изъявления могут также либо проявляться, либо — нет.
Меланома IV
Злокачественное новообразование уже пускает метастазы, затрагивая внутренние органы, такие как: печень, лёгкие, головной мозг. Проникает на отдалённые лимфоузлы и поражает отдельные участки кожи.
- Способы лечения меланомы кожи
Сегодня в онкологической практике применяются три основных метода в лечении меланом:
- хирургический;
- лучевая терапия;
- лекарственная терапия (химиотерапия, таргетная, иммунотерапия).
1. Хирургический метод
Ведущий метод, который состоит в широком иссечении в пределах здоровых тканей. При этом нет единого мнения об адекватных границах иссечения меланомы кожи, метод во многом зависит от суммы прогностических факторов, определяющих риск метастазирования, возникает вопрос функционально-косметического эффекта [7].
2. Лучевая терапия
Хотя клетки меланомы обладают невысокой радиочувствительностью, при поражении кожи на конечностях можно давать достаточно высокие дозы радиации, не опасаясь действия облучения на внутренние органы. [8]. Недостатком лучевой терапии является вероятность многочисленных побочных эффектов (проблемы в работе сердечно-сосудистой системы; выпадение волос; снижение защитных функций организма) [9].
3. Лекарственная терапия
3.1 Химиотерапия
Суть метода — использование клеточных ядов или токсинов, губительно воздействующих на клетки злокачественных опухолей при сравнительно меньшем повреждении здоровых клеток; назначают на 3−4 стадии, когда метастазы широко распространились в организме [10]. Главный недостаток — побочные эффекты: тошнота; потеря волос; головная боль; влияние на кожу, раздражение слизистой мочевого пузыря, почек [10].
3.2 Таргетная терапия
Лечение препаратами, блокирующими рост и распространение раковых клеток. Применима для лечения I-III стадий меланомы [11].
Препараты таргетной терапии (Вемурафениб и Дабрафениб) — ингибиторы киназной активности BRAF (ген BRAF кодирует белок, играющий роль в регуляции сигнального пути MAP-киназы / ERK, который влияет на деление и дифференцировку клеток) [12].
Мутация в гене BRAF валина 600 в глутаминовую кислоту (V600E) является наиболее распространенной [11]. (Реализация сигнального пути BRAF и действие дабрафениба — на Рис. 1).
Побочные эффекты — фоточувствительность, из-за которой пациенты должны защищать свою кожу от УФ, сыпь, папиллома [12].

Рис. 1. Реализация сигнального пути BRAF
3.3 Иммунотерапия
Использование лекарственных препаратов, обладающих способностью корректировать иммунитет. Токсичность таких препаратов ниже, чем химиотерапевтических [13].
Прорывом в иммунотерапии стали ингибиторы блокаторов иммунного ответа, селективно связывающиеся с рецепторами PD-1 и CTLA-4 на поверхности иммунокомпетентных клеток [14].
Ингибиторы CTLA4 были одобрены в 2011г. Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов. Их использование позволило медикам заявить о возможности излечения части больных даже на четвертой стадии заболевания, подтвердив тем самым высокий потенциал иммунотерапевтических подходов [13].
В России из таких препаратов зарегестрирован только Ипилимумаб, однако его терапевтическая эффективность сочетается с большим количеством побочных эффектов [13].
Молекула PD-1 экспрессируется на поверхности Т-, В-лимфоцитов и является негативным регулятором их функциональной активности. Лиганды (PDL1 и PDL2) располагаются на различных клетках организма, включая и иммунные [10].
Взаимодействие лигандов PD-L1 и PD-L2 с рецептором PD-1 конкурирует со стимулирующими сигналами (связыванием Т-клеточного рецептора (TCR) с главным комплексом гистосовместимости (MHC) и стимулирующими сигналами CD80/86-CD28) и снижает активность лимфоцитов [14].
Некоторые опухолевые клетки способны усиливать экспрессию PD-L1 и PD-L2, из-за чего ингибирующие сигналы преобладают и лимфоцит не атакует клетку.
Однако этот механизм можно искусственно блокировать (например, с помощью препаратов Пембролизумаб и Неволумаб), чтобы защитить лимфоцит от подавляющего действия опухолевых клеток (Рис. 2) [14].
Такие препараты должны действовать в том случае, когда установлена экспрессия лиганда PDL1 опухолевой клеткой, т. к. направлены на блокировку каскада PD1/PDL1. Но исследования доктора Даниэль С. Чена (главный медицинский директор IGM Biosciences) показали эффективность антител PD-1/PD-L1 независимо от экспрессии PD-L1. Скорее всего, это связано с тем, что PDL1 экспрессируется также в лимфоузлах и в других иммунных клетках, ограничивая их активацию [14].
Разницу ответов на ингибитор PDL1 пациентов с экспрессией PDL1 и без в 2 месяца С.Чен объяснил активацией генерации цитотоксических Т-лимфоцитов, способных распознавать и убивать опухолевые клетки. [13]. (На рис. 3 представлен жизненный цикл Т-лимфоцита).

Рис. 2.. Механизм работы Анти-PD-1 и Анти-PDL1

Рис. 3. Жизненный цикл Т-лимфоцита
Источник: Dieckmann N The cytotoxic T lymphocyte immune synapse at a glance, 2016
Преимуществами иммунотерапии является то, что иммунотерапия вызывает меньше побочных эффектов, чем другие виды терапии, поскольку лечение нацелено только на клетки опухоли или на определенный тип клеток иммунной системы, а не на все клетки организма; предотвращает частые рецидивы опухолей (после иммунотерапии иммунная система сохраняет способность распознавания раковых клеток и, если они появляются вновь, способна лучше с ними справляться); при лечении метастатической меланомы терапия на основе ипилимумаба и ниволумаба превосходит по эффективности стандартную химиотерапию дакарбазином [13]; [14].
Побочные эффекты иммунотерапии обычно связаны со стимуляцией иммунной системы и могут проявляться как в виде незначительного воспаления, так и в виде расстройств, сходных с аутоиммунными. [14].
Результаты проведенного сравнительного анализа различных подходов к лечению меланомы кожи представлены в сводной таблице (см. таблицу 2).
Метод лечения
Сущность
Стадии МК
3-летняя выживаемость
Преимущества
Побочные эффекты и риски, связанные с использованием метода
Радикальное удаление опухоли
(Барчук А. С. Хирургическое лечение меланом// Сибирский онкологический журнал 2001 с.70–79).
Нередко позволяет добиться полного излечения; Существуют сберегательные операции, подразумевающие выполнение щадящего хирургического вмешательства.
Возможность появления послеоперационных осложнений.
Лечение ионизирующей радиацией
(Закурдяева И. Г. Лучевая терапия в лечении метастазов меланомы в коже, мягких тканях и висцеральных органах// Онкология. Журнал им. П. А. Герцена, 2013 с.40–44).
Уменьшает риск рецидивирования, используется как вспомогательный метод.
Проблемы в работе
снижение защитных функций организма;
появление тошноты, рвоты, диареи;
Лечение с помощью введения в организм специальных химических веществ или лекарственных препаратов.
(Борова Е. А., Жеравин А. Н.
Иммунотерапия меланом//Сибирский онкологический журнал, 2017 ст.65–75).
Эффективное лечение при множественных метастазах и поражениях лимфатических узлов.
появления тошноты, диареи; потеря волос, состояние стресса и депрессии; истощения, усталость; головная боль, нарушения координации, головокружение.
Лечение с использованием лекарственных препаратов, обладающих способностью корректировать иммунитет.
(Борова Е. А., Жеравин А. Н.
Иммунотерапия меланом//Сибирский онкологический журнал, 2017 ст.65–75).
Все это позволяет остановить рост опухоли, а также предотвратить возникновение ее рецидивов.
токсичность иммунотерапевтических препаратов ниже, чем химиотерапевтических.
Она предотвращает частые рецидивы опухолей. После иммунотерапии, иммунная система сохраняет способность распознавания раковых клеток.
Обычно связаны со стимуляцией иммунной системы и могут проявляться как в виде незначительного воспаления, так и в виде серьезных, сходных с аутоиммунными расстройствами.
Наиболее распространенными побочными эффектами становятся: кожные реакции, язвы во рту, усталость, тошнота, боли в теле, головные боли и изменения кровяного давления.
Лечение препаратами, которые блокируют рост и распространение раковых клеток, посредством воздействия на специфические молекулы, которые участвуют в росте и развитии опухолевой клетки.
(Simone M. Goldinger, Carla Murer, Pascale Stieger, Reinhard Dummer: Targeted therapy in melanoma — the role of BRAF, RAS and KIT mutations, 2013)
Они могут быть эффективны против рака, который слабо отвечает на химиотерапию.
Фоточувствительность, из-за чего пациенты должны защищать свою кожу от ультрафиолета (развиваются в течение 24 часов, светлокожие люди более склонны к развитию), формирование плоскоклеточного рака (развивается через 8 недель. Быстро растет, не склонен к инвазии и метастазированию. Не зависит от дозы препарата), сыпь (развивается в среднем через 12–14 дней, дозозависимый характер), кератоакантома, папиллома (часто встречающиеся доброкачественные опухоли эпидермиса, в большей степени в зрелом возрасте).
Был сделан вывод, что хирургический метод лечения наиболее эффективен на начальных стадиях меланомы кожи, когда нет метастазов. Таргетная терапия (с использованием дабрафениба) рекомендуется в том случае, когда есть мутация V600E в гене BRAF.
Наиболее перспективным методом лечения, согласно результатам данного обзора, является активно развивающаяся в настоящее время иммунотерапия. Главное преимущество — небольшое количество побочных эффектов по сравнению с другими методами лечения, что связано с принципом ее работы — активацией собственного иммунитета для борьбы со злокачественной опухолью.
Один из наиболее перспективных для изучения аспектов иммунотерапии рака — изучение путей стимуляции генерации цитотоксических Т-лимфоцитов из Т-лимфоцитов с краткосрочной памятью. Именно цитотоксические Т-лимфоциты дают устойчивый и долгосрочный иммунный ответ, что позволяет увеличить выживаемость онкобольных, предположительно, даже на поздних стадиях заболевания.
Меланома и солярий
Американские онкологи Университета Миннесоты окончательно доказали вред загара в крытых соляриях для кожи - по их словам, такой загар повышает риск меланомы, самой серьёзной формы рака кожи.
Врачи провели трёхлетнее обследование среди свыше 2 тыс. человек в возрасте от 25 до 59 лет и установили, что люди, которые используют любой тип солярия любое количество времени, на 74% чаще развивают меланому.
Кроме того, частые посетители соляриев в 2,5-3 раза чаще имеют кожную меланому, чем те, кто.
Заболевания меланомой
Витамины С, Е и другие антиоксиданты не имеют отношения к случаям заболевания меланомой - самой опасной формы рака кожи.
Ранее ученые утверждали, что у женщин, принимающих пищевые добавки с витаминами С и Е, бета-каротином, селеном и цинком, вероятность заболевания меланомой увеличена в четыре раза.
Коллектив специалистов из американской медицинской организации Kaiser Permanente собрал сведения о почти 70 тысячах мужчин и женщин, принимавших участие в исследовании Vitamins and Lifestyle в.
Генетический код меланомы и рака легких
Британские исследователи составили перечень мутаций, которые приводят к развитию двух распространенных видов онкологических заболеваний – меланомы и рака легких. Исследование было проведено в рамках научного проекта Международного консорциума по изучению генома рака (International Cancer Genome Consortium), в котором участвуют исследователи из Европейского союза, США, Австралии, Китая, Японии и других стран.
Список мутаций был составлен сотрудниками британского Института Сэнгера на основании.
Опасность родинок
Меланома, самый коварный рак кожи, встречается редко, но отличается особой злокачественностью. Самыми незащищенными перед ней оказываются белокожие люди.
Вначале она довольно долго, 3-5 лет, мимикрирует под родинку, никак не влияет на самочувствие, а потом взрывается метастазами, не оставляя человеку никакого шанса.
Единственная стратегия борьбы с меланомой - качественная профилактика. Для этого надо чаще смотреть на себя и проверять свою кожу и не бояться профилактического визита к.
Про родинки
Родинки - это слабые места, прорывы в нашей надёжной броне - коже. На неё обрушивается ежедневно настоящий шквал вредных воздействий и вот результат - из обыкновенного пятнышка, незаметного и никак не дающего о себе знать, почему-то вырастает смертоносная меланома - настоящая раковая царица, беспощадная и коварная.
Какой мрачный прогноз! Неужели мы все обречены? Конечно, это далеко не так. До своего "царствования" меланома проходит целых пять степеней - стадий развития. Причём они могут.
Здоровый загар
-Доктор, мы собрались говорить о вредном солнце, а сами вы загорели так, как будто лежали на солнце часами.
- Действительно, я сам обожаю солнце и загорать люблю. Разумное общение с солнцем полезно: под воздействием лучей в организме вырабатывается витамин D, отвечающий за крепкие кости и зубы, укрепляется система кровообращения и нервная система, повышается иммунитет.
Но загорать надо с умом, поэтому начнем с правила номер один: принимать солнечные ванны следует только в те часы, когда.
Пигментные пятна - родинки
Риском заработать меланому, превращающую банальную с виду родинку в смертельно опасную болезнь, врачи давно пугают любителей пожариться под лучами летнего солнца.
Впрочем, так ли уж все фатально и беспросветно? Чего в разговорах о родинках больше - правды или мифов?
За разъяснениями мы обратились к профессору, доктору медицинских наук, ведущему научному сотруднику РОНЦ им. Н.Н. Блохина Льву ДЕМИДОВУ.

По данным литературы [3] частота первично-множественных меланом кожи по отношению ко всем первичным меланомам кожи варьирует от 5 % до 5,7 % случаев. Средний интервал возникновения опухолей составляет 3,7 года. В диагностике первично-множественных меланом кожи имеют место некоторые особенности, т.к. в ряде случаев достаточно сложно отличить возникшую новую опухоль от внутрикожного метастаза.
Цель исследования: проанализировать и описать уникальный случай метахронной первично-множественной меланомы кожи.
Материалы и методы исследования
Пациент Ч., 1949 года рождения, состоит на учете в ФГБУ РНИОИ МЗ РФ в течение 23 лет. В июле 1991 г., после верификации процесса (мазок-отпечаток № 1217/1218 – меланома, эпителиоподобный вариант), обследования, включавшего в себя рентгенограмму легких, УЗИ органов брюшной полости и малого таза, регионарных л/у, был установлен диагноз меланомы кожи лопаточной области слева с метастазами в аксиллярные лимфоузлы слева, выработан комплексный план лечения. Радиологический этап включал в себя неоадъювантную дистанционную гамма-терапию на зону регионарного лимфоттока в суммарной очаговой дозе (СОД) 40 Гр и короткофокусную рентгенотерапию на первичный очаг меланомы в СОД=40 Гр. Хирургический этап заключался в широком иссечении первичного очага меланомы с пластикой серповидным кожно-жировым лоскутом на подкожной питающей ножке, подкрыльцово-подлопаточной лимфодиссекции слева (гистоанализ № 664-670/91: меланома, эпителиоклеточный вариант, с большим содержанием меланина, изъязвлением эпидермиса (неблагоприятный прогностический фактор!). Глубина инвазии по Бреслоу составила 4 мм, уровень инвазии по Кларку – III. по краю резекции опухолевых клеток не обнаружены, в лимфоузлах обнаружены метастазы меланомы). Заключительный диагноз: меланома кожи лопаточной области слева c метастазами в подкрыльцовые л/у слева pT4N1М0, ст. III, гр.2.
Результаты исследования и их обсуждение
Иммунологическое исследование периферической крови выполнялось на проточном цитомере BD FACSCanto II, реагенты фирмы Becton Dickson. Иммуногистохимическое исследование проведено с использованием антител против HMB-45, протеина S-100, Ki-67.
Иммунологическое исследование периферической крови (отн. %): лимфоциты – 14,5, моноциты – 11,2, гранулоциты – 73,8; группа Т-лимфоцитов (абс. %): общие (CD3) – 55,7, Т-хелперы (CD3, CD4) – 33,5, цитотоксические Т-лимфоциты (CD3, CD8) – 19,9, двойные положительные Т-лимфоциты (СD3, CD4, СD8) – 0,4, двойные негативные Т-лимфоциты (СD3, CD4, CD8) – 2,0, иммунорегуляторный индекс (CD4, CD8) – 1,6; В-лимфоциты (CD19) – 17,8; NК-клетки: (CD16+56) – 22,7, NKT-клетки (CD3 CD16+56) – 4,9.
При анализе параметров иммунного статуса на фоне лимфопении отмечено угнетение Т-клеточного звена иммунной системы, проявляющееся снижением относительного содержания CD3-положительных Т-лимфоцитов до 55,7 %, а также их субпопуляций: СВ3+СВ4+ Т-лимфоцитов-хелперов до 33,5 % и СD3+CD8+ цитотоксических Т-лимфоцитов до 19 %. Наблюдалось повышение относительного содержания NK-лимфоцитов (CD16+56+) до 23 %, что может быть расценено, как компенсаторная реакция иммунной системы при снижении функциональной активности NK-клеток. Равнонаправленные изменения данных показателей отмечены и в абсолютных значениях, а именно снижение уровня Т-лимфоцитов и их субпопуляций и повышение NK-лимфоцитов. При этом относительное и абсолютное содержание CD19-положительных В-лимфоцитов оставалось в норме.
При иммуногистохимическом исследовании было обнаружено: HMB-45 – положительная экспрессия, Ki-67 – пролиферативная активность в 35 % опухолевых клеток. Незначительное отклонение от нормы протеина S-100 – 97 нг/л. Мутаций BRAF V600Е не выявлено.
В результате этого наблюдения установлен интересный факт: в течение 23 лет у пациента возникли 3 меланомы кожи различной локализации и гистотипа. Уже первая меланома имела весьма неблагоприятный прогноз (изъязвление и регионарное метастазирование). Однако, период ремиссии составил 22 года. Среди наших пациентов это рекордный срок. Однако, второй период ремиссии длился менее 1 года, что делает прогноз весьма неблагоприятным. Этот случай очень интересен и тем, что взаимоотношения организма-опухоленосителя и опухоли на длительный срок приняли симбиотический характер, длительное время не отмечалось прогрессии заболевания. Стоит ли расценивать появление новых опухолей с другой гистоструктурой как вариант прогрессирования первого заболевания или рассматривать их как отдельные, не связанные друг с другом болезни, еще необходимо выяснить. Безусловно, подобные казуистические случаи требуют продолжения научных исследований в данной области и наше наблюдение за дальнейшей судьбой вышеописанного больного будет иметь пристальный характер.
Сроки ремиссии в лечении меланомы кожи могут достигать 22 лет, несмотря на неблагоприятный прогноз при первой меланоме.
Современные лабораторные (морфологические, иммуногистохимические, иммунологические, молекулярно-генетические) методы исследования в настоящий момент не могут быть использованы в качестве прогностических критериев течения злокачественного процесса.
Актуальность. По данным ВОЗ, в структуре рака кожи меланома составляет 1%, занимая первое место по смертности. За последние 40 лет заболевание меланомой увеличилось в 15 раз. По данным American Cancer Society медиана выживаемости при меланоме пропорциональна стадии заболевания и метастазированию опухоли в отдалённые участки кожных покровов, отдалённые лимфоузлы, но не в другие органы. Узловая меланома является наиболее агрессивным типом опухолей кожи, характеризуется ранним метастазированием в лимфоузлы, лёгкие, печень, головной мозг, кости.
Целью исследования явилось установление морфологических особенностей метастазов меланомы в печени, почке, лёгких – органах, подвергающихся отдалённому метастазированию. Наши исследования были направлены на анализ гистологических подтипов метастазов по сравнению с первичной опухолью.
В связи с этим решались задачи провести сравнительный анализ особенностей строения первичной опухоли и метастазов меланомы в различных органах.
Материал и методы Исследования проведены на пациентах онкологической поликлиники г. Владивостока в соответствии с требованиями Минздравмедпрома РФ от 29.04.94 № 82 и согласно номенклатуре клинических лабораторных исследований МЗ РФ (приказ № 64 от 21.02.2000 г.) с учётом положений Хельсинской декларации (2013). В работе использован трупный материал лёгких, почек, кожи, печени, тонкого кишечника, простаты и надпочечников пациентов с метастазами меланомы. С помощью кластерного анализа исследованы потенциальные однородные подгруппы дермального и внутриорганного поражения метастазами меланомы в соответствии с принципами доказательной медицины. Использован классический морфологический метод исследования с окрашиванием срезов гематоксилином и эозином с последующим анализом полученного иллюстративного материала. Ретроспективная оценка поражений проводилась по морфологическим признакам, наблюдавшимся при использовании микроскопа Olympus Bx 52. Исследование проведено с разрешения Этического комитета ФГАОУ ВО ДВФУ.
Морфологические особенности первичной опухоли и метастазов рассматривались по наличию изменений в структуре эпидермиса и дермы, печени и почек, надпочечника, простаты и стенки тонкого кишечника, степени васкуляризации, топографии и количества лимфоцитов и меланоцитов в просвете сосудов и располагающихся перивазально, содержания недифференцированных клеток в поле зрения на срезах, по составу клеточных ансамблей опухолевых инфильтратов, степени целостности эндотелия сосудов.
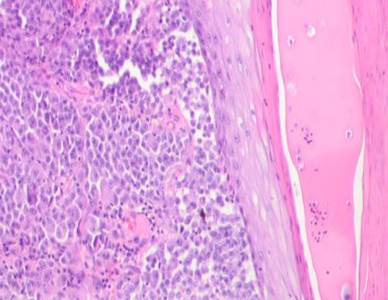
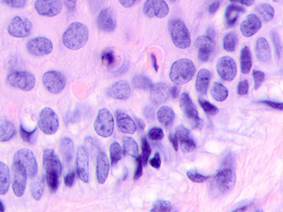
Результаты и их обсуждение. Нами был изучен материал пациентов с диагнозом узловой меланомы на стадии TN1М1b в соответствии с международной классификацией меланом по системе TNM 1997 года. Особое внимание уделяли морфологическим изменениям в структуре кожи, связанным с программированной гибелью кератиноцитов, степени нарушения контактов в структуре эпидермиса, инфильтрации эпидермиса и дермы, а также опухолевой инвазии вглубь кожи с учетом коэффициентов малигнизации по Кларку и Бреслоу. Кроме этого были рассмотрены морфологические особенности элементов микроциркуляторного русла. Под малым увеличением микроскопа на препарате со срезами меланомы виден неравномерный слой утолщенного эпидермиса с обильным лимфоцитарным инфильтратом, распложенным под эпидермисом в виде яркой сплошной полоски, что отражает характерные диагностические признакиля микроинвазии опухоли в дерму. Опухолевые меланоциты, единичные или в виде небольших групп, инфильтрируют все слои эпидермиса. Характерным для меланомы является отсутствие кожного рисунка на поверхности малигнизирующейся кожи (рис. 1, 2).
а
б 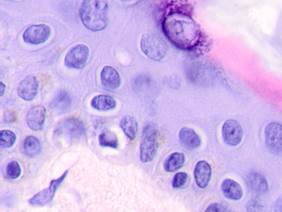
в
Рис. 1.Узловая меланома. Деструкция эпидермиса. Отсутствие кожного рисунка на поверхности меланомы. А) поверхность опухоли; б, в) ткань на границе опухоли. Окраска гематоксилином и эозином. Микрофото. Ув. а) х100; б, в) х400.
а 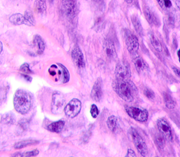
б 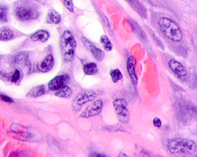
в
Рис. 2. Меланома кожи. Рост сосудов, апоптоз кератиноцитов, утрата межклеточных контактов в базальных слоях эпидермиса. Окраска гематоксилином и эозином. Микрофото. Ув. х400.
После операции у пациентов через 2 месяца увеличились лимфатические узлы, обнаружились метастазы печени и костей. Компоненты метастазов наблюдались и в лимфатических узлах, а также были повышены опухолевые маркеры, такие как ProGRP и nse. Пациентам была проведена комбинированная химиотерапия с цисплатином и этопозидом (ЭП). Всего больными получено 6 курсов химиотерапии. Через 4,5 месяцев после заключительного курса EP-химиотерапии клиника онкопатологии у всех пациентов восстановилась, появились метастазы в удаленных от опухоли органах. Морфологические особенности первичной опухоли и метастазов рассматривались по наличию изменений в структуре эпидермиса и дермы, печени, почек, надпочечника, простаты, лёгких и стенки тонкого кишечника. Была рассмотрена степень деструкции ткани органов, сопровождающая процесс инфильтрации ткани раковыми метастазами. При морфологической характеристике состава клеточных ансамблей опухолевых инфильтратов, степени целостности эндотелия сосудов было отмечено, что метастазы вызвали атрофию и некротические изменения в предсуществующей ткани. Выявлены патологические изменения в виде кальцификатов и склероза во всех органах. В печени отмечены стеатоз, цирроз и очаги некроза, идентифицировались подобные меланоцитам клетки.
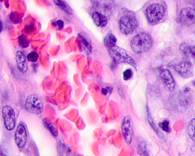
В клинической картине было отмечено, что морфологические изменения привели к последующей утрате функции тканей исследуемых нами органов. В составе клеточных ансамблей метастазов во всех образцах обнаруживались меланоциты (рис. 3).
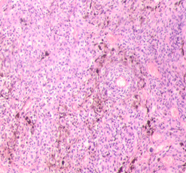
а 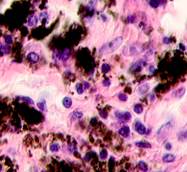
б 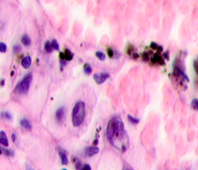
в
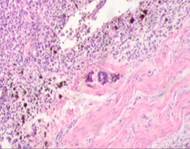
г 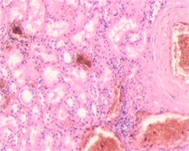
д 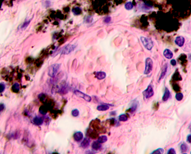
е
Рис. 3. Метастазы меланомы кожи а, б) в печень; в) надпочечник; г) простату; д, е) почку. Окраска гематоксилином и эозином. Ув. а, г, д) х100; б, в, е) х400.
Стандартное лечение в случаях ранней диагностики меланомы хирургическое, оно имеет более низкую частоту метастазирования лимфатических узлов, но происходит отдаленное метастазирование, как предполагают, гематогенным способом через кровеносные сосуды. Этот вариант наблюдается чаще всего [10]. Статистика свидетельствует о низкой эффективности системной химиотерапии при меланоме с метастатическими осложнениями.
Известно, что метастазирование и инвазия являются основными признаками прогрессии опухоли и неблагоприятного прогноза не только при меланоме, но и при любом канцерогенезе. Инвазивный рост сопровождается миграцией опухолевых клеток с распространением сквозь тканевые барьеры. Опухоль начинает прорастать в соседние ткани вследствие биохимических и генетических изменений, развивающихся в клетках опухоли. Несомненным признаком злокачественности опухоли является инвазия клеток за пределы органа, попадание клеток в лимфоузлы и кровеносные сосуды, а также рост по периневральным щелям – инвазивный рак. Такой вид рака характеризуется достаточно быстрым ростом, способностью к диссеминации и метастазированию, инвазией опухолевых клеток в прилегающие органы. Идентифицируется распространение инвазивного рака по перисосудистым пространствам, вокруг лимфатических сосудов.
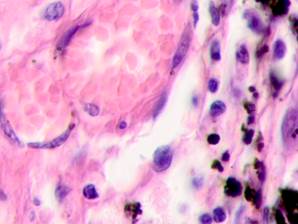
Нами отмечено, что во всех случаях метастазов меланомы пигментные клетки идентифицируются в паренхиме всех исследуемых органов, вокруг кровеносных сосудов (рис. 4).
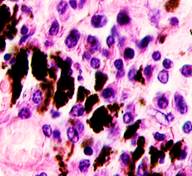
а 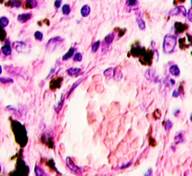
б 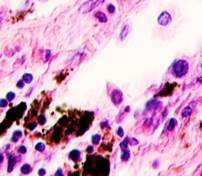
в
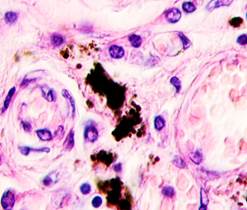
г 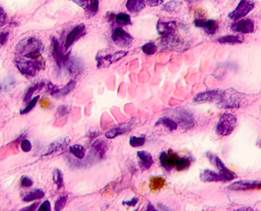
д
е 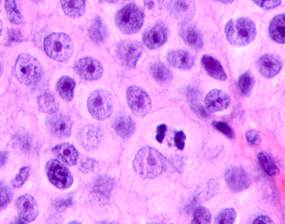
ж
Рис. 4. Пигментные клетки а) в паренхиме печени; б, в, г, д, е) расположенные периартериально; ж) фигуры митоза в гепатоцитах на границе метастазов. Окраска гематоксилином и эозином. Ув. х400.
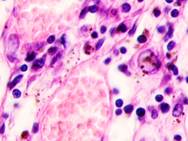
Утрачивается балочная структура печени, дольчатое строение не идентифицируется. Наблюдаются митозы и амитозы (рис. 4 ж). Появление пигментных клеток в составе органа, удаленного от первичной опухоли меланомы, можно рассматривать как начальный регенеративный акт элементов соединительной ткани органа в ответ на атрофические изменения паренхимы. Отсутствие пигментных клеток или макрофагов, содержащих в своей цитоплазме гранулы пигмента, свидетельствует о местной дифференцировке соединительнотканных клеток в пигментосодержащие клетки. Кроме этого, в составе метастазов содержатся инфильтраты, состоящие из клеток, морфологически соответствующих лимфоидному ряду. Такие инфильтраты могут служить выражением экстрамедуллярных процессов кроветворения [11]. Появление лимфоцитарно-плазматических инфильтратов является результатом процесса секреции антител плазматическими клетками, предшественниками которых являются В-лимфоциты, при участии макрофагов (рис. 5).
а 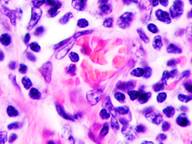
б 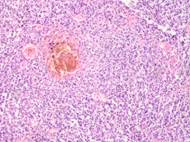
в
Рис. 5. Метастазы а) надпочечник; б) кожа; в) печень. Инфильтрат. Окраска гематоксилином и эозином. Микрофото. Ув. а, б) х400; в) х100.
Метастазы меланомы на коже могут быть темно-синего, черного, иногда розового цвета, склонны к быстрому росту, изъязвлению и распаду и консервативному лечению практически не поддаются. Метастазы в коже также характеризуются ещё и тем, что бывают разного цвета и консистенции.
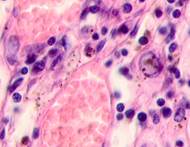
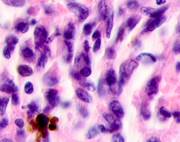
Клетки инфильтрата в органах, удаленных от первичной опухоли, идентифицируются не только в паренхиме, но и в просвете кровеносных сосудов (рис. 6).
а 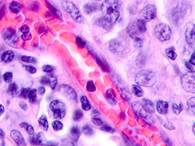
б 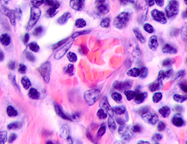
в
г 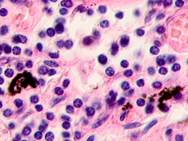
д 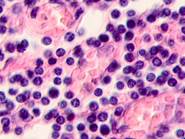
е
Рис. 6. Метастазы а) надпочечник; б) кожа; в) печень. Инфильтрат. Окраска гематоксилином и эозином. Микрофото. Ув. а, б) х400; в) х100.
Анализ результатов нашего исследования морфологии опухоли и метастазов позволил установить, что в зоне малигнизации, соответствующей первичной опухоли, идет изменение структуры кожи с нарушением функции, инфильтрат распространяется в дерме. Закономерно возникает вопрос о том, с чем связано появление пигментных клеток в органах, удаленных от первичной опухоли. На основании того, что пигментные клетки в просвете кровеносных сосудов не идентифицируются, мы сделали предположение, что может быть два варианта для объяснения этого явления. Первый связан с тем, что клетки, содержащие пигмент в цитоплазме, являются местными, но получили неправильный сигнал для дифференцировки в меланоциты и к секреции и накоплению пигмента. Второй вариант предполагает, что это пришлые клетки, являющиеся прекурсорными, получившими программу развития и дифференцировки в направлении меланоцитов. Второй вариант предполагает более сложный путь развития, связанный с сигнальной индукцией миграции меланобластов, что требует дополнительного подтверждения, а затем с дифференцировкой меланобластов в меланоциты. Клетки инфильтрата опухоли идентифицируются как в просвете сосудов, так и вокруг сосудов, поэтому не исключается их миграция из первичной опухоли. Противоречит этому только отсутствие иногда первичной опухоли, метастазирование, минующее регионарные лимфатические узлы, быстрое развитие генерализованного метастазирования.
Нарушение функции органов характеризуется клинической картиной в зависимости от степени малигнизации органа. Проблемы метастазов в печени связаны не только со сдавливанием желчных протоков и нижней полой вены. Клинически у пациентов отмечается боль в верхнем подреберье, развитие острой желтухи и образование хронических отеков нижних конечностей, небольшие злокачественные островки деструкции легких. Метастатический рак почти не поддаётся полноценному излечению. На стадии формирования вторичных злокачественных очагов возможна только паллиативная и симптоматическая терапия, призванная продлить жизнь больного и улучшить её качество. Поэтому знание механизмов метастазирования позволит решить проблему профилактики этого грозного осложнения и разработать патогенетически обоснованные методы профилактики. Вторичные опухолевые узлы в кишечнике могут быть результатом рака печени, почек, поджелудочной железы, непосредственно кишечника и многих других онкологических заболеваний. Хирургическое лечение редко применяется на стадии метастазирования, но иногда операции могут быть выполнены с целью восстановления жизненно важных функций органа [12]. В остальных случаях применяют лучевую терапию, химиотерапию, симптоматическое лечение обезболивающими препаратами.
С ростом количества клеток в метастазах, в них начинают формироваться собственные системы кровоснабжения, что ведет к истощению организма вследствие перераспределения питательных веществ и кислорода в пользу вторичных очагов малигнизации. Это связано с кахексией и вторичным иммунодефицитом, наблюдаемых при раках любой локализации.
Средняя продолжительность жизни больных с метастазами в различные органы зависит от локализации: в печени – 6 месяцев, с метастазами в костной ткани при полноценном лечении – несколько лет, с метастазами в почках – от года до 3 лет, с метастазами в головном мозге – несколько недель.
Обсуждение. Результаты хирургического лечения при меланоме не являются гарантией полного излечения пациентов. Вопросы метастазирования первичных опухолей и установление причин способности к инвазии опухолевой клетки не только меланомы, но и других канцерогенезов, требуют разрешения этих вопросов. Вопрос истинных мишеней для консервативного лечения опухолей ждет своего решения. Поиск сигнальных молекул, индукторов дифференцировки и миграции клеток, на современном этапе является наиболее перспективным. Повышения эффективности хирургического метода лечения онкологических заболеваний можно добиться только при подавлении способности к инвазии раковых клеток, воздействуя на эти молекулы лекарственными средствами до и после операции. Пока не будет окончательно доказана природа раковых клеток, создание вакцин на основе дендритных клеток, экстракты из эмбриональных тканей и лекарственных препаратов к белкам-маркерам и генам-маркерам опухолевых клеток будет затруднительным.
Выводы Терапевтическая стратегия, основанная на правильном представлении процессов метастазирования и оценке того, какой клеточный компонент вызвал метастаз, важна в разработке методов патогенетически обоснованного лечения первичных и метастатических опухолей. Изучение процессов индукции на дифференцировку плюрипотентных клеток, как в первичных опухолях, так и в метастатических, лежит в основе выяснения механизмов малигнизации.
Работа выполнена при поддержке Научного фонда ДВФУ, в рамках государственного задания 17.5740/2017/6.7.
This work was supported by Science Foundation Far Eastern Federal University, in the framework of the state task from 17.5740/2017/6.7.
Читайте также:

