Спонтанная опухоль молочной железы мыши
"Модель – это ложь, которая помогает увидеть правду"
Говард Скиппер, американский онколог
О том, что животных можно использовать в качестве моделей для изучения различных воздействий, ученые догадались достаточно давно. Еще в Древней Греции Аристотель проводил эксперименты на живых животных. Позднее Авицена тестировал новые хирургические процедуры на животных, прежде чем выполнить их у пациентов. 
В наше время в онкологии животные модели используются с различной целью:
- изучение эффективности и безопасности лекарственных препаратов, которые предполагается внедрить в клиническую практику - доклинические исследования;
- дальнейшая интерпретация результатов клинических исследований - пост-клинические исследования;
- скрининг в поисках новых лекарств;
- изучение биологии опухоли;
- изучение механизмов противоопухолевого лечения: взаимодействие препарата с мишенью.
Чтобы получить представление о роли экспериментальных исследований на животных в развитии онкологии, обратимся к двум историческим примерам.
Пример 1
В 1954 году в США был принят законопроект, поручавший Национальному институт онкологии разработать программу по целенаправленному и эффективному поиску лекарств для химиотерапии. За десять лет на миллионе мышей было протестировано около 83 тысяч синтетических веществ, 115 тысяч продуктов ферментации и свыше 17тысяч веществ растительного происхождения. В итоге, в распоряжении врачей для лечения детей с острым лимфобластным лейкозом было 4 препарата - метотрексат, преднизон, 6-меркаптопурин и винкристин. Все они использовались, но по отдельности. Лечение лейкемии у детей продолжало оставаться паллиативным.
На этой модели Скиппер впервые описал два важных наблюдения:
- Химиотерапия в каждый момент убивает определенный процент от общего числа клеток, вне зависимости от того, сколько их в организме.
Так, если взять мышь, у которой сто тысяч лейкозных клеток, и применить вещество, убивающее за один раз девяносто девять процентов этих клеток, то каждый новый прием будет убивать ровно эту долю, а в результате после каждого раза таких клеток будет оставаться все меньше и меньше: сто тысяч, тысяча, десять – и, наконец, после четвертого цикла упадет до нуля. - При комбинированном применении противоопухолевые лекарства работают синергически, усиливая действие друг друга.
При использовании нескольких препаратов и нескольких повторных циклов химиотерапии с малыми промежутками между ними Скипперу удавалось на своей мышиной модели добиться полного исцеления от лейкемии.
Было решено испробовать схему, сочетающую в себе четыре лекарства: винкристин, аметоптерин, меркаптопурин и преднизон. Эта схема получила сокращенное название по первым буквам каждого лекарства: ВАМП.
В первом же небольшом исследовании у 14 из 16 пациентов была достигнута полная ремиссия, а отдаленная безрецидивная выживаемость отмечена у трех из них.
Позже концепцию сочетания противоопухолевых препаратов и их курсового введения, выработанную на экспериментальной модели, применили для поздних стадий лимфомы Ходжкина. Было решено взять четыре препарата – метотрексат (позже замененный на более сильнодействующее средство – прокарбазин), винкристин, азотистый иприт (или мустарген) и преднизон. Получился не менее токсичный, чем ВАМП, коктейль с аббревиатурой МОМП (МОПП – с прокарбазином), а курс лечения был увеличен с 2,5 мес. до 6. 
Более половины испытуемых выздоровели окончательно и бесповоротно. Для поздних стадий лимфомы Ходжкина подобный ответ на лечение и количество ремиссий был беспрецедентен. Успехи комбинированной химиотерапии разительным образом изменили прогнозы пациентов с ранее неизлечимыми III и даже IV стадиями лимфомы Ходжкина. И изначально это стало возможным благодаря модели лейкемии Л1210 у мышей.
Пример 2
Еще один яркий пример использования животных моделей в онкологии – это создание анти Her2-препаратов. В 1982 в лаборатории Роберта Вайнберга выделили очередной онкоген из крысиной опухоли под названием нейробластома. Ген окрестили neu в честь типа рака, из которого этот ген был получен. От многих других открытых в то же время онкогенов его отличало то, что он не прятался в глубине клетки, а проходил через мембрану, причем так, что большой фрагмент его торчал наружу, доступный любому лекарству, т.е. это была идеальная мишень. Но эксперимент по связыванию этой мишени имеющимися в лаборатории антителами не был проведен.
Теперь от истории вернемся к предмету разговора – моделям опухолей. Классическими объектами экспериментальной онкологии являются млекопитающие, прежде всего мыши и крысы, которые хорошо адаптируются к условиям жизни в неволе и дают многочисленное потомство. Нет ни одной проблемы онкологии, которую не исследовали бы с использованием этих грызунов.
- У животных встречаются спонтанные опухоли (особенно это относится к опухолям молочной железы); подобные модели довольно близки по своей картине к клинической ситуации.
Ограничение - невозможно набрать в конкретный срок требуемое количество животных с опухолями схожих размеров и этапов развития, чтобы провести эксперимент.
- Химически индуцированные опухоли.
Например, бензпиреновые опухоли индуцируются введением мышам однократно подкожно бензпирена в масляном растворе. Это приводит к равномерному развитию подкожных фибросарком у всех животных в месте инъекции в течение 4-5 недель после введения.
Ограничения: эффекты канцерогена на поведение самой опухоли, риск для других животных и персонала.
- Генетически созданные мышиные модели (genetically engineered mouse models – GEMM).
Такие модели позволяют достаточно точно моделировать спорадические человеческие опухоли за счет контролируемого изменения генома мышей, что обеспечивает развитие конкретной опухоли с определенными свойствами в заданной локализации. Так, создаются линии животных, которые целенаправленно лишены определенного гена, или, напротив, имеют встроенный дополнительный ген.
Ярким примером трансгенных мышей является линия мышей с повышенной экспрессией онкогена HER2. У этих животных в возрасте от 2 месяцев появляются опухоли молочных желез (HER2/neu-положительных).
Ограничения: несмотря на гистологическое и генетическое сходство со злокачественными новообразованиями у человека, для большинства GEMM характерно асинхронное развитие опухолей в организме-хозяине. Такие модели, как правило, гетерогенны с точки зрения частоты развития опухолей, времени задержки в развитии опухолей и характеристик роста.
- Перевиваемые опухоли – это самая многочисленная подгруппа.
Здесь можно выделить два принципиально разных способа перевивки.
Первый, когда фрагмент мышиной/крысиной опухоли в последующем перевивается животному той же линии.
Во втором случае животным (обязательно иммунодефицитным) вводится культура опухолевых клеток человека. Такие модели получили название ксенографтных.

Усовершенствованным и наиболее перспективным вариантом стандартной ксенографтной модели является модель, для создания которой используются фрагменты опухолей, полученные непосредственно от пациентов, т.е. осуществляется прямой перенос опухолевого материала, взятого у пациента, в организм животного с иммунодефицитом без предварительного культивирования опухолевых клеток (patient-derived xenografts – PDX). Подобные PDX-модели продемонстрировали способность точно предсказывать положительный клинический ответ на лечение у 90% пациентов, и резистентность к проводимой терапии у 97% больных. Цифры, близкие к этим были получены в целом ряде исследований.
Ограничения использования данной модели обусловлены техническими особенностями ее создания, для которого необходим доступ к опухолевой ткани определенного качества непосредственно после ее получения от пациента, а также определенной материально-технической базы лаборатории, позволяющей проводить соответствующую обработку полученного материала и поддерживать опухоль через серию пассажей в организме-хозяине.
GEMM и PDX-модели, несмотря на свои недостатки, сегодня рассматриваются как наиболее ценные и перспективные с точки зрения тестирования вновь создаваемых противоопухолевых препаратов.
Г.С. Киреева, кандидат биологических наук,
научный сотрудник научной лаборатории канцерогенеза и старения
Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова.
Было решено испробовать схему, сочетающую в себе четыре лекарства: винкристин, аметоптерин, меркаптопурин и преднизон. Эта схема получила сокращенное название по первым буквам каждого лекарства: ВАМП.

Развитие опухоли молочной железы у нерожавших мышей
Mary Feigman et al. / Nature Communications, 2020
После первой беременности в эпителиальных клетках молочных желез мышей происходит изменение транскрипционных программ и эпигенетические перестройки. В результате формируется молекулярная память, и при последующих беременностях (или при гормональной имитации беременности) паттерн экспрессии генов быстро перестраивается. Кроме того, благодаря эпигенетическим изменениям молочные железы рожавших мышей подавляют канцерогенное влияние гена cMYC. При этом у животных активируется молекулярный фенотип клеточного старения — авторы статьи в Nature Communications предполагают, что он может защищать молочные железы от развития новообразований.
Во время беременности в молочных железах женщины происходят масштабные перестройки: клетки эпителия расширяются, появляется множество протоков, в которых накапливается молоко. Когда лактация заканчивается, железы возвращаются в исходное состояние, однако на молекулярном уровне некоторые изменения остаются навсегда. Регуляция транскрипции ряда генов в молочных железах женщин, которые рожали хотя бы один раз, отличается; в клетках происходят эпигенетические изменения, которые лежат в основе молекулярной памяти, — при последующих беременностях клетки молочных желез быстро перестраивают работу своих генов.
Лактация — не единственное направление перестройки эпителиальных клеток молочных желез во время беременности. Известно, что после родов у женщин изменяется риск развития рака груди: в первые годы он увеличивается, но в долгосрочной перспективе снижается. Подавление онкогенеза в молочных железах после беременности наблюдали и у грызунов, однако объяснение этому эффекту до сих пор не нашли.
Ученые из США под руководством Камилы Дос Сантос (Camila dos Santos) из Лаборатории в Колд-Спринг-Харбор анализировали экспрессию генов (по их РНК-транскриптам) в эпителиальных клетках молочных желез у нерожавших мышей и после беременности. Кроме того, для имитации двух последовательных беременностей животным вводили гормоны. Чтобы проверить, связана ли экспрессия генов с эпигенетическими изменениями, в тех же группах животных исследовали количество активных гистонов (ядерных белков, ответственных за эпигенетическую регуляцию молекулярных процессов) по специфическим меткам.
После беременности в клетках молочных желез произошли эпигенетические перестройки: число активных гистонов увеличилось в 10 раз, и располагались они в участках генома, которые отвечают за другие клеточные процессы.
Чтобы проверить влияние беременности на развитие опухоли, у мышей индуцировали экспрессию гена cMYC, который запускает рост новообразований. В результате у нерожавших животных в молочных железах за несколько дней развилось предопухолевое состояние; после восьми дней активации cMYC мыши умирали. После беременности же cMYC не вызывал отклонения в морфологии тканей — срезы молочных желез рожавших животных на пятый день экспрессии этого гена выглядели так же, как и у контрольных мышей.

Срезы молочных желез мышей до и после беременности после пяти дней гиперэкспрессии гена cMYC
Mary Feigman et al. / Nature Communications, 2020
Основным методом лечения рака молочной железы (рМЖ) является оперативное вмешательство [1,2]. Применение современных инструментальных методов диагностики и программ профилактического обследования женщин в развитых странах увеличивает долю больных с ранними стадиями РМЖ, но даже ранняя диагностика не приводит к излечению всех пациентов. Возможно, это связано с тем, что, как полагают Demicheli с соавт., удаление первичной опухоли молочной железы может приводить к стимуляции вторичного опухолевого роста [3]. Для проверки этой гипотезы требуются подходящие мышиные модели рМЖ.
Ранее нами было показано, что спонтанные опухоли молочных желез (сОМЖ) мышей оригинальных линий BLRB, BYRB и CBRB с хромосомной транслокацией Rb(8.17)1Iem (далее RB-линий) и высокой частотой возникновения MMTVассоциированных сОМЖ во многом адекватны соответствующему раковому заболеванию человека [4]; при этом у каждой
второй самки BYRB и каждой третьей самки BLRB и CBRB наблюдается более одной локализации ОМЖ, иногда билатерально. Для анализа эффективности метода лечения в онкологической практике принято оценивать продолжительность безрецидивного периода и продолжительность жизни пациентов с рМЖ. Поэтому целью данной работы было сравнить продолжительность жизни самок мышей-опухоленосителей после удаления спонтанной опухоли и без хирургического вмешательства и оценить значимость величины безрецидивного периода для выявления эффективности хирургии.
Методы
В работе использовали самок мышей RBлиний из племенных ядер, поддерживаемых в стандартных конвенциональных условиях вивария Института биоорганической химии рАН, Москва [4]. Для каждой самки регистрировали даты рождения, возникновения первичной и вторичных опухолей, дату смерти. Животных в терминальном состоянии подвергали эвтаназии, считая этот день датой гибели самки. Еженедельно измеряли размер опухоли для определения динамики опухолевого роста [4]. На основании этих данных для каждой самки вычисляли возраст появления первичной опухоли (ВО1), возраст появления вторичной опухоли (ВО2) и период времени между первичной и вторичной ОМЖ (ВО2-ВО1), продолжительность жизни с опухолью (ПЖПО) и общую продолжительность жизни (ОПЖ).
Статистическую значимость различий в средних значениях параметров определяли с помощью непараметрического U-критерия Вилкоксона-Манна-уитни.
Результаты и обсуждение
Сравнительный анализ данных (Табл. 1) показал, что средний возраст мышей на момент возникновения первичной опухоли в опытной и контрольной группах совпадал. Таким образом, в среднем, сОМЖ возникали у самок мышей (n=61) в возрасте 62 недель. Интересно, что средний возраст ВО1 для самок мышей в неделях практически совпал со средним возрастом на момент первичного диагноза рМЖ в клинике, исчисляемым в годах [5]. Это послужило основанием, во-первых, считать, что одна неделя возраста мыши (после 6-ти месяцев) в рассматриваемой мышиной модели рМЖ соответствует одному году жизни человека; вовторых, проводить аналогию 5-недельного выживания самок мышей после проведения операции с 5-летним выживанием пациентов, как критерием эффективности лечения РМЖ.
Продолжительность жизни после обнаружения первичной сОМЖ до гибели (ПЖПО) у прооперированных мышей увеличилось в среднем в 2.2 раза, ВО2-ВО1 - в 1.7 раза, а общая продолжительность жизни (ОПЖ) - в 1.1 раза (на 12%) по сравнению с неоперированным контролем. Приведенные данные наводят на мысль, что как ПЖПО, так и ОПЖ увеличились у оперированных самок на величину безрецидивного периода (9.5 нед.), а именно ПЖПО опыт контроль = 9,5 нел. и ОПЖ опыт.контроль = 8,5 нед. соответственно. Однако после операции количество локализаций сОМЖ на момент гибели в среднем увеличилось с 1.5 в контроле до двух (Табл. 1). При этом доля самок с двумя и более опухолями в опытной группе достигла 80% (при 34% в контроле).
Полученные данные позволяют предположить, что для части животных (80-34=46%) операция по удалению первичной опухоли могла привести к неблагоприятному исходу, например, из-за стимуляции роста вторичных локализаций. Тогда самок мышей разделили на подгруппы с коротким ( 5 недель) безрецидивным периодом (Табл. 2).
Наше предположение заключалось в том, что именно самки с коротким БРП и были теми животными, для которых проведение операции не привело к успеху. Данные были проанализированы с целью выяснить,
Таблица 1. Характеристики прооперированных самок по сравнению с неоперированным контролем
содержание
- 1 Инфекция и жизненный цикл
- 2 Гормональные отзывчивость интегрированной ДНК MMTV
- 3 промотор MMTV в моделях рака молочной железы человека
- 4 Примечания
- 5 Ссылки
Инфекция и жизненный цикл
Несколько штаммов мыши являются носителями вируса эндогенно, но оно также передается вертикально через молоко от матери к щенку. Он содержится в ДНК провируса , интегрированном в ДНК молока лимфоцитов . Вирусы становятся транспортироваться через желудочно - кишечный тракт к пейеровым бляшек , где они заражают новый хозяин макрофаги , а затем лимфоциты.
Вирус опухоли молочной железы мышей (MMTV) ранее был классифицирован как простой ретровирус ; Однако, недавно было установлено, что MMTV кодирует дополнительный саморегулируемой мРНК экспорта белка, Rem, с подобием к вирусу иммунодефицита человека ВИЧ - Rev белка, и , следовательно, первый комплекс мышиный ретровирус быть документированы.
MMTV коды для ретровирусных структурных генов и дополнительно для суперантигена . Это стимулирует Т - лимфоциты с определенным типом V бета - цепи в их Т - клеточного рецептора , который в свою очередь стимулирует В - клеток пролиферацию , увеличивая популяцию клеток , которые могут быть заражены. В периоде полового созревания, вирус проникает в молочных железах с миграцией лимфоцитов и заражает пролиферирующий эпителиальные клетки молочных желез.
Когда геном вируса вставлен в геном хозяина он тогда в состоянии расшифровывать свои собственные вирусные гены. В FU Ройсс и JM Coffin (2000) эксперименты упоминаются , что экспрессия генома вируса активируется энхансер элемент , который присутствует в U3 области длинного концевого повтора генома. Кроме того, экспрессия генома активируется специфический в клетках молочной железы. Эстроген может дополнительно активировать экспрессию вирусного генома. Экспрессия потеков гена , который присутствует в провирусе несет ответственность за производство суперантигена.
ВОМЖЙ может быть переданы или через экзогенный или эндогенный маршрут. Если вирус передается экзогенно, он передается от матери мыши к ее щенкам через ее молоко.
С другой стороны , щенки могут быть заражены вертикально через эндогенную инфекцию, наследуя вирус непосредственно от их матери в зародышевом. Мыши , которые заражаются таким образом , имеют более высокий уровень возникновения опухолей. Ретровирус является эндогенным для хозяина , как только провирусная ДНК вставляется в хромосомной ДНК. В результате, у мышей с эндогенными MMTV имеют Вирус размножается в каждой клетке своего тела, так как вирус присутствует в ДНК спермы или яйцеклетки , из которых мыслится животное.
Гормональная отзывчивость интегрированной ДНК MMTV
Эндогенный ВОМЖМ реагирует на целый ряд гормонов , которые регулируют нормальное развитие молочных желез и лактацию, реакция была продемонстрирована стероидных гормонов ( андрогенов , глюкокортикоидов и прогестины ), а также пролактина .
Когда мышь достигает половой зрелости, вирус начинает выражать свою матричную РНК в эстрогена чувствительных тканей. В результате, после полового созревания всех грудных клетки будут содержать активный ретровирус и начинают размножаться в геноме и выразить вирусный РНК во всех новых клетках ткани молочной железы.
Промотор MMTV в моделях рака молочной железы человека
ДКП ( длинный концевой повтор ) из MMTV содержит глюкокортикоиды элемента ответа гормона . Этот глюкокортикоид элемент представляет собой промотор , который часто используется для создания мышей , которые развивают рак, как заболевание молочной железы, так как животная модель системы для рака молочной железы , близкой к человеческой болезни очень искал.
Промотор MMTV используется в модельной системе PyMT из мышиных моделей метастазов рака молочной железы . Здесь Py это аббревиатура полиомы и MT является сокращением среднего Т. Есть еще модель системы рака молочной железы , которые используют промотор MMTV. Полиомы средний Т-антиген взят из вируса полиомы . Модель MMTV-PyMT было показано, что надежная модель метастаз рака молочной железы. При раке молочной железы человека полиома среднего Т- антиген не был найден.
РАКА МОЛОЧНЫХ ЖЕЛЕЗ ВИРУСЫ (син.: вирус Биттнера, фактор молока) — группа вирусов сем. Retroviridae, возбудителей рака молочных желез мышей. Первый из них был открыт в 1936 г. амер. исследователем Дж. Биттнером, к-рый обнаружил, что рак молочных желез мышей может передаваться потомству через молоко матери, содержащее особый фактор.
Вирусы рака молочных желез мышей составляют группу антигенно родственных, морфологически идентичных вирусов, относящихся к онковирусам типа В и обладающих различной онкогенной активностью. Диаметр вириона 80—120 нм. Электронно-оптически плотный асимметрично расположенный нуклеоид вириона размером ок. 50 нм, окружен одинарной мембраной. Вирусы рака молочных желез мышей содержат 30% липидов, 2% РНК и 68% белка, инактивируются при нагревании до £° 65—66° в течение 30 мин., нечувствительны к воздействию больших доз рентгеновского излучения и могут длительное время (до нескольких лет) сохраняться при замораживании до —79°, лиофилизации и в 50% нейтральном глицерине.
Подобно другим ретровирусам (см.), вирусы рака молочных желез мышей содержат одноцепочечную РНК с мол. весом (массой) ок. 10 млн. дальтон и обратную транскриптазу (ревертазу). Помимо белка этого фермента, в составе вирионов различают 5 основных белков, два из к-рых являются гликопротеидами с мол. весом 52 000 и 34 000 дальтон, а три — негликозилированными белками (28 000, 18 000 и 12 000 дальтон).

Вирионы этих вирусов в большом количестве всегда присутствуют во всех раковых опухолях молочных желез (рис., а, б), в нормальной ткани молочной железы и в молоке мышей, в т. ч. и при первой беременности молодых самок тех линий, для к-рых характерна высокая частота развития опухолей молочных желез. Вирусы проявляют инф. свойства при введении новорожденным мышам; их можно титровать по способности вызывать опухоли молочных желез. Удовлетворительные методы титрования вирусов в культуре клеток не разработаны.
Вначале было показано, что исходный штамм вируса Биттнера содержит две разновидности — S и L. Причем штамм S вызывает опухоли у самок вскоре после родов и передается только через молоко матери и лишь у тех мышей, к-рые несут специфический аллель — MSe. Другой штамм вируса — L, напротив, не передается через молоко, однако одинаково хорошо распространяется со сперматозоидами и яйцеклетками. Этот вирус обладает менее выраженными бластомогенными свойствами, чем штамм S.
Впоследствии от нескольких линий мышей был выделен третий тип вируса — Р, к-рый аналогично штамму S был высокоонкогенен и передавался как с молоком, так и со сперматозоидами и яйцеклетками. Обработка мышей, считавшихся свободными от вирусов рака молочных желез, различными химическими и физическими онкогенами, а также гормонами приводит к продукции высокоонкогенного вируса, отношение к-рого к штаммам S, L и Р окончательно не установлено.
Общепризнанно, что практически нет ни одной линии мышей, не содержащей генетической информации ретровируса типа В. Передача эндогенного вируса ' у мышей различных линий осуществляется посредством неотделимого от генетического материала половых клеток ДНК-провируса, т. е. вирусных генов, находящихся в составе хромосомной клеточной ДНК. Выявлены доминантные клеточные гены, контролирующие чувствительность к онкогенному действию вируса. У мышей с высоким уровнем возникновения спонтанных опухолей молочных желез вирусы рака молочных желез передаются через молоко (экзогенная горизонтальная передача). Этот инф. вирус, вызывающий раннее развитие рака молочной железы у мышей первого поколения, отсутствует в молоке безвирусных мышей с низким уровнем возникновения спонтанных опухолей молочной железы. Вместе с тем в ДНК клеток нормальной молочной железы этих линий животных, а также в геноме клеток других паренхиматозных органов (придатки яичка, почки, вилочковая железа) содержатся ДНК-провирусные последовательности (провирус инфекционного вируса рака молочных желез мышей), к-рые передаются вертикально половыми клетками (эндогенная вертикальная передача). Эндогенные ДНК-провирусные последовательности ассоциированы с 3 независимыми парами хромосом мышей. Так, хромосома 4 содержит 2 копии ДНК вируса. Вероятно, 4 копии ДНК-провирусных последовательностей локализованы в хромосомах 15 и 17. В процессе индукции опухолей молочной железы онкогенами или гормонами постоянный уровень экспрессии (функционирования вирусных генов) эндогенного провируса резко увеличивается, и опухолевые клетки уже содержат в 30—50 раз большую концентрацию вирусных РНК.
Т. о., возможно, что онкогенное действие гормонов и хим. онкогенов опосредовано изменением экспрессии эндогенных вирусов рака молочных желез мышей, и, вероятно, вирусы, онкогены и гормоны являются коканцерогенными факторами (совместно ускоряющими) малигнизации клеток паренхимы молочной железы. Продукция инф. частиц вирусов происходит только в клетках молочной железы или опухолей этого органа. различия в чувствительности мышей к экзогенным вирусам не связаны с организацией и экспрессией генов эндогенных вирусов.
Различные линии мышей являются носителями специфичных для каждой из них типов вирусов рака молочных желез, к-рые отличаются по биол, характеристикам: по кругу хозяев, вирулентности, способу передачи, морфологии вызываемых ими опухолей и др. Вирусы рака молочных желез крыс, кошек и собак изучены мало. С раком молочных желез у крыс и кошек ассоциируют ретровирусы типа С, а у собак вирусные частицы обнаруживаются крайне редко. Большое внимание уделяют раку молочных желез обезьян в связи с выделением из спонтанно возникшей опухоли у макаки резуса ретровируса Мейсона—Пфайзера, отнесенного впоследствии к вирусам типа Б.
Предполагают наличие и у человека вируса, аналогичного или родственного вирусам рака молочных желез мышей. Эти предположения основаны на обнаружении в ультратонких срезах клеток раковой опухоли молочных желез человека, а также в клетках эпителия вирусных частиц, в нек-рых случаях морфологически неотличимых от вирусов рака молочных желез мышей. В клетках рака молочных желез человека обнаружены основные компоненты ретровирусов, а в нек-рых случаях и вирионы. С помощью иммунол. методов были получены данные, свидетельствующие о возможном наличии у человека белков, близко-родственных или даже идентичных основным белкам вирусов рака молочных желез мышей.
Механизм онкогенного действия вирусов рака молочных желез мышей чрезвычайно сложен и окончательно не выяснен. Генетические факторы влияют на гормональный баланс, репродукцию вируса, его передачу и восприимчивость клеток. Бластомогенная активность вирусов зависит от дополнительных факторов: диеты, численности популяции мышей, температуры среды и др. Для малигнизации клеток вирусами необходима постоянная стимуляция их пролиферации и дифференцировки маммотропными гормонами; в то же время длительная обработка этими гормонами приводит к малигнизации клеток паренхимы молочной железы, содержащих в ДНК гены эндогенных и экзогенных типов вируса рака молочных желез мышей.
Библиогр.: Городи лова В. В. Специфический антиген рака молочных желез и его значение в этиологии данной опухоли, М., 1961, библиогр.; Крюкова И. Н. О возможной ассоциации онковирусов, родственных онковирусам типа В мышей, с карциномами молочных желез человека, Эксперим. онкол., т. 2, № 4, с. 13, 1980; Gross L. Oncogenic viruses, Oxford а. о., 1970.

- Как возникает рак молочной железы?
- Типы рака молочной железы
- Причины и факторы риска
- Симптомы рака молочной железы
- Самостоятельная диагностика рака груди
- Диагностика
- Стадии рака молочной железы
- Лечение рака молочной железы
- Прогноз при раке молочной железы
Как возникает рак молочной железы?
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными .
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
Типы рака молочной железы
Злокачественные опухоли груди делятся на два типа: протоковые и железистые. Протоковый рак молочной железы встречается чаще. Он может быть внутриэпителиальным (in situ) и инвазивным. У внутриклеточного протокового рака молочной железы более благоприятный прогноз, он редко дает метастазы и излечивается в 98% случаев. Инвазивный же вариант опухоли склонен к бесконтрольному росту и генерализации процесса.
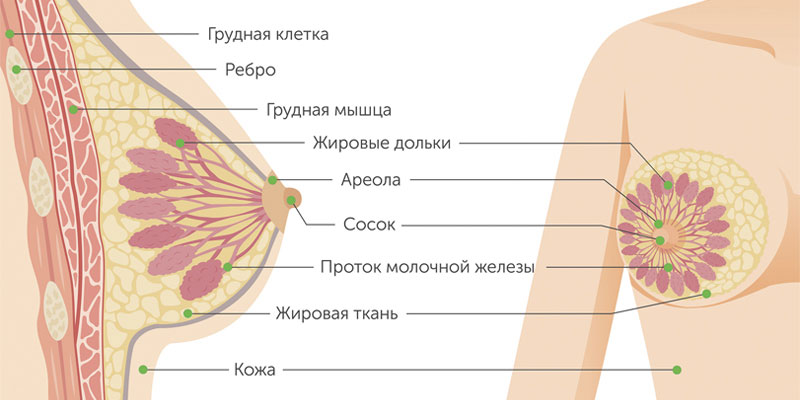
Железистый рак молочной железы может быть дольковым (инвазивная лобулярная карцинома) или произрастать из других клеток железистой ткани. Для долькового рака нередко характерен мультицентричный рост. Скорость увеличения в размерах и сроки метастазирования форм узлового рака груди зависят от степени дифференцировки опухоли.
Причины и факторы риска
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Симптомы рака молочной железы
На ранних стадиях рак молочной железы, как правило, никак клинически не проявляется. Чаще всего опухоль обнаруживается самими больными или выявляется случайно при проведении профилактических исследований.
Пациентки обычно жалуются на наличие пальпируемого образования, выделения из соска. Боль является редким симптомом рака грудной железы, однако болевой синдром может выйти на первый план на этапе генерализации процесса, в особенности при распространении метастазов в кости.
Довольно часто выявляются такие признаки рака груди, как появление асимметрии вследствие изменения размеров пораженной железы. Уменьшение, смещение кверху, деформация и сморщивание молочной железы может наблюдаться при скиррозной (фиброзной) форме опухоли. Напротив, увеличивается грудь на стороне поражения при быстром росте образования или из-за отека, который формируется по причине нарушенного оттока лимфы.
При распространении новообразования в подкожную клетчатку могут наблюдаться изменения кожи. При этом выявляются следующие симптомы рака молочной железы:
Иногда, при распространении опухоли на поверхность кожи могут наблюдаться такие признаки рака груди, как покраснение и изъязвление. Наличие этих симптомов говорит о запущенности процесса.
Изменения соска тоже могут определяться, но только на поздних стадиях. При этом имеют место такие симптомы рака грудной железы, как:
- Симптом Форга — на стороне поражения сосок находится выше, чем на здоровой стороне.
- Симптом Краузе — сосок утолщен, складки ареолы заметно выражены.
Такой признак рака молочной железы, как патологические выделения, является довольно редким, но в ряде случаев может быть единственным симптомом, который выявляется при осмотре. Часто выделения носят кровянистый характер, реже встречаются серозные и гнойные.
Также были выделены особые формы рака груди, которые проявляются типичной симптоматикой. К ним относятся:
- Отечно-инфильтративная форма, для которой характерно увеличение и отечность железы, мраморный цвет кожи, выраженная гиперемия.
- Маститоподобная. Данный вид рака груди проявляется уплотнением пораженной груди, повышением температуры тела.
- Рожистоподобная форма, при которой на коже выявляются очаги (иногда появляются изъязвления), которые внешне напоминают рожистое воспаление.
- Панцирная форма характеризуется наличием множественных узлов, за счет которых происходит сморщивание и деформация железы.
- Рак Педжета — поражает сосок и ареолу. При данной разновидности наблюдают утолщение соска, изменение кожи в виде покраснения и уплотнения, образование корок и чешуек.
Иногда люди, интересуясь по каким признакам можно распознать наличие опухоли молочной железы, по ошибке ищут симптомы рака грудины. Данное название является неверным, так как грудина является центральной плоской костью грудной клетки и даже при метастазировании злокачественного образования груди практически никогда не поражается.
Самостоятельная диагностика рака груди
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц после менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
Диагностика
Диагностика рака молочной железы начинается с беседы. На этом этапе для врача важно оценить жалобы женщины и выяснить, встречались ли случаи рака молочной железы в её семье, если да — насколько часто. Это помогает заподозрить наследственную форму рака, связанную с мутациями в генах BRCA1, BRCA2, NBS1, CHECK, TP53.
Далее врач осматривает, ощупывает молочные железы, проверяет, нет ли в них узлов и уплотнений, не увеличены ли лимфатические узлы в подмышечной, надключичной и подключичной областях.
После осмотра врач может направить женщину на маммографию — рентгенографию молочной железы. Показаниями к этому исследованию являются: уплотнения в молочной железе, изменения со стороны кожи, выделение крови из соска, а также любые другие симптомы, которые могут указывать на злокачественную опухоль. Также для диагностики рака молочной железы назначают ультразвуковое исследование. Маммография и УЗИ являются взаимодополняющими методами, каждый из них имеет свои преимущества:
Маммография
УЗИ молочных желез
Позволяет обнаружить патологические изменения за 1,5–2 года до появления симптомов.
При кровянистых выделениях из соска можно провести дуктографию — рентгенографию с контрастированием молочных протоков. Это помогает получить дополнительную полезную информацию.
Высокая чувствительность — точная диагностика до 90% случаев рака.
Возможность обнаружить микрокальцинаты до 0,5 мм.
Безопасность — нет воздействия на организм рентгеновскими лучами.
Хорошо подходит при высокой плотности ткани молочной железы, у молодых женщин (до 35–45 лет).
Позволяет отличать кисты (полости с жидкостью) от плотных опухолей.
Позволяет оценить состояние регионарных лимфатических узлов.
Хорошо подходит для контроля положения иглы во время биопсии.
Магнитно-резонансная томография — высокоинформативный метод диагностики злокачественных опухолей молочной железы. Ее применяют при лобулярном раке, когда неинформативны маммография и УЗИ, а также для оценки размеров и расположения опухоли, что помогает определиться с тактикой хирургического лечения. МРТ может применяться для скрининга у женщин-носительниц аномальных генов, связанных с повышенным риском рака молочной железы, при отягощенном семейном анамнезе.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:

В лаборатории проводят цитологическое и гистологическое исследование, то есть оценивают строение отдельных клеток и ткани. В настоящее время доступны молекулярно-генетические исследования: они помогают выявить мутации, за счет которых произошло злокачественное перерождение, и подобрать оптимальную противоопухолевую терапию.
Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой , что также влияет на схему лечения.
После того как рак диагностирован, важно определить его стадию и понять, насколько сильно он распространился в организме. Для этого применяют следующие исследования:

Стадии рака молочной железы
Стадирование при раке молочной железы опирается на общепринятую систему TNM. Буква T в этой аббревиатуре обозначает размер первичной опухоли:
Буквой N обозначают наличие метастазов в регионарных лимфатических узлах. N0 — очаги в лимфатических узлах отсутствуют. N1, N2 и N3 — поражение разного количества лимфатических узлов.
Буква M обозначает наличие отдаленных метастазов. Рядом с ней может быть указана одна из двух цифр: M0 — нет отдаленных метастазов, M1 — отдаленные метастазы имеются.
В зависимости от значений T, N и M, выделяют пять основных стадий рака молочной железы (внутри некоторых из них есть подстадии):
- Стадия 0: рак на месте.
- Стадия I: опухоль в молочной железе диаметром до 2 см.
- Стадия II: опухоль в молочной железе диаметром до 5 см и более, могут быть метастазы в подмышечных лимфоузлах на стороне поражения.
- Стадия III: опухоль в молочной железе до 5 см и более, может прорастать в грудную стенку или в кожу, имеются очаги в регионарных лимфатических узлах.
- Стадия IV: опухоль может быть любых размеров, не имеет значения, поражены ли регионарные лимфоузлы. Если обнаруживают отдаленные метастазы, всегда диагностируют рак четвертой стадии.
Лечение рака молочной железы
Стратегия лечения рака молочной железы должна подбираться индивидуально для каждой пациентки с учетом таких факторов, как тип опухоли, стадия, чувствительность новообразования к гормональной терапии. Берется во внимание и общее состояние больной. Если опухоль обнаружена на ранних стадиях и выбрана правильная тактика ведения пациентки, то шанс полностью вылечить рак груди является весьма высоким.
Выберите врача-онколога и запишитесь на приём:

Пластический хирург, онколог-маммолог, доктор медицинских наук
Читайте также:

