Соматические мутации и опухоли
Мутация — любое изменение в молекуле ДНК либо структуре хромосом. Изменения, которые происходят в гаметах — половых клетках, называют герминальными, в любых других клетках организма — соматическими. Герминальные мутации передаются от родителей по наследству в виде генетических заболеваний. Соматические изменения не наследуются, а возникают в результате внешних воздействий (курения, радиоактивного излучения и других).
Доказано, что злокачественные опухоли в 90–95 % случаев возникают в результате соматических мутаций (спорадический рак). Наследственный рак, развивающийся в результате герминальных изменений, составляет 5–10 % от всех случаев заболевания.
Клеточные механизмы возникновения рака: протоонкогены и онкосупрессоры
Соматические мутации увеличивают шанс превращения здоровых клеток в раковые за счет активации онкогенов — генов, стимулирующих образование злокачественных опухолей. Онкогены образуются из обычных генов — протоонкогенов.
Деление клеток опухоли и разрастание опухолевой ткани тормозят антионкогены — гены-супрессоры. Протоонкогены и гены-супрессоры образуют систему стимуляции и подавления злокачественного процесса.
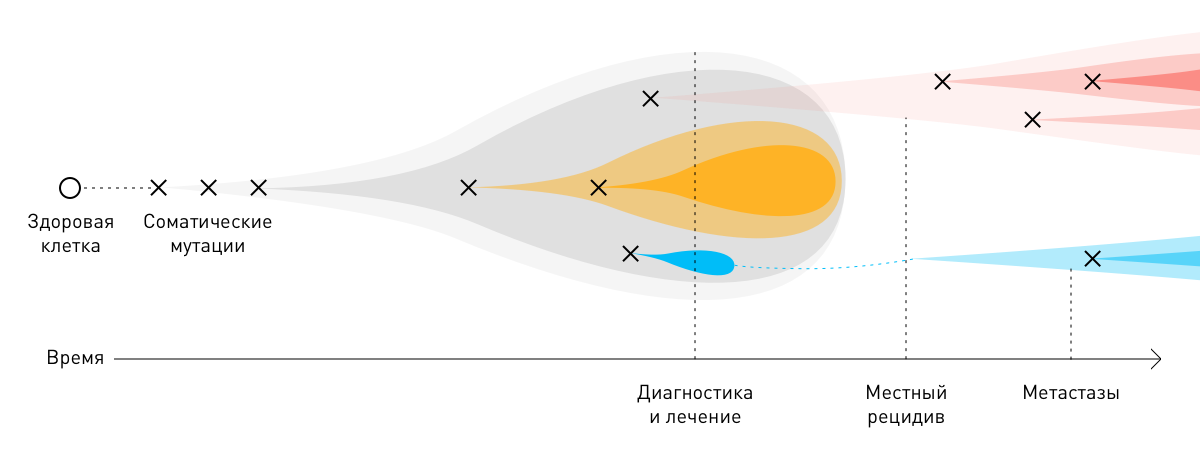
В подавляющем большинстве случаев раковые опухоли возникают из одной клетки в результате двух последовательных мутаций: первичной (герминальной) и вторичной (соматической). Для развития новообразования достаточно 3–6 таких повреждений. Вызванные ими изменения постепенно накапливаются в ДНК, вызывают неконтролируемое размножение пораженных клеток и образование атипичных тканей.
Драйверные соматические мутации и их использование для лечения злокачественных опухолей
В этиологии опухолей изменения в клетках вызывают ошибки копирования ДНК при делении — соматические драйверные мутации. В одних органах и тканях стволовые клетки делятся чаще, чем в других. В них злокачественные новообразования образуются чаще, чем в других структурах организма. По данным международного агентства по исследованию рака IARC, риск заболеть раком, а также выживаемость раковых клеток на 70–80 % зависят от интенсивности деления стволовых клеток и увеличиваются с возрастом.
Генетические маркеры опухолей (изменения в структуре белков в результате соматических драйверных мутаций) можно использовать как мишень и прицельно блокировать с помощью фармакологических препаратов. На этом принципе основан один из наиболее результативных современных методов лечения рака — таргетная терапия. Она позволяет:
- значительно повысить эффективность противоопухолевого лечения;
- снизить его токсичность и тем самым существенно улучшить состояние пациента.
Выявление драйверных соматических мутаций для диагностики злокачественных опухолей
Чем больше генетических маркеров известно, тем более адекватно подбирается лечение. Для выявления соматических мутаций при диагностике злокачественных опухолей используют следующие методики:
- секвенирование генома;
- выявление специфической аллели на амплифицированной ДНК;
- масс-спектрометрия;
- флуоресцентная гибридизация in situ (FISH).
Целесообразность использования того или иного метода в каждом конкретном случае определяет врач.
Соматические мутации опухолей: влияние на диагностику и лечение
В процессе роста злокачественные новообразования приспосабливаются к факторам онкологического лечения — лучевой, химио- и иммунотерапии. Молекулы онкологических клеток, выжившие после того или иного лечебного этапа, нередко мутируют. Соматические мутации опухолей способствуют прогрессированию болезни и её более агрессивному (рецидивирующему и метастатическому) течению. Из-за индивидуальных различий на молекулярном уровне общеклинические стратегии лечения того или иного вида рака могут быть неэффективны для отдельных пациентов.
Чтобы максимально снизить риск рецидивов, улучшить качество жизни больных и увеличить её продолжительность, соматические мутации в опухолях в ответ на фармако- и химиотерапию необходимо учитывать. Для их выявления разработан инновационный метод исследования — молекулярное профилирование. Результаты этого вида диагностики позволяют врачу назначать наиболее оптимальное персонализированное лечение.
Автор статьи - Л.В. Окольнова. 
Сразу на ум приходят Люди Х… или Человек - Паук …
Но это в кино, в биологии тоже так, но немного более научно, менее фантастично и более обыденно.
Мута́ция (в переводе — изменение) — устойчивое, передающееся по наследству изменение ДНК, происходящее под влиянием внешних или внутренних изменений.
Мутагенез - процесс появления мутаций.





Обыденность в том, что эти изменения (мутации) происходят в природе и у человека постоянно, почти каждодневно.
В первую очередь, мутации подразделяются на соматические - возникают в клетках тела, и генеративные - появляются только в гаметах.
Соматические мутации
Генеративные мутации
Передаются по наследству.

Разберем сначала виды генеративных мутаций.
Генные мутации
Что такое ген? Это участок ДНК (т.е. несколько нуклеотидов), соответственно, это и участок РНК, и участок белка, и какой-либо признак организма.
Т.е. генная мутация - это выпадение, замена, вставка, удвоение, изменение последовательности участков ДНК.
Вообще, это не всегда ведет к болезни. Например, при удвоении ДНК случаются такие “ошибки”. Но они возникают редко, это очень малый процент от всего количества, поэтому они незначительны, что практически не влияют на организм.
Бывают и серьезные мутагенезы:
- серповидно-клеточная анемия у человека;
- фенилкетонурия - нарушение обмена веществ, вызывающее довольно серьезные нарушения умственного развития
- гемофилия
- гигантизм у растений
Геномные мутации
Вот классическое определение термина “геном”:
- совокупность наследственного материала, заключенного в клетке организма;
- геном человека и геномы всех остальных клеточных форм жизни, построены из ДНК;
- совокупность генетического материала гаплоидного набора хромосом данного вида в парах нуклеотидов ДНК на гаплоидный геном.
Для понимания сути мы очень сильно упростим, получится такое определение:
Геном - это количество хромосом
Геномные мутации - изменение числа хромосом организма. В основном, их причина - нестандартное расхождение хромосом в процессе деления.
- синдром Дауна - в норме у человека 46 хромосом (23 пары), однако при этой мутации образуются 47 хромосом
рис. синдром Дауна
- полиплойдия у растений (для растений это вообще норма - большинство культурный растений - полиплойдные мутанты)
Хромосомные мутации - деформации самих хромосом.
Примеры (некоторые перестройки такого рода есть у большинства людей и вообще никак не отражаются ни внешне, ни на здоровье, но есть и неприятные мутации):
- синдром кошачьего крика у ребенка
- задержка в развитии
и т.д.
Цитоплазматические мутации - мутации в ДНК митохондрий и хлоропластов.
Есть 2 органеллы со своими собственными ДНК (кольцевыми, в то время как в ядре - двойная спираль) - митохондрия и растительные пластиды.
Соответственно, есть мутации, вызванные изменениями именно в этих структурах.
Есть интересная особенность - этот вид мутации передается только женским полом, т.к. при образовании зиготы остаются только материнские митохондрии, а “мужские” отваливаются с хвостом при оплодотворении.
Примеры:
- у человека - определенная форма сахарного диабета, туннельное зрение;
- у растений - пестролистность.
Соматические мутации.
Это все описанные выше виды, но возникают они в клетках тела ( в соматических клетках).
Мутантных клеток обычно намного меньше, чем нормальных, и они подавляются здоровыми клетками. (Если не подавляются, то организм перерождаться или болеть).
Примеры:
- у дрозофилы глаз красный, но может иметь белые фасеты
- у растения это может быть целый побег, отличающийся от других (И.В. Мичурин таким образом выводил новые сорта яблок).
- раковые клетки у человека
Примеры вопросов ЕГЭ:
Синдром Дауна является результатом мутации
Генные мутации связаны с изменением
А) числа хромосом в клетках;
Б) структуры хромосом;
B) последовательности генов в аутосоме;
Г) нуклеогидов на участке ДНК.
Мутации, связанные с обменом участками негомологичных хромосом, относят к
Животное, в потомстве которого может появиться признак, обусловленный соматической мутацией
Поразительное свойство живых организмов — это высокая степень мутабильности генов.
Мутации возникают в клетках любых тканей многоклеточного организма и на различных стадиях его развития. По типу клеток, в которых мутации произошли, различают: генеративные и соматические мутации [1].
Генеративные мутации возникают в половых клетках, не влияют на признаки данного организма, проявляются только в следующем поколении.
Соматические мутации возникают в соматических клетках, проявляются у данного организма и не передаются потомству при половом размножении. Мутации, возникающие в соматических клетках, наследуются дочерними клетками, которые образуются в процессе митотических делений. Фенотипические последствия таких изменений проявляются только у самой мутантной особи и только в том случае, если возникшие мутации препятствуют осуществлению специфических функций, свойственных данной клетке. Соматические мутации могут содержаться не во всех клетках организма, т.е. нормальные и мутантные клетки сосуществуют у одного индивидуума, что приводит к мозаицизму — наличию в организме клеток, отличающихся по своему генотипу и его фенотипическим проявлениям от других клеток этого же организма. Сохранить соматические мутации можно только путем бесполого размножения (прежде всего вегетативного).
В зависимости от того, выявлен ли мутаген, вызвавший данную мутацию, или нет, различают индуцированные и спонтанные мутации. Обычно спонтанные мутации возникают естественным путем, индуцированные — вызываются искусственно. В зависимости от уровня наследственного материала, на котором произошла мутация, выделяют: генные, хромосомные и геномные мутации.
Соматические мутации по своей природе ничем не отличаются от генеративных. Различие состоит лишь в проявлении и методах их обнаружения. Чем раньше в онтогенезе возникает соматическая мутация, тем больше оказывается участок ткани, несущие данную мутацию, и чем позднее — тем меньше. Соматическая мутация проявляется мозаично. Особи, несущие участки мутантной ткани, называют мозаиками, или химерами. В силу диплоидности набора хромосом в клетках соматической ткани, проявление мутации возможно только в тех случаях, когда мутантная аллель оказывается доминантной или будет рецессивна и будет находиться в гомозиготном состоянии.
Различий в частоте возникновения соматических и генеративных мутаций не обнаружено. Однако есть факты, что ряд генов мутирует с разной скоростью на разных стадиях онтогенеза. Так если у растений дельфиниума ген лавандовой окраски мутирует на поздней стадии развития цветка в лепестках встречаются одиночные клетки с измененной окраской, а при возникновении той же мутации на ранней стадии она может затрагивать большие по размеру участки — половину лепестка или даже целый цветок.
Ярким примером соматической мутации является окраска шерстного покрова у овцы: черное пятно на фоне коричневой окраски. Эта мутация могла проявиться либо как доминантная, либо как рецессивная при потере части или всей гомологичной хромосомы.
Подобные явления часто встречаются у самцов дрозофилы, у которых иногда часть глаза имеет красные фасетки, а часть — белые. Эта мозаичность связана с возникновением рецессивной мутации в локусе white половой хромосомы во время развития имагинальных дисков глаз. Но появляется она не только у самцов, у которых этот ген в Х-хромосоме находится в гомизиготном состоянии, но и у гетерозиготных самок в силу утраты целой хромосомы, несущей доминантную аллель w + , или потери части хромосомы (дефишенси), несущей ту же аллель. В этом случае рецессивная аллель, теперь уже находясь в гомозиготном состоянии, также может проявиться, но эта химерность будет не следствием мутации гена, а следствием изменений в числе или структуре хромосом.
Исследование соматических мутации в настоящее время приобретает важное значение для изучения причин возникновения рака у человека и животных. Предполагают, что ряд злокачественных опухолей возникает по типу соматических мутаций. Соматические мутации имеют прямое отношение также к выяснению причин старения человеческого организма, так как с возрастом может происходить накопление физиологических мутаций в популяции соматических клеток различных органов. Считают, что очень высокая частота заболеваний раком у людей старшего возраста обусловлена в какой-то мере накоплением соматических мутаций.
Наследственные заболеваний человека связаны с мутациями, приводящими к изменению уровней экспрессии генов [3]. Мутации в определенных генах нарушают функционирование биохимических систем, что приводит к развитию соответствующих патологических состояний организма (рисунок 1).
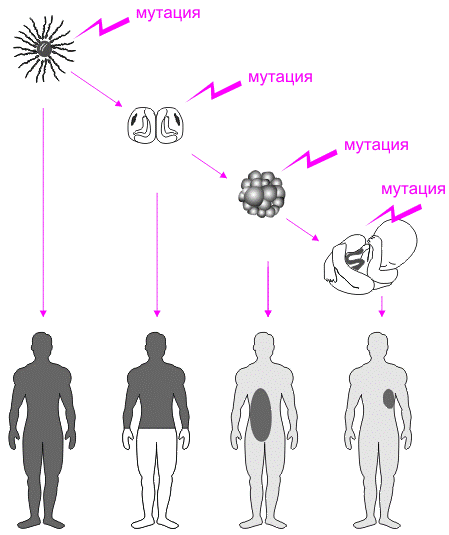
Рисунок 1 — Генетические последствия мутаций, происходящих в геноме соматических клеток человека на разных стадиях эмбриогенеза Черным цветом закрашены места лока-лизации клонов мутантных клеток разных размеров в организме человека [3]. Если мутации происходят в геноме клеток зародышевой линии человека, все соматические клетки организма-потомка, который развивается из мутантной зиготы, образовавшейся от слияния мутантных гамет, будут содержать эту мутацию. Чем позже в онтогенезе возникает соматическая мутация, тем меньше размер клона мутантных клеток во взрослом организме. Если мутация доминантна, то возникает наследственное заболевание. Если мутация рецессивна, можно говорить о предрасположенности организма — гетерозиготы к соответствующему заболеванию и носительстве мутантного гена.
Организм, у которого действие рецессивной мутации маскируется функционированием полноценного аллеля, фенотипически выглядит нормальным, однако имеет больше шансов дать больное потомство в браке с носителем такого же мутантного гена. Кроме того, может произойти соматическая мутация в соответствующем аллельном гене соматических клеток, что станет причиной развития приобретенного генетического заболевания. Примером таких заболеваний может служить ретинобластома [3].
У организмов, размножающихся исключительно половым путем и имеющих раннее обособление зачаткового пути, соматические мутации не играют роли в эволюции и не представляют какой-либо ценности для селекции. Но у тех организмов, у которых есть бесполое размножение, соматические мутации могут иметь огромное значение, особенно в селекции, так как у таких форм из соматической ткани развиваются половые клетки. Так, например у плодовых и ягодных вегетативно размножаемых растений любая соматическая мутация может дать растение и целый клон с новым мутантным признаком.
Одним из видов соматических мутаций у растений являются почковые мутации, возникающие в меристемных клетках точки роста стебля. В этом случае весь побег, развившийся из этой клетки, будет нести мутантный признак. Многие сорта плодовых растений, винограда, картофеля являются соматическими мутантами. Эти сорта сохраняют свои свойства, если их воспроизводят вегетативным путем, к примеру, прививая обработанные мутагенами почки (черенки) в крону немутантных растений; таким путем размножают, к примеру, бессемянные апельсины. Почковые мутации были известны давно и назывались спортами; от такого спорта И. В. Мичурин получил сорт яблони, названный им Антоновка 600-граммовая
Соматические мутации используют для изучения частоты возникновения видимых мутаций. По мозаичности проявления мутантного признака в тканях можно обнаруживать соматические мутации вплоть до одиночных мутантных клеток. Растения чая в природных условиях характеризуются высокой пластичностью. При этом отмечаются как отдельные модификации, проявляющиеся на кусте, так и целиком измененные формы [4]. Спектр соматических мутаций представлен морфологическими (отклонения по длине, ширине, форме, морфологии листа, длине междоузлий), физиологическими (изменения окраски листа, вегетационного периода, генеративной активностью и урожайности) и пластидными (секториальные и периклинальные химеры) модификациями. Интересны формы с измененной фотосинтетической активностью, улучшенными биохимическими и органолептическими показателями [5]. При анализе растений сухумского района был установлен сорт с наибольшей частотой как соматических, так и структурных мутаций [6]. При этом кариологический анализ сорта и мутантных форм имели стандартный диплоидный набор хромосом (2n=30). В итоге в Сухумском районе были отобраны целиком измененные формы и выделены 23 мутантные формы чая с комплексом ценных признаков (урожайность и биохимические показатели).
Высокой пластичностью характеризуется также карельская береза, которая представлена группой переходных морфологических форм и не имеет четкого дендрологического описания. В естественных условиях B. pendula var. carelica представлена различными вариантами, включая деревья высотой до 25 м или сильно ветвящиеся кустарники с приподнимающимися стволиками до 3 м высотой. Биологические особенности карельской березы связаны с наличием аномальных процессов при делении и дифференцировки камбиальных клеток [7].
При выращивании в условиях Беларуси плантационные культуры березы карельской, представляют собой совокупность морфологических форм: высокоствольные (1а — крупноузорчатая и 1б — шаровидноутолщенная), короткоствольные (11а — пятнистоузорчатая и 11б — лироствольная), кустовидная, кустарниковая и безузорчатая. Соотношение узорчатых и безузорчатых растений в насаждениях березы карельской примерно одинаковое 50:50. Такое широкое формовое разнообразие по росту в высоту, диаметру, а, соответственно, и узорчатости древесины указывает на высокую пластичность данной березы, ее способность произрастать в различных условиях [7].
ВЕДЬМИНЫ МЕТЛЫ, СУВЕЛИ И КАПЫ У ДРЕВЕСНЫХ РАСТЕНИЙ
Ведьмины мётлы — фрагменты кроны растения с аномальным морфогенезом (рисунок 2). Проявляется как образование многочисленных тонких побегов, чаще бесплодных, прорастающих из спящих почек. Обильное ветвление приводит к образованию множества укороченных ветвей с недоразвитыми листьями, которые часто формируют плотные скопления в виде шара или бесформенные. Дерево с ведьминой метлой представляет собой химеру [9]. При этом, отношения между компонентами химеры всегда конкурентные. Метлы, образующиеся в кронах взрослых, вполне сформировавшихся, деревьев обычно недолговечны, а возникшие в верхней части кроны сравнительно молодых растений часто подавляют произведшую их крону и полностью замещают ее собой [10].
Рисунок 2 – Ведьмины метлы на сосне обыкновенной (А), лиственнице европейской (Б), берёзе (В) и ели обыкновенной (Г) [9]
Классической точкой зрения на происхождение ведьминой метлы является заражение растений ржавчинными грибами, микоплазмами, грибами рода Тафрина (на вишне, сливе, березе) или вирусами (на картофеле). По другой версии появление ведьминой метлы связано с инфицированием растений группой бактерий — фитоплазмой. Переносчиком которых являются насекомые. Однако кроме патологических встречаются ведьмины метлы с нормальной жизнеспособностью, высокой долговечностью и полным отсутствием каких-либо патогенов или следов их жизнедеятельности (рисунок 3). Причинами их возникновения являются соматические мутации. Такие нарушения играют решающую роль в видообразовании и выведении сортов.

Рисунок 3 – 5-летние ветви Abies sibirica: НК-П – контроль к паразитарной ведьминой метле; ВМ-П – ведьмина метла паразитарная, ВМ-М – ведьмина метла мутационная; НК-М – контроль к мутационной ведьминой метле [11]. Клоны ведьминых мётел хвойных растений используются в селекции для создания декоративных сортов так как отличаются ценными свойствами: высокой жизнеспособностью, замедленным ростом, скороплодностью, обильным плодоношением [12]. При этом в семенном потомстве ведьминых мётел, наблюдается расщепление сеянцев на растения с обычным габитусом и обильно ветвящимися карликами [13]. Установлено, что у растений сосны обыкновенной с ведьминой метлой число геномных и хромосомных мутаций выше, чем у нормальных деревьев. Они содержат триплоидные и тетраплоидные клетки, отличаются большей активностью ядрышкообразующих зон, а также нарушением структуры и функций ядрышек в интерфазных ядрах. В митозе отмечены отстающие и хаотически расходящиеся хромосомы, мосты, с-митоз, а в метафазе митоза обнаружены аномальные формы ядрышек [14].
Специфичная, оригинальная форма растений придает им декоративный вид, что используется в селекции, а получаемые сорта используются в ландшафтном дизайне и при озеленении населенных пунктов (рисунок 4 и 5).
Широко распространены в природе капы – тоже шаровидные или почти шаровидные наросты на стволах (чаще в комлевой части) и ветвях деревьев, поверхность капов покрыта многочисленными спящими почками. Скопление придаточных спящих почек и является причиной образования наплывов древесины. Анатомическое строение древесины капов, как и сувелей, сохраняет черты видоспецифичности. Способность образовывать капы, по мнению большинства исследователей [18], является адаптацией к условиям, затрудняющим семенное возобновление. Спящие почки, дающие в определенных условиях побеги, обеспечивают вегетативное возобновление.
Сувели, капы, ведьми метлы являются аномальностью строения, что проявляется во внешней морфологии, в то время как анатомические особенности проводящих элементов в основном сохраняют видовую специфику, меняются преимущественно их количественные и топологические особенности. Например, во вторичной ксилеме сувелей, капов и множества других наростов, образующихся на стеблях древесных растений под влиянием различных агентов и факторов среды, структурные изменения касаются в основном пространственной организации как паренхимных, так и прозенхимных клеток [9].
Подобные аномалии описаны у растений в зоне отчуждения вследствие аварии на Чернобыльской атомной станции в первые годы [20] и наблюдаются в настоящее время (рисунок 6).
Рисунок 6 – Изменение морфологических форм растений, произрастающих на лугу ур. Учитель (внп. Масаны): А – изменение хлорофильной пигментации хвои сеянцев сосны, Б-Г – морфозы сосны, Д – искривление стебля Oenothera biennis L.
(фотографии из личного архива Н.В. Шамаль)
Литература
Об этом мы поговорили с онкогинекологом, хирургом Владимиром Носовым, руководителем Клиники гинекологии и онкогинекологии Eвропейского медицинского центра – первой клиники в России, где персонализированная терапия онкогинекологических заболеваний стала стандартной практикой.
В своём нормальном состоянии эти гены участвуют в восстановлении ДНК после различных повреждений, тем самым защищая клетки от опухолевого перерождения. Если возникает мутация в этих генах, здоровые клетки оказываются не защищенными и сами могут становиться злокачественными. Вероятность заболеть раком груди при носительстве мутации гена BRCA 1/2 колоссальная — до 80%(в общей популяции у женщин без мутации — около 10-12%), риск заболеть раком яичников — до 40-45 %( в популяции —около 1,5%) .
В большинстве случаев назначение этих препаратов после первой линии химиотерапии обеспечивает ремиссию около 3 лет – это огромное достижение, еще никогда в онкогинекологии ремиссия при 3-4 стадии заболевания не продлевалась каким-либо лекарством на столь длительный срок.
Дальнейшие исследования позволили выяснить, что мутации могут быть не только герминогенными, то есть присутствующими во всех клетках организма. Дополнительные 15-20% мутаций генов BRCA происходят только в клетках опухоли, но в крови и других клетках организма их нет. Эти мутации называют соматическими. Они не передаются по наследству, не увеличивают риск развития других онкологических заболеваний, но пациенты, у которых обнаружены мутации в клетках опухоли, также являются кандидатами для лечения ингибиторами PARP.
В Институте онкологии EMC мы предлагаем всем пациентам с раком яичников провести полное секвенирование генов BRCA опухоли и крови. Это позволяет подобрать наиболее эффективную персонализированную терапию. Если речь идет о наследственной мутации – мы рекомендуем в обязательном порядке генетическое обследование детям, сестрам, братьям, родителям, а самим пациенткам-носителям мутации – также пройти дополнительный скрининг на рак молочных желез, риски которого колоссально повышены.
Плохое наследство
Наследственная мутация передается детям с вероятностью 50%, причем как по женской, так и по мужской линии. Носителям мы рекомендуем специальную программу наблюдения и профилактические мероприятия для снижения риска онкологических заболеваний, а также обсуждаем с ними вопросы сохранения репродуктивной функции.
Например, на днях я оперировал пациентку 57 лет с раком яичника. На плановой гистологии был подтвержден злокачественный характер опухоли. Мы провели генетическое исследование опухоли, выявили мутацию BRCA1. Затем было выполнено полное генетическое исследование по крови, чтобы понять, является ли мутация соматической (присутствующей только в опухоли) или герминогенной (наследственной). Выяснилось, что мутация наследственная. Мы рекомендовали пройти обследование двум дочерям пациентки, которые, к сожалению, унаследовали эту мутацию. Женщины-близнецы, им сейчас 31 год, обе еще не планировали беременность и роды. Я рекомендовал им обратиться к репродуктологу, провести стимуляцию и заморозить яйцеклетки, а в 35 лет, именно с этого возраста риски рака яичников начинают расти, удалить профилактически яичники и маточные трубы. В этом случае мы сохраняем матку, и в будущем они смогут выносить своих биологических детей.
Более того, во время ЭКО можно провести предимплантационную диагностику и подсадить эмбрионы, не унаследовавшие мутацию. Таким образом, будущее поколение уже будет защищено.
Рак эндометрия (рак тела матки) – самое распространенное онкогинекологическое заболевание у женщин. Сегодня подходы к его лечению также меняются благодаря персонализированной терапии.
До недавних пор считалось, что существует два типа рака эндометрия. Наиболее частый, первого типа, обычно возникает у полных пациентов, часто с сопутствующими диабетом и гипертонией. Второй – серозный, более агрессивный, не связанный с избытком эстрогенов. На основании клинической картины врачи принимали решение о необходимости дополнительного лечения после операции. Сегодня, благодаря лучшему пониманию биологии опухоли, мы знаем, что этих типов не два, а четыре. И для каждого из них предусмотрено определенное лечение. Чтобы определить, с каким типом рака эндометрия мы имеем дело, достаточно для начала провести иммуногистохимическое исследование.
Каждую опухоль эндометрия вне зависимости от стадии, мы тестируем на наличие определенных молекул, указывающих на благоприятный или менее благоприятный прогноз заболевания. Например, наличие мутации гена P53 говорит о менее благоприятном прогнозе. В этом случае мы рекомендуем не только наблюдение, но и дополнительное лечение с помощью химио-или лучевой терапии.
Некоторые раки матки, так же, как и некоторые раки яичников и молочной железы, имеют в своей основе генетический синдром – синдром Линча. Если мы находим проявления синдрома Линча в опухоли, мы направляем пациентов на полноценное генетическое тестирование. Это важно, потому что рак матки – не единственное заболевание, к которому предрасположены носители мутаций, вызывающих синдром Линча. В частности, у них повышен риск рака толстой кишки в молодом возрасте.
Часто первым возникает рак матки, через какое-то время развивается рак толстой кишки.
Поэтому носителям синдрома Линча рекомендуют начинать скрининг на рак кишки не в 45-50, а гораздо раньше — с 30 лет и делать колоноскопию раз в 6 или 12 месяцев, чтобы не пропустить развитие заболевания.
Выявление синдром Линча у пациентки с раком матки может повлиять и на лечение.
При поздних стадиях пациентам с синдромом Линча мы назначаем специфическую иммунотерапию препаратом пемпролизумаб, что позволяет улучшить прогнозы пациентов.
Генетическое профилирование опухоли – это колоссальный прорыв, который позволил нам подойти к полностью персонализированной терапии в онкологии, основанной не только на диагнозе, но и на понимании биологии опухоли. Для пациентов — это возможность получить точное узкоспециализированное лечение, дающее лучшие результаты, а в случае наследственных раков — возможность защитить будущие поколения от опасных заболеваний.
Мутации различного ранга (генные, хромосомные или геномные), возникающие в соматических клетках организма, наследуются потомками этих клеток и делают организм мозаиком, т.е. особью со смешанными популяциями клеток. В разд. 3.6.5.1 и 3.6.5.2 рассмотрены примеры естественного мозаицизма женского организма по активно функционирующим в его клетках Х-хромосомам и связанное с этим явление аллельного исключения, когда в разных клетках организма экспрессируются разные аллели Х-сцепленных генов.
К примеру, у женщины — гетерозиготной носительницы рецессивного аллеля гемофилии — степень нарушения свертывающей системы крови зависит от соотношения соответствующих клеток с генетически инактивированными Х-хромосомами, несущими нормальный или му-тантный аллель.
Нередко у человека встречается мозаицизм по геномным мутациям, связанный с нарушением расхождения хромосом при митозе. Например, в случае синдрома Дауна (трисомия по 21-й хромосоме) мозаицизм встречается с частотой 2 на 48 пациентов, а в популяции их частота равна 1 на 31 000. Чем раньше в ходе развития организма происходит нарушение деления соматических клеток, сопровождающееся нерасхождением дочерних хромосом к полюсам ахроматинового веретена, тем более выраженной будет симптоматика заболевания, вызываемого данной анэуплоидией. Нарушение митоза на более поздних стадиях индивидуального развития приводит к локальному мозаицизму, который может не сопровождаться выраженными отклонениями от нормы. В этом случае наиболее опасным является мозаицизм клеток генеративных тканей, из которых с достаточно большой вероятностью организм может образовывать гаметы с аномальным числом хромосом.
Иногда возникающие соматические мутации являются причиной появления злокачественных новообразований. На рис. 4.2 представлена последовательность событий, приводящих к образованию таких опухолей. Как правило, в основе лежит повреждение ДНК, вызываемое внутренними факторами (нарушением процессов репликации, репарации или рекомбинации) или внешними воздействиями (ионизирующей радиацией, химическими мутагенами или вирусами). Одним из результатов такого повреждения ДНК может оказаться появление клона клеток, обладающего дефектами регуляции клеточного размножения, что приводит к опухолевому росту.
Причиной злокачественного разрастания ткани могут быть также нарушение митоза и неравноценное распределение хромосом между дочерними клетками с возникновением анэуплоидий или хромосомных аберраций. Это вызывает либо гибель клеток, либо приводит к появлению клонов, способных к неконтролируемому росту. В злокачественных образованиях обычно встречаются субклоны, имеющие разные кариотипы, что свидетельствует о множественных аномалиях митоза в клетках опухолей.

Рис. 4.2. Соматические мутации как причина злокачественного перерождения тканей
Так как в основе злокачественного перерождения тканей может лежать изменение наследственного материала клеток, становится очевидной важная роль мутагенных факторов в процессе возникновения опухолей. Одним из таких мутагенных факторов являются вирусы, которые могут индуцировать в хромосомах то или иное мутационное изменение. Среди опухолей человека вирусное происхождение имеет лимфома Беркитта.
Пониманию молекулярно-биологических механизмов опухолевого роста способствовало открытие так называемых онкогенов, вызывающих злокачественное перерождение клеток и входящих в состав генома ретровирусов. Геном ретровируса состоит из одноцепочечной РНК и содержит ген обратной транскриптазы. При проникновении вируса в клетку-хозяина под контролем фермента обратной транскриптазы образуются множественные копии генетической информации вируса, но уже в виде двухцепочечной ДНК, которые встраиваются в ДНК клетки-хозяина. Функционирование таких ДНК-копий в составе генома клетки приводит к синтезу вирусных РНК и белков, причем вирусный онкоген (v-onc) трансформирует клетку-хозяина в опухолевую.
Предполагают, что вирусные онкогены на каком-то этапе эволюции произошли от клеточных онкогенов, интегрированных в геном вируса. Причины, обусловливающие большую трансформирующую активность вирусных онкогенов в сравнении с клеточными, до настоящего времени не вполне ясны.
В опухолевых клетках часто наблюдаются хромосомные аномалии, причем некоторые опухоли отличаются наличием специфических хромосомных дефектов.
Установлено, что онкогены нередко обнаруживаются в непосредственной близости от точек разрывов, происходящих при опухолеспецифичных хромосомных перестройках. Это подтверждает их роль в злокачественной трансформации клеток.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:

