Солитарная опухоль что это такое
Солитарными раками чаще всего поражались желудок (18,4%) и толстая кишка (13,6%); Далее по частоте поражаемости следуют матка (8,9%). пищевод (6,8%), легкие (6,7%), молочная железа (6,6%); более редки поражения других органов. Частота поражаемости отдельных органов при первично множественных раках также не одинакова, и здесь заметно преобладают опухолевые поражения желудка и толстой кишки. Вместе с тем, при сравнении с данными о солитарных раках обращает на себя внимание намечающееся различие.
По отношению к некоторым органам частота поражаемости их множественными раками заметно выше, чем солитарными. Например, для толстой кишки частота локализации поражения при множественных раках составляла 18,7%, а при солитарных—13,6%; для мочевого пузыря — соответственно 4,1% и 2,8%, для почек— 3,8% и 1,7%, для кожи — 5,1% и 1,9% и для предстательной железы— 10,3% и 4,5%- В других органах первично множественные раки на патологоанатомическом материале были отмечены реже, чем солитарные раки.
Поражение желудка при первично множественных раках зарегистрировано в 11,7% случаев, а при солитарных — в 18,4%; для матки — соответственно 5,5%) и 8,9%, Для легких — 4,4% и 6,7%. На патологоанатомическом материале в целом самой частой локализацией опухолевого поражения при множественных раках является толстая кишка, желудок и предстательная железа, значительно реже молочная железа, пищевод, матка, почки, легкие, мочевой пузырь и др.
Патологоанатомические данные далеко не всегда отражают многообразные особенности первично множественных злокачественных опухолей, наблюдаемых в клинике. Поэтому мы приводим данные о частоте поражаемости отдельных органов при солитарных и первично множественных раках по клиническим материалам Desaive (1997).
В этой клинической статистике отмечена примерно одинаковая частота поражаемости солитарными и первично множественными раками ряда органов. Что касается наиболее часто поражаемых органов, то, по клиническим данным, на первом месте стоят кожа, молочные железы и женские половые органы.
Нетрудно видеть, что это соотношение меняется параллельно с показателями частоты поражаемости данного органа — наиболее высокие цифры отмечаются при тех локализациях, где частота поражаемости первично множественными раками значительно выше, чем при солитарных. Данный показатель выражает степень вероятности первично множественного рака в случаях обнаружения хотя бы одного узла в данном органе.
Степень подобной вероятности неодинакова для опухолевых поражений различных органов, при этом в патологоанатомической статистике выражается значительно более высокими цифрами, чем на клинических материалах; кроме того, указанные статистики представляют разноречивые результаты в отношении отдельных органов.
Таким образом, нами сделана попытка разрешения трех вопросов в отношении органной локализации первично множественных раков: частоты поражаемости отдельных органов, соотношения ее с частотой солидарных раков тех же органов и, как вытекающую из этого, степень вероятности выявления первично множественных форм при солитарпых раках того или иного органа. Как видно, определенных однозначных ответов на все эти вопросы указанный анализ не дает.
Это можно объяснить прежде всего тем, что нельзя сопоставлять оторванные друг от друга патологоанатомические и клинические материалы; кроме того, приводимые в таблицах данные 0 солидарных и первично множественных раках не равноценны в статистическим отношении; если первые представлены сотнями наблюдении, то вторые составлены лишь десятками поражении среди еще меньшего числа наблюдаемых случаев. Тем не менее, следует признать, что подобный подход к изучению органного распределения первично множественных злокачественных опухолей заслуживает должного внимания и при устранении указанных недостатков, является одним из важных путей дальнейшего изучения этого вопроса.
Статьи
Особенности кистозно-солидных образований
- Солидное образование (рак) – это самое опасное состояние, при котором шансы излечиться от недуга минимальны; оно имеет твердую оболочку и заполнено тканью.
- В отличие от него, кистозное новообразование легко поддается лечению, оно мягкое, может расти и уменьшаться.
- Кистозно-солидное образование является промежуточным звеном между ними. Оно может появиться в любом органе, меняться в размерах или оставаться неизменным, а также содержать в себе как ткань, так и жидкую субстанцию.
Классификация солидных образований
Любое солидное образование (онкология) относится к одной из следующих категорий: доброкачественное или злокачественное.
Медленно растет, может самостоятельно уменьшаться без дополнительного вмешательства. Отсутствуют метастазы.
Основная проблема, которую несет данное солидное образование (рак) – это сдавливание собой соседних органов или тканей.
Состоит из неустанно делящихся клеток, изменивших свой вид и структуру, может дорасти до немалых размеров.
Явление проявляет себя крайне агрессивным образом, распространяет метастазы даже на самых ранних стадиях недуга.
Основные причины возникновения солидных образований при раке
Солидное образование – это рак, который может появиться практически в любой системе организма. Однако существует ряд причин, которые, по заявлениям специалистов, являются своеобразными провокаторами и стимулируют появление и распространение метастазов.
Солидное образование (рак) может возникнуть вследствие следующих явлений:
- неблагоприятная экологическая обстановка, в особенности, в густонаселенных мегаполисах и городах с крупными заводами и фабриками;
- обилие стрессов и чрезмерная психологическая нагрузка;
- алкоголизм и табакокурение;
- плохая наследственность;
- слабая иммунная система;
- частые переломы и иные травмы.
Порядок диагностики солидных образований
Диагностируется любое солидное образование (рак) посредством нескольких методов. Они могут быть задействованы как в комплексе, так и по отдельности.
- УЗИ внутренних органов – дает возможность определить точную локализацию, размеру, структуру и форму образования. Сообщает о разновидности опухоли, что позволяет подбирать схему лечения.
- Биопсия – осуществляется с помощью тонкой иглы, вводимой в область образования и использующей его частички. Определяет степень злокачественности и уровень агрессии опухоли.
- Общий анализ и биохимия крови – рассказывают о наличии воспалительных процессов, сбоев в работе гормонов и патологий в организме.
- Компьютерная томография – самый востребованный вид диагностики. Солидное образование – это рак, лечение которого подбирается индивидуально, в зависимости от ряда показателей. КТ дает возможность выявить точное расположение опухоли и сообщить предельно точные данные о ней.
Лечение солидного онкологического заболевания
Солидное образование – это рак, крайне серьезный недуг, требующий основательного подхода и высочайшего уровня квалификации. Только действительно опытные специалисты в состоянии осуществить точную диагностику и подобрать наиболее подходящее лечение, которое зависит от локализации, размеров и иных особенностей конкретной опухоли.

Опухоли — это патологические образования, которые образуются из-за нарушения роста и дифференцировки клеток. Они могут развиваться практически из любой ткани: эпителиальной, нервной, соединительной, кроветворной и др. В зависимости от того, из какой ткани развилось новообразование выделяют солидные опухоли и гемобластозы.
- Как диагностируют солидный рак
- В каких органах чаще всего развивается солидный рак
- Способы лечения солидного рака
- Химиотерапия при раке
- Иммунотерапия
- Чем опасен солидный рак
- Прогнозы на выздоровление при солидном раке
К группе гемобластозов относят лейкозы, лимфомы и миеломы. Их особенностью является повсеместное распространение по организму, без образования локализованных очагов.
Солидные опухоли могут быть доброкачественными и злокачественными.
- Доброкачественные опухоли состоят из высокодифференцированных зрелых клеток, растут относительно медленно, не прорастают в окружающие ткани, не дают метастазов и чаще всего не представляют смертельной опасности, за исключением опухолей головного и спинного мозга. Иногда они могут самопроизвольно исчезать. Некоторые доброкачественные опухоли могут озлокачествляться (малигнизироваться) и превращаться в рак.
- Злокачественные солидные опухоли (саркомы, карциномы, глиомы) состоят из низко или умеренно дифференцированных клеток. Они быстро увеличиваются в размерах, прорастают окружающие ткани, разрушая их, а также могут давать метастазы (очаги отсеивания, расположенные вдали от первичного новообразования) и оказывают системное воздействие на организм. Они опасны для здоровья и несут смертельную угрозу.
Как диагностируют солидный рак
Методы диагностики солидного рака можно разделить на несколько групп:
Методы, позволяющие обнаружить наличие образования. В некоторых случаях, если рак располагается поверхностно, его можно увидеть во время осмотра или пропальпировать. В остальных случаях на помощь приходят методы медицинской визуализации — УЗИ, КТ, МРТ, рентгенологическое исследование, ПЭТ, эндоскопическое исследование и другие. В некоторых случаях обнаружить рак помогают лабораторные анализы, в частности определение онкомаркеров — особых молекул, количество которых повышается при возникновении той или иной формы новообразования.

Методы, позволяющие верифицировать диагноз. Окончательный диагноз можно поставить только после морфологического исследования опухолевой ткани. Для этого фрагмент новообразования изучают под микроскопом после специального окрашивания. В ряде случаев для уточнения диагноза и определения молекулярно-генетического профиля образования проводят дополнительное тестирование, например, иммуногистохимическое исследование, молекулярно-генетическое тестирование. Это позволит подобрать оптимальную схему лечения, учитывая прогностические особенности рака.
После постановки диагноза необходимо определить стадию заболевания. Здесь на помощь приходят методы лучевой диагностики (то же УЗИ, КТ, МРТ), которые позволяют верифицировать размеры рака, его взаимоотношения с рядом расположенными тканями, вовлечение в процесс лимфатических узлов и наличие метастазов.
В каких органах чаще всего развивается солидный рак
Солидный рак может развиться в любом органе, в котором есть эпителиальные ткани. Чаще всего диагностируются опухоли молочной железы, легких, предстательной железы, желудочно-кишечного тракта.
Способы лечения солидного рака
В рамках лечения солидного рака применяются те же подходы, которые используются во всей онкологии. Ключевыми методами является хирургия, лучевая терапия и химиотерапия.
Хирургические операции в онкологии делятся на две большие группы — радикальные и паллиативные.
Радикальные вмешательства предполагают полное удаление опухоли в пределах здоровых тканей и зоны возможного метастазирования. Здесь выделяют:
- Типовые операции — удаление ткани пораженного органа в оптимальном объеме для достижения радикальности. Также выполняется необходимая лимфодиссекция.
- Комбинированные радикальные вмешательства — удаляется первично пораженный орган, и проводится частичная резекция соседних органов и тканей, на которые распространился рак.
- Расширенные операции — помимо затронутых органов и стандартных групп лимфатических узлов, на которые распространяется рак, удаляют дополнительные группы лимфатических узлов.
Раньше проведение обширных радикальных операций зачастую приводило к инвалидизации больного. Сейчас же идет тенденция не только к его излечению, но и сохранению приемлемого качества жизни. Поэтому совершенствуются хирургические технологии органосохраняющих методик и реконструктивных операций после удаления рака.
- Паллиативные вмешательства. Они проводятся при наличии отдаленных метастатических очагов. На первом этапе предполагается удаление первичного опухолевого очага в радикальном объеме. Вторым этапом проводятся попытки лечения метастазов, если это возможно. В целом такие операции не подразумевают полного излечения и проводятся для улучшения состояния больного и облегчения тягостных симптомов.
- Симптоматические паллиативные операции. Они выполняются по жизненным показаниям, при развитии осложнений рака. Ликвидации опухоли они не предусматривают и направлены восстановление жизненно важных функций, например, дыхания, отведение кишечного содержимого, возобновление пассажа желчи, остановку кровотечения и др.
Лучевая терапия предполагает использование ионизирующего излучения в дозировках, приводящих к гибели раковых клеток. Все методы можно разделить на три большие группы — дистанционная лучевая терапия, контактная лучевая терапия и системная лучевая терапия.
При дистанционной лучевой, терапии источник ионизирующего излучения находится за пределами тела пациента на определенном расстоянии. При таком лечении используется сложное высокотехнологичное оборудование, которое генерирует определенный вид ионизирующего излучения (ИИ). При помощи специальных технологий производят распределение его дозы таким образом, чтобы максимально полно облучить рак и минимально затронуть не вовлеченные в процесс ткани.
При контактной лучевой терапии ИИ располагается либо непосредственно возле раковой опухоли, либо в ее толще. Здесь выделяют:
- Аппликационную ЛТ. Таким методом лечатся поверхностно расположенные опухоли, например, рак кожи, рак вульвы или рак влагалища.
- Внутриполостная ЛТ — ИИ вводят в полость полого органа (матка, желудок, мочевой пузырь и др) с помощью специального аппликатора, заполненного радиоактивным материалом. Таким методом лечится рак полых органов.
- Внутритканевая ЛТ — ИИ вводят непосредственно в раковую опухоль с помощью игл или трубочек, заполненных радиоактивным материалом. Таким методом может лечиться рак простаты, рак тела матки, рак шейки матки, рак желудка и др.
Как правило, контактную лучевую терапию сочетают с дистанционной ЛТ, что позволяет максимально сфокусировать воздействие ионизирующего излучения на раковой опухоли, при этом минимально затронув окружающие ткани.
Эффективность этого метода лечения основана на том, что опухоли захватывают определенные молекулы и используют их для своего дальнейшего роста. Если на эти молекулы присоединить радиоактивные изотопы, они избирательно накопятся в опухолевой ткани и разрушат ее. Как правило, таким образом проводят лечение отдаленных метастазов.
Химиотерапия при раке
Для лечения рака разработано большое количество химиотерапевтических препаратов. По оказываемому эффекту их разделяют на цитостатические и цитотоксические препараты. Цитостатики нарушают процессы размножения раковых клеток, что в конечном итоге приводит к их гибели. Цитотоксические препараты направлены на непосредственное уничтожение клеток. Химиотерапия при раке предполагает несколько курсов лечения, которые чередуются с перерывами. Это связано с двумя моментами:
- Раковые клетки имеют жизненный цикл, который состоит из активной фазы и фазы покоя. Химиотерапия действует только на активные клетки.
- Химиотерапия оказывает токсическое действие на организм, поэтому нужно время для его восстановления.
Химиотерапии солидного рака проводится в рамках комбинированного лечения совместно с хирургией или лучевой терапией. Ее преимуществом является системное воздействие на организм, что помогает уничтожить как злокачественные клетки, которые остались в первичном очаге после удаления опухоли, так и метастазы.
Иммунотерапия
Иммунотерапия является одним из новых методов лечения солидного рака. Суть метода заключается в коррекции противоопухолевого иммунного ответа, что позволит организму уничтожить рак с помощью собственных ресурсов. Вторым направлением иммунотерапии является работа с самой опухолью, которая вырабатывает определенные вещества, делающие ее незаметной для иммунной системы. Если рак демаскировать, иммунитет его уничтожит.
Чем опасен солидный рак
Солидный рак зачастую характеризуется агрессивным течением и, за редким исключением, метастазированием. При отсутствии лечения, первичная опухоль будет разрастаться, захватывая новые ткани и нарушая работу вовлеченных органов. Это чревато самыми разнообразными осложнениями, начиная от кровотечений и заканчивая кишечной непроходимостью, нарушением дыхания, болевым синдромом, неврологическими проявлениями.
По мере нарастания опухолевой массы, рак оказывает системное воздействие на организм — развивается истощение и слабость. В конце концов при отсутствии специальной помощи человек погибает.
Прогнозы на выздоровление при солидном раке
Прогноз на выздоровления при солидных опухолях определяется видом рака, степенью его дифференцировки и стадией на момент установки диагноза. Чем раньше начато лечение, тем более благоприятный прогноз.
Солитарная фиброзная опухоль первоначально была описана как новообразование плевры, позже она была обнаружена в других областях организма. В настоящее время она все чаще выявляется в глазнице (1-24).
В собственной серии наблюдений авторов среди 1264 новообразований глазницы была диагностирована только одна солитарная фиброзная опухоль. Но на основании многочисленных недавно опубликованных сообщений мы предполагаем, что некоторые случаи в нашей серии наблюдений были отнесены к другим веретеноклеточным опухолям еще до того, как солитарная фиброзная опухоль стала широко известной.
Furusato et al. провели недоступные ранее иммуногистохимические исследования 41 опухоли, ранее диагностированных как фиброзная гистиоцитома, гемангиоперицитома и гигантоклеточная ангиофиброма; оказалось, что все эти опухоли соответствуют диагностическим критериям солитарной фиброзной опухоли (7).
а) Клиническая картина. Солитарная фиброзная опухоль глазницы развивается монолатерально как у детей, так и у взрослых (4-24). У пациента обычно развивается экзофтальм и смещение глазного яблока. В большинстве случаев опухоль развивается медленно и не сопровождается выраженными болями или ухудшением зрения.
Развиваясь в верхневисочной части глазницы, эта опухоль может симулировать эпителиальную опухоль слезной железы. Опухоль может одновременно поражать полость носа и глазницу. Изредка солитарная фиброзная опухоль может вести себя агрессивно и прорастать из глазницы в центральную нервную систему. Злокачественная трансформация и метастазирование наблюдается редко.
В одной работе проанализировано 153 случая солитарной фиброзной опухоли шеи и головы — личные наблюдения и случаи, описанные в английской литературе (5). Средний возраст на момент манифестации опухоли составлял 50 лет, соотношение женщин: мужчин составляло 5:4. Средний размер опухоли составил 2,6 см.
Во всех случаях наблюдалась экспрессия цитоплазматического CD34. После хирургического удаления рецидивы наблюдались лишь в 4 (из 9) случаях с наличием опухолевых клеток в краях удаленной опухоли и только одна (из 10) опухоль классифицирована как злокачественная (5).
Клинически солитарная фиброзная опухоль проявляется аналогично другим четко отграниченным опухолям глазницы. Показан пример клиникопатологической корреляции.
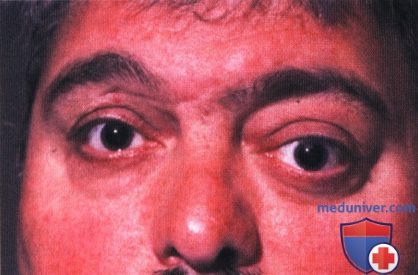
Внешний вид мужчины средних лет с левосторонним экзофтальмом. 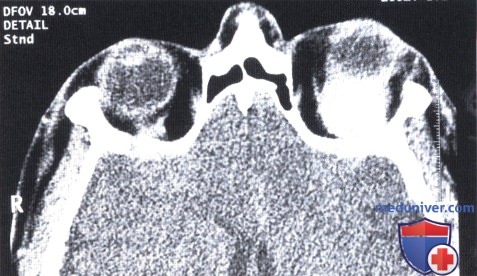
КТ, аксиальная проекция: сверху от глазного яблока определяется округлее объемное образование. 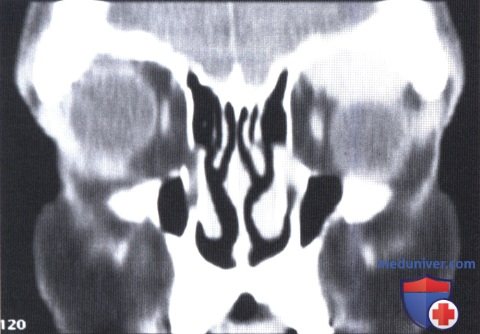
КТ, корональная проекция: в верхней части глазницы визуализируется овоидное четко отграниченное объемное образование. 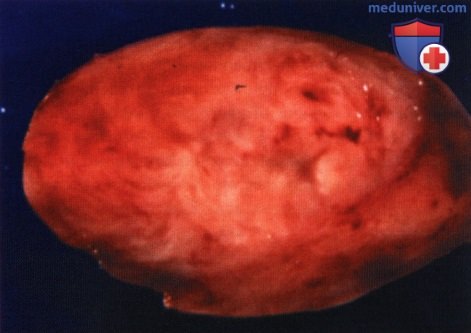
Фотография новообразования, полностью удаленного доступом через верхнелатеральную орбитотомию. 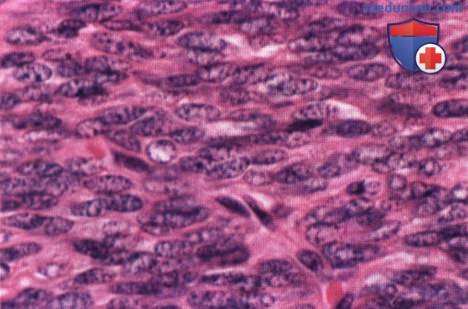
На микропрепарате видны однотипные плотно упакованные веретенообразные клетки с типичными для солитарной фиброзной опухоли признаками (гематоксилин-эозин, х200). 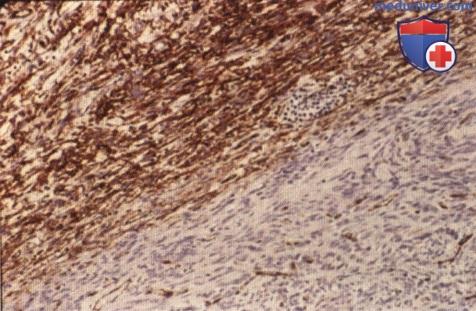
Иммуногистохимическая реакция на антиген к CD34: отмечается выраженная положительная реакция ткани опухоли (вверху фотографии). В опухолевой ткани внизу фотографии наблюдается менее выраженная реакция (х100).
Солитарная фиброзная опухоль — новообразование низкой степени злокачественности. Рекомендуется полная хирургическая резекция. В обоих представленных внизу случаях была выполнена почти полная хирургическая резекция, у обоих пациентов несколько лет спустя медленно развился рецидив.
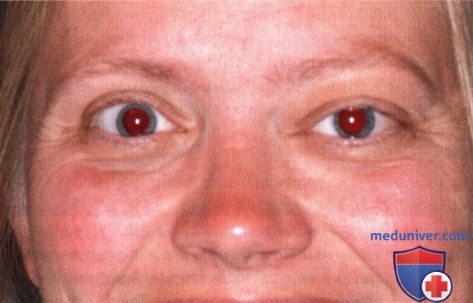
Внешний вид женщины средних лет с левосторонним экзофтальмом. 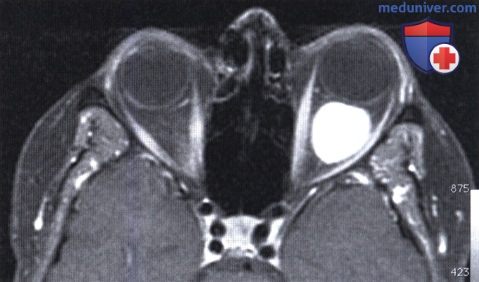
Та же пациентка, что и на рис. выше, МРТ с гадолиниевым усилением: в мышечном конусе определяется четко отграниченное мягкотканное объемное образование. 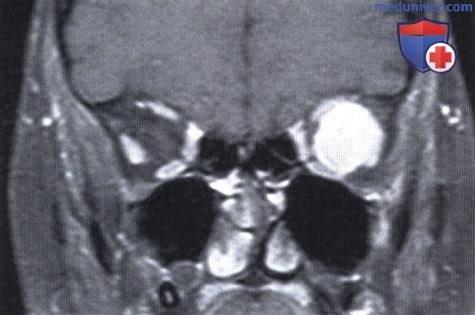
На корональной МР-томограмме в мышечном конусе определяется округлое четко отграниченное контрастное объемное образование. 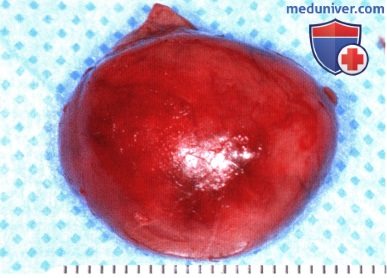
После резекции был подтвержден диагноз солитарной фиброзной опухоли. При гистологическом исследовании установлено, что опухоль распространялась далее заднего края резецированных тканей. Повторная операция для удаления рецидивировавшей опухоли проведена через три года. 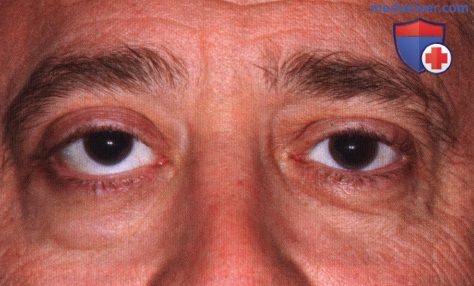
Внешний вид мужчины средних лет с небольшим экзофтальмом справа. 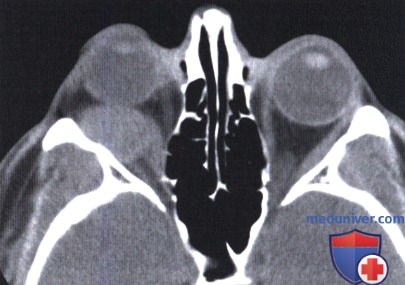
Аксиальная КТ: тотже пациент; внутри мышечного конуса — отграниченное мягкотканное образование. После удаления опухоли при гистологическом исследовании обнаружены опухолевые клетки по заднему краю макропрепарата.
б) Диагностика. При лучевых исследованиях солитарная фиброзная опухоль глазницы выглядит как округлое или овоидное четко отграниченное объемное образование, чаще локализующееся вне мышечного конуса. Часто наблюдается гладкая деформация прилегающей кости, что указывает на доброкачественное течение солитарной фиброзной опухоли.
Опухоль не имеет патогномоничных признаков на МРТ, некоторые авторы выделяют такие специфические признаки, как гетерогенность ткани опухоли и в целом низкая интенсивность сигнала в режиме Т2 (6).
в) Патологическая анатомия. Результаты гистологических и иммуногистохимических исследований широко обсуждались в последние годы. Многие случаи гемангиоперицитом и других веретеноклеточных новообразований были исследованы повторно и переклассифицированы в солитарную фиброзную опухоль (7-9).
Слабоположительная реакция на CD34 может наблюдаться при гемангиоперицитоме и других веретеноклеточных опухолях, но она не столь выражена, как при солитарной фиброзной опухоли. Также при солитарной фиброзной опухоли наблюдается положительная реакция на виметин, но реакции на протеин S-100, мышечные и эпителиальные маркеры отрицательны.
г) Лечение. Полная хирургическая резекция — метод выбора при лечении солитарной фиброзной опухоли. На основании результатов лучевых исследований следует тщательно спланировать оперативный доступ. Неполная резекция может привести к рецидиву опухоли и инфильтрации ею окружающих тканей и кости (16).
д) Список использованной литературы:
1. Shields JA, Shields CL, Scartozzi R. Survey of 1264 patients with orbital tumors and simulating lesions: the 2002 Montgomery Lecture, part 1. Ophthalmology 2004; 111: 997-1008.
2. Shields JA, Bakewell B, Augsburger JJ, et al. Classification and incidence of space-occupying lesions of the orbit. A survey of 645 biopsies. Arch Ophthalmol 1984;102: 1606-1611.
3. Shields JA, Bakewell B, Augsburger JJ, et al. Space-occupying orbital masses in children: A review of 250 consecutive biopsies. Ophthalmology 1986;93:379-384.
4. Bowe SN, Wakely PE, Ozer E. Head and neck solitary fibrous tumors: diagnostic and therapeutic challenges. Laryngoscope 2012;122:1748-1755.
5. Cox DP, Daniels T, Jordan RC. Solitary fibrous tumor of the head and neck. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2010;110:79-84.
6. Gigantelli JW, Kincaid MC, Soparkar CN, et al. Orbital solitary fibrous tumor: radiographic and histopathologic correlations. Ophthal Plast Reconstr Surg 2001; 17:207-214.
7. Furusato Е, Valenzuela IA, Fanburg-Smith JC, et al. Orbital solitary fibrous tumor: encompassing terminology for hemangiopericytoma, giant cell angiofibroma, and fibrous histiocytoma of the orbit: reappraisal of 41 cases. Hum Pathol 2011;42: 120-128.
8. Goldsmith JD, van de Rijn M, Syed N. Orbital hemangiopericytoma and solitary fibrous tumor: a morphologic continuum. Int J Surg Pathol 2001;9:295-302.
9. Heathcote JG. Pathology update: solitary fibrous tumour of the orbit. Can J Ophthalmol 1997;32:432-435.
10. Krishnakumar S, Subramanian N, Mohan ER, et al. Solitary fibrous tumor of the orbit: a clinicopathologic study of six cases with review of the literature. Surv Ophthalmol 2003;48:544-554.
11. Bernardini FP, de Conciliis C, Schneider S, et al. Solitary fibrous tumor of the orbit: is it rare? Report of a case series and review of the literature. Ophthalmology 2003; 110:1442-1448.
12. Polito E, Tosi M, Toti P, et al. Orbital solitary fibrous tumor with aggressive behavior. Three cases and review of the literature. Graefes Arch Clin Exp Ophthalmol 2002; 240:570-574.
13. Hayashi S, Kurihara H, Hirato J, et al. Solitary fibrous tumor of the orbit with extraorbital extension: case report. Neurosurgery 2001;49:1241-1245.
14. Lucci LM, Anderson RL, Harrie RP, et al. Solitary fibrous tumor of the orbit in a child. Ophthal Plast Reconstr Surg 2001;17:369-373.
15. Alexandrakis G, Johnson ТЕ. Recurrent orbital solitary fibrous tumor in a 14-year old girl. Am J Ophthalmol 2000;130:373-376.
16. DeBacker CM, Bodker F, Putterman AM, et al. Solitary fibrous tumor of the orbit. Am J Ophthalmol 1996;121:447-449.
17. Ing EB, Kennerdell JS, Olson PR, et al. Solitary fibrous tumor of the orbit. Ophthal Plast Reconstr Surg 1998;14:57-61.
18. Le CP, Jones S, Valenzuela AA. Orbital solitary fibrous tumor: a case series with review of the literature. Orbit 2014;33:145-151.
19. Ali MJ, Honavar SG, Naik MN, et al. Orbital solitary fibrous tumor: a rare clinicopathologic correlation and review of literature. J Res Med Sci 2013;18:529-531.
20. Polomsky M, Sines DT, Dutton JJ. Solitary fibrous tumor of the orbit with multiple cavities. Ophthal Plast Reconstr Surg 2013;29: el 17-e119.
21. Patel MM, Jakobiec FA, Zakka FR, et al. Intraorbital metastasis from solitary fibrous tumor. Ophthal Plast Reconstr Surg 2013;29: e76-e79.
22. Young TK, Hardy TG. Solitary fibrous tumor of the orbit with intracranial involvement. Ophthal Plast Reconstr Surg 2011;27: e74-e76.
23. Feuerman JM, Flint A, Elner VM. Cystic solitary fibrous tumor of the orbit. Arch Ophthalmol 2010;128:385-387.
24. Demirci H, Shields CL, Eagle RC Jr, et al. Giant cell angiofibroma, a variant of solitary fibrous tumor, of the orbit in a 16-year-old girl. Ophthal Plast Reconstr Surg 2009;25:402-404.
Редактор: Искандер Милевски. Дата публикации: 24.5.2020
- ЖАНРЫ 360
- АВТОРЫ 262 301
- КНИГИ 605 758
- СЕРИИ 22 725
- ПОЛЬЗОВАТЕЛИ 570 582
: 01.1. АНАТОМИЯ И ГИСТОЛОГИЯ ЛЕГКИХ
Анатомия, топографическая анатомия легких и структура их отдельных элементов изучены достаточно подробно и представлены в учебниках, руководствах и атласах по анатомии человека. В главе будут рассмотрены анатомия и гистология воздухопроводящих путей (трахея, бронхи, альвеолярные ходы), респираторной части легких (альвеолярные ходы, мешочки, альвеолы, аэрогематический барьер), сосудов легких, нервной и лимфатической системы легких, плевры и диафрагмы.
Воздухоносные пути - это структуры между окружающей средой и терминальной респираторной единицей (ТРЕ). ТРЕ является структурнофункциональным образованием, которое включает в себя 100 альвеолярных ходов и около 2000 альвеол, расположенных дистальнее респираторных бронхиол первого порядка. В легких насчитывается всего 150 000 ТРЕ. Эту структурнофункциональную единицу клинические физиологи, анатомы и патологоанатомы традиционно выделяют как основную структурную единицу - ацинус [1].
Трахея является продолжением гортани, представляет собой полую эластическую трубку, которая начинается от перстневидного хряща и заканчивается бифуркацией на уровне IV грудного позвонка, разделяясь на два главных бронха под углом 65 - 95 0 ;. Длина трахеи у взрослого человека колеблется от 90 до 150 мм, диаметр от 15 до 16 мм. Остов трахеи состоит из 16 - 20 хрящевых неполных колец, обращенных к пищеводу и соединенных между собой кольцевидными связками [2]. Задняя стенка ее представлена мембранозной частью, состоящей из коллагеновых, эластических и гладкомышечных волокон. Такое строение трахеи позволяет ей при разных условиях менять свою конфигурацию, а следовательно, и воздушный поток. Минимальный размер трахеи соответствует фазе выдоха, максимальный - фазе вдоха. При кашлевом толчке просвет трахеи уменьшается в 3 - 10 раз в зависимости от возраста человека (чем моложе, тем больше сужается просвет). Во время вдоха бифуркация трахеи смещается вниз и на 2 - 3 см кпереди.
БРОНХИАЛЬНОЕ ДЕРЕВО
Бронхиальное дерево состоит из двух главных бронхов (правого и левого) и 23 - 26 генераций ветвлений, включая бронхиолы и альвеолярные ходы (рис. 1-1). Общее число ветвлений равно 223, т.е. около 8x10 6 [3]. Правый главный бронх отходит под углом 15 - 40 0 , длина его 28 - 32 мм, диаметр 12 - 22 мм. Левый отходит под углом 50 - 70 0 , длина составляет 40 - 50 мм, а диаметр - 8 - 16 мм [4]. Таким образом, правый главный бронх короче, шире и имеет более вертикальное направление, чем левый. Главные бронхи делятся, как правило, дихотомически на долевые, сегментарные, субсегментарные и на бронхи более мелких генераций, вплоть до терминальных и респираторных бронхиол. В стенках респираторных бронхиол I, II и III порядка уже появляются альвеолы. Респираторные бронхиолы и их альвеолы одновременно выполняют воздухопроводящую и газообменную функцию. На протяжении субсегментарных бронхов может насчитываться до 5 делений, в малых (мышечных) бронхах - до 15 делений. По мере ветвления бронхов закономерно уменьшается и их диаметр. Размерные взаимоотношения предыдущей и последующей генераций бронхов оптимальны для того, чтобы обеспечить должный поток воздуха с минимальными затратами энергии на этот процесс [5].
Рис. 1-1. Строение дыхательных путей (по Э.Р. Вейбелю, 1970 [3]).
Бронхи с 4й по 13ю генерацию имеют диаметр до 2 мм; общее число таких бронхов около 400. Наибольшее число бронхов диаметром 2 мм наблюдается с 7й по 9ю генерацию [3]. В терминальных бронхиолах диаметр колеблется от 0,5 до 0,6 мм, диаметр респираторных бронхиол (17 - 19я генерации) и альвеолярных ходов от 0,2 до 0,6 мм. Длина воздухоносных путей от гортани до ацинусов составляет 23 - 38 см, протяженность от 9й генерации бронхов до респираторных бронхиол около 5 см. В воздухоносных путях выделяют около 50 типов клеток, 12 из которых относятся к эпителиальным [6].
По мере уменьшения калибра бронхов и бронхиол хрящевая пластинка в них сначала уменьшается в размерах, а в терминальных бронхиолах исчезает. Для того чтобы бронхиолы не спадались при вдохе, они располагаются внутри легочной паренхимы, которая за счет эластической тяги расправляется при вдохе и расширяет бронхи. Кроме того, в хрящевых бронхах мышечная оболочка не столь мощная, как в бронхиолах, в стенке мало сосудов, и каждый бронх имеет адвентицию. В стенках мелких бронхов много сосудов и отсутствует адвентиция [7].
Эпителиальная выстилка трахеи и бронхов образована многорядным реснитчатым эпителием с бокаловидными, промежуточными и базальными клетками. Указывается также на наличие нейроэндокринных клеток. На уровне сегментарных бронхов толщина эпителия составляет от 37 до 47 мкм. Собственная пластинка слизистой оболочки трахеи и бронхов уплотнена и образует отчетливую базальную мембрану, толщина которой колеблется от 3,7 до 10,6 мкм. Ткань, расположенная глубже, называется подслизистой основой. В нее погружены секреторные отделы многочисленных белково-слизистых желез, расположенные в треугольнике между двумя хрящами [8].
Белковослизистые железы являются дериватом секреторных клеток слизистой оболочки воздухоносных путей и функционально взаимосвязаны с ней. Железы имеют альвеолярно-трубчатую структуру и состоят из ацинусов, содержат серозные и слизистые клетки, расположенные на базальной мембране. Серозные клетки имеют призматическую форму, эллипсоидное ядро и пиронинофильную цитоплазму. Белковослизистые железы выделяют смешанный белково-мукополисахаридный секрет, в котором преобладают муцины. Секреция осуществляется по мерокриновому и апокриновому типам. Выводные протоки желез выстланы мерцательным кубическим однослойным эпителием, расположенным на базальной мембране; в стенке протоков содержится сеть эластических волокон. По периферии подслизистых желез расположены соединительная ткань, подразделяющая их на дольки, а также скопления лимфоидных клеток (особенно в области протоков), единичные макрофаги, тучные клетки, плазмоциты. Между эпителиальными клетками и базальной мембраной располагаются миоэпителиальные клетки, сокращение которых способствует выведению секрета из концевых отделов желез, протоки которых открываются на внутренней поверхности трахеи и бронхов [9].
Структурная организация всех слоев стенки воздухоносных путей обеспечивает три основные функции: барьернозащитную с обеспечением мукоцилиарного клиренса, контроль за калибром бронхов и бронхиол, механическую стабильность воздухоносных путей.
Эпителиальная выстилка воздухоносных путей здорового человека включает следующие разновидности клеток: реснитчатые (РК), секреторные (бокаловидные) (СК), переходные, или промежуточные (ПК), базальные (БК), нейроэндо-кринные (НЭК) (рис. 1-2) [10].
При изучении поверхности эпителиального пласта воздухоносных путей человека и экспериментальных животных был выявлен ряд закономерностей [11, 12]:
---вопервых, все клетки эпителиальной выстилки воздухоносных путей имеют на своей апикальной поверхности микроворсинки - небольшие выросты цитоплазмы. Наличие этих структур способствует увеличению поверхности эпителиального пласта, соприкасающегося с жидким надэпителиальным секреторным покрытием, и указывает на возможность всасывания путем эндоцитоза жидкой части секрета из просвета бронхов;
---вовторых, межклеточные контакты плотные и представлены в виде валикообразных структур или черепицеобразных наложений, что обеспечивает непрерывность эпителиальной выстилки и позволяет ей выполнять барьернозащитную функцию;
Читайте также:

