Сочетание гепатобластомы с опухолью желточного мешка
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
канд. мед. наук, ведущий научный сотрудник патологоанатомического отделения I,
119991, Москва, ГСП-1, Абрикосовский пер., 2
1. Czauderna P., Lopez-Terrada D., Hiyama E., Häberle B., Malogolowkin M.H., Meyers R.L. Hepatoblastoma state of the art: pathology, genetics, risk stratification, and chemotherapy. Current Opinion in Pediatrics 2014; 26 (1): 19–28. DOI: 10.1097/MOP.0000000000000046
2. Spector L.G., Birch J. The epidemiology of hepatoblastoma. Pediatric Blood and Cancer 2012; 59 (5): 776–9. DOI: 10.1002/pbc.24215
3. Tanaka Y., Inoue T., Horie H. International pediatric liver cancer pathological classification: current trend. Int J Clin Oncol 2013; 18 (6): 946–54. DOI: 10.1007/s10147-013-0624-8
4. Cross S.S., Variend S. Combined hepatoblastoma and yolk sac tumor of the Liver. Cancer 1992; 69: 1323–6. DOI: 10.1002/1097-0142 (19920315)69: 63.0.co;2-1
5. O'Sullivan P., Daneman A., Helen S.L., Chan H.S., Smith C., Robey G., Fitz C., Martin D.J. Extragonadal endodermal sinus tumors in children: a review of 24 cases. Pediatric Radiology 1983; 13: 249–57. DOI: 10.1007/bf00973340
6. Hart W.R. Primary endodermal sinus (yolk sac) tumor of the liver. First Reported case. Cancer 1975; 35: 1453–8. DOI: 10.1002/1097-0142(197505)35:5 3.0.co;2-u
7. Шабанов М.А., Пашков Ю.В., Сухарев А.В., Керимов П.А, Поляков В.Г. Опухоль желточного мешка с первичной локализацией в печени: описание наблюдения и обзор литературы. Детcкая онкология 2005; 1: 39–44.
8. Putra J., Ornvold K., Suriawinata A.A. Primary hepatic yolk sac tumor: a case report of a ruptured tumor in 22-monthold boy. JSM Сlinical Case Reports 2014; 2 (1): 1015.
9. Wang L.L., Filippi R.Z., Zurakowski D., Archibald T., Vargas S.O., Voss S.D., et al. Effects of neoadjuvant chemotherapy on hepatoblastoma: a morphologic and immunohistochemical study. The American Journal of Surgical Pathology 2010; 34 (3): 287–99. DOI: 10.1097/pas.0b013e3181ce5f1e
10. Huang W.-J., Tsai J.-H., Jeng Y.-M. Complementary roles of β-catenin and glutamine synthetase immunostaining in diagnosis of chemotherapy-treated and untreated hepatoblastoma. Journal of the Formosan Medical Association 2017; 116 (7): 549–53. DOI: 10.1016/j,jfma2016/09/013
11. Nakashima N., Fukatsu T., Nagasaka T., Sabue M., Takeuchi J. The frequency and histology of hepatic tissue in germ cell tumors. American Journal of Surgical Pathology 1987; 11 (9): 682–92. DOI: 10.1097/00000478-198709000-00004
12. Jacobsen G.K., Jacobsen M. Possible liver cell differentiation in testicular germ cell tumors. Histopathol 1983; 7 (4): 537–48. DOI: 10.1111/j.1365-2559.1983.tb02266.x

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Опухоли желточного мешка (опухоли эндодермального синуса) вторые по частоте среди злокачественных герминогенных новообразований яичников. По данным одного крупного исследования, они составляют 22 % в этой группе опухолей.
Средний возраст пациенток 19 лет. В 75 % случаев начальными симптомами были боль и объемное образование в животе или тазу. Перекрут ножки опухоли вызывает острые проявления, которые могут быть приняты за острый аппендицит или нарушенную эктопическую беременность. Опухоли желточного мешка почти всегда односторонние, диаметром 10—30 см.
На разрезе поверхность их желто-серая с участками кровоизлияний и кистозных желеобразных изменений.
Эти опухоли чрезвычайно злокачественные, они рано метастазируют и прорастают окружающие ткани. Интраабдоминальное метастазирование носит генерализованный характер. Наблюдается и лимфогенное метастазирование. Содержание АФП часто повышено. Опухоли желточного мешка характеризуются быстрым ростом и обширным распространением в пределах брюшной полости.
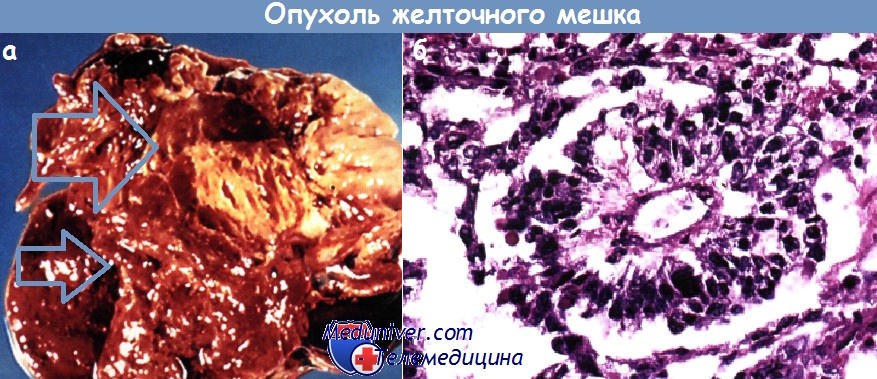
Опухоль желточного мешка:
А - внешний вид участков кровоизлияния и желатинового некроза;
В — микроскопическая картина с изолированными папиллярными разрастаниями, содержащими единичные кровеносные сосуды и имеющими периферическую выстилку из опухолевых клеток (тельце Шиллера-Дюваля).
Schiller называл эти опухоли мезонефромами, но сейчас большинство патологов относят их к другим герминогенным опухолям, не связанным с мезонефросом. Полагают, что они происходят из первичных половых клеток, образующихся в желточном мешке, поскольку структура опухоли аналогична таковой желточного мешка крыс.
Опухоли состоят из отдельных трубочек или пространств, выстланных одним слоем уплощенных кубовидных клеток, свободной ретикулярной стромы и множества рассеянных ПАСК-позитивных (ПАСК — парааминосалициловая кислота) глыбок; в некоторых пространствах и щелях отмечают типичные инвагинированные папиллярные структуры с центральным кровеносным сосудом — тельце Шиллера— Дюваля.
Долгое время прогноз для пациенток с опухолями желточного мешка оставался неблагоприятным, т. к. большинство из них умирали в течение 12—18 мес. с момента установления диагноза. До введения в клиническую практику многокомпонентной XT были известны лишь единичные случаи 5-летней выживаемости. У большинства больных опухоль была ограничена одним яичником.
В некоторых случаях новообразование состоит из опухоли желточного мешка в сочетании с элементами других герминогенных злокачественных опухолей, чаще с дисгерминомой. Клиническое течение заболевания при таких смешанных опухолях практически не отличается от чистых опухолей желточного мешка. При микроскопическом исследовании часто можно выявить внутри- и внеклеточные капли гиалина, представляющие собой отложения АФП.
Смешанные герминогенные новообразования часто содержат опухоли желточного мешка как один из морфологических компонентов.
- Список членов редколлегии
Федеральное государственное бюджетное учреждение науки
"Институт токсикологии Федерального медико-биологического агентства"
(ФГБУН ИТ ФМБА России)
Институт теоретической и экспериментальной биофизики Российской академии наук.
199406, Санкт-Петербург, ул.Гаванская, д. 49, корп.2
ТОМ 2, СТ. 38 (сс. 201-202) // Июль, 2001 г.
В печени могут развиваться первичные опухоли, т.е. опухоли из печеночных клеток и опухоли другого происхождения, как например, рабдомиосаркома, ангиосаркома. В печени также могут возникать и доброкачественные опухоли, самыми частыми из которых являются гемангиома, гамартома и аденома.
Первичные опухоли печени у детей занимают третье место по частоте среди абдоминальных опухолей после нейробластом и опухоли Вилмса. 80% этих опухолей являются злокачественными, причем преимущественно встречаются гепатобластомы (НВ) и гепатоцеллюлярные карциномы (НСС). Тактика лечения больного и прогноз зависят от гистологических находок после проведенной биопсии опухоли.
Гепатобластома (НВ) - наиболее часто встречается в раннем детском возрасте (моложе 5 лет). У детей, страдающих этой опухолью практически не наблюдается развитие цирроза печени. Эта опухоль закладывается в процессе эмбрионального развития, когда происходит распространенное нарушение органогенеза, и, вследствие этого, неконтролируемая пролиферация незрелой ткани. Наблюдаемое сочетание опухоли Вилмса и НВ, обеих эмбриональных опухолей, доказывает, что в процессе созревания действует определенный онкоген. Отмечается некоторая связь между возникновением НВ и применением матерью оральных контрацептивов, а также с фетальным алкогольным синдромом.
Гепатоцеллюлярная карцинома (НСС) - встречается у детей более старшего возраста (более 10 лет) и носит название "взрослый тип", поскольку практически не отличается от гепатоцеллюлярного рака взрослых. Но прогноз у детей, перенесших резекцию печени, значительно лучше, чем у взрослых.
Четвертая часть всех детских НСС возникает на фоне цирроза печени, тогда как у взрослых рак развивается преимущественно на фоне цирроза печени.
Очень редко, и, главным образом, у детей старшего возраста, встречается холангиокарцинома.
НСС часто ассоциируется с вирусом гепатита В, а именно:
-австралийский антиген часто обнаруживается у детей с НСС с циррозом печени и без него;
-в регионах с повышенной заболеваемостью гепатитом В также увеличена частота случаев НСС.
Риск развития этой опухоли значительно увеличивается у носителей HBsAg, по сравнению со здоровыми людьми.
Высокая частота развития НСС, причем с циррозом печени, отмечается у детей с хронической формой наследственной тирозинемии, а также при длительном использовании андрогенных анаболических стероидов, при снижении уровня альфа-1-антитрипсина (главного ингибитора протеаз в плазме) до 10%-15% от нормы.
НВ является преимущественно унифокальной опухолью и поражает чаще всего правую долю печени. Опухоль часто инкапсулирована, имеет вид дольчатой массы, с участками некроза и кровоизлияний. Опухоль обычно содержит мезенхимальные элементы - наряду с клетками гепатобластомы, встречается остеоидная ткань, незрелая мезенхима и очаги гемопоэза. В зависимости от степени клеточной дифференцировки, опухоль обычно представляет сочетание различных клеточных типов.
Опухоль, преимущественно состоящая из фетальных клеток, определяется как фетальный тип или высокодифференцированная НВ. Фетальные клетки меньше нормальных гепатоцитов, имеют малый плеоморфизм и более низкое ядерно- цитоплазменное соотношение. Митозы встречаются редко. Между клетками часто располагаются канальцы с желчью или без нее, но они не являются желчными протоками. Эти опухолевые клетки похожи на клетки печени плода фетального периода развития.
Эмбриональный тип НВ представлен более мелкими и менее дифференцированными клетками с выраженным плеоморфизмом, частыми митозами. Клетки могут формировать канальцы и выглядеть как ранние протоки эмбриональной печени. Эмбриональной, или низкодифференцированной гепатобластомой называется опухоль, в которой содержится более половины клеток эмбрионального типа.
Макротрабекулярный тип - фетальные и/или эмбриональные опухолевые клетки располагаются в виде тяжей или пластинок. Размер клеток может превосходить размер нормальных гепатоцитов и может напоминать клетки НСС.
Анапластический тип НВ состоит главным образом, из мелких клеток с темным ядром и скудной цитоплазмой, большим количеством митозов. Часто в опухоли этого типа находятся незрелые формы печеночных протоков.
Установлено, что примерно 30% НВ являются опухолями смешанного типа, с наличием мезенхимального и эпителиального компонента, причем наличие эпителиального компонента - это наиважнейший фактор, определяющий прогноз. По данным других исследователей, прогностически неблагоприятным фактором является присутствие эмбрионального или низкодифференцированного компонента в опухоли. НВ метастазирует чаще всего в легкие и ворота печени. Редко встречаются метастазы в кости.
НСС чаще всего развивается мультицентрично, с широкой инвазией печени. Опухоль состоит из клеток различного размера и плеоморфизма, но значительно более крупных, чем нормальные гепатоциты. Гораздо чаще, чем при НВ встречаются очаги некроза и кровоизлияний. Опухоль часто содержит желчь, гигантские клетки. В отличие от НВ очаги гемопоэза отсутствуют. Особый вариант НСС встречается у детей старшего возраста - фиброламеллярная карцинома. Эта опухоль имеет более благоприятное течение и не осложняется циррозом печени. Она характеризуется округлыми, густо эозинофильными гепатоцитами, в изобилии окружающими фиброзную строму, состоящую из тонких, параллельно расположенных фиброзных волокон. Обилие фиброзной ткани необычно для НСС, и эта опухоль может напоминать нодулярную гиперплазию. НСС также метастазирует в легкие, регионарные лимфоузлы и редко - в кости.
К редким вариантам злокачественных опухолей печени относится эмбриональная (мезенхимальная) саркома печени. Она встречается в более поздний период детства, чем НВ, но несколько раньше, чем НСС (средний возраст пациентов 6-10 лет). До недавнего времени пациенты с данным вариантом опухоли имели плохой прогноз, смертность составляла 80% (в среднем в течение 11 месяцев). Несмотря на радикальную операцию, часты рецидивы опухоли. В последнее время, в связи с применением комплексной терапии, выживаемость несколько улучшилась.
К другим вариантам редких злокачественных опухолей печени относятся: ангиосаркома, рабдомиосаркома, лейомиома, злокачественая тератома, первичная лимфома.
Выявление опухоли печени обычно не представляет трудности уже при осмотре больного. Первым клиническим признаком является увеличение живота в объеме. Опухоль почти всегда пальпируется через переднюю брюшную стенку. Боли отмечаются редко, в основном у более старших детей. Часты жалобы на анорексию, тошноту, рвоту, лихорадку. Может быть выявлена анемия. При НСС в 25% случаев нарастает желтуха (гораздо чаще, чем при НВ). При сопутствующем циррозе печени отмечается спленомегалия. Клинические симптомы нарастают в течение 1-2 месяцев.
Среди пациентов с НВ в 2% случаев выявляется преждевременное половое созревание (вследствие продукции опухолью гонадотропина).
1.Клинический анализ крови - выявляется нормохромная, нормоцитарная анемия, тромбоцитоз. При НСС может наблюдаться полицитемия.
2.Биохимический анализ крови - незначительное повышение уровня печеночных ферментов и щелочной фосфатазы (чаще при НСС). Уровень билирубина повышается редко.
3.Определение уровня альфа- фетопротеина (AFP). Этот гликопротеин продуцируется желточным мешком, печенью и кишечником плода, достигая максимальной концентрации на 13 неделе гестации и затем уровень его снижается, уменьшаясь до ''взрослого'' уровня к 3 месяцам жизни ребенка. У пациентов с НВ уровень AFP значительно повышается, в основном, при опухолях фетального типа. Эмбриональные опухоли реже продуцируют AFP. Повышение его уровня также может наблюдаться и при НСС, но значительно реже. Уровень AFP является маркером опухоли в процессе ее лечения и последующего наблюдения за пациентом. Но иногда встречаются не продуцирующие AFP метастазы после удаления AFP-продуцирующей опухоли.
4.При фиброламеллярной НСС выявляется специфическая аномалия витамин-В12-связывающего протеина (повышение его уровня).
5.При НВ иногда отмечается повышение уровня человеческого хорионического гонадотропина в сыворотке и моче. В редких случаях эта опухоль может продуцировать прогестерон и тестостерон.
6.При обзорной рентгенографии живота - выявляется увеличение печени, в редких случаях могут быть кальцификаты. Опухоль, исходящая из правой доли, смещает кишечник вниз и вперед. Опухоль, исходящая из левой доли, смещает желудок кзади и латерально. Может наблюдаться смещение книзу правой почки.
7.УЗИ брюшной полости исключает, в первую очередь, гидронефроз, кисты холедоха, печеночный абсцесс. Кистозный очаг в печени, как правило, связан с доброкачественным процессом, но такой же вид может иметь и злокачественная опухоль при кровоизлиянии в нее или развитии массивного некроза. Наиболее эффективным методом диагностики опухолей печени является интраоперационное УЗИ (чувствительность 98%-100%). Этот метод позволяет точно установить связь опухоли с сосудами (v.hepatica, v.porta).
8.Сцинтиграфия печени с различными изотопами (I-131, Au198, Tc99m) - выявляет локализацию и размеры опухоли (опухолевые очаги имеют вид дефекта наполнения), может выявить множественные опухолевые очаги.
9.Ангиография (аортография или, предпочтительнее coeliac-артериография) дает весьма важную информацию. Смещение сосудов вокруг опухоли, аномальное их расположение, наличие дополнительных сосудов, артерио- венозных шунтов - все это важно знать при предоперационном обследовании для планирования тактики операции (Рис.16-1).
10.Компьютерная томография живота дает наиболее полную информацию о местном распространении опухоли и состоянии регионарных лимфатических узлов (Рис.16-1).
11.До начала терапии необходимо гистологическое исследование опухоли. Традиционно проводится диагностическая лапаротомия. Но в настоящее время многие предпочитают проводить пункционную биопсию печени, особенно в случаях, когда опухоль неоперабельна.
Стадирование злокачественных опухолей печени проводится после оперативного вмешательства.
Международная система стадирования (King D.R, Ortega J, Campbell J et al. 1991г.):
Стадия I. Полная резекция опухоли.
Микроскопически- отсутствие опухолевых клеток в оставшейся ткани печени.
Стадия IIА. Полная резекция опухоли.
Микроскопически - наличие опухолевых клеток в оставшейся ткани печени.
Стадия IIB. Полная резекция опухоли.
Микроскопически- наличие опухолевых клеток в тканях, прилегающих к печени.
Стадия IIIA. Полная резекция опухоли.
Наличие метастазов в лимфоузлы и нарушение целостности опухоли Наличие метастазов в лимфоузлы без нарушения целостности опухоли
Стадия IIIB. Неполная резекция опухоли (макроскопически).
Наличие метастазов в лимфоузлы и нарушение целостности опухоли. Наличие метастазов в лимфоузлы без нарушения целостности опухоли
Стадия IV. Наличие отдаленных метастазов.
Наиболее эффективный метод лечения опухоли печени - радикальное ее удаление. Без оперативного вмешательства средняя продолжительность жизни у больных с НСС составляет 5 месяцев (максимальная- 24 месяца). Однако при опухолях больших размеров операция связана с большими техническими трудностями и большим риском для жизни больного.
При проведении эффективного оперативного лечения необходимо решить 4 основные задачи:
-удаление всей опухоли;
-сохранение функции резецированной печени;
-сохранение портального и печеночного венозного кровотока;
-сохранение хорошего билиарного дренажа.
Детям допустимо резецировать до 80% печеночной ткани. В основном проводится лобэктомия, гемигепатэктомия и резекция правой доли печени.
НВ принадлежит к высокочувствительным к химиотерапии опухолям. В их лечении используются антрациклины, ифосфамид, препараты платины. Даже в случае радикального удаления опухоли показана послеоперационная химиотерапия, как правило, адрибластином. Локализованная резектабельная НВ может быть излечена в 60% случаев. При опухолях больших размеров проводят интенсивную химиотерапию, переводя опухоль в разряд операбельных, и после операции продолжают химиотерапию. Маркером хорошего ответа на химиотерапию является снижение уровня AFP.
Современные методы терапии позволяют улучшить прогноз заболевания в случае неоперабельных опухолей печени.
1. Трансплантация печени
2. Криохирургический метод - разрушение опухолевой ткани с помощью местного воздействия низких температур
3. Химиоэмболизация - инфузия цитостатиков непосредственно в печеночную артерию или воротную вену. Эмболизация печеночной артерии избирательно лишает опухоль кровоснабжения из воротной вены. При этом в опухоли создается и высокая концентрация химиопрепарата (в 10-25 раз больше, чем при внутривенной инфузии, но с минимальным общим токсическим эффектом) и увеличивается время его воздействия на опухоль.
4. Введение в опухоль 99,5% спирта под контролем УЗИ - метод эффективен при наличии опухоли малых размеров (менее 3-4 см в диаметре), но нерезектабельных.
Как вспомогательный метод, иногда применяется и лучевая терапия
Опухоли яичек
Эпидемиология. На опухоли яичек приходится менее 2% всех солидных опухолей у детей. В Соединенных Штатах частота тестикулярных опухолей у мальчиков младше 15 лет составляет 0,5 на 100 000. От 2 до 5% всех опухолей яичек приходится на детский возраст с пиком частоты в возрасте 2 лет. Что касается расовой предрасположенности, то чаще опухоли яичек встречаются у представителей восточных и азиатских национальностей, реже — у чернокожих людей.
Классификация и стадирование. Опухоли яичек подразделяются на опухоли поддерживающих структур (из интерстициальных клеток, из клеток Сертоли-Лейдига, гранулезоклеточные) и опухоли герминогенного происхождения (опухоли желточного мешка, эмбриональноклеточные, семиномы), развивающиеся непосредственно из самого яичка. Стадирование опухолей яичек у детей представлено в таблице 72-3, а сокращенная классификация, основанная на системе Всемирной Организации Здравоохранения, — в таблице 72-4.
Многие опухоли, включенные в таблице 72-4 в рубрику эмбриональноклеточных, могли бы сегодня быть отнесены к опухолям желточного мешка.
Клинический подход. Опухоли яичек у детей проявляются в виде безболезненного образования. Они обычно солидные и не просвечивают при осмотре в лучах проходящего света. Нередко опухоль обнаруживается случайно во время осмотра или операции по поводу паховой грыжи. У одной трети пациентов с опухолями яичка имеется сопутствующая водянка яичка. На первый план могут выступать признаки гормональной активности, особенно при опухолях из клеток Сертоли-Лейдига.
Герминогенные опухоли часто существуют уже в течение какого-то времени прежде, чем пациенты обращаются по этому поводу к врачу. Интервал между появлением опухоли и обращением к врачу, как правило, больше при негерминогенных опухолях. Очень важно внимательно оценивать состояние яичек у детей, ибо чем позже установлен диагноз опухоли яичка, тем ниже показатели выживаемости таких пациентов.
При физикальном исследовании необходимо внимательно обследовать контралатеральное яичко и брюшную полость. Важный метод диагностики, позволяющий удостовериться в наличии опухоли и определить ее характер - ультразвуковое исследование. Помогает в этом и сцинтисканирование яичка. Пункционная биопсия водяночной жидкости у мальчиков с опухолевидным образованием яичка позволяет провести цитологическое исследование этой жидкости.
Лучшим методом выявления метастазов опухоли в брюшную полость и в грудную клетку является КТ. У детей с клинически локализованной опухолью яичка производится его удаление до проведения КТ, поскольку в большинстве случаев поражение в детском возрасте носит доброкачественный характер, что исключает необходимость дальнейшего обследования. До операции и в послеоперационном периоде необходимо определять сывороточные маркеры (чХГ и АФП), являющиеся показателями резидуальной или рецидивной опухоли.
Операцию проводят через паховый доступ, поскольку чрезмошоночные биопсия или удаление яичка сопровождаются более высоким риском местных рецидивов. Если ранее была произведена чрезмошоночная биопсия, выявившая злокачественный процесс, то необходимо произвести гемискротальную резекцию. Во время операции после вхождения в паховый канал элементы канатика атравматично окклюзируют.
Герминогенные опухоли. Опухоль желточного мешка (опухоль энтодермального синуса - ОЭС) — наиболее распространенная опухоль яичек у детей, диагностируемая чаще всего в возрасте 3 лет. Данный термин в какой-то степени неправилен, поскольку опухоль возникает из зародышевых клеток, которые больше похожи на образования желточного мешка, чем являются истинными его клетками.
Почти у всех пациентов отмечается повышение уровня АФП в сыворотке — важного маркера резидуальной или рецидивной опухоли. Период его полураспада - около 5 дней. Уровень АФП в сыворотке снижается до нормального (
Группа мягкотканных опухолей включает в себя широкий круг разнообразных неоплазм. У детей доброкачественные опухоли в большинстве своем исходят из сосудов или из фиброзных тканей. Среди злокачественных новообразований мягкотканная саркома (МТС) встречается у детей более часто, чем у взрослых.
Мезенхимома печени и рабдомиосаркома внутрипеченочных желчных протоков у детей встречаются в редких случаях. Более, чем 95% злокачественных опухолей печени, обнаруживаемых в детском возрасте, относятся к гепатобластомам или гепатоцеллюлярным карциномам.
Лечебная тактика при кистозных гигромах определяется их клиническими проявлениями, размерами, локализацией, а также наличием (или отсутствием) осложнений. Наилучший метод — полное тщательное иссечение гигромы, но, к сожалению, это не всегда бывает возможно. Удаление некоторых гигром может ин.
Хилезный асцит возникает в результате скопления лимфы в брюшной полости. У взрослых пациентов эта патология является вторичной по отношению к воспалительным заболеваниям, внутрибрюшным злокачественным опухолям и лимфомам. Хилезный асцит может также развиться после хирургических вмешательств. У детей.
Опухоли желудочно-кишечного тракта редко встречаются у детей, хотя в литературе имеются описания как доброкачественных, так и злокачественных новообразований в детском возрасте с локализацией их на любом уровне — от пищевода до аноректальной зоны. Опухоли у детей обычно бывают доброкачественными как.
Капиллярная лимфангиома. Простые лимфангиомы имеют вид поверхностных, слегка возвышающихся, гладких однородных образований, иногда напоминающих бородавки. Они могут быть единичными или множественными и часто располагаются в области рта и особенно языка, но иногда поражают и другие области, в частнос.

Рак в яичке тоже бывает, но это особый эмбриональный рак, развивающийся у взрослого мужчины из эпителия гонад, его относят к герминогенным злокачественным опухолям яичка. Предполагается, что герминогенные опухоли закладываются ещё в период эмбрионального развития в утробе матери, когда в первую половину беременности половая клетка плода приобретает злокачественный потенциал.
- Причины развития и факторы риска опухоли яичка
- Классификация. Виды опухолей яичка
- Симптомы опухолей яичек
- Диагностика рака яичка
- Лечение рака яичка
- Прогноз при раке яичка
- Профилактика рака яичка
- Цены на лечение в Европейской клинике
Злокачественные опухоли яичка не очень часты, на их долю приходится не более 2% от всех злокачественных новообразований, но последние 2–3 десятилетия они демонстрируют удвоение заболеваемости. Россияне болеют злокачественными опухолями яичка раза в 4 реже европейцев, правда, по скорости ежегодного прироста заболеваемости опухоли прочно вышли в топ, занимая второе место. Благо, что на сегодняшний день от рака яичка, который совсем не рак, а другая злокачественная опухоль, излечивается до 90% больных.
Распространение их необъяснимо. Никто не скажет, почему испанцы и португальцы болеют в 5 раз реже датчан, и даже ближайшие к Дании северные соседи финны страдают раком яичка в 4 раза реже. К злокачественным опухолям яичка более склонны белокожие мужчины, для чернокожих они совсем не характерны. Главную озабоченность вызывает то, что болеют злокачественными опухолями яичка молодые мужчины от 15 до 44 лет.
При неуклонном росте заболеваемости, с 1970-х годов смертность от злокачественных опухолей яичка снизилась почти четырёхкратно. В ХХ веке смертность от опухолей яичка росла ровно до времени выхода на фармацевтический рынок препаратов платины, совершивших химиотерапевтическую революцию. Препаратам платины очень помогли новые диагностические методики, а особенно, определение опухолевых маркёров. Всё это в совокупности обеспечивает крайне низкую смертность: один на 300 тысяч мужского населения.
Причины развития и факторы риска опухоли яичка
Научившись лечить злокачественные опухоли яичка, ещё не вполне определились с факторами риска, приводящими к злокачественному росту. Во всяком случае, их несколько, но главного и ведущего не определено, правда, герминогенные опухоли уже серьёзно считают пороком эмбрионального развития.
В первую очередь предполагают неблагоприятное действие материнских эстрогенов на гонады плода мужского пола в первую половину беременности, когда идёт активное формирование половых желёз. Эстрогены, вроде бы, впрямую тормозят процесс опущения яичек в мошонку, неблагоприятно меняют половые клетки, подготавливая их к развитию предшественника всех злокачественных опухолей carcinoma in situ. Заметили, что выраженный токсикоз беременности или приём препаратов эстрогенов способствует увеличению рака яичка у сына.
Виновна в злокачественном росте и атрофия яичка, возникающая при крипторхизме, травме, инфекционном паротите — свинке. Атрофированное яичко производит мало тестостерона, поэтому главный регулятор эндокринной деятельности — гипоталамус увеличивает выработку гормонов-стимуляторов гонад, в ответ на которые начинается размножение половых клеток. Клетки сбиваются с правильного пути развития — мутируют, и появляется всё та же carcinoma in situ.
Не опустившееся в мошонку яичко — крипторхизм - пятикратно увеличивает вероятность рака, а двусторонний крипторхизм — в 10 раз. Так окончательно и не определились, помогает ли операционное низведение яичка избавиться от будущего рака или нет. С другой стороны, операционная травма тоже влияет, способствуя атрофии ткани яичка. Но точно известно, что в низведённом яичке развиваются совсем другие опухоли, нежели возникают в оставленном в брюшной полости яичке, прогноз их хуже.
Операционная травма при лечении паховой грыжи тоже увеличивает заболеваемость раком яичка, и просто повреждение органов мошонки не стоит в стороне.
В 2–4 раза увеличивается вероятность рака у сына, если папа болел злокачественной опухолью яичка. Отмечены случаи семейного рака яичка, особенно высока вероятность опухоли у родных братьев — в 8–10 раз чаще. У больных медицинские генетики находят дефекты 4, 5, 6 и 12 хромосом, в некоторых хромосомах генетический материал в избытке, в других — в недостатке. При многих других раках находят мутацию белка р53, в норме при повреждении клетки запускающего программу её гибели. Мутантный белок р53 позволяет повреждённой клетке выжить и размножаться, производить подобных себе. При злокачественных опухолях яичка белок р53 не только остаётся совершенно нормальным, но и вырабатывается в больших количествах, что, как считают, помогает высокой эффективности химиотерапии и облучения.
Родителей мальчиков всегда предупреждали, что осложнение эпидемического паротита (свинки) — вирусный орхит - может привести к раку яичка, но статистика этого не подтверждает и не отвергает. А вот ВИЧ-инфицирование увеличивает риск тестикулярного рака. Одно время с риском развития злокачественной опухоли яичка связывали высокий рост пациента, но пока не подтвердили и не отвергли.
Классификация. Виды опухолей яичка
Опухоли яичка по клеточному строению весьма разнообразны, но 90–95% их относится к компании герминогенных опухолей:
- внутриканальцевая неоплазия;
- опухоль желточного мешка;
- семинома;
- тератома;
- трофобластическая опухоль (хориокарцинома);
- эмбриональный рак;
- смешанные опухоли
Остальные 5–10% составляют доброкачественные и злокачественные опухоли из клеток Лейдига или Сертоли, взрослые и ювенильные гранулёзоклеточные опухоли, тека-фибромы и смешанные.
Дающую начало раковой инвазии — проникновении клеток через ограничительную базальную мембрану — внутриканальцевую неоплазию (TIN) или carcinoma in situ часто находят в окружении опухоли яичка, и у 2–5% больных обнаруживают её даже в здоровом яичке, поэтому лечение её очень серьёзное. Поскольку четыре из 10 герминогенных опухолей — семиномы, а остальные — все прочие гистологические типы с одинаковым ответом на лечение, то клинически все герминогенные опухоли яичка (ГОЯ) делят на две группы: семиномы и несеминомы, которые лечатся по-разному.
Симптомы опухолей яичек
Пик несеминомных опухолей регистрируется после 20 лет, семиномы, как правило, проявляются после 30-летия. Одновременное поражение обеих яичек отмечается очень редко — один из сотни больных.
Первый и самый частый симптом — увеличение размеров яичка. Второй симптом — боли в месте развития метастазов из-за сдавления органа, а метастазы появляются чрезвычайно рано, разносит злокачественные клетки преимущественно лимфатическая жидкость. Метастазами поражаются забрюшинные лимфатические узлы в 90% случаев, что даёт не связанные с движением боли в пояснице, тогда как при радикулите боли возникают при движениях позвоночника.
Возможно сдавление мочеточника увеличенными лимфоузлами забрюшинного пространства, что приводит к застою мочи в почечной лоханке и блокировке работы почки. Лимфатические узлы могут нарушить отток крови по нижней полой вене, вызывая односторонний отёк ноги, не проходящий при приёме мочегонных. Метастазы в лимфатические узлы средостения способны инициировать одышку и кашель, но чаще эти симптомы дают метастазы в лёгкие, тоже очень частые.
Гранулёзоклеточные опухоли яичка могут вырабатывать женские гормоны, что отражается на внешности: утрачивается мужественность, прогрессирует гинекомастия — увеличение молочных желёз, как у женщин жировая клетчатка распределяется на бедрах, снижено либидо и возможна импотенция. Повышенную продукцию андрогенов гранулёзоклеточной опухолью у мужчины сразу не заметишь, разве что половое поведение меняется на крайне активное.
Диагностика рака яичка
Обычно, если во время осмотра врач обнаруживает в мошонке у пациента опухоль, первым делом он назначает УЗИ. Это быстрое и доступное исследование помогает визуализировать новообразование, определить его расположение, размеры, изучить внутреннюю структуру.
Проводят анализ на онкомаркеры: альфа-фетопротеин и хорионический гонадотропин человека. Их присутствие в крови свидетельствует в пользу рака яичка.
Если результаты ультразвукового исследования и анализов указывают на онкологическое заболевание, яичко удаляют и отправляют в лабораторию для цитологического и гистологического исследования. Удалять для биопсии только часть яичка нецелесообразно, так как это повышает риск распространения раковых клеток.
Если есть подозрение на отдаленные метастазы, назначают компьютерную томографию, магнитно-резонансную томографию (она особенно хорошо помогает обнаруживать очаги в головном и спинном мозге), позитронно-эмиссионную томографию, рентгенографию костей.
Вовремя обнаружить патологические изменения и обратиться к врачу помогут регулярные самостоятельные осмотры мошонки. Процедура довольно проста, ее можно проводить во время приема душа:
- Встаньте перед зеркалом и осмотрите мошонку. Проверьте, нет ли на ней припухлостей, покраснений.
- Ощупайте яичко большим пальцем, придерживая четырьмя остальными. В норме оно не должно быть увеличено, в нем не должно быть уплотнений и узелков, ощупывание не должно быть болезненным. Затем аналогичным образом ощупайте второе яичко.
Если вы обнаружили какие-либо патологические изменения, нужно обратиться к врачу. Но не стоит паниковать раньше времени: возможно, это не рак.

Лечение рака яичка
Основной метод лечения — хирургический. Яичко удаляют через разрез в паховой области. На его место можно вставить имплант: функции мужской половой железы он, ясное дело, выполнять не сможет, но косметический эффект обеспечит.
Если высока вероятность того, что раковые клетки распространились в близлежащие лимфатические узлы, последние тоже удаляют. Для предотвращения рецидива врач может назначить курс лучевой терапии или химиотерапии.
Лечение имеет некоторые побочные эффекты. Если хирург повредит нервы во время удаления лимфатических узлов, возникнут проблемы с эякуляцией. Химиотерапия и лучевая терапия вызывают бесплодие.
Прогноз при раке яичка
В первую очередь прогноз зависит от того, насколько сильно рак успел распространиться в организме. Все злокачественные опухоли яичка условно делят на три вида:
- Локализованные — в пределах яичка.
- Регионарные — успевшие прорасти в соседние органы и распространиться в близлежащие лимфоузлы.
- Распространенные — при наличии отдаленных метастазов.
Главным прогностическим показателем является пятилетняя выживаемость — процент пациентов, оставшихся в живых в течение пяти лет с момента диагностики заболевания. При разных стадиях рака яичка пятилетняя выживаемость составляет:
- При локализованных — 99%.
- При регионарных — 96%.
- При распространенных — 73%.
Помимо стадии, имеют значение и другие факторы, в частности, тип опухоли и уровни онкомаркеров в крови после удаления яичка.
Профилактика рака яичка
Эффективных способов профилактики заболевания не существует. При неопущении яичка — крипторхизме — требуется его низведение в мошонку хирургическим путем. Операция необходима по многим причинам, но неизвестно, помогает ли она снизить риск опухоли.
Читайте также:

