Собственная кровь остановит рак
Переливание крови (гемотрансфузия) — процедура, которая формально приравнивается к хирургическому вмешательству. Ее проводят с помощью иглы, введенной непосредственно в вену пациента, или заранее установленного венозного катетера. Несмотря на кажущуюся простоту переливания крови, оно должно проводиться с учетом целого ряда факторов, особенно если речь идет о онкологических больных.
Необходимость хотя бы в разовом переливании крови у ракового больного возникает с большой долей вероятности: по данным Всемирной организации здравоохранения, анемия тяжелой степени наблюдается у 30% пациентов на ранних стадиях онкозаболеваний и у 60% пациентов после химиотерапии. Что же следует знать о процедуре гемотрансфузии?
Нюансы переливания крови при раке
Правильно назначенное и организованное переливание крови помогает нормализовать состояние онкологического больного и предотвратить осложнения заболевания. Современная медицина накопила достаточную статистику по выживаемости онкобольных, подвергавшихся процедурам гемотрансфузии. Выяснилось, что переливание цельной крови может усилить процессы метастазирования и ухудшить способность организма сопротивляться патологическим процессам. Поэтому при раке переливают только отдельные компоненты крови, причем подбор препарата должен быть индивидуальным и учитывать не только группу крови и диагноз больного, но и его состояние. В тяжелых случаях (поздние стадии рака, послеоперационный период) могут потребоваться повторные переливания крови. Остальным больным после первой процедуры необходим динамический контроль показателей крови, иногда — назначение индивидуального курса гемотрансфузии. Эффект от правильно выполненной гемотрансфузии заметен практически сразу после процедуры: самочувствие больного улучшается, чувство слабости отступает. А вот длительность эффекта — вопрос индивидуальный.
Опросы показывают, что лишь 34% онкологических больных ставят на первое место обезболивающие процедуры. 41% опрошенных высказываются, прежде всего, за избавление от постоянной усталости, вызванной в основном анемией.
Когда же требуется переливать кровь? Некоторые виды онкологических заболеваний, например злокачественные опухоли ЖКТ и женских половых органов, часто вызывают внутренние кровотечения. Длительное течение рака приводит к различным нарушениям жизненно важных функций, вызывающим так называемую анемию хронического заболевания. При поражении красного костного мозга (как вследствие самого заболевания, так и в результате химиотерапии), селезенки, почек снижаются функции кроветворения. И наконец, при раке могут потребоваться сложные хирургические операции, сопровождающиеся большой кровопотерей. Все эти состояния требуют поддержки организма с помощью препаратов донорской крови.
Переливать кровь нельзя при аллергиях, заболеваниях сердца, гипертонии 3-й степени, нарушениях мозгового кровообращения, отеке легких, тромбоэмболической болезни, тяжелой почечной недостаточности, остром гломерулонефрите, бронхиальной астме, геморрагическом васкулите, нарушениях со стороны центральной нервной системы. При тяжелых анемиях и острых кровопотерях переливание проводится всем больным без исключения, но с учетом и профилактикой возможных осложнений.
Переливание крови будет в наименьшей степени сопряжено со стрессом для организма, если использовать собственную кровь пациента. Поэтому в некоторых случаях (например, перед курсом химиотерапии) пациент ее сдает заранее, она хранится в банке крови и используется по мере необходимости. Также собственная кровь пациента может быть собрана во время операции и перелита обратно. Если нет возможности использовать собственную кровь, из банка крови берется донорская.
В зависимости от показаний переливают либо очищенную плазму, либо плазму с высоким содержанием тех или иных кровяных телец.
Плазму переливают при повышенной кровоточивости и тромбообразовании. Ее хранят в замороженном виде, чтобы при необходимости разморозить и провести переливание. Срок хранения замороженной плазмы — один год. Существует методика отстаивания размороженной плазмы для получения криопреципитата — концентрированного раствора факторов свертывания крови. Он переливается при повышенной кровоточивости.
Эритроцитарная масса переливается при хронической анемии и острых кровопотерях. В первом случае есть время понаблюдать за пациентом, во втором требуются экстренные меры. Если запланирована сложная хирургическая операция, предполагающая большую потерю крови, переливание эритроцитарной массы может быть проведено заранее.
Тромбоцитарная масса в основном требуется для восстановления показателей крови после химиотерапии. Также ее могут переливать при повышенной кровоточивости и кровопотерях в результате хирургического вмешательства.
Лейкоцитарная масса помогает повысить иммунитет, но в настоящее время ее переливают крайне редко. Вместо этого пациенту вводят колониестимулирующие препараты, активизирующие выработку организмом собственных лейкоцитов.
Несмотря на то, что в современной медицине устоялась тенденция назначать переливания крови только в самых крайних случаях, раковым больным гемотрансфузия назначается довольно часто.
Перед переливанием изучают анамнез и информируют пациента об особенностях переливания крови. Необходимо также измерить артериальное давление пациента, пульс, температуру, взять на исследование кровь и мочу. Потребуются данные о предыдущих переливаниях крови и осложнениях при них, если таковые были.
У каждого пациента должна быть определена группа крови, резус-фактор и Kell-антиген. Пациентам с отрицательным Kell-антигеном можно переливать только Kell-отрицательную донорскую кровь. Также у донора и реципиента должны быть совместимы группа и резус-фактор. Однако правильный подбор по этим параметрам не исключает негативной реакции организма на чужую кровь и на качество препарата, поэтому делается биопроба: вводится сначала 15 мл донорской крови. Если в последующие 10 минут нет никаких тревожных симптомов, переливание можно продолжать.
На одну процедуру может потребоваться от 30–40 минут до трех–четырех часов. Переливание тромбоцитарной массы занимает меньше времени, чем переливание эритроцитарной. Используются одноразовые капельницы, к которым подсоединяют флаконы или гемаконы с препаратами крови. По окончании процедуры пациент должен оставаться в лежачем положении как минимум два–три часа.
При назначении курса длительность и частота процедур переливания определяется показателями анализов, самочувствием больного и тем, что за одну процедуру больному можно перелить не более двух стандартных доз препарата крови (одна доза — 400 мл). Разнообразие онкологических заболеваний и особенностей их течения, а также индивидуальная переносимость процедур не позволяют говорить о каких-либо универсальных схемах. Например, больным с лейкемией могут требоваться ежедневные процедуры с варьированием объема и состава препаратов крови. Курс проводится под постоянным контролем всех параметров жизнедеятельности организма больного, его самочувствия и при первой необходимости прекращается.
Несмотря на все меры предосторожности, примерно в 1% случаев гемотрансфузия может вызывать негативную реакцию организма. Чаще всего это проявляется в виде лихорадки, озноба и сыпи. Иногда могут наблюдаться проблемы с дыханием, повышение температуры, покраснение лица, слабость, появление крови в моче, боль в пояснице, тошнота или рвота. При своевременном выявлении этих признаков и обращении к врачу опасности для жизни больного нет.
Переливание крови онкологическим больным надежнее всего проводить в специализированном стационаре, где они будут находиться под круглосуточным наблюдением медперсонала. Однако в некоторых случаях переливание проводится амбулаторно. По возвращении домой после процедуры необходимо следить за состоянием больного и при ухудшении его самочувствия вызвать неотложную помощь.
Злокачественную опухоль можно усыпить, не вмешиваясь в клеточную ДНК – можно просто отключить белки, которые помогают клеткам делиться.
Обычные методы противораковой терапии нацелены на то, чтобы повредить ДНК раковых клеток. Это может быть жесткое ионизирующее излучение, как при радиотерапии, или какое-нибудь вещество-мутаген, как в химиотерапии; в любом случае в ДНК возникают множественные разрывы, с которыми клетка не может размножаться – у нее просто не получится правильно скопировать свою ДНК для дочерних клеток, да и вообще гены с повреждениями работать не могут.
Конечно, есть специальные ремонтные системы, но у раковых клеток такие системы часто изначально повреждены – ведь и сами злокачественные опухоли возникают из-за неотремонтированных дефектов в геноме. Лекарства и облучение портят ДНК еще сильнее, чтобы даже раковая клетка не смогла выжить.
Однако такие средства повреждают не только раковые, но и здоровые клетки – побочные эффекты от радиотерапии и химиотерапии бывают весьма и весьма тяжелыми. Здесь можно, с одной стороны, попытаться организовать адресную доставку: сделать прибор для облучения, который можно было бы настроить строго на область опухоли, или сделать какие-нибудь частицы с лекарственной начинкой, которые накапливались бы только в злокачественных клетках, высвобождая в них лекарство. С другой стороны, можно пойти иной дорогой и действовать на рак, не разрушая ДНК.
Часто клетки перерождаются в опухолевые оттого, что в них из-за мутаций становятся слишком активны определенные белки – обычно те, что помогают клетке делиться. Одни из самых известных таких белков – KAT6A и KAT6B. Про KAT6A обычно говорят в связи с острым миелоидным лейкозом, KAT6B связан с целым рядом различных опухолей.
Не вдаваясь в подробности, напомним, что ДНК в клетках всегда находится в комплексе с особыми белками – гистонами. Некоторые участки ДНК сильно упакованы с помощью гистонов и недоступны для молекулярных машин, считывающих генетическую информацию; другие участки ДНК, наоборот, открыты для работы. Есть специальные ферменты, которые химически модифицируют гистоны-упаковщики, так что они то открывают ДНК ко всеобщему доступу, то закрывают. И вот KAT6A и KAT6B как раз открывают для работы те гены, от которых зависит размножение клетки.
Сотрудники Института медицинских исследований Уолтера и Элизы Холл вместе с коллегами из Мельбурнского университета, Университета Монаша и других научных центров в прошлом пытались выключать сам ген KAT6A, и оказалось, что с выключенным KAT6A больные животные живут в четыре раза дольше.
Но если все-таки не вмешиваться в ДНК? В новой статье, опубликованной в Nature, исследователи описывают два вещества, которые избирательно подавляют активность белков KAT6A и KAT6B – оба вещества испытывали на клеточных культурах и на животных: на рыбах с карциномой печени и на мышах с лимфомой.
Во всех случаях злокачественные клетки переставали делиться, как бы засыпая, однако сон этот оказывался вечным. Раковая клетка, в общем-то, ничего другого не умеет, кроме как размножаться, и все у нее нацелено на деление. Если им запретить делиться, они начинают стареть: они синтезируют меньше белков, у них снижается энергообмен, в них накапливается биохимический мусор. В стареющих клетках может включиться программа клеточного самоубийства – чтобы клетка погибла аккуратно, не мешая окружающим; если же такая программа не включается, их уничтожает иммунитет.
Пока что авторы работы увидели, как раковые опухоли останавливаются в росте и как их клетки начинают стареть. И стоит еще раз отметить, что это удалось сделать, не портя им ДНК.
Конечно, возникает вопрос, как к таким веществам, которые запрещают делиться, отнесутся другие, здоровые клетки, которые тоже сохраняют способность к размножению, вроде стволовых.
Источник: Наука и жизнь (nkj.ru)
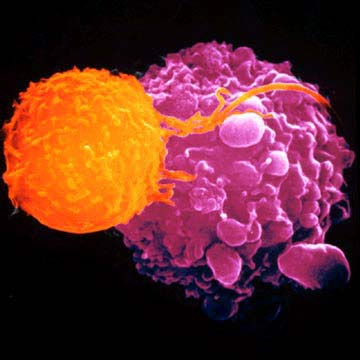
Если разбудить Т-лимфоциты, сидящие внутри опухоли, они не только уничтожат ее саму, но и найдут другие очаги болезни, рассеянные по организму.
Отвечаем на самые важные вопросы про лейкоз
" title="Показать лейкоз может исследование периферической крови
" itemprop="contentUrl">
Показать лейкоз может исследование периферической крови
Фото: Сергей Яковлев
В сентябре мы познакомились с архангелогородкой Вероникой Рожновской, жизнь которой изменилась, когда у её дочери Даши диагностировали лейкоз. Девочка в тот момент училась в пятом классе, а на недомогания врачи не обращали должного внимания. Специалисты отмечают, что рак крови действует тем агрессивнее, чем моложе организм, который поражает болезнь. На другие важные вопросы об этом раке отвечают профессор кафедры онкологии и медицинской радиологии Уральского государственного медицинского университета Сергей Берзин и гематолог из Уфы Нэлли Янтурина.
Лейкоз — опухолевое заболевание клеток крови. При лейкозе происходит патологическая трансформация лейкоцитов и их бесконтрольное деление. В итоге они замещают собой нормальные клетки костного мозга, из которых образуются циркулирующие в крови лейкоциты, эритроциты и тромбоциты.
При хронических лейкозах деление клеток идёт медленнее, и клиника тоже развивается с меньшей скоростью. Лейкозный клон током крови разносится по всей кроветворной ткани. Органами-мишенями, где откладываются метастазы, становятся почки и кости. Оседая в костной ткани, эти клетки, по-другому они называются миеломные, нарушают ее структуру. Это может проявляться частыми переломами, болью в позвоночнике, ребрах. Хронические лейкозы могут годами протекать без каких-либо явных отклонений в самочувствии, тогда выявить их можно только при исследовании крови.
Начало заболевания нередко протекает без выраженных симптомов. Больные отмечают общую слабость, утомляемость, неопределенную боль в костях, непостоянную температуру по вечерам в пределах 37,1–38 градусов. Но уже в этот период у некоторых больных можно обнаружить небольшое увеличение лимфатических узлов, селезенки. В анализе крови тоже будут изменения — повышение или снижение количества лейкоцитов, анемия.
Лейкоз может проявляться разнообразными симптомами. При острой форме пациенты могут жаловаться, что стали часто простывать, у них возникли инфекционные осложнения или синяки на теле, а кого-то будет беспокоить резкая потеря веса, появление шишек на теле или увеличение лимфоузлов.
Симптомы лейкоза неспецифичны, они таковы:
- слабость;
- головокружения;
- высокая температура без явных на то причин;
- боли в руках и ногах;
- кровотечения.
При замещении патологически размножающимися лейкоцитами других клеток крови на первое место выходят анемии и кровотечения из-за уменьшения числа других клеток крови — эритроцитов и тромбоцитов. Из-за накопления лейкоцитов в лимфоузлах, печени или селезёнке эти органы могут увеличиться, но обнаружить эти симптомы уже может только врач.
При лейкозе субстратом опухоли является костный мозг, который находится во всех трубчатых и плоских костях. Здесь же развиваются предшественники крови: эритроциты, лейкоциты и тромбоциты. Когда в ткани начинают развиваться опухолевые клетки, места для нормальных здоровых клеток крови просто не остается. Если в случае с раком желудка пораженный участок можно удалить, вовремя провести химиотерапию и добиться длительной ремиссии, то при раке крови такая тактика не приемлема.
Есть формы острого лейкоза, которые могут развиваться с первых дней жизни человека. Хроническим формам лейкоза подвержены люди старшего возраста. Чем моложе возраст, тем агрессивнее протекает болезнь, но при современных методиках лечения больной может жить до 5–7 лет. На течение хронического миелолейкоза (и это научно доказано) большое влияние оказывает состояние нервной системы больного — если есть стрессы, депрессии, люди сгорают буквально на глазах.
Лечение лейкоза — это достаточно длительный процесс. В среднем на достижение ремиссии при острых лейкозах уходит от 3 месяцев до 2–3 лет.
Первый и самый сложный этап в лечении острого лейкоза — это интенсивная химиотерапия, с помощью которой мы должны убить опухолевые клетки. Пациенты должны находиться в специальном асептическом блоке, в котором созданы стерильные условия, чтобы исключить их контакт с любой инфекцией. Больные в этот момент не имеют никаких собственных факторов защиты, потому что кроветворение у них пострадало от самой болезни и применяемых химиопрепаратов. Для закрепления результатов терапии после этапа восстановления (или поддержки ремиссии) принимается решение о необходимости трансплантации костного мозга.
Пересадку можно делать, если пациента ввели в ремиссию. Она бывает двух видов: аутотрансплантация, когда пересаживается костный мозг самого больного, и аллотрансплантация, в этом случае ткани забирают у донора.
В первом случае у пациента из вены берется периферическая кровь, из нее при помощи сепаратора извлекают стволовые клетки, консервируют и передают на хранение в банк. Затем пациенту проводят сильнейшую химиотерапию, а следом проводят пересадку — так же, через вену, вводят стволовые клетки, и они начинают творить новое потомство. Технически это выглядит как переливание крови. Пересадка может быть сделана и при хроническом лейкозе.
Аллотрансплантация дает хорошие результаты, если доноры — родные сестра или брат, у них самый близкий фенотип. Пересадка даже от двоюродных родственников не всегда бывает столь успешна, но все равно это шанс на то, что человек будет жить.
Лучшие доноры костного мозга — это мужчины в возрасте 30–40 лет, семейные, имеющие постоянное место работы. Желательно — на промышленном производстве, на заводах. Практика показывает, что именно такие люди относятся к донорству с наибольшей ответственностью.
Женщина тоже может стать донором костного мозга. Но здесь важно учесть, что после родов и беременностей в крови у женщин циркулируют антитела, и их лейкоциты уже настроены бороться с чужеродными антигенами. Поэтому результат пересадки может оказаться хуже.
40 и 80. Две цифры.
Первая – известие, к которому невозможно оказаться готовым. Отчаяние. Страх. Крушение. Для таких коннотаций 40% – это очень и очень много. Это почти половина.
Вторая – вероятность успешного исхода. Победа. Выздоровление. Жизнь. И для этих значений 80% – это тоже очень много (и вообще очень хотелось бы, чтобы было все 100).
Что это за цифры?
80% – именно на столько увеличивает шансы на благоприятный исход обнаружение первых симптомов рака крови. Если выявить болезнь на ранних стадиях, то шансы ее победить очень и очень высоки.

Мне могут возразить, что результативность любого лечения зависит от быстроты обнаружения болезни. Я отвечу, что в случае с лейкозом это особенно важно. Потому что лейкоз очень трудно распознать из-за неспецифичных признаков.
Беда в том, что точных причин возникновения и способов профилактики лейкоза фактически не существует. На сегодняшний день так до конца и неизвестно, что именно вызывает сбой работы костного мозга и почему начинают бесконтрольно вырабатываться незрелые клетки крови. Как заранее предотвратить этот сбой, современная медицина тоже пока не знает. И к тому же симптоматика лейкоза очень размыта.
Это значит, что лейкоз практически нельзя прогнозировать. Это также значит, что нельзя просто взять и проделать какую-то последовательность действий, чтобы не допустить болезнь. А еще это значит, что лейкоз достаточно сложно диагностировать. В общей сложности это значит, что любой ребенок в возрасте до 14 лет находится в зоне риска.
И все-таки мы что-то можем. Мы можем предупредить. Рассказать о том, что существуют определенные нюансы здоровья ребенка, которые могут оказаться первыми возможными симптомами злокачественного заболевания крови. Нюансы, которым родители часто не придают значения, или принимают за свидетельства других, гораздо менее опасных заболеваний.
Мы можем заострить внимание родителей на малоприметных симптомах, определенное сочетание которых может свидетельствовать о том, что в организме уже что-то пошло не так, но шансы на благоприятный исход лечения все еще очень высоки.

Как работает наш проект. Пользователь сайта может пройти онлайн-тест о том, на что нужно обращать внимание в первую очередь. По итогам родитель получает рекомендации, нужно ли срочно обращаться к педиатру или признаков для беспокойства нет.
Все, кажется, просто. Но вместе с тем сложно.
В течение года мы проводили исследование, чтобы понять, как люди реагируют на информацию нашего проекта. Мы замеряли важность, актуальность, полезность такой информации, исследовали, что у нас получилось, а что нужно было бы доработать. Мы изучали причины, по которым время может быть упущенным.
Мы поняли, как важно рассказать о первых, именно первых, симптомах – об этом мало, кто знает и информирует. А надо!
Мы поняли, что важно обратить внимание родителей на то, что может показаться незначительным, а значит остаться незамеченным.

Человеку не свойственно думать о том, что с ним или с его близкими может что-то произойти. Беспечность? Я думаю, нет, тут другое. Обыденное и естественное. Понятное и невинное. Мы просто не хотим плохих новостей.
Мы не хотим, чтобы нас что-то сбило с привычного ритма жизни, расстроило, ранило, лишило надежды. Убило. Мы так хотим, чтобы все было хорошо. Простое человеческое желание. Естественное и беззащитное. Ну правда, почему если чему-то суждено случиться, то непременно со мной? Нам свойственно бояться. Нам свойственно самообманываться.
Вопрос ранней диагностики онкологических заболеваний — принципиально важный. Ведь от этого зависит и успех лечения. Известно, что опухоли, обнаруженные на ранних этапах, более успешно устраняются, а выживаемость пациентов в этом случае существенно вырастает. Причем прогнозы по дальнейшей жизни в ремиссии достаточно высокие, если заболевание рано обнаружено и быстро ликвидировано доступными современным онкологам методами.

Отвечает главный врач медицинского центра, эндокринолог, онколог, хирург Вадим Колосюк:
— Тут однозначного ответа нет. Наверное, вопрос о том, какой рак диагностировать сложнее всего, звучит не совсем корректно. Тут, скорее, надо говорить о том, какие опухоли труднее распознать на ранних стадиях, начальных этапах, когда лечение было бы более успешным.
Вообще опухоли делятся на две группы — наружной и скрытой локализации. К скрытой относятся очень часто опухоли, которые трудно, практически невозможно диагностировать на ранних этапах. Это рак легкого, желудка и толстой кишки. Они лидируют в структуре заболеваемости, их рано найти сложно. Как правило, такие онкологические заболевания обнаруживаются лишь на поздних стадиях, когда уже есть какие-то симптомы. Для легкого, например, есть такой вариант скрининга, как флюорография. Но опухоли легкого делятся на центральные и периферические. Вторые встречаются, к сожалению, реже, при этом они легко диагностируются на флюорографии. А вот если говорить про центральные, то тут сложнее, так как они ползут по большим бронхам и их практически не видно при обследовании, соответственно, диагностировать тяжело. Для рака желудка и кишки также нет ранних методов. Потому что желудок мы обследуем преимущественно методом ФГДС (гастроскопии), а кишечник — посредством колоноскопии. Но всем подряд такие исследования не назначают и не делают. Поэтому такие варианты рака либо случайно выявляют, либо когда уже появились свои характерные симптомы — боли, кровянистые выделения, потеря веса и прочие признаки.

Есть сомнения у людей по поводу простой диагностики рака крови. Строго говоря, по терминологии это не рак, потому что рак — это образование из эпителиальных клеток. Раки крови называют лейкозами, это системное заболевание, когда самой собственно опухоли нет. При этом я бы тоже не сказал, что лейкозы сложно диагностировать. Во-первых, банальный анализ крови дает диагноз, а во-вторых, эти опухоли весьма агрессивны, они бурно развиваются, довольно быстро проявляют себя. Допустим, в качестве симптомов могут быть резкое снижение иммунитета, очень сильная анемия.
Если говорить про опухоли наружной локализации, их обнаруживать проще. Самыми распространенными называют рак молочной железы у женщин и простаты у мужчин. Здесь проще, потому что женщинам назначают ежегодно маммографию, мужчины простату также обследуют относительно часто. Так что в этих случаях вполне возможно на ранних стадиях выявить заболевание.
Распад опухоли — это закономерное следствие слишком активного роста ракового узла по периферии или осложнение избыточно высокой реакции распространённого злокачественного процесса на химиотерапию.
Не каждому пациенту доводится столкнуться с тяжелой проблемой распада ракового процесса, но при любой интенсивности клинических проявлений инициируемое распадом злокачественной опухоли состояние непосредственно угрожает жизни и радикально меняет терапевтическую стратегию.

Распад опухоли: что это такое?
Распад — это разрушение злокачественного новообразования, казалось бы, что именно к распаду необходимо стремиться в процессе противоопухолевой терапии. В действительности при химиотерапии происходит уничтожение раковых клеток, только убийство органичное и не массовое, а единичных клеток и небольших клеточных колоний — без гибели большого массива ткани с выбросами в кровь из распадающихся клеток токсичного содержимого.
Под действием химиотерапии клетки рака приходят не к распаду, а к процессу апоптоза — программной смерти. Останки раковых клеток активно утилизируются фагоцитами и уносятся прочь от материнского образования, а на месте погибших возникает нормальная рубцовая ткань, очень часто визуально не определяющаяся.
Регрессия злокачественного новообразования в форме апоптоза происходит медленно, если наблюдать за новообразованием с перерывами в несколько дней, то заметно, как по периферии раковый узел замещается совершенно нормальной тканью и сжимается в размере.
При распаде раковый конгломерат не замещается здоровыми клетками соединительной ткани, мертвые клеточные пласты формируются в очаг некроза, отграничивающийся от остальной раковой опухоли мощным воспалительным валом. Внутри злокачественного новообразования некроз не способен организоваться и заместиться рубцом, он только увеличивается, захватывая новые участки ракового узла, походя разрушая опухолевую сосудистую сеть. Из мертвого очага в кровь поступают продукты клеточного гниения, вызывая интоксикацию.
Массированный выброс клеточного субстрата становится причиной тяжелейшей интоксикации, способной привести к смерти.
Причины распада злокачественной опухоли
Инициируют распад ракового образования всего только две причины: сама жизнедеятельность клеток злокачественной опухоли и химиотерапия.
Первая причина спонтанного — самопроизвольного распада характерна для солидных новообразований, то есть рака, сарком, злокачественных опухолей головного мозга и меланомы. Вторая причина распада типична для онкогематологических заболеваний — лейкозов и лимфом, при онкологических процессах встречается чрезвычайно редко.

Второй вариант распада, типичный для онкогематологических заболеваний, можно констатировать по клиническим симптомам тяжелейшей интоксикации с осложнениями — тумор-лизис-синдрому (СОЛ) и биохимическим анализам крови, где резко повышена концентрация мочевой кислоты, калия и фосфора, но существенно снижен кальций. Конкретная побудительная причина для развития СОЛ — обширное злокачественное поражение с очень высокой чувствительностью к химиотерапии.
При онкологических процессах — раках, саркомах, меланоме реакция на цитостатики преимущественно умеренная и не столь стремительная, поэтому СОЛ принципиально возможен только в исключительных случаях мелкоклеточного, недифференцированного или анаплазированного злокачественного процесса.
Симптомы распада злокачественной опухоли
Клиническим итогом спонтанного распада раковой опухоли становится хроническая интоксикация, нередко сочетающаяся с симптомами генерализованного воспаления вследствие образования гнойного очага. Симптомы разнообразны, но у большинства отмечается прогрессивно нарастающая слабость, повышение температуры от субфебрильной до лихорадки, сердцебиение и даже аритмии, изменение сознания — оглушенность, нарушение аппетита и быстрая потеря веса.
Локальные проявления спонтанного разрушения раковой опухоли определяются её локализацией:
- рак молочной железы, меланома и карцинома кожи, опухоли ротовой полости — гнойная, обильно секретирующая открытая язва с грубыми подрытыми краями, часто источающая гнилостный запах;
- распадающаяся карцинома легкого — при прободении некротической полости в крупный бронх возникает приступообразный кашель с гнойной мокротой, нередко с прожилками крови, иногда случается обильное легочное кровотечение;
- разрушение новообразования органов желудочно-кишечного тракта — развитие локального перитонита при прободении ракового конгломерата в брюшную полость, кровотечение с чёрным стулом и рвотой кофейной гущей;
- распадающаяся карцинома матки — интенсивные боли внизу живота, нарушение мочеиспускания и дефекации при образование гнойных свищей.
Синдром опухолевого лизиса при лейкозах и лимфомах потенциально смертельное состояние, приводящее:
- в первую, очередь к осаждению кристаллов мочевой кислоты в почечных канальцах с выключением функции и острой почечной недостаточностью;
- дополнительно повреждает почки быстрое закисление крови — лактатацидоз;
- снижение уровня кальция и повышение фосфатов инициирует судорожный синдром, дополняемый неврологическими проявлениями вследствие выброса цитокинов;
- повышения калия негативно отражается на сердечной деятельности;
- выброс биологически-активных веществ из клеток приводит к повышению проницаемости мелких кровеносных сосудов, что снижает уровень белков и натрия крови, уменьшает объем циркулирующей плазмы, клинические проявляется падением давления и усугублением поражения почек;
- обширные и глубокие нарушения метаболизма во всех системах органов с исходом в полиорганную недостаточность.
Лечение распада опухоли
Формально при распадающейся опухоли невозможна радикальная операция, зачастую заболевание считается неоперабельным, но химиотерапия и облучение исключаются из программы, потому что способны усугубить некроз. Отчаянное положение пациента и вероятность массированного кровотечения из изъеденного раком крупного сосуда оправдывает выполнение паллиативной операции, основная цель которой — удаление очага хронического воспаления и интоксикации.
Синдром лизиса опухоли лечится многочасовыми капельными вливаниями при усиленном диурезе — выведении мочи, связыванием мочевой кислоты специальными лекарствами. Одновременно поддерживается работа сердечно-сосудистой системы, купируется интоксикация и воспаление. При развитии острой почечной недостаточности проводится гемодиализ.
Синдром лизиса опухоли сложно лечить, но можно предотвратить или хотя бы уменьшить его проявления. Профилактика начинается за несколько дней до курса химиотерапии и продолжается не менее трёх суток после завершения цикла. Кроме специальных препаратов, выводящих мочевую кислоту, назначаются продолжительные капельницы, вводятся недостающие микроэлементы, а избыточные выводятся или связываются другими лекарствами.
Профилактика лизиса опухоли стала стандартом лечения онкогематологических больных, чего нельзя сказать об онкологических пациентах с распадающимися злокачественными процессами, которым очень сложно найти хирурга, готового выполнить паллиативную операцию. Во вмешательстве по санитарным показаниям отказывают из-за сложности выхаживания тяжелого больного после обширного хирургического вмешательства. В нашей клинике никому не отказывают в помощи.
Читайте также:

