Скрининговые программы для выявления рака яичников
Рак яичников часто протекает бессимптомно и выявляется на поздних стадиях, когда опухоль распространяется на соседние анатомические структуры и другие органы. Диссеминированный (распространённый) процесс нельзя устранить радикально, он часто не поддаётся консервативной терапии и имеет неблагоприятный прогноз. Поэтому ранняя диагностика и лечение рака яичников является приоритетным направлением в современной онкогинекологии.
похожее по теме
Рак яичников у женщин
С чего начинается диагностика рака яичников
Чтобы провести правильный комплекс мероприятий по выявлению новообразований в женских половых органах, следует обратиться к врачу. Именно ежегодное посещение гинеколога считается лучшей профилактикой рака яичников. Только доктор, проведя беседу и осмотр, сможет назначить необходимые для каждой конкретной женщины обследования.
Собрав жалобы и анамнез, врач относит пациентку к определённой группе риска. После тщательного гинекологического осмотра в зеркалах с забором стандартных мазков специалист даст направления на дополнительные исследования. Оценив все их результаты в комплексе, доктор сможет выставить предварительный диагноз. Для подтверждения злокачественной природы новообразования обязательно проводится морфологический анализ 1 .
Лабораторная диагностика при раке яичников
Диагностика рака яичников у женщин включает в себя стандартные лабораторные тесты (общий анализ мочи, общий анализ крови, биохимия, коагулограмма). Они не будут являться специфичными для данной патологии. Однако, с их помощью врач сможет оценить общее состояние пациентки и наличие сопутствующих заболеваний, что особенно важно при планировании дальнейшего лечения (операция, химиотерапия).
- рак молочной железы;
- кровные родственники с аналогичными генными мутациями или злокачественными опухолями репродуктивной системы;
- отягощённая общая онкологическая наследственность (трое и более кровных родственников умерли от злокачественной патологии).
При наличии определённых мутаций, развитие рака яичников случается на 11-49% чаще, чем в общей популяции 2 . Поэтому при выявлении генетических изменений, женщина определяется в группу риска и подлежит взятию на учёт. Она каждые 6 месяцев посещает гинеколога и проходит комплексное обследование.
В комбинации с другими диагностическими методами обязательно проверяется уровень онкомаркеров в крови. В зависимости от гистологического типа опухоли будут иметь значение следующие анализы:
- СА-125 (является основным маркером при раке яичников);
- РЭА (раковый эмбриональный антиген);
- СА19-9 (характерен для муцинозной карциномы);
- НЕ-4 (кислый гликопротеин);
- АФП (альфа-фетопротеин);
- ингибин В;
- ХГЧ (человеческий хорионический гонадотропин).
Три последних показателя часто повышаются при росте неэпителиальных овариальных образований. В последние годы учёные доказали роль более 30 специфических онкологических маркеров в ранней диагностике злокачественных опухолей яичников, которые также могут быть определены при изучении венозной крови пациентки (мезотелин, остеопонтин, TPAcyk и другие).
При первичной диагностике определение онкомаркеров всегда проводится в комплексе с другими исследованиями и не является строго специфичным методом. Важное значение этот тест приобретает для оценки результативности проводимого лечения и выявления рецидивов 3 .
Функциональная диагностика при раке яичников
Инструментальные методы диагностики рака яичников включают в себя:
- УЗИ органов репродуктивной системы;
- КТ органов малого таза;
- МРТ;
- лапароскопию.
При наличии признаков метастазирования могут быть назначены дополнительные исследования (КТ лёгких, сонография органов брюшной полости, маммография, колоноскопия и т. д.). Материал для гистологического исследования может быть взят во время диагностической лапароскопии или получен после удаления новообразования.
Методы лечения раннего рака яичников
Ранним раком яичников можно считать только первую стадию процесса. При второй стадии уже имеется распространение злокачественных клеток на органы и ткани малого таза. Радикально прооперировать пациентку удаётся только при условии, что капсула яичника не повреждена, и опухоль локализуется внутри органа. Помимо хирургического вмешательства, в лечении раннего рака яичников могут быть использованы консервативные методики. Часто улучшить результат позволяет послеоперационный курс химиотерапии.
В остальных случаях выбор лечебной тактики будет зависеть от многих факторов (один очаг или несколько, гистологический тип образования, возраст пациентки, наличие симптомов сопутствующей патологии и т. д.). При 2 стадии преимущественно назначается комплексное лечение, включающее в себя химиотерапию, таргетные препараты, операцию и облучение.
При наличии метастазов в лимфоузлах и отдалённых органах показана консервативная специфическая и симптоматическая терапия. Также по показаниям проводят циторедуктивные вмешательства (максимальное удаление имеющихся очагов).
Поскольку разные опухоли яичников обладают сходной клинической картиной, диагноз раннего рака яичников (РЯ) скорее дело случая, а не триумф научного метода. Увеличение яичника вызывает прогрессирующую компрессию тазовых структур с неопределенным дискомфортом в животе, диспепсией, учащенным мочеиспусканием и чувством давления в тазу. Незаметное начало рака яичников (РЯ) не позволяет идентифицировать специфические симптомы. Когда опухоль достигает 15 см в диаметре, отмечается незначительное увеличение живота. Поскольку заболевание протекает скрыто, без патогномоничных ранних симптомов, пациенткам следует рекомендовать обращать внимание на минимальные изменения самочувствия.
Цитологическое исследование аспирата из прямокишечно-маточного углубления и частое гинекологическое исследование не влияют на раннюю диагностику заболевания. Опухоли яичников растут быстро и безболезненно, любое длительно существующее объемное образование служит показанием коперации. Точныйдиагноз устанавливают только на основании морфологического исследования; тяжесть заболевания не зависит от размера опухоли. Некоторые самые большие опухоли — доброкачественные, чаще всего это муцинозные цистаденомы. Кроме того, многие объемные образования в проекции придатков матки не исходят из яичников. Как правило, они связаны с дивертикулитом, тубоовариальным абсцессом, раком слепой или сигмовидной кишки, тазовой дистопией почки, субсерозными, интрамуральными и интралигаментарными миомами.
Во время операции иногда трудно дифференцировать злокачественные и доброкачественные опухоли яичников. Значительное совпадение морфологических критериев злокачественных новообразований этой локализации представляет определенные диагностические трудности. Точный диагноз устанавливают только на основании гистологического исследования удаленного препарата. Ошибочные результаты срочного гистологического исследования получают в 5 % случаев.
Остается надеяться, что иммунологическая диагностика субклинического рака яичников (РЯ) по специфическим опухолевым антигенам сыворотки — дело недалекого будущего. К настоящему времени обнаружили и выделили несколько опухоль-ассоциированных антигенов, включая СА-125. Достоверность современного изучения структуры белковых фрагментов у больных РЯ нуждается в подтверждении при проведении исследований с большим количеством пациенток.

Для ранней диагностики рака яичников (РЯ) и исключения скрытого заболевания каждой женщине необходимо регулярно проходить исследование у гинеколога, УЗИ органов таза и определение уровня СА-125. Но при этом подсчитали, что для выявления 1 случая раннего рака яичников (РЯ) в популяции пациенток без клинических симптомов необходимо провести 10 000 бимануальных исследований. Jacobs и соавт. провели скрининг СА-125 у 22 000 женщин в постменопаузе старше 45 лет, средний период наблюдения составил 6,76 года. Выявили 49 случаев РЯ и рака маточных труб: 16 (32 %) — 1 стадии, 4 — II, 22 — III, 7 — IV стадии. В этой группе в 1180 (2,5 %) образцах из общего количества 47 775 образцов у 767 (3,5 %) женщин концентрация СА-125 составляла 30 ед./мл.
Специфичность и прогностическая ценность положительного результата равнялись 96,6 и 3,1 % соответственно. Чувствительность 1-и 7-летнего наблюдения составляла 75 и 57 % соответственно. Только у 49 (6,3 %) женщин с повышенным уровнем СА-125 (16 %) обнаружили рак яичников (РЯ), что составляет 0,0022 % всех участниц скринингового обследования. Отметим, что скрининг рака яичников (РЯ) с определением СА-125 не организован для всех женщин в постменопаузе. Продолжая контроль над этими 22 000 женщинами, Jacobs разделил их на две группы: проходящие ежегодный скрининг в течение 3 лет и находящиеся под наблюдением.
В группе ежегодного скрининга выявили 6 случаев рака яичников (РЯ), поровну I и III стадии; при этом у 468 женщин с повышенным уровнем СА-125 выполнено 781 УЗИ, 29 диагностических лапаротомий и получено 80 % ложноположительных результатов. При последующем наблюдении после скрининга дополнительно выявили 10 случаев рака, из них 8 — III и IV стадий. В группе наблюдения (без скрининга) впоследствии диагностировали 20 случаев рака, из них 8 — III и IV стадий. Хотя в группе скрининга шанс ранней диагностики был выше, общее число случаев оставалось низким, что отражает уровень заболеваемости. Как уже отмечали раньше, определение СА-125 в качестве скринингового теста, особенно у женщин в пременопаузе, не представляется эффективным методом обнаружения рака яичников (РЯ). Концентрация СА-125 увеличена при многих доброкачественных процессах и злокачественных опухолях ЖКТ. Особое внимание для скрининга раннего рака яичников (РЯ) привлекает ультрасонография.
Herrmann сравнил результаты УЗИ у 312 пациенток, полученные до хирургического лечения, с данными из протоколов операций и установил, что прогностическая ценность метода составляет 73 %.

Campbell и соавт. сообщили о ранней диагностике 5 случаев первичного рака яичников (РЯ) при УЗИ органов брюшной полости примерно у 5000 пациенток. Трансвагинальное УЗИ повышает не только точность диагностики объемных образований придатков, но и стоимость обследования, особенно когда речь идет о длительном наблюдении женщин с увеличенными яичниками. Группа специалистов из Кентукки провела трансвагинальные УЗИ в большой группе женщин в постменопаузе, а также у более молодых, если у них были указания в семейном анамнезе на наличие рака яичников (РЯ) (24 %). Скрининг провели 6470 женщинам, выполнив 14 829 УЗИ; у 90 пациенток выявили персистирующие образования при трансвагинальном УЗИ и провели хирургическое лечение. Обнаружено 6 первичных злокачественных опухолей яичников (пять I стадии и одна — III ), из них только в 4 случаях выявлен эпителиальный рак.
Чувствительность метода составила 0,857, специфичность — 0,987, прогностическая ценность положительного результата — только 0,069, а отрицательного — 0,999.
Одно из возможных направлений улучшения эффективности скрининга рака яичников (РЯ) — обследование пациенток из группы повышенного риска, например с семейным анамнезом заболевания. Bourne и соавт. сообщили о результатах наблюдения за 1601 женщиной с применением трансвагинального УЗИ, цветного допплеровского картирования и морфологического исследования. Повторное трансвагинальное УЗИ для подтверждения диагноза объемного образования выполнено у 57 % пациенток, РЯ диагностировали в 6 случаях (2 — I стадии, 3 — низкой степени злокачественности, 1 — III стадии). Karlan и соавт. провели скрининг у 597 пациенток с семейный анамнезом рака яичников (РЯ): определение уровня СА-125, трансвагинальное УЗИ и цветное допплеровское сканирование. Первоначально при выполнении трансвагинального УЗИ у 115 пациенток обнаружили патологию, а у 68 — повышенный уровень СА-125.
По результатам цветного допплеровского исследования и повторного трансвагинального УЗИ 19 женщинам выполнили операцию и обнаружили только одну опухоль низкой степени злокачественности.
Bell и соавт. проанализировали 25 скрининговых исследований рака яичников (РЯ): в 16 участвовали женщины со средним риском и в 9 — с высоким. Во многих исследованиях былоо малое число обследованных женщин с неточным соблюдением методики; в немногих отражены детали наблюдения. В ряде исследований применяли один метод скрининга, в других — несколько. В группе пациенток со средним риском 75 % случаев первичного рака приходилось на I стадию, если использовали только УЗИ, и 50 %, если применяли несколько методов скрининга.

*ЧАМА — человеческие анти-мышиные антитела
При высоком риске во время скрининга выявили 60 % опухолей I стадии, но после исключения новообразований низкой степени злокачественности этот показатель снизился до 25 %. В популяции высокого риска количество ложноотрицательных результатов было выше.
Такой уровень ложноотрицательных результатов в популяции с ежегодной заболеваемостью 40 случаев на 100 000 женщин означает, что при каждом случае рака, выявленного с применением ежегодной эхографии по серой шкале, выполняют 30 — 60 операций (предполагая 100%-ю чувствительность), а при использовании мультимодального скрининга — 2,5—15 вмешательств. Даже при выявлении рака яичников (РЯ) благодаря скринингу и лечению всех случаев рака яичников (РЯ) со 100%-м успехом абсолютное снижение смертности составит всего 1 случай на 2500 женщин, прошедших скрининг в течение года. Это намного меньше числа осложнений от ненужных диагностических операций и избавляет от необходимости многократного повторения диагностических тестов.
Несмотря на проведенные рандомизированные клинические испытания, пока нет надежных данных о том, что скрининг рака яичников (РЯ) эффективно улучшает продолжительность и качество жизни пациенток. Другой путь повышения чувствительности и специфичности скрининга рака яичников (РЯ) состоит в определении нескольких маркеров опухоли, поскольку СА-125 повышен менее чем у 50 % больных раком яичников (РЯ) I стадии. В то время как исследования в этом направлении не увенчались успехом, недавние достижения в протеомике (область науки, изучающая белки и их взаимодействия в организме) вселяют надежду на открытие нового, более эффективного метода скрининга рака яичников (РЯ). Эти биомаркеры можно использовать при выборе метода лечения и прогнозировании его эффективности.
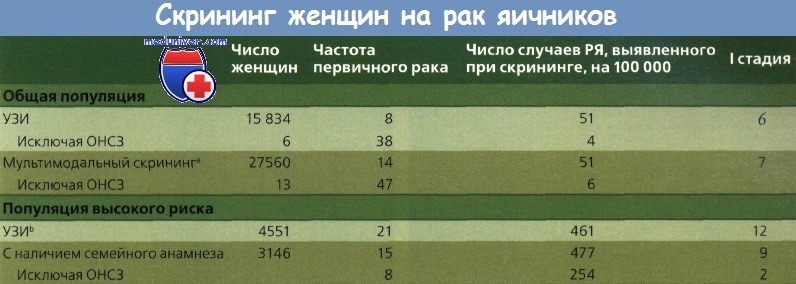
a Кроме УЗИ определяли также уровень СА-125.
b С определением уровня СА-125 или без него.
ОНСЗ - опухоли низкой степени злокачественности.
Выводы National Institutes of Health Consensus Development Conference поданным скрининга РЯ за 1994 г. представлены ниже.
До настоящего времени отсутствуют данные об эффективном использовании определения СА-125 и трансвагинального УЗИ для скрининга с целью снизить заболеваемость и смертность от рака яичников (РЯ). Стандартный скрининг приводит к выполнению ненужных операций с сопутствующими осложнениями. Необходимо разработать действенные методы скрининга рака яичников (РЯ), включая способы визуализации опухолей, оценить их эффективность в клинических исследованиях и продолжить поиск дополнительных маркеров. Если при наличии родственницы первой степени родства с РЯ (риск заболевания 5 %) женщина не может участвовать в клинических исследованиях, то ей, несмотря на отсутствие проспективных убедительных данных об эффективности скрининга, необходимо самой оценить имеющийся риск заболевания и пройти скрининговое обследование. Такой вариант женщина должна обсудить со своим врачом.
Удаление яичников во время операции на органах таза практически полностью устраняет риск рака яичников (РЯ), хотя остается минимальный риск канцеромато-за брюшины. У женщин в пременопаузе важно вначале обсудить заместительную терапию эстрогенами, поскольку при отсутствии лечения у молодых пациенток риск сердечно-сосудистых заболеваний и остеопороза может превышать риск сохранения яичников и развития рака.
Крайне сложно выявить опухоль в придатках матки на ранних стадиях. Предварительная диагностика рака яичников включает все методы визуализации, но поставить точный диагноз можно только во время операции и по результатам гистологии.

Символ борьбы с онкологией яичников
Скрининг
К сожалению, только в 30% случаев злокачественное новообразование в области придатков матки выявляется на ранних стадиях. Диагностика рака яичников затруднена из-за технической сложности и отсутствия эффективного скрининга. Нет ни одной методики, которая могла бы гарантировать раннее выявление опухолевого роста. Из малоэффективных методов чаще всего применяются:
- Ультразвуковая эхография;
- Анализ на онкомаркер CA-125.
Заподозрить опасную болезнь при УЗИ можно – наличие кистозного новообразования любых размеров с сосочковыми разрастаниями в полости является веским основанием для проведения полноценного обследования. Особенно если значительно увеличен результат онкомаркера.
Диагностика рака яичников
Обнаружение при УЗИ в области придатков матки кистозной опухоли вовсе не является обязательным признаком злокачественного новообразования. Но и кажущаяся обычной киста – это не основание для отказа от онконастороженности. Помимо сонографии и анализа на онкомаркер, необходимо сделать следующие исследования:
- Томография с контрастированием (КТ, МРТ);
- Рентгеновские снимки легких (для исключения метастазов);
- Фиброгастроскопия (ФГС) для исключения первичного рака желудка, метастаз из которого может стать причиной появления кисты в яичнике;
- Ирригоскопия (оценка состояния кишечника и выявление сдавления полого органа кистомой);
- Лапароскопия с взятием биопсии.
Только врач-гистолог в лаборатории сможет четко диагностировать карциному. А до этого момента считается, что любая кистома яичника – это потенциально возможный рак. Хирургическое вмешательство решает 2 задачи: помогает поставить точный диагноз и становится лечебным мероприятием. Если будет доброкачественный процесс, то хирургически удаленная киста станет оптимальным объемом операции. При обнаружении злокачественного перерождения врач предложит расширенное онкохирургическое вмешательство. При обоснованном подозрении на карциному нельзя делать эндоскопическую операцию (лапароскопию). Только полноценная лапаротомия с обязательной проверкой всех внутренних органов, оценкой лимфатических узлов и хирургическим удалением первичного очага.
Бессимптомность и скрытность протекания болезни являются основными факторами позднего обнаружения яичниковой карциномы. Скрининг и диагностика рака яичника должны проводиться всем женщинам, имеющим наследственную предрасположенность, факторы риска по онкологии и рецидивирующую кистому в придатках матки, даже если нет никаких признаков рака яичников.
Статья опубликована на канале Яндекс.Дзен Onkos
- Главная
- Новости
- Масштабная программа по раннему выявлению онкологических заболеваний.
Что такое программа скрининга?
Скрининг - это массовое обследование населения, направленное на выявление групп риска к тому или иному заболеванию, либо его наличия на ранних стадиях – широко распространенная в мире практика. Такой подход широко распространен в мире и особенно важен в случаях, когда своевременное диагностирование заболевания имеет решающее значение для успешного лечения, например, в онкологии.
В настоящее время научно подтверждена эффективность скрининговых программ по раннему выявлению рака молочной железы, яичников и рака предстательной железы. Диагностика проводится с помощью лабораторных исследований крови людей групп риска. Применительно к этим заболеваниям это женщины всех возрастов и мужчины старше 40 лет.
Кто осуществляет программу скрининга?
Департамент здравоохранения города Москвы и Московский клинический научный центр им. С.А. Логинова ДЗМ.
Когда?
Каждую субботу с 07 июля по 22 сентября 2018 года
Время – с 8.00 до 14.00
Где осуществляется программа скрининга?
Какие анализы можно сдать?
Женщины любого возраста (старше 18 лет) могут сдать анализ крови на наличие предрасположенности к раку молочной железы и раку яичников (BRCA1, BRCA2). Мужчины старше 40 лет – анализ ПСА (PSA) на наличие признаков рака предстательной железы (простаты).
Зачем это делать?
Рак молочной железы, рак яичников у женщин и рак предстательной железы у мужчин относятся к числу наиболее распространенных онкологических заболеваний. При этом выявление этих видов рака на начальной стадии дает возможность полного излечения. Наиболее эффективным способом установить предрасположенность к этим видам рака, либо наличие их признаков является анализ крови на наличие мутаций генов BRCA1 и BRCA2 (от английского BReast CAncer – рак молочной железы) и ПСА (PSA) - простатический специфический антиген, повышенный уровень которого говорит о вероятном развитии рака простаты.
Что включает в себя диагностика?
Диагностика на выявление факторов предрасположенности к онкологическим заболеваниям – раку простаты для мужчин, раку молочной железы и раку яичников для женщин – проводится с помощью анализа венозной крови. Анализ выполняется БЕСПЛАТНО квалифицированным медицинским персоналом медицинских организаций государственной системы здравоохранения Москвы с соблюдением всех санитарно-гигиенических требований.
Как это будет происходить?
Для сдачи анализа необходимо иметь при себе паспорт и дать согласие на обработку персональных данных (представить достоверный способ обратной связи). Анализ осуществляется путем забора крови из вены.
Как подготовиться к анализам?
Женщины: анализ крови на BRCA1 и BRCA2 (определяет риск развития рака молочной железы и рака яичников) не требует предварительной подготовки.
Мужчины: анализ крови ПСА на наличие предрасположенности к раку предстательной железы:
За два дня до проведения анализа желательно отказаться от половой активности.
За полчаса до забора крови нужно исключить физическое перенапряжение.
Помните: несоблюдение рекомендаций может исказить результаты исследования!
Гарантирована ли точность результатов?
Для получения максимально точных данных скрининговое исследование будет проводиться по стандартизованной процедуре с соблюдением современных требований. Это позволит исключить влияние случайных факторов на результаты анализов.
Лабораторные исследования будут проводиться на одном типе оборудования, с использованием одних и тех же реагентов и при строгом соблюдении регламентных процедур по контролю качества на всех этапах технологического процесса.
Как будут проводиться исследования крови после сдачи анализа?
Технологическими возможностями выполнения больших объемов исследований при массовом обследовании населения обладают только крупные лаборатории, оснащенные полностью автоматизированным оборудованием, использующие современные информационные технологии для обработки полученных данных и способные выполнять скрининговые тесты в автоматическом режиме.
Такие лаборатории есть в медицинских организациях Департамента здравоохранения города Москвы.
Как долго ждать результатов анализов?
Время проведения исследования может занять до 1 месяца, потому что именно при скрининговых лабораторных обследованиях обработка полученных результатов занимает достаточно продолжительное время.
Результаты будут сообщены по указанному адресу электронной почты или (по желанию) в поликлинику по месту прикрепления.
Конфиденциальность полученной личной информации и полученных результатов анализов обеспечивается в соответствии действующим законодательством.
Что делать после получения результатов?
В случае, если результаты исследования покажут отклонения от нормы, пациент будет приглашен на консультацию в поликлинику (мужчины) или Клинику женского здоровья Московского клинического научного центра им. С.А. Логинова ДЗМ (женщины).
Помните: выявление онкологических заболеваний на ранних стадиях дает высокую вероятность полного излечения!


В техническом переоснащении существуют свои приоритеты. В онкологии ими являются радиология, радионуклидная диагностика, развитие позитронной эмиссионной томографии (ПЭТ). Сейчас ее не хватает онкологам для постановки диагноза и правильного лечения.


Чаще всего говорят о томографах - о том, что их должно быть достаточно. На самом деле их и сейчас немало: только в медучреждениях Минздрава России почти 700 магнитно-резонансных томографов и две тысячи компьютерных. Но сегодня основной упор и минздрав, и регионы делают на радионуклидной диагностике. Первый шаг уже сделан: за последние 2-3 года во всех региональных онкодиспансерах установлены однофотонные эмиссионные компьютерные томографы. Это изотопные приборы, которые позволяют выявлять метастатическое поражение органов и тканей, особенно в сочетании с компьютерной томографией. Но это относительно простая технология. Сейчас речь идет о позитронно-эмиссионной томографии, точнее сказать, о сочетании ПЭТ и компьютерной томографии - технологии, которая становится почти обязательным методом при обследовании большинства онкобольных. Основные цели - поиск метастазов и оценка эффективности лечения. Если мы провели курс химиотерапии, скажем, пациенту с лимфомой, то должны сделать повторное исследование и сказать: подействовали лекарства или нет. КТ или МРТ изменений не покажут - опухоль внешне та же, но в ней уже нет опухолевых клеток, они все погибли, превратились в фиброзную ткань. А у другого пациента все точно так же, но опухолевые клетки остались и его надо лечить дальше или использовать другие препараты. Но это может показать только ПЭТ/КТ. Поэтому принципиальная задача заключается в том, чтобы сделать эти исследования доступными во всех регионах.
Вторая задача - это изменение организационной структуры онкологической службы таким образом, чтобы лечение онкологических пациентов начиналось как можно быстрее. Это зависит от правильной маршрутизации. Если врач в городской поликлинике или больнице предполагает, что у пациента может быть онкологическое заболевание, он должен сразу же направить его в централизованный онкологический кабинет, где ему в кратчайшие сроки смогут провести все необходимые исследования - ультразвук, рентген, маммографию, компьютерную томографию, эндоскопию, анализы крови. Если нужно, пациент направляется в межрегиональный онкологический центр для выполнения сложных инструментальных исследований - биопсии и т.д. и для проведения специального лечения. Если межрегиональный центр не может справиться, пациент должен быть направлен в любой из национальных медицинских исследовательских центров в Москве или в Санкт-Петербурге. Они выполняют самое сложное, трудоемкое, дорогостоящее лечение.
Такая структура видоизменит всю диагностику и онкологическую помощь. По сути, мы получили в наследство систему, которая не была рассчитана на такое увеличение количества онкологических пациентов. А оно происходит, потому что увеличивается продолжительность жизни, изменяется образ жизни. И настал момент, когда мы говорим: если кардинально не улучшим онкологическую помощь, никакого решения демографических проблем, никакого роста продолжительности жизни не будет.
Самая больная проблема сегодня - ранняя первичная диагностика. Она должна решаться двумя способами. Первый - онкологическая настороженность. У каждого врача любой специальности должна быть постоянной мысль о том, что у пациента потенциально может возникнуть онкологическое заболевание. И он должен найти его простые признаки. Пациент кашляет, у него нарушен стул, что-то болит, появилась одышка, изменился цвет кожи. Врач при осмотре пациента, в разговоре с ним должен предположить, нет ли здесь этого заболевания? Он обязан знать алгоритм действий и иметь инструментарий, чтобы ответить на вопрос: есть или нет. Но это пассивная позиция. Вторая часть - активная, это стремление выявить рак на доклинической стадии. Она обеспечивается проведением скринингов. Классический пример - маммография как способ доклинической диагностики опухолей молочной железы у женщин старше 50 лет. Причем таких опухолей, которые никак не проявляются - их невозможно прощупать, они не изменяют ни кожу, ни функцию. Наша задача заключается в том, чтобы в стране было достаточно маммографов и врачей-рентгенологов и чтобы женщины соответствующего возраста знали, что они должны раз в два года пройти это исследование. А на практике во многих регионах женщины отказываются его проходить, потому что "это рентгеновские лучи, а они опасны". Хотя та доза облучения, которую они получат, не имеет никакого физиологического значения - ее можно сравнить с дозой, которую человек получает за несколько перелетов в самолете или за пару дней на пляже.


Совершенствование техники приводит к появлению совершенно фантастических технологий. Чтобы улучшить результаты лечения рака ободочной кишки, все люди старше 60-65 лет должны раз в 5 лет пройти колоноскопию, которую многие боятся до того, что отказываются от этого исследования. Но сегодня мы можем выполнить им колонографию с помощью компьютерного томографа, то есть провести менее инвазивную процедуру. И колоноскопию делать уже не всем, а только тем пациентам, у которых при КТ обнаружены полипы, требующие морфологического уточнения. Примерно так работают все методы скрининга.
Но такого метода, который позволил бы полностью обследовать весь организм человека, не существует, это рекламные трюки. Конечно, можно сделать пациенту КТ всего тела. Но оно не выявит опухоли, которые не видны при компьютерной томографии. Можно провести ПЭТ-КТ, но она не покажет опухоли, которые не накапливают изотопные препараты. Одного диагностического метода нет, как нет единственной таблетки от всех болезней. Но если женщина определенного возраста будет раз в два года делать маммографическое исследование, то ее риск смерти от рака молочной железы сократится примерно на 30 процентов. Стоит это того, чтобы выполнить исследование? Выбор только за ней.
Я очень надеюсь, что реализация онкологической программы изменит психологию людей, и медицинских работников в том числе. А кроме того, нужно, чтобы все поняли, что в ранней диагностике рака гигантскую роль играет не только медицина, но и образование, воспитание, позиция средств массовой информации.
Игорь Тюрин, заведующий кафедрой рентгенологии и радиологии Российской медицинской академии последипломного образования, д.м.н.
Читайте также:

