Системы радиочастотной термодеструкции опухолей
Онкология наряду с другими высокотехнологичными направлениями современной медицины шагнула в XXI век с мощным арсеналом лечебно-диагностических возможностей. Сегодня трудно представить крупное медицинское учреждение без магнитнорезонансного, компьютерного и ультразвукового томографа, эндоскопической стойки, рентгено-телевизионного комплекса, хорошо оснащенных операционных и реанимационных блоков.
Разумеется, все это оснащение и оборудование эффективно работает лишь при условии, что имеется профессиональный, высококвалифицированный коллектив. Несмотря на внушительный перечень достижений науки и техники, основы терапии в онкологии за последние десятилетия принципиально не изменились: ряд опухолей имеют высокую чувствительность к химио- и лучевой терапии, но единственным радикальным методом лечения при большинстве злокачественных новообразований остается хирургия, эффективность которой дополняется лучевой и/или химиотерапией.
Однако даже радикальная операция на начальной стадии не гарантирует полного излечения. Механизмы канцерогенеза до настоящего времени не изучены в полной мере, и потому мы говорим лишь о потенциально радикальном лечении и о факторах прогноза, которые с определенной долей вероятности позволяют предположить отдаленный результат лечения. Но и потенциально радикальную операцию удается выполнить далеко не во всех случаях.
Например, операбельность пациентов с метастазами колоректального рака в печень не превышает 15%. В то время как метастазы в печень при злокачественных опухолях толстой кишки выявляются более чем у половины больных. С другой стороны, некоторым больным, которым операция показана и технически выполнима, хирурги вынуждены отказывать по причине тяжелой сопутствующей патологии. И, наконец, ряд пациентов, осознавая тяжесть заболевания сами, отказываются от операции.
До недавнего времени большинство этих пациентов вынуждены были обращаться к экстрасенсам и народным целителям. Но сегодня во многих перечисленных случаях современная онкология может предложить целый комплекс малоинвазивных технологий, которые при малом количестве осложнений несут в себе высокий терапевтический потенциал. При этом сохраняются основные направления противоопухолевого воздействия. Речь идет о методах локальной доставки химио- и радиофармпрепаратов (химио- и радио-эмболизация опухолевых сосудов) и технологиях локальной деструкции опухолей (различные виды аблации, фотодинамическая терапия).
Аблация (абляция; от латинского ablatio) – это методика прямого направленного разрушения ткани, которое достигается путем термического либо химического/ электрохимического воздействия.
Виды аблации:
– Химическая/электрохимическая (инъекции этанола, уксусной кислоты, электрохимический лизис)
– Термическая:
• лазерная (гипертермическая)
• микроволновая (гипертермическая)
• радиочастотная (гипертермическая)
• ультразвуковая (гипертермическая)
• криодеструкция (гипотермическая)
Несмотря на сравнительно короткую историю клинического применения, методики локальной деструкции опухолей в настоящее время широко используются при лечении пациентов с опухолями печени, почек, легких и других органов. Широкое распространение технологии обусловлено наряду с малой инвазивностью и сравнительно не дорогим оборудованием, главным образом – хорошим терапевтическим эффектом, демонстрируемым в большинстве исследований.
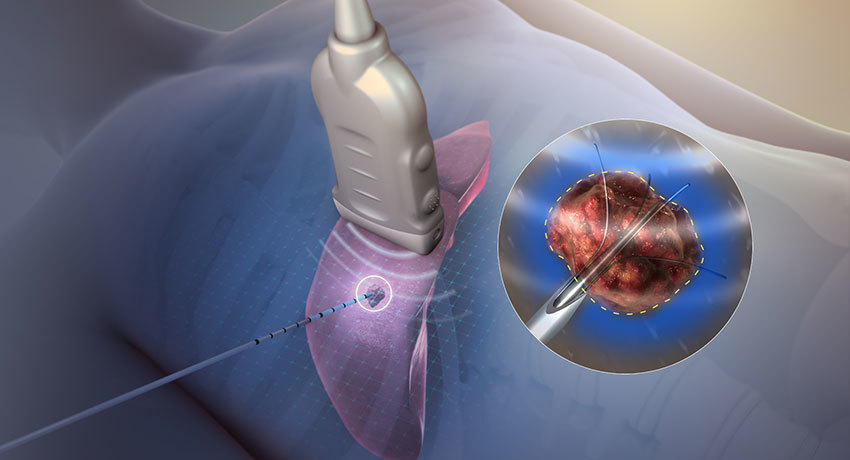
Из методов аблации сегодня наиболее применяемым является радиочастотная деструкция. Эта технология подразумевает введение специального атравматичного электрода в опухоль и воздействие на последнюю током частотой 450-500 кГц. В результате опухолевая ткань разогревается до температуры (60-90°С), при которой происходят необратимые изменения в клетках. Опухолевая масса некротизируется.
Метод радиочастотной термодеструкции впервые был применен для аблации опухолей печени. Первые экспериментальные работы были опубликованы в 80-х гг, а уже в середине 90-х гг. вышли в свет результаты предварительных клинических наблюдений. Через год появились первые публикации о применении РЧА для аблации опухолей легких, а затем почек и др. органов. Первые РЧ- системы позволяли создавать зону гипертермии малого радиуса (до 2 см), и несколько лет ушло на техническое усовершенствование оборудования. Современные РЧ системы дают возможность получать область некроза до 7 см в диаметре в ходе одной аппликации.
Рассматривая показания к РЧА опухолей всегда имеют в виду два аспекта: технический (возможность оказать гипертермическое воздействие по запланированной программе, не травмируя прилежащие органы и структуры) и онкологический (будет ли радикальная деструкция опухоли у данного пациента способствовать улучшению продолжительности и качества его жизни). Для успешного лечения желательно наличие узлового типа поражения и четкой визуализации опухоли (РКТ, УЗКТ).
Прицельное термическое воздействие на опухоль является эффективным методом терапии рака. Радиочастотная деструкция – это локальная коагуляция очага злокачественного перерождения с помощью высокочастотных радиоволн под обязательным контролем визуальных методов диагностики.
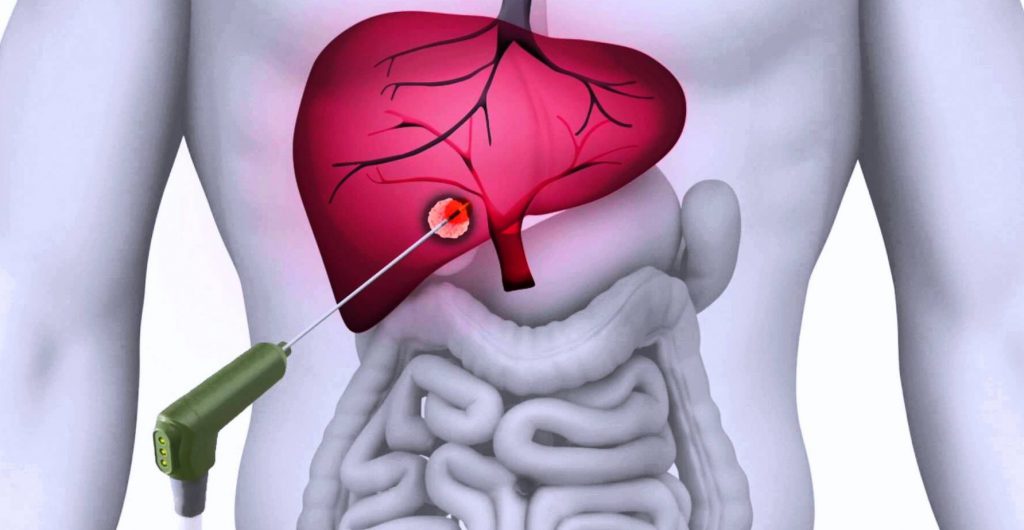
Прицельное разрушение опухоли с помощью радиочастотного воздействия
Радиочастотная деструкция – что это такое
Ток высокой частоты при воздействии на опухолевую ткань создает эффект термодеструкции или коагуляции (гипертермическое разрушение). Радиочастотная деструкция используется в разных областях медицины: для онкологии эффективной является методика подведения специального датчика непосредственно к очагу рака с последующим разрушительным действием радиоволн на опухоль. Важный элемент терапии – возможность прицельной аблации злокачественного новообразования с минимальным повреждением соседних здоровых тканей. Выделяют следующие варианты методики:
- Через кожные покровы;
- Эндоскопический;
- Прямой хирургический.
Первые 2 варианта относятся к малоинвазивной хирургии, третий – используется при проведении радикальных операций. Важный фактор терапии – визуальный контроль: радиочастотная деструкция проводится под обязательным контролем УЗИ или МРТ.
Термодеструкция – при каких видах рака используется
Современная радиочастотная аппаратура способна прицельно выжигать опухолевую ткань, но только в объеме не более 70 мм, поэтому радиочастотная деструкция не используется при размере новообразования больше 7 см. Оптимально применять методику при следующих видах рака:
- Первичная опухоль печени;
- Очаги метастазов в печеночной ткани;
- Рак почки;
- Новообразования в легочной ткани;
- Рак предстательной железы;
- Первичные и вторичные опухоли костей.
Кроме величины узлового новообразования, к противопоказаниям для использования метода термодеструкции относятся:
- диффузные виды рака;
- выход опухоли за пределы ограничивающей капсулы;
- рак с прорастанием крупного сосуда или врастанием в соседний орган;
- высокий риск внутреннего кровотечения на фоне нарушений в свертывании крови;
- болезни сердца с наличием у пациента искусственного водителя ритма;
- тяжелые сопутствующие осложнения основного заболевания (асцит, почечная недостаточность, прорастание крупного бронха);
- общее количество отдаленных метастазов более 6.
Для каждого пациента врач-онколог подбирает индивидуальное комплексное лечение, стараясь с минимальными осложнениями выполнить основную задачу – удалить злокачественное новообразование.
Лечение рака печени
Эффективная радиочастотная деструкция чаще всего применяется при опухолях в печени. К основным показаниям для назначения термодеструкции относятся:
- Первичный гепатоцеллюлярный рак;
- Вторичное метастатическое поражение, при условии, что удален первичный очаг в желудочно-кишечном тракте;
- Количество метастазов 5 и менее;
- Размер каждого узла до 40 мм;
- Остаточная опухоль или рецидив рака печени;
- Визуализируемые узлы (на УЗИ или МРТ).
Важное условие для проведения процедуры – минимальный риск осложнений (злокачественные очаги должны находиться на расстоянии 10 мм и более от воротной вены и крупных междольковых протоков). Методика малоинвазивного хирургического вмешательства предполагает прицельное подведение специального датчика размером 2 мм к опухолевому очагу через прокол кожи живота, который выполняется под постоянным визуальным контролем УЗИ или МРТ. После коагуляции в ткани печени остается очаг некроза, который постепенно замещается рубцовой тканью.
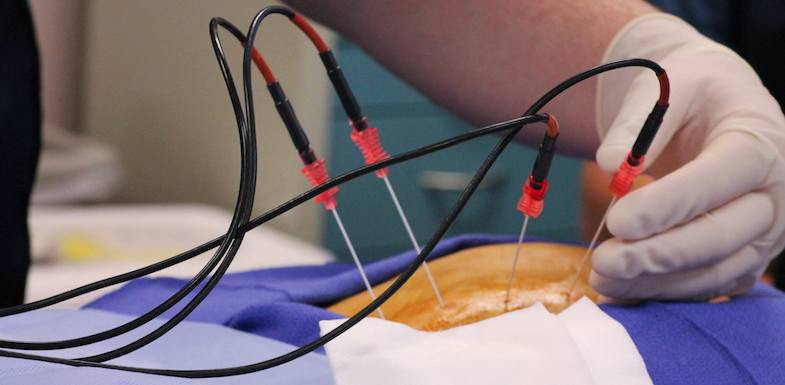
Эффективная и малоинвазивная методика лечения рака
Терапия при почечных опухолях
Почки – парный орган, поэтому при обнаружении злокачественного новообразования оптимально сделать радикальную операцию: оставшаяся здоровая почка выполнит все необходимые жизненные функции за двоих. Радиочастотная деструкция используется в следующих случаях:
- Рак единственной почки;
- Опухоль величиной 3-5 см, расположенная на наружной поверхности органа;
- Невозможность проведения радикальной операции из-за наличия противопоказаний;
- Отказ пациента от удаления почки.
Методика типична – датчик подводится через прокол кожи в области поясницы. Процедура проводится при визуальном контроле на экране УЗ монитора или при постоянном МР сканировании.
Возможные осложнения термодеструкции
Любой вариант термического воздействия может стать причиной следующих осложнений:
- внутреннее кровотечение при повреждении артерии или вены;
- воспаление и нагноение в очаге некроза;
- нарушение целостности соседних здоровых органов с формированием свищей;
- недостаточно полное удаление очага рака.
Радиочастотная деструкция опухоли является эффективной и высокотехнологичной методикой лечения, которая применяется по строгим показаниям и позволяет получить хорошие результаты терапии рака (5-летняя выживаемость при раке печени составляет 48-61%).
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Применение радиочастотной абляции для лечения нарушений ритма сердца началось только в годах. Первые же публикации относительно объема коагулируемой ткани в печени относятся к началу годов ХХ века.
В годах опубликованы и другие экспериментальные данные о применении радиочастотной абляции печени. В середине годов ХХ века появились первые сообщения о паллиативном лечении метастатического поражения печени с использованием радиочастотной абляции. А вскоре и лечения опухолей легких и почек.
В настоящее время в России не более 10 центров, занимающихся проблемой лечения метастатического рака печени. В основном они располагаются в крупных городах, областных центрах с сильной медицинской школой — Москве, , Новосибирске, Томске. Таким образом, потребность в данной высокотехнологичной медицинской помощи удовлетворяется не более чем на 15%. Другой проблемой, сдерживающей развитие данной методики, является дороговизна аппаратного обеспечения. Так, стоимость одноразового набора для радиочастотной абляции составляет до 1000 долларов США, стоимость одного сеанса криоабляции может составлять до 5000 долларов США.
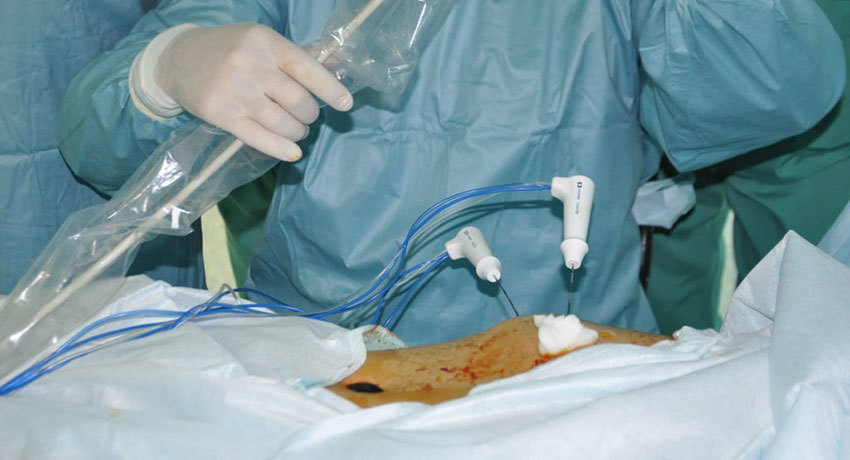
Методика термоабляции новообразований (физические основы абляции тканей)
Основным элементом электрохирургической системы является электрогенератор. Высокочастотный ток передается на электроды. Аппарат нагревает прилегающие к электроду мягкие ткани высокочастотным током специальной формы. В процессе разогрева с периодичностью 2 мс контролируется импеданс тканей. Высокочастотный ток может подаваться однократно или циклически в течение заданного времени. При однократной подаче высокочастотный ток разогревает прилегающие к электроду ткани до температуры (95–110 С) и в момент полного высушивания тканей подача тока автоматически прекращается. При циклической подаче аппарат в течение установленного времени повторяет следующие циклы: подача высокочастотного тока до разогрева (95–110 С) и полного высушивания тканей, выдержка паузы для увлажнения (уменьшения импеданса), возобновление подачи высокочастотного тока. Циклический процесс подачи тока, разогрева и высушивания, повторяющийся многократно, позволяет поддерживать высокую температуру в зоне абляции длительное время и достигать большого объёма коагулированной ткани.
Форма и объём зоны абляции зависят от выбранного электрода и режима работы. Зона абляции делится на три области по степени поражения ткани:
- ближе к электроду расположена область высушивания (дессикации) мягких тканей;
- далее располагается область коагуляции мягких тканей;
- область девитализации располагается вокруг зоны коагуляции.
При увеличении длительности (экспозиции) процедуры абляции общая зона абляции растёт незначительно, однако область дессикации увеличивается.
Показания и противопоказания
Абляцию опухолей применяют в тех случаях, когда невозможно выполнить радикальное оперативное лечение. Это может быть неоперабельность первичной опухоли или сопутствующая патология, которая делает невозможным выполнение радикальной операции в силу её объема и тяжести, но не препятствует выполнению абляции.
Согласно национальным рекомендациям, имеются следующие показания и противопоказания к радиочастотной абляции опухолей печени:
При чрескожном доступе:
- Предшествующее радикальное хирургическое лечение первичной опухоли;
- Отсутствие внепеченочных проявлений заболевания (при колоректальных метастазах);
- Наличие в печени 5 и менее опухолевых узлов (при метастазах нейроэндокринного рака допускается большее количество узлов);
- Диаметр узлов не более 5 см каждый (допустимо подвергать воздействию узлы исходно большего диаметра, но регрессировавшие в объеме под воздействием химиотерапии и других методов лечения);
- Остаточная опухоль после ранее проведенной РЧА либо другого метода лечения;
- Местный рецидив после ранее проведенной РЧА, резекции печени либо другого метода лечения;
- Метахронные метастазы после ранее проведенной РЧА, резекции печени либо другого метода лечения.
Показания к проведению РЧА лапароскопическим доступом:
- Отсутствие выраженных сращений;
- Отсутствие стандартных противопоказаний для всех лапароскопических вмешательств;
- Расположение очага в зонах, доступных лапароскопии;
- Подкапсульное расположение с возможным прилежанием к органам, которые в ходе вмешательства возможно отведением обезопасить от термического воздействия;
- При билобарном поражении печени наличие единичных небольших (до 5 см) узлов в правой доле, в то время как образование левой доли может быть удалено лапароскопически.
Показания к проведению РЧА в ходе открытого вмешательства:
- Билобарное поражение, при котором возможно удалить большую часть пораженной печени и подвергнуть РЧА остающиеся очаги;
- Прилежание к органам брюшной полости и забрюшинного пространства, магистральным сосудам и диафрагме, когда возможно отделение (резекция) этих участков;
- Заранее планируемое сочетанное вмешательство;
- Выраженные сращения, процесс в брюшной полости, особенно после ранее произведенных операциях на печени, когда патологический очаг расположен непосредственно по краю резекции;
- Наличие кроме внутрипеченочного еще и экстраорганного, но удалимого опухолевого узла; общее операбельное состояние пациента; согласие больного на выполнение данного вида лечения.
Противопоказания к проведению РЧА:
Показания к проведению радиочастотной абляции опухолей легких (по Herrera L.J. et al.):
- Больные НМКРЛст., не подлежащие хирургическому лечению по следующим причинам: сопутствующие заболевания, отказ пациента от хирургического лечения.
- Больные, имеющие несколько метастазов в разных долях легких.
- Рецидив опухоли менее чем через 6 месяцев после резекции легкого.
- Диаметр опухоли до 4 см.
- Согласие больного на проведение лечения.
Противопоказания к проведению гипертермической абляции опухолей печени (по et al.):
- Расположение опухоли ближе 3 см от прикорневых структур.
- Первичная опухоль не удалена.
- Более 3 метастазов в каждом легком.
- Общее количество метастазов более 5.
- Имеется метастатический плеврит.
Показания к абляции первичного рака почки:
- Пациентов с тяжелой сопутствующей патологией, либо отказавшихся от хирургического лечения.
- Наличие опухолевого узла до 5 см в диаметре (лучшие результаты при РЧА экзофитно расположенных опухолей до 3 см в диаметре).
- Опухоль единственной почки.
Выполнение РЧА чрескожным или лапароскопическим доступом требует соблюдения ряда условий:
При чрескожном доступе:
- Четкая визуализация патологических очагов при УЗИ и КТ/МРТ (в зависимости от способа навигации);
- Возможность достаточно безопасного доступа к опухолевому узлу (достаточная отдаленность от магистральных печеночных сосудов и желчных протоков);
- Отсутствие прорастания (тесного контакта) диафрагмы, почки, желудка, кишки, желчного пузыря;
- Невозможность выполнения оперативного вмешательства в силу соматического состояния;
- Полная обеспеченность возможности экстренной лапаротомии и адекватности традиционного вмешательства;
- Согласие больного на выполнение данного вида лечения;
При лапароскопическом доступе:
- возможность обеспечения достаточно полноценного со стороны брюшной полости;
- полная обеспеченность возможности экстренной лапаротомии и адекватности традиционного вмешательства;
- согласие больного на выполнение данного вида лечения.
Используемое оборудование и инструментарий
В настоящее время на рынке имеется множество приспособлений для выполнения радиочастотной абляции тканей. Пожалуй, наиболее известным является аппарат Radionics ® Ablation System и набор водоохлаждаемых электродов RITA ® Medical Systems (Angiodynamics, США).
Эта система комплектуется тремя моделями многозубцовых электродов:
Доступы для проведения процедуры абляции
На сегодняшний день нет единого мнения о выборе доступа для проведения абляции. Для позиционирования электрода используется чреcкожный доступ под УЗИ, КТ- или . И интраоперационные доступы при лапаротомии под УЗИ наведением и чреcкожный доступ под контролем лапароскопии.
Методики РЧА
Наиболее часто прибегают к чреcкожным методам позиционирования электрода. В качестве метода контроля над движением электрода наиболее часто используется ультразвуковая навигация.
Преимущества ультразвуковых методов заключаются в простоте проведения процедуры, отсутствии вредных воздействий на пациента в виде лучевой нагрузки, контроль над происходящими процессами в реальном времени, возможность визуализации сосудистых структур органа, а также наличие направляющих адаптеров на рукоятке ультразвукового датчика.
При выборе направления движения электрода необходимо учитывать расстояние от кожи до места проведения абляции, наличие на пути электрода полых органов, таких как кишка, желудок, желчный пузырь, крупных сосудов, синусов плевры.
Также необходимо учесть угол, под которым будет осуществляться ультразвуковой контроль, дыхательную экскурсию, что особенно важно при поддиафрагмальном расположении опухолевых узлов. Немаловажным является и расположение опухолевых узлов относительно правой или левой долей печени. Так, при расположении опухоли в левой доли печени наиболее целесообразным будет выбор эпигастральной области в качестве места проведения электрода.
При локализации опухолевого узла в правых сегментах печени более целесообразным представляется установка электродов в межреберьях. В этих случаях необходима четкая визуализация расположения плеврального синуса.
В целом выбор области для проведения чрескожной абляции аналогичен таковому при проведении пункционных биопсий очаговых образований печени.
В ряде случаев выполнение абляции под ультразвуковым наведением может оказаться затруднительным или даже невозможным. Это может быть связано с изоэхогенной структурой опухоли, когда выполнить её четкую визуализацию не представляется возможным, наличием выраженной гиперэхогенной зоны при неоднократном проведении процедуры абляции, а также наличием костей или заполненных газами полых органов на предполагаемом пути установки электрода. В таких случаях для позиционирования электрода можно воспользоваться компьютерной томографией.
Выделяются 5 этапов абляции:
- Планирование;
- Прицеливание;
- Мониторинг;
- Контроль эффективности;
- Оценка эффективности.
Сначала определяют точку введения электрода путем размещения пациента на столе в наиболее удобном для доступа к опухоли положении, установки стола на уровне среза, выбранного для доступа, и маркировки точки введения электрода.
После установки электрода и его продвижения производят контроль его положения путем последовательного сканирования, при этом дистальная тень позволяет контролировать положение кончика электрода.
В тех случаях, когда опухоль не визуализируется ни при УЗИ, ни при КТ без контрастного усиления, можно выполнить предварительную жировую эмболизацию.
Преимуществом МРТ перед КТ является отсутствие ионизирующего излучения, хорошая контрастность мягких тканей, возможность мультипланарной реконструкции, возможность отображать функциональность и температуру ткани.
Лапаротомия или торакотомия, которые выполняют для проведения абляции, имеют ряд преимуществ по сравнению с чрескожными методами. К ним относятся возможность интраоперационной ревизии органов, выполнение ИОУЗИ печени, уточнение распространения опухоли, стадии онкологического процесса, выявления необнаруженных на дооперационном этапе отсевов опухоли.
Кроме того, возможно выполнить освобождение предполагаемой области вмешательства от прилегающих петель кишки, выполнить абляцию на участках, прилегающих к желчному пузырю, куполу диафрагмы, сосудам.







Новый КУЛ-Тип предназначен для радиочастотной абляции опухолей. Новый радиочастотный аблятор Cool-tip сочетает в себе приемущества старого прибора и свич-контроллера, а также имеет новый простой интерфейс управления.
Радиочастотная абляция – метод лечения, относящийся к разряду интерстициальной термотерапии. От других методов РЧ-воздействие отличается легкостью исполнения, хорошей переносимостью, малым количеством осложнений, хорошей выживаемостью больных, которым не показано радикальное хирургическое лечение. Система радиочастотной абляции опухолей паренхиматозных органов: печень, легкие, почки, молочная железа, кости, надпочечник, щитовидная железа и др. Быстрое лечение опухолей до 5–7 см в диаметре. Чрезкожное и интраоперационное применение. Простота визуализации воздействия.
Самый мощный генератор среди абляторов. Предсказуемая геометрия коагуляции, простота использования – измерение импеданса, температуры в очаге с автоматическим регулированием воздействия. Тонкие электроды с водяным охлаждением позволяют получить заданную сферическую форму коагулята, соответствующего форме опухоли. Объем коагулята регулируется размером рабочей части, выбираемой мощностью, временем воздействия. Длительность сеанса не превышает 12 минут. Форма иглы позволяет легко устанавливать электрод в объемном образовании под контролем УЗИ, КТ или ЯМР. Возможность использования для резекций печени с минимальной кровопотерей.
Код продукта:
RFAGEN Генератор Cool-tip™ E Series
RFAPAC Набор компонентов к Cool-tip™ E Series
FT900 Тележка для генератора
FT3X Набор компонентов к тележке для генератора
Наборы одиночных игольчатых электродов (1 игольчатый электрод, 1 пластина пациента, 2 трубки)
RFA1020 Набор с игольчатым электродом для Cool-tip™ E Series 10 см. 2 см.
RFA1030 Набор с игольчатым электродом для Cool-tip™ E Series 10 см. 3 см.
RFA1507 Набор с игольчатым электродом для Cool-tip™ E Series 14,4 см. 0,7 см.
RFA1510 Набор с игольчатым электродом для Cool-tip™ E Series 15 см. 1 см.
RFA1520 Набор с игольчатым электродом для Cool-tip™ E Series 15 см. 2 см.
RFA1530 Набор с игольчатым электродом для Cool-tip™ E Series 15 см. 3 см.
RFA2020 Набор с игольчатым электродом для Cool-tip™ E Series 20 см. 2 см.
RFA2030 Набор с игольчатым электродом для Cool-tip™ E Series 20 см. 3 см.
RFA2530 Набор с игольчатым электродом для Cool-tip™ E Series 25 см. 3 см.
Наборы электродов - кластеров (1 кластерный электрод, 2 пластины пациента, 2 трубки)
RFA15302 Набор из двух электродов для Cool-tip™ E Series 15 см. 3 см.
RFA15303 Набор из трех электродов для Cool-tip™ E Series 15 см. 3 см.
RFA15403 Набор из трех электродов для Cool-tip™ E Series 15 см. 4 см.
RFA25303 Набор из трех электродов для Cool-tip™ E Series 25 см. 3 см.
RFA25403 Набор из трех электродов для Cool-tip™ E Series 25 см. 4 см.
Температурные пробы
RTP20 Температурная проба для Cool-tip™ E Series
RTP20B Температурная проба для Cool-tip™ E Series
Аксессуары
RFAPADB Пластины пациента
Первый опыт применения радиочастотной абляции при раке молочной железы
Рожкова Н.И. 1 , Шевченко С.А. 2 , Берзин С.А. 3
2 ГБУЗСО Свердловский областной онкологический диспансер, г. Екатеринбург
3. Уральская государственная медицинская академия (УГМА), г. Екатеринбург .
Адрес документа для ссылки : h ttp://vestnik.rncrr.ru/vestnik/v11/papers/ shevchen _ v 11. htm
Статья опубликована 7 февраля 2011 года.
Идентификационный номер статьи в ФГУП НТЦ “ИНФОРМРЕГИСТР”:
Рожкова Надежда Ивановна : д.м.н., профессор, раб.тел. +7 (495)334-99-93
Ответственный за переписку:
Шевченко Светлана Анатольевна :к.м.н., раб. тел. +7 (343) 356-16-24, моб. +7 (912) 289-92-72, e - mail : sv _ maxson @ mail . ru
Рабочий адрес: 620029, г . Екатеринбург, ул. Соболева 29, Свердловский областной онкологический диспансер, отделение лучевой диагностики
Берзин Сергей Александрович: д.м.н., профессор, заведующий кафедрой, главный онколог Управления здравоохранения г.Екатеринбурга, раб. тел.+7( 343)356-25-81
Рабочий адрес: 620028, Свердловская обл., г. Екатеринбург, ул. Репина, д. 3, Уральская государственная медицинская академия, кафедра онкологии,
В статье изложены технологические особенности и аспекты применения РЧА, а также данные о первом опыте применения РЧА при раке молочной железы в Свердловском областном онкологическом диспансере.
Описываются показания для проведения РЧА, рассказывается о подборе наиболее оптимальных параметров воздействия на молочную железу, приводится сравнение метода РЧА с другими методами хирургического и малоинвазивного лечения.
Дается оценка результатов применения РЧА в виде сроков безрецидивного периода и качества жизни пациенток.
Предлагаются оптимальные сроки мониторинга больных в послеоперационный период.
Делается вывод в отношении области наиболее эффективного применения РЧА, указывается на необходимость продолжения начатых исследований.
Ключевые слова: рак груди, биопсия, ультразвуковое исследование маммография, радиочастотная абляция
First experience of radiofrequency ablation in breast cancer
Rozkova N.I. 1 , Shevchenko S.A. 2 , Bersin S.A. 3
1. Federal State Establishment Russian Scientific Center of Roentgenoradiology (RSCRR) of Ministry of Health and Social Development of Russian Federation , Moscow
2 Intervention diagnost. Department of oncology
3. Ural State Medical Academy
- Rozkova N.I. MD. Department of RX RNCRR, Moscow Profsousnaja 84, +7(495)334-99-93
- Shevchenko S.A. Intervention diagnost. Department of oncology, Ekaterinburg, 620020, Soboleva 29, 343 3561624, mob. +7 ( 912 ) 289 - 92 - 72
- Bersin S.A. MD, Ural State Medical Academy (Ugma), Ekaterinburg, 620020, Soboleva 29, 343 3561860
The article gives a brief historical background, outlined technological features and the application of RFA, as well as data on the first experience of RFA in breast cancer in the Sverdlovsk Regional Cancer Center .
We describe indications for RFA, present the selection of the optimal parameters of exposure to the breast, compare method of RFA with other methods of surgical and minimally invasive treatment, assess the results of RFA in the form of timing relapse-free periods and quality of life of patients, offer the optimum time monitoring of patients during the postoperative period.
The article concludes with regard to field the most effective application of RFA, indicates the need for further studies were initiated.
Keywords: breast cancer, biopsy, ultrasound study, mammography. RFA .
Материал и методы
Несмотря на все достижения теоретической и практической медицины, в России ежегодно выявляется более 49000 новых случаев рака молочной железы (в Свердловской области – более 1500 в год). Заболеваемость за последние 10 лет увеличилась на 30%. При этом 51% женщин, заболевших РМЖ , старше 60 лет. Пожилые больные, как правило, имеют тяжелую соматическую патологию: сердечно-сосудистые заболевания, тяжелые нарушения обмена веществ, почечно-печеночную недостаточность. В таких случаях риск общей анестезии превышает риск хирургического вмешательства.
Целью настоящей работы явилось определение роли и места радиочастотной абляции (РЧА) в лечении РМЖ у пожилых, соматически отягощенных пациенток.
В соответствии с поставленной целью решались следующие задачи:
1. Определить показания для проведения РЧА.
2. Выработать наиболее оптимальные параметры воздействия на молочную железу.
3. Сравнить метод РЧА с другими методами хирургического и малоинвазивного лечения (стереотаксическая биопсия, мастэктомия по Мадену).
4. Установить сроки мониторинга.
5. Оценить результаты в виде сроков безрецидивного периода и качества жизни пациенток .
Первые исследования по воздействию радиочастотного излучения (РЧИ) на живую ткань провел d`Arsonval еще в 1891г. Он показал, что прохождение радиочастотных волн через ткань вызывает местное повышение температуры. При этом не происходит нервно-мышечного возбуждения. Данное наблюдение послужило толчком к созданию с начала до середины 1900-х годов целого ряда устройств медицинской диатермии. Наиболее известное из них – хирургический скальпель Bovie. Это инструмент для коагуляции кровоточащих тканей. Аппарат состоял из генератора, работающего в радиочастотном диапазоне, электрода в виде скальпеля и коврика заземления. Последний помещался на бедре пациента и выполнял роль большого рассеивающего электрода, позволяя электро-магнитному потоку свободно проходить через ткани не травмируя их, за исключением зоны вокруг кончика скальпеля. При соприкосновении кончика скальпеля с телом пациента, в точке контакта происходило рассечение и оплавление тканей[4].
Физический смысл воздействия радиочастотного излучения в том, что электро-магнитный поток, проходя через ткань, вызывает возбуждение йонов, которые приходят в движение и за счет фрикционного тепла разогревают прилежащюю ткань. При нагревании свыше 50-60 градусов развивается коагуляционный некроз [9].
Современные аппараты принципиально не отличаются от скальпеля Bovie.
Современные технологии и материалы позволили создать малотравматичные и легко управляемые системы для направленного термического воздействия на ткань (термоаблация).
Термоаблация представлена гипотермическим воздействием (криодеструкция) и группой методов гипертермического воздействия : микроволновая, лазерная, ультразвуковая и радиочастотная деструкция.
Микроволновая, лазерная и радиочастотная деструкция начали широко применяться для лечения опухолей печени с конца 80-хх, начала 90-хх годов прошлого века. Локальное гипертермическое воздействие (свыше 50 0 С приводит к развитию коагуляционного некроза, с последующим замещением его соединительной тканью. Различия перечисленных способов аблации заключаются в мощности подводимой энергии, времени экспозиции и в геометрии зоны некроза. Мощность современных радиочастотных генераторов достигает 200 вт. При микроволновой и лазерной аблации – это 30 – 50 вт максимально.
Основной характеристикой аппаратов для аблации является зона некроза. Для радиочастотной абляции характерна сферическая форма [10].
Процедура проводится, как правило, под местной анестезией после премедикации. Положение больного – лежа на спине. Электроды вводят под ультразвуковым контролем. Зонд подводится к очагу. Выдвигаются электроды и проводится облучение по намеченной программе. Как уже отмечалось, при радиочастотной деструкции удается создать сферическую зону некроза. Это достигается путем увеличения поверхности излучения при использовании специальных многоэлектродных зондов (рис.1).

Рис. 1. Прибор для проведения радиочастотной абляции (РЧА)
Электроды всех производителей как правило имеют термопары, что позволяет контролировать температуру в очаге в реальном масштабе времени. В тех случаях, когда диаметр узла превышает возможную зону некроза, применяют специальные методики перекрывающихся полей.
Метод радиочастотной термодеструкции впервые был применен для аблации опухолей печени. Первые экспериментальные работы были опубликованы в 80-хгг, а уже в середине 90-х гг. вышли в свет результаты предварительных клинических наблюдений. Через год появились первые публикации о применении РЧА для аблации опухолей легких, а затем почек и др. органов. Первые РЧ- системы позволяли создавать зону гипертермии малого радиуса (до 2 см ), и несколько лет ушло на техническое усовершенствование оборудования [10].
Рассматривая показания к РЧА опухолей, всегда имеют в виду два аспекта: технический (возможность оказать гипертермическое воздействие по запланированной программе, не травмируя прилежащие органы и структуры) и онкологический (будет ли радикальная деструкция опухоли у данного пациента способствовать улучшению продолжительности и качества его жизни). Для успешного лечения нужна четкая визуализация опухоли (РКТ, УЗКТ), показанием для РЧА является узловой тип поражения [2].
В литературе опубликованы лишь пилотные исследования по поводу применения РЧА при РМЖ. Это данные университетской клиники Нидерландов, департамента гинекологии, перенатологии и репродуктивной медицины Флорентийского университета, университетских клиник Арканзаса и Техаса (США) и др. В этих исследованиях подчеркивается, что после проведения РЧА обязательным является хирургическая резекция. Причем авторы указывают, что по гистологическим данным клетки опухоли в резецированном материале обнаружены не были [3]. Все пациенты очень хорошо перенесли процедуру, с минимумом побочных эффектов [4].
Наиболее целесообразно применять метод радиочастотной абляции (РЧА) под УЗИ контролем у пациенток с наличием РМЖ в виде узла размером до 1,5 см , хорошо визуализируемым при УЗИ. Предварительно проводится трепанбиопсия опухоли [4]. Сообщается, что, несмотря на многочисленные методологические различия, при использовании РЧА опухоль разрушалась в 80 - 100% случаев. Безрецидивный период в среднем составлял 15 месяцев. В последующем назначались адьювантная химо-, гормоно- и (или) лучевая терапии [7,9].
В соответствии с целью для решения поставленных задач были выделены 3 группы больных: 10 пациенток после РЧА молочной железы, 25 – после проведения стереотаксической биопсии, 25 (группа сравнения) – после хирургического лечения (мастэктомия по Мадену). Средний возраст во всех группах составил 74,5 лет.
В Свердловском областном онкологическом диспансере РЧА при РМЖ стала применяться с 2008 года. За это время абляция проведена 10 соматически отягощенным пациенткам в возрасте от 70 до 80 лет (средний возраст 74 года). Размеры опухолевого узла составляли от 1,2 до 1,7 см (средний размер - 1,45 см ) (рис.3).

Рис. 3. Опухоль молочной железы, до проведения РЧА
Региональные лимфатические узлы были интактны во всех случаях на момент проведения манипуляции. У 5-и женщин была выявлена тяжелая сердечно-сосудистая патология, у 2-х - почечная недостаточность, у - 2-х метастатическое поражение легких (плеврит) и печени. У 1 пациентки были выявлены множественные метастазы в кости скелета, при наличии синхронного процесса в молочных железах. В этом случае РЧА проведена с двух сторон.
Перед РЧА всем пациентам проводилась трепан-биопсия опухоли под УЗ-контролем для иммуногистохимического исследования и определения факторов прогноза. По гистологической структуре у 9 больных был выявлен инфильтративный протоковый рак (рис. 4), у 1 – неинфильтративный протоковый рак. У 6-и больных были РЭ+, у 5 – РП+, у 3 – HER 2 neo +++.

Рис. 4. Инфильтрирующий протоковый рак окр г+э ув 100
Метод радиочастотной абляции выполнялся на аппарате Radionics Cool-Tip RF Ablation System (подразделение "Tyco Healthcare Group LP"). Применялись водоохлаждаемые по закрытому контуру электроды длинной 10 см , с рабочей частью 1 см . Чрескожное вмешательство проводилось под местной анестезией с внутривенным потенцированием.. Среднее время проведения РЧА составило 12 минут (5-25 минут).
Всего прооперировано 160 пациентов. Их них - 50 (31%) женщин с диагнозом РМЖ. Половине женщин (25 человек) стереотаксическая биопсия проводилась как этап диагностического исследования, затем были выполнены стадирующие операции. Остальные 24 женщины имели противопоказания к полноценному хирургическому лечению: 9 женщин с тяжелой сердечно-сосудистой патологией, 8- с метастатическим поражением различных органов, 5- с почечной недостаточностью, 2- с тяжелой формой сахарного диабета, 1 – отягощена по неврологическому статусу. Одна женщина предпочла стереотаксическое удаление опухоли молочной железы стандартной хирургической операции. Возраст женщин колебался в пределах 45-86 лет. Средний возраст составил 65,5 лет. Размер опухолевого узла не превышал 2, 0 см . Средний диаметр – 1,6 см . Следует отметить, что стереотаксическая биопсия проводилась под местной анестезией. Среднее время проведения ABBI -биопсии составило 45 минут.
При гистологическом исследовании были получены следующие данные: в 96%случаев был выявлен инфильтративный протоковый рак, в 4% - неинфильтративный протоковый рак, в 45% - были выявлены РЭ+, в 36% – РП+, в 26% – HER 2 neo +++, в 13% опухоль была трижды негативной
Пациентки из группы сравнения (25 женщин) имели опухоль в молочной железе размером до 2-х см. По гистологической структуре и рецепторному статусу опухоли в молочной железе были практически идентичны первым двум группам.
Всем больным (10 человек) после проведения РЧА была назначена адьювантная гормонотерапия, 3 больным - таргетная терапия герцептином. Последующие цитологические исследования молочной железы были сделаны через месяц, 3, 6, 9 в течение первого года после операции. Материал для исследования получали при помощи ТАБ из центра очага абляции и из его краев. Во всех случаях были получены данные за асептическое воспаление (рис. 6).
Окр. гематоксилин- эозин ув. 80.
Размер очага некроза в среднем был 3,4 см , что превышало размер первоначального очага в 1,5 раза (рис. 7).

Рис. 7. Зона асептического некроза сразу после проведения РЧА
Данные за местный рецидив не были получены ни в одном случае. У 1 пациентки был выявлен метастаз в аксиллярный гомолатеральный лимфатический узел через 9 месяцев после проведения РЧА, у 3-х пациенток были обнаружены метастазы в легкие, у 2-х – в печень через год после проведения операции. Срок наблюдения после РЧА составил 1,5 года.
Пациентки после проведения стереотаксического удаления опухоли молочной железы (25 человек) наблюдались в сроки 1 раз в 3 месяца в течение первого года, затем 1 раз в 6 месяцев. Через 3 года после операции - 1 раз в год. Всем больным было назначено лечение в соответствии с их рецепторным статусом. У 6 (24%) женщин в течение 2-х лет наблюдения были выявлены местные рецидивы, у 5 (20%) - метастатическое поражение региональных лимфатических узлов, у 4-х (16%) – метастазы в печень, у 3-х (12%)- в легкие. Остальные 7 женщин в течение 5 лет не имели прогрессирования процесса.
У женщин из группы сравнения (25 человек) местные рецидивы и метастазы в региональные лимфатические узлы возникали в течение первых двух лет наблюдения в 8% случаев.
В результате проведенного исследования можно сделать следующим выводы.
Показаниями для проведения РЧА является тяжелая соматическая патология, генерализация процесса для удаления первичного очага, пожилой возраст. Обязательным условием является хорошая визуализация очага при УЗ- исследовании и размеры опухоли в молочной железе, не превышающие 3,0 см .
Наиболее оптимальные параметры воздействия на молочную железу при РЧА следующие: применение водоохлаждаемых по закрытому контуру электродов длиной 10 см , с рабочей частью 1 см , мощность при проведении манипуляции равна 25-30 Вт, время проведения РЧА – 12 – 15 мин.
При проведении РЧА молочной железы не получено ни одного местного рецидива. Но зона асептического некроза в 1.5 раза превышала размер опухолевого узла и лишь незначительно уменьшилась за 1,5 года наблюдения. Безусловно, это имело отрицательное значение для психо-эмоцонального состояния. В половине случаев женщины жаловались на боль в проекции зоны некроза в течение года. Сроки наступления прогрессирования процесса после проведения РЧА сопоставимы с данными, полученными после проведения стереотаксической биопсии. С группой сравнения эти данные не сопоставимы, что вполне объяснимо онкологическими принципами радикальности хирургического лечения.
Наиболее оптимальные сроки мониторинга – 1 раз в 3 месяца в течение первого года наблюдения, 1 раз в 6 месяцев и раз в год в последующем.
О сроках продолжительности жизни пациенток после РЧА мы судить не можем из-за достаточно короткого периода наблюдения.
Т.о, РЧА – новое средство для минимально инвазивного вмешательства малых карцином молочной железы. Все исследования в направлении РЧА молочной железы носят на сегодняшний день экспериментальный характер. Требуются оценки долгосрочных результатов для определения преимуществ РЧА перед другими консервативными методами лечения. Приоритетным в лечении рака молочной железы на сегодняшний день, по-прежнему, остается хирургический метод.
1. Гиппократ . Сочинения. - Пер. В. И. Руднева, комм. В . П . Карпова 1989. 210 с.
2. Долгушин Б.И., Патютко Ю.И., Шолохов В.Н., и др. Радиотермоаблация в онкологии. Мировой опыт и анализ собственных наблюдений.// Доклад на заседании Московского Онкологического Общества
3. Barista, I. Comments on Current and Future Trends in the Multidisciplinary Approach for High-risk Breast Cancer. The Experience of the Milan Cancer Institute.// European Journal of Cancer 1997; № 33 P.164-165.
4. Baum, M. Does Surgery Disseminate or Accelerate Cancer.// The Lancet. 1996 V3. P. 347:- 260.
5. Grabau, et al. Needle Biopsy of Brest Cancer. Appearance of tumor cells along the Needle Track. - Case Reports 192-194.
6. Harter, et al. Malignant Seeding of the Needle Track during Stereotaxic Core Needle Breast Biopsy.// Radiology 1992. № 185. P. 713-714.
7. Terry, John D. Percutaneous Core Biopsy of the Breast. // Radiology. . 1994 V 196: P. 581-582
8. James Henry Breasted. The Edwin Smith Papyrus. // New-York Historical Society Quarterly Bulletin 6.1 April 1922. P. 5-31
9. Zlotta, et al. Radiofrequency Interstitial Tumor Ablation (RITA) Is a Possible New Modality for Treatment of Renal Cancer: Ex Vito and in Vito Experience. // Journal of Endouology 1997. № 11 P. :251-258.
Читайте также:





