Сера проявляет окислительные свойства при взаимодействии с хлором
Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное применение. Куски самородной серы использовались для совершения обряда изгнания злых духов. Так, по легенде, Одиссей, возвратившись в родной дом после долгих странствий, первым делом велел окурить его серой. Много упоминаний об этом веществе встречается в Библии.
В Средние века сера занимала важное место в арсенале алхимиков. Как они считали, все металлы состоят из ртути и серы: чем меньше серы, тем благороднее металл. Практический интерес к этому веществу в Европе возрос в XIII – XIV вв., после появления пороха и огнестрельного оружия. Главным поставщиком серы была Италия.

Кристаллы природной серы
В наши дни сера используется как сырьё для производства серной кислоты, пороха, при вулканизации каучука, в органическом синтезе, а также для борьбы с вредителями сельского хозяйства. Порошок серы применяют в медицине в качестве наружного дезинфицирующего средства.
Сера образует несколько аллотропных модификаций. Устойчивая при комнатной температуре ромбическая сера представляет собой жёлтый порошок, нерастворимый в воде. При кристаллизации из хлороформа CHCl3 или из сероуглерода CS2 она выделяется в виде прозрачных кристаллов октаэдрической формы. ромбическая сера состоит из циклических молекул S8, имеющих форму короны. При 113 о С она плавится, превращаясь в жёлтую легкоподвижную жидкость. При дальнейшем нагревании расплав загустевает, так как в нем образуются цепочки. А если нагреть серу до 445 о С, она закипает. Выливая кипящую серу струйкой в холодную воду, можно получить пластическую серу – резиноподобную модификацию, состоящую из полимерных цепочек. При медленном охлаждении расплава образуются игольчатые кристаллы моноклинной серы (tпл = 119 о С). Подобно ромбической сере, эта модификация состоит из молекул S8. При комнатной температуре пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в порошок ромбической серы.
В природе сера находится как в свободном состоянии, так и в виде соединений. Важнейшие из них следующие: FeS2 – пирит; или железный (серный) колчедан, CuS – медный блеск, Ag2S – серебряный блеск, PbS – свинцовый блеск. Сера часто встречается в виде сульфатов: гипса – CaSO4 ∙2H2O; мирабилита, или глауберовой соли Na2SO4∙10H2O; горькой (английской) соли MgSO4 ∙ 7H2O и др. Сера входит в состав нефти, каменного угля, содержится в растительных и животных организмах (в составе белков).
Серу, содержащуюся в свободном состоянии (в виде включений) в горных породах, выплавляют из них в специальных аппаратах – автоклавах.
В лабораторных условиях свободную серу можно получить, например, при сливании растворов сероводородной и сернистой кислот, при неполном сгорании сероводорода:
Сера – типичный активный неметалл. Она реагирует с простыми и сложными веществами. В химических реакциях сера может быть как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств веществ, с которыми она реагирует. Сера проявляет свойства окислителя при взаимодействии с простыми веществами – восстановителями (металлами, водородом, некоторыми неметаллами имеющими меньшую ЭО). Восстановителем сера является по отношению к более сильным окислителям (кислороду, галогенам и кислотам – окислителям).
Взаимодействие серы с простыми веществами

Взаимодействие серы с цинком
Сера реагирует как окислитель:
Сера расположена в VIа группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s 2 3p 4 . В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS2 — железный колчедан или пирит,
ZnS — цинковая обманка или сфалерит (вюрцит),
PbS — свинцовый блеск или галенит,
Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О2 и О3, S2 и S8, Р2 и Р4 и т.д).
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S8, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
1) ромбическая — S8
t°пл. = 113°C; r = 2,07 г/см 3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см 3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
- Реакция Вакенродера:
Окислительные свойства серы
(S 0 + 2ē → S -2 )
1) Сера реагирует со щелочными металлами без нагревания:
c остальными металлами (кроме Au, Pt) — при повышенной t°:
2) С некоторыми неметаллами сера образует бинарные соединения:
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
(S — 2ē → S +2 ; S — 4ē → S +4 ; S — 6ē → S +6 )
S + O2 – t° → S +4 O2
S + Cl2 → S +2 Cl2
Со сложными веществами:
5) c кислотами — окислителями:
Реакции диспропорционирования:
7) сера растворяется в концентрированном растворе сульфита натрия:


Сероводород H2S и сульфиды- химические свойства
Соединения серы +4: сернистый газ, сернистая кислота и её соли сульфиты.
Серная кислота – химические свойства и промышленное производство
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
Сера - элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов - элементов VIa группы.
Сера - S - простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

- FeS2 - пирит, колчедан
- ZnS - цинковая обманка
- PbS - свинцовый блеск (галенит), Sb2S3 - сурьмяный блеск, Bi2S3 - висмутовый блеск
- HgS - киноварь
- CuFeS2 - халькопирит
- Cu2S - халькозин
- CuS - ковеллин
- BaSO4 - барит, тяжелый шпат
- CaSO4 - гипс
В местах вулканической активности встречаются залежи самородной серы.

В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
-
Реакции с неметаллами
На воздухе сера окисляется, образуя сернистый газ - SO2. Реагирует со многими неметаллами, без нагревания - только со фтором.

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
Реакции с кислотами
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Реакции с щелочами
Сера вступает в реакции диспропорционирования с щелочами.

Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.

Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Сероводород - сильный восстановитель (сера в минимальной степени окисления S 2- ). Горит в кислороде синим пламенем, реагирует с кислотами.

Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
Сернистый газ - SO2 - при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
С основными оксидами, основаниями образует соли сернистой кислоты - сульфиты.

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
В реакциях с основными оксидами, основаниями образует соли - сульфиты и гидросульфиты.
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота - основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.

Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия - Pr, V2O5).
В лабораторных условиях разложением солей серной кислоты - сульфатов.
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли - сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке - средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке - кислая соль)

SO3 - сильный окислитель. Чаще всего восстанавливается до SO2.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
Элементы VIa группы по-другому называются халькогены.
Количество валентных электронов у элементов VIa группы (в основном состоянии) - два.
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств. Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию. Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 o C и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах:
Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном:
Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода:
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:
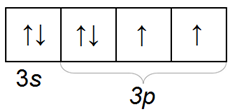
Валентных электронов у атома серы 6. Поэтому, ceра может образовывать до 6 валентных связей. Атом серы имеет больший радиус и потому проявляет меньшую электроотрицательность по сравнению с кислородом. Степени окисления, которые может проявлять сера в окислительно-восстановительных реакциях: S 0 , S -2 , S +4 , S +6 .
Сера это
Сера цвет
Соединения двухвалентной серы
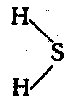
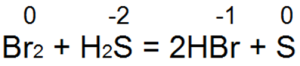
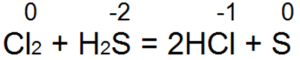
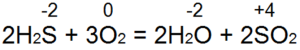
Соединения четырехвалентной серы
Соединения шестивалентной серы
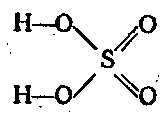
Что такое серная кислота
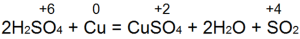

Концентрированная серная кислота реагирует с металлами, более активными, чем водород, иначе, чем разбавленная. Цинк например, из концентрированной серной кислоты не вытесняет водород, а восстанавливает серную кислоту до двуокиси серы, свободной серы или сероводорода:
H2SО4 + Zn → ZnSО4 + SO2
H2SО4 + Zn → ZnSО4 + S
H2SО4 + Zn → ZnSО4 + H2S
■ 91. Все три приведенных уравнения реакций серной кислоты с цинком являются окислительно-восстановительными. Расставьте в них коэффициенты на основе электронного баланса. (См. Ответ)
Безводная серная кислота называется моногидратом. Моногидрат не содержит ионов и поэтому не проводит электрического тока. Моногидрат хорошо поглощает влагу. Поскольку многие реакции серной кислоты с металлами являются ионными, моногидрат не вступает в реакцию с некоторыми металлами, более активными, чем водород, например с железом, поэтому его можно перевозить в железных цистернах. Золото, платина устойчивы к серной кислоте в любых концентрациях. Концентрированная серная кислота окисляет и некоторые неметаллы, например углерод.
■ 93. В чем сходство И различие серной кислоты с другими кислотами? (См. Ответ)
94. Могут ли осуществляться реакции, в которых серная кислота проявляла бы восстановительные свойства?
95. Как осуществить следующие превращения:
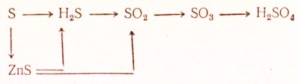
Напишите уравнения соответствующих реакций. Для окислительно-восстановительных составьте электронный баланс, уравнения ионных реакций напишите в ионной форме.
96. В одной склянке находится раствор серной кислоты, в другой — азотной, в третьей — соляной. Как их различить?
97. Для получения двуокиси углерода на мрамор СаСО3 действуют соляной кислотой. Почему для этой цели нельзя применить серную кислоту? (См. Ответ)
98. Как осуществить следующие превращения:
Общая характеристика неметаллов главных подгрупп IV – VII групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах. Б. Все неметаллы являются р-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
2. При обычных условиях из двухатомных молекул состоят
1) гелий и аргон
2) азот и неон
3) сера и фосфор
4) водород и кислород
3. Верны ли следующие суждения о неметаллах?
А. Все неметаллы являются химически активными веществами. Б. Неметаллы обладают только окислительными свойствами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
4. «Верны ли следующие суждения о неметаллах?
А. Неметаллы образуют с щелочными металлами соединения преимущественно с ионной связью.
Б. Между собой неметаллы образуют соединения с ковалентной связью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
6. Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
7. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) H2SO3 3) Н3РО4 4) H2SiО3
8. Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
9. Водород проявляет окислительные свойства при реакции с
1) натрием 2) хлором 3) азотом 4) кислородом
10. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F -->O -->N
2) N -->F -->0
3) N -->O -->F
4) O -->N -->F
11. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
12. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
13. В ряду: Si -->Р --> S --> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
14. В ряду элементов мышьяк -->селен --> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
15. Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
3) бор
4) азот
16. Верны ли следующие суждения о галогенах?
А. Наиболее электроотрицательным среди галогенов является иод.
Б. Хлор вытесняется бромом из хлорида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Кислород не реагирует с
1) водой и оксидом кальция
2) железом и оксидом фосфора (V)
3) водородом и оксидом фосфора (III)
4) сероводородом и оксидом углерода (IV)
18. Высшему гидроксиду элемента VIIA группы соответствует формула
19. Верны ли следующие суждения о галогенах?
А. Фтор в соединениях проявляет как положительную, так и
отрицательную степень окисления.
Б. При нормальных условиях бром и иод являются жидкостями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
20. Водород проявляет окислительные свойства при взаимодействии с
1) натрием 2) хлором 3) азотом 4) кислородом
21. Окислительные свойства фосфор проявляет при взаимодействии с
1) кислородом
2) магнием
3) хлором
4) серой
22. Верны ли следующие суждения о свойствах серы и хлора?
А. Максимальная валентность серы и хлора в соединениях равна номеру группы.
Б. В водородных соединениях серы и хлора связь ковалентная полярная.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
23. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3> хлором 4) кислородом
24. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4> HClO4
25. Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
2) - 2, +4, +6, +8
3) -3, +3, +5
4) -1, +2, +5
26. Оцените справедливость суждений о неметаллах:
А. Атомы неметалла могут участвовать в образовании как ионных,
так и ковалентных связей.
Б. Гидроксиды неметаллов имеют кислотный характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. Оцените справедливость суждений о неметаллах:
А. Чем больше заряд ядра атома, тем сильнее выражены его
неметаллические свойства.
Б. Чем сильнее выражены неметаллические свойства элемента, тем
более кислотный характер имеет его оксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
28. Оцените справедливость суждений о неметаллах:
А. В периоде с увеличением зарядов атомных ядер происходит
усиление неметаллических свойств элементов.
Б. В главной подгруппе с увеличением зарядов атомных ядер
происходит ослабление кислотных свойств гидроксидов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
29. Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
30. Только восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
Ответы: 1-1, 2-4, 3-4, 4-3, 5-2, 6-2, 7-1, 8-1, 9-1, 10-3, 11-2, 12-4, 13-1, 14-4, 15-1, 16-4, 17-1, 18-4, 19-4, 20-1, 21-2, 22-3, 23-1, 24-4, 25-1, 26-3, 27-2, 28-3, 29-1, 30-2.
Читайте также:

