Секвенирование нового поколения онкология

По сравнению с анализом точечных мутаций более совершенные методы секвенирования нового поколения (СНП) при раке легких дают возможность выявлять мутации сразу в нескольких генах.
Этот метод находит применение при обследовании пациентов, страдающих метастатическим немелкоклеточным раком легких (НМРЛ), давая надежные и доступные результаты.
Исследование финансировалось Novartis Pharmaceuticals.
Доктор Пеннел отмечает, что таргетная терапия рака легких существенно увеличила продолжительность жизни без прогрессирования болезни, но слабым звеном в подборе лечения остается медленный генетический анализ.
Как обнаружить все мутации рака легких за один анализ?
Новое исследование добавляет ценный вклад в зарождающееся, но очень перспективное направление онкологии.
Экономический эффект СНП при лечении метастатического НМРЛ становится очевидным.
Эта работа показала, что секвенирование нового поколения успешно выявляет пациентов с активирующими мутациями рака легких, которых можно зачислять в клинические испытания новых лекарств. Очевидно, что такой подход ускорит разработку таргетной терапии и даже сделает новые препараты дешевле.
Представленная в журнале компьютерная модель оценивала среднее время до начала терапии, стоимость и исходы лечения для пациентов с вновь диагностированным метастатическим НМРЛ.
Перечень исследований включал определение мутаций PD-L1, EGFR, ALK, ROS1, BRAF, MET, HER2, RET и NTRK1.
В первом варианте ученые анализировали результаты анализа точечных мутаций (с определением мутации KRAS или без таковой), а также метода секвенирования нового поколения. Авторы отметили, что их модель опиралась на оценках экспертов, которые нужно валидировать с помощью эмпирических данных.
Следует заметить, что себестоимость СНП во всем мире стремительно снижается.
Стоимость анализов и хранения данных продолжает сокращаться, что делает целесообразным применение секвенирования нового поколения при раке легких, как в процессе лечения, так и при организации клинических испытаний.

По словам Герштейна, технология помогает врачам создавать наборы высокоточных баз биомедицинской информации для решения будущих вопросов.
Общее время от получения образца для анализа до начала таргетной терапии (включая обработку данных и время, необходимое для выполнения повторной биопсии) в новой модели составляет 2 недели для СНП против 4,7-4,8 недели для традиционного анализа точечных мутаций рака — вдвое быстрее.
В масштабах Соединенных Штатов, где подобные анализы становятся регулярными, потенциальная экономия средств уже составляет 1,5-2 миллиона долларов для гипотетической популяции из 2066 пациентов Medicare.
От 15 до 40% наших пациентов с метастатическим немелкоклеточным раком легких не имеют достаточного количества ткани для исследования, из-за чего им требуются повторные биопсии. Поскольку число маркеров растет, потребность в ткани для серии последовательных тестов увеличивается.
В исследовании NILE установлено, что 18% завершают серию генетических анализов, и только 5,6% в состоянии выполнить анализы на все рекомендуемые маркеры.
Время простых решений прошло.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
NGS, или next generation sequencing, — секвенирование нового поколения. Термин означает определение нуклеотидной последовательности (исследование первичной структуры) ДНК или РНК. Секвенировать можно и другие биополимерные молекулы, например белки, но в этой статье речь пойдет только о нуклеиновых кислотах.
В настоящее время применяется несколько вариантов метода. Один из наиболее распространенных — секвенирование по Сэнгеру. Преимуществом является высокая точность и относительно низкая стоимость при исследовании небольших фрагментов ДНК. Недостатком является низкая пропускная способность и дороговизна при исследовании большого объема данных. Именно эти минусы стали основой для разработки и внедрения более современной технологии — NGS.
Особенности NGS
Необходимость разработки NGS была обусловлена стремлением к автоматизации анализа, увеличению объема получаемой информации и снижению стоимости исследования. Принцип технологии NGS основан на массовом одновременном секвенировании тысяч фрагментов ДНК на базе подготовленных однонитевых библиотек. Методика включает три этапа:
- подготовка библиотек;
- сиквенс;
- анализ полученных данных.
- снижение стоимости исследования;
- автоматизация анализа;
- большой объем получаемой информации.
Методы NGS имеют большую производительность, позволяют выполнять одновременное считывание миллиардов коротких фрагментов нуклеиновых кислот. Кроме того, NGS дает возможность проводить секвенирование сразу нескольких десятков геномов за один запуск анализатора.
Виды NGS
Технология секвенирования следующего поколения может быть реализована на основе следующих методов:
- Пиросеквенирование — основано на регистрации пирофосфата, образующегося при мобилизации очередного нуклеотида на матрицу ДНК. Регистрация пирофосфата производится посредством каскада химических реакций, в конце которого выделяется квант света.
- Секвенирование на молекулярных кластерах также происходит на базе синтеза новой молекулы ДНК на основании матрицы. Она крепится на поверхности проточной ячейки, а детекция осуществляется посредством флуоресцентной метки нуклеотидов.
- Техническое лигазное секвенирование в отличие от предыдущих методов использует образование химических связей между нуклеотидами посредством лигазы. Клональная библиотека наносится на магнитные сферы и помещается в проточную ячейку. Последовательность нуклеотидов определяется с помощью отщепляющейся флуоресцентной метки.
- Ионное полупроводниковое секвенирование основано на использовании полупроводниковых микрочипов. В момент удлинения синтезируемой цепи на один нуклеотид происходит изменение рН на микрочипе. Оно регистрируется, и таким образом определяется последовательность нуклеотидов.
- Одномолекулярное секвенирование относится к методам третьего поколения. Оно позволило отказаться от полимеразной цепной реакции на этапе пробоподготовки и дает возможность следить за наращиванием синтезируемой цепи в режиме реального времени.
Области применения NGS
- Секвенирование генома de novo — расшифровка ранее неизученного генома. Используется в бактериологии, вирусологии и др.
- Полногеномное ресеквенирование.
- Направленное ресеквенирование генов, про которые известно, что наличие в них мутации приводит к развитию заболевания.
- Секвенирование РНК — проводится для оценки экспрессии генов. При этом можно оценивать как кодирующие, так и регуляторные РНК.
- Метагеномное секвенирование — позволяет определить состав организмов в исследуемом образце, например, в материале, взятом из кишечника или ротовой полости.

В конце 2018 года швейцарская компания Roche наладила доставку образцов тканей онкологических больных из России в лабораторию в Германии, где проводятся молекулярно-генетические исследования по современной технологии NGS.
В этой статье мы расскажем о том, как в раковых клетках обнаруживают мутации с применением метода NGS, как результаты этого анализа могут повлиять на эффективность лечения, и кому необходимо данное исследование.
Каждый рак уникален
Еще совсем недавно злокачественные опухоли классифицировали только по гистологическому принципу, то есть в зависимости от того, в каком органе они возникали, и как опухолевая ткань выглядела под микроскопом.
Для этого и нужны молекулярно-генетические анализы.
Некоторые из генов, связанных с развитием рака, хорошо изучены и постоянно на слуху. Например это мутации EGFR при раке легких, HER2, BRCA1 и BRCA2 при раке молочной железы, BRAF при меланоме.
Мы в Европейской клинике поддерживаем это начинание и считаем его важным шагом в развитии помощи онкологическим больным в России. Если пациенту необходим молекулярно-генетический анализ, наши врачи рассказывают о такой возможности и помогают ею воспользоваться.
Технология нового поколения
С помощью NGS изучают все известные мутации четырех видов:
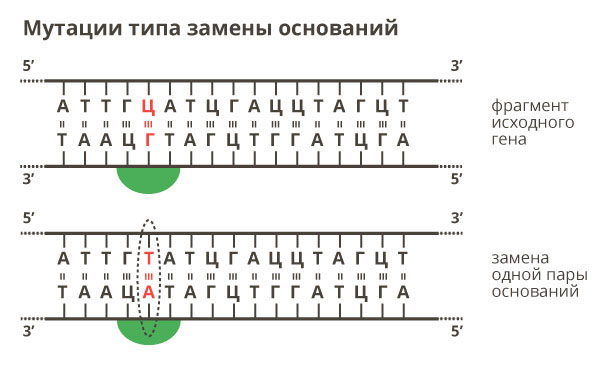
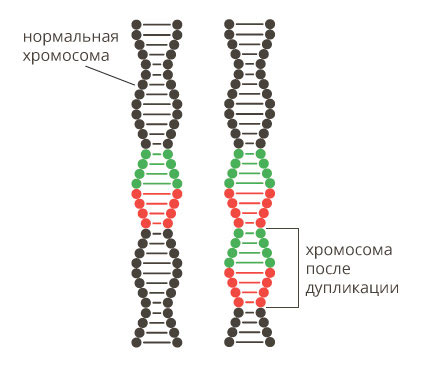
3. Изменение числа генов – увеличение или уменьшение числа копий определенного гена, в результате чего снижается или повышается его экспрессия (активность).
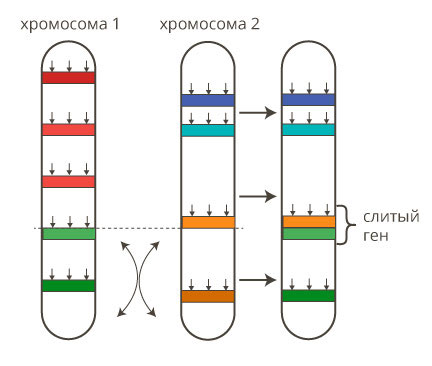
4. Фьюжн – слияние генов, когда из двух отдельных образуется один гибридный.
Кроме того, NGS помогает выявить микросателлитную нестабильность, мутационную нагрузку – количество мутаций на определенный объем генома клеток опухолей.
По завершении анализа врач получает максимально полную информацию о состоянии генов злокачественной опухоли, и эти данные помогают:
- Выявить мутации, которые могут повлиять на эффективность лечения, прогноз для пациента.
- Подобрать оптимальные схемы терапии.
- Узнать, в каких клинических испытаниях может принять участие пациент, если ему не помогают доступные виды лечения.
Услуги FMI
В настоящее время FMI предлагает три вида анализов:
- FoundationOne CDx – для солидных (плотных) опухолей. Именно этот анализ применяется в большинстве случаев. Врач проводит биопсию – получает фрагмент опухоли и отправляет в лабораторию. В среднем через 2 недели из лаборатории приходит отчет. Анализируются все рекомендованные гены при солидных опухолях. Исследование микросателлитной нестабильности и мутационной нагрузки помогает в принятии решений по поводу проведения иммунотерапии. Тест FoundationOne CDx одобрен американским Управлением по контролю качества лекарственных препаратов и продуктов питания (FDA), он регулярно обновляется в соответствии с текущими рекомендациями.
- FoundationOne Heme – для сарком (злокачественных опухолей соединительной ткани) и злокачественных заболеваний кроветворной системы (лимфом, лейкозов и др.).
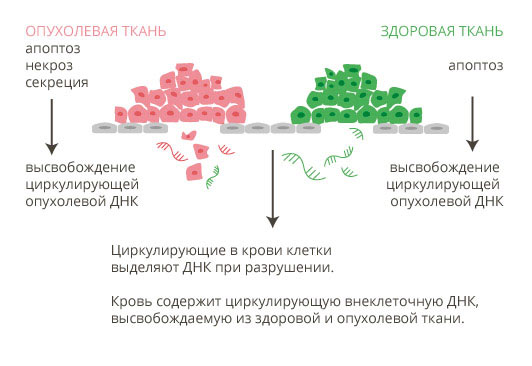
- FoundationOne Liquid – анализ ДНК опухолевых клеток, свободно циркулирующей в крови. Это наиболее современная технология, так называемая жидкостная биопсия. Для того чтобы провести такой анализ, нужны две пробирки с кровью по 8,5 мл.
Кому необходимо такое исследование?
Тест FoundationOne CDx, как правило, показан на поздних стадиях рака, когда нужно подобрать эффективные таргетные препараты, иммунопрепараты. Тесты FoundationOne Heme могут быть использованы для диагностики заболевания, оценки прогноза, выбора подходящего лечения.
Чаще всего анализ FoundationOne CDx применяют при следующих типах рака:
- Немелкоклеточный рак легкого: мутации EGFR, ALK, BRAF.
- Меланома: мутации BRAF.
- Рак молочной железы: мутация HER2.
- Колоректальный рак: мутация KRAS.
- Рак яичников: мутации BRCA1, BRCA2.
Для лечения опухолей с такими мутациями существуют зарегистрированные таргетные препараты. Но этими пунктами список не ограничивается. Решение о необходимости исследования должен принимать лечащий врач в каждом случае индивидуально.
Какую информацию предоставляет лаборатория по результатам анализа?
Отчет состоит из трех частей. В первой части указаны все мутации, обнаруженные в опухоли у данного пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае:
- Таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями.
- Таргетная терапия, которая одобрена для лечения других типов рака с аналогичными мутациями.
- Список клинических исследований, которые могут иметь значение в случае с данным пациентом.
Во второй части отчета представлен литературный обзор с подробными данными об уровне значимости, частоте встречаемости, действии на течение заболевания и возможности использовать тот или иной вид таргетной терапии при выявленных генетических нарушениях. Эта информация регулярно обновляется.
В третьей части отчета указаны клинические исследования, в которых пациент может принять участие.
Анализы FNI уже хорошо себя зарекомендовали на бесплатных образцах по 50 пациентам с раком молочной железы, толстой и прямой кишки, пищевода, желудка, яичников. После тестирования, проведенного компанией Roche, некоторые пациенты, которым не удавалось подобрать таргетные препараты с помощью других методов диагностики, ответили на терапию, составленную в соответствии с рекомендациями лаборатории.
В Европейской клинике доступны наиболее современные методы диагностики и оригинальные противоопухолевые препараты последних поколений. Мы знаем, как помочь при запущенном раке, если лечение, назначенное другим врачом, перестало помогать. Свяжитесь с нами.

ТАСС, 15 июня. Биологи впервые диагностировали раковую опухоль с помощью секвенирования РНК – метода, который позволяет отслеживать изменения в активности отдельных генов в клетках. Об этом пишет пресс-служба МФТИ со ссылкой на статью в научном журнале Biomedicines.
"Мы впервые показали, что результаты РНК-анализа и иммуногистохимических исследований прекрасно соответствуют друг другу. Только для последних нужно сделать намного больше экспериментов и потратить гораздо больше материала. Секвенирование РНК позволяет сразу количественно охарактеризовать работу всех 20 тысяч генов, кодирующих белки", – рассказал один из авторов исследования, заведующий лабораторией в МФТИ Антон Буздин.
По статистике Всемирной организации здравоохранения (ВОЗ), различные формы рака сейчас находятся на втором месте среди всех возможных причин смерти. Примерно каждый шестой человек умирает от злокачественных опухолей или связанных с ними осложнений, и только за прошлый год от рака умерли почти 10 млн человек по всему миру.
Около 90% этих смертей связаны с тем, что врачи или сам больной обнаруживают рак слишком поздно, когда его клетки уже начинают распространяться по организму, а иммунитет не может подавить метастазы. Поэтому ранняя диагностика рака сегодня остается одним из главных приоритетов как для врачей, так и для ученых.
Буздин и его коллеги сделали большой шаг в сторону создания простых и дешевых систем диагностики рака. В помощью их методики можно искать следы самых разных типов опухолей по характерным изменениям в работе всех генов клеток.
Новая диагностика рака
Как правило, медики определяют конкретный тип рака, от которого страдает пациент, с помощью иммуногистохимического исследования. Для этого ученые извлекают небольшой фрагмент опухоли из тела, погружают его в парафин и разрезают на множество тонких слоев. Эти слои окрашиваются при помощи специальных антител, которые могут присоединяться к различным белкам, молекулы которых раковые клетки вырабатывают в больших количествах.
Как правило, у каждого типа рака есть свой собственный набор подобных белковых маркеров, поэтому его диагностика – очень сложная и дорогая процедура. Российские и швейцарские ученые выяснили, как сделать этот процесс быстрее и дешевле, используя те же срезы опухолей, которые применяются при иммуногистохимии.
Буздин и его команда предположили, что те же самые изменения в работе генов, которые фиксируются при помощи антител, можно обнаружить, используя секвенирование РНК. Они проверили, так ли это на самом деле, на 60 образцах опухолей, извлеченных из груди и легких нескольких пациентов, а также из их лимфатических узлов.
Ученые подготовили срезы этих новообразований и обработали их и тем, и другим образом. Далее ученые следили за тем, как менялась активность четырех ключевых генов, связанных с развитием рака груди, а также гена PDL1, нарушения в работе которого служат главным индикатором появления одной из распространенных форм рака легких.
Эксперименты показали, что результаты работы традиционной методики диагностики рака и РНК-секвенирования полностью совпали. Как считают ученые, это говорит о том, что их подход можно уже сейчас применять в медицинской практике для определения типа опухолей и выработки оптимальных стратегий лечения раковых больных.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению — сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента — не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют тестирование — определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все — мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Иногда в процессе деления получаются сбои — мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
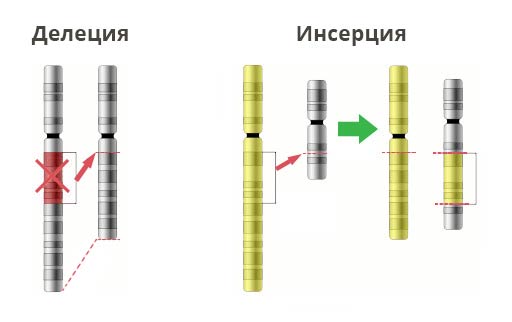
Мутации можно разделить на 4 вида
2. Хромосомные аберрации.
Делеция — утрата участка хромосомы. Происходят обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё — этот ген в хромосоме больше не экспрессируется.
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы — в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
Каждый этап клеточного цикла контролируется
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) — две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF — немелкоклеточный рак легкого;
- BRAF — меланома;
- HER2 — рак молочной железы (РМЖ);
- KRAS — колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
опухоли (антионкогены) — напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация в результате мутации — резко увеличивает вероятность появления злокачественной опухоли.
- мутации BRCA1, BRCA2 — рак молочных желез, яичников;
- мутации p53 — до 50% различных видов раковых опухолей, саркомы;
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
Иматиниб связывается с активным участком молекулы белка , и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения профиля опухоли — начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, , иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, — и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности — полезно для спокойствия пациента.
Отчет получается довольно увесистым — 30 страниц захватывающего чтения
Кому это нужно?
В этом случае исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс — время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом — и остались немутировавшими. Да, мы назначаем препарат по результатам теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли — по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования — без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли — это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов тестирования — все еще редкий случай, к сожалению — для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона — технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) — а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел — нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF — у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.

ТАСС, 15 июня. Биологи впервые диагностировали раковую опухоль с помощью секвенирования РНК – метода, который позволяет отслеживать изменения в активности отдельных генов в клетках. Об этом пишет пресс-служба МФТИ со ссылкой на статью в научном журнале Biomedicines.
"Мы впервые показали, что результаты РНК-анализа и иммуногистохимических исследований прекрасно соответствуют друг другу. Только для последних нужно сделать намного больше экспериментов и потратить гораздо больше материала. Секвенирование РНК позволяет сразу количественно охарактеризовать работу всех 20 тысяч генов, кодирующих белки", – рассказал один из авторов исследования, заведующий лабораторией в МФТИ Антон Буздин.
По статистике Всемирной организации здравоохранения (ВОЗ), различные формы рака сейчас находятся на втором месте среди всех возможных причин смерти. Примерно каждый шестой человек умирает от злокачественных опухолей или связанных с ними осложнений, и только за прошлый год от рака умерли почти 10 млн человек по всему миру.
Около 90% этих смертей связаны с тем, что врачи или сам больной обнаруживают рак слишком поздно, когда его клетки уже начинают распространяться по организму, а иммунитет не может подавить метастазы. Поэтому ранняя диагностика рака сегодня остается одним из главных приоритетов как для врачей, так и для ученых.
Буздин и его коллеги сделали большой шаг в сторону создания простых и дешевых систем диагностики рака. В помощью их методики можно искать следы самых разных типов опухолей по характерным изменениям в работе всех генов клеток.
Новая диагностика рака
Как правило, медики определяют конкретный тип рака, от которого страдает пациент, с помощью иммуногистохимического исследования. Для этого ученые извлекают небольшой фрагмент опухоли из тела, погружают его в парафин и разрезают на множество тонких слоев. Эти слои окрашиваются при помощи специальных антител, которые могут присоединяться к различным белкам, молекулы которых раковые клетки вырабатывают в больших количествах.
Как правило, у каждого типа рака есть свой собственный набор подобных белковых маркеров, поэтому его диагностика – очень сложная и дорогая процедура. Российские и швейцарские ученые выяснили, как сделать этот процесс быстрее и дешевле, используя те же срезы опухолей, которые применяются при иммуногистохимии.
Буздин и его команда предположили, что те же самые изменения в работе генов, которые фиксируются при помощи антител, можно обнаружить, используя секвенирование РНК. Они проверили, так ли это на самом деле, на 60 образцах опухолей, извлеченных из груди и легких нескольких пациентов, а также из их лимфатических узлов.
Ученые подготовили срезы этих новообразований и обработали их и тем, и другим образом. Далее ученые следили за тем, как менялась активность четырех ключевых генов, связанных с развитием рака груди, а также гена PDL1, нарушения в работе которого служат главным индикатором появления одной из распространенных форм рака легких.
Эксперименты показали, что результаты работы традиционной методики диагностики рака и РНК-секвенирования полностью совпали. Как считают ученые, это говорит о том, что их подход можно уже сейчас применять в медицинской практике для определения типа опухолей и выработки оптимальных стратегий лечения раковых больных.
Читайте также:





