Сандостатин при нейроэндокринной опухоли
ЗАБОЛЕВАЕМОСТЬ
Одна из наиболее часто встречающихся опухолей диффузной нейроэндокринной системы!
Опухоль секретирует:
- серотонин
- брадикинин
- 5-гидрокситриптофан
- простагландины
- ВИП
- гистамин
Это приводит к развитию карциноидного синдрома.
Проявления:
- приливы (63-94%). Внезапное появление глубокой красной или фиолетовой эритемы верхней части туловища, в основном лица и шеи. Сопровождается неприятным ощущением тепла, слезотечением, зудом, отеком лица и конъюнктивитом, саливацией и потоотделением, ощущением пульсации.
- диарея (68-84%)
- бронхоспазм (3-19%)
- одышка (3-19%)
- телеангиэктазии (25%)
- изменения сердца (11-53%)
- пеллагроподобный синдром с гиперкератозом и пигментацией (2-6%)
- поражение сердца – карциноидный кардиальный синдром (синдром Хедингера)выявляется более чем у 50% больных.
Синдром обусловлен развитием фиброзных изменений в эндо- и миокарде правых отделов сердца с поражением клапанов.
Характерны стеноз и недостаточность трехстворчатого клапана и клапана легочной артерии.
- Может возникать спонтанно или провоцироваться стрессами, алкоголем, некоторой пищей (например, сыром), инъекциями катехоламинов.
- Первоначальные приступы длятся 2-5 минут, а в дальнейшем их продолжительность может увеличиваться до нескольких часов.
- Кризы чаще возникают при суточной экскреции 5-ГИУК более 200 мг и провоцируются стрессами, наркозом, биопсией или операцией, химиотерапией, давая высокую летальность.
- Высокодифференцированная нейроэндокринная опухоль (доброкачественная).
- Высокодифференцированная нейроэндокринная карцинома (низкой степени злокачественности).
- Низкодифференцированная нейроэндокринная карцинома (мелкоклеточная).
- Смешанная экзокринная и эндокринная карцинома.
- Опухолевоподобное поражение.
- низкий пролиферативный потенциал
- способность секретировать различные биологические вещества
- низкая чувствительность к химиотерапии.
К ним относятся различные карциноиды передней, средней и задней кишки, феохромоцитома, медуллярный рак щитовидной железы.
- высокозлокачественные опухоли с высоким пролиферативным потенциалом
- чувствительны к химиотерапии и лучевой терапии.
К ним относится мелкоклеточный рак легкого и других органов.
- к ним относятся различные опухоли поджелудочной железы (кроме карциноидов)
- чувствительность к химиотерапии данных опухолей умеренная.
- Верхние (2-9%) (передняя кишка): опухоли дыхательных путей, тимуса, пищевода, желудка, двенадцатиперстной кишки, поджелудочной железы. Характерна низкая секреция серотонина, повышенная – гистамина и различных гормонов, атипичное течение карциноидного синдрома, частое метастазирование в кости.
- Средние (75-87%) (средняя кишка): опухоли тонкой кишки, аппендикса, слепой кишки, восходящего отдела ободочной кишки. Гиперсекреция серотонина и других вазоактивных субстанций, карциноидный синдром.
- Нижние (1-8%) (задняя кишка): опухоли поперечно-ободочной и нисходящей ободочной кишки, сигмовидной и прямой кишки. Карциноидный синдром не характерен, частое метастазирование в печень.
- Гормонально-активные опухоли – характерна гиперсекреция гормонов. Клинические симптомы позволяют осуществить раннюю диагностику.
- Гормонально-неактивные опухоли(нет симптомов гиперсекреции гормонов) – до 50% нейроэндокринных опухолей. Клинически проявляются при большой опухолевой массе – на этом этапе опухоль метастазирует, а также может проявляться симптомами сдавления кишки.
- Определение уровня серотонина и его метаболитов в моче. Наиболее распространенный тест – измерение экскреции 5-ГИУК (5-гидроксииндолуксусной кислоты) в суточной моче. Однако данный анализ может давать ложноположительные результаты в зависимости от характера употребляемой больными пищи (цитрусовые, бананы, ананасы, киви, орехи).
- Определение уровня хромогранина А в крови (повышение уровня хромогранина А наблюдают у 87-99% больных), норма - менее 4,5 ммоль/л. Этот плазменный маркер является самым достоверным при НЭО.
- Определение уровня экскреции нейронспецифической енолазы в крови.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
- рентгенография органов грудной клетки
- рентгенография пищевода и желудка
- ирригоскопия
- ЭГДС
- ректороманоскопия
- колоноскопия
- бронхоскопия
- УЗИ
- Ультразвуковая допплерография сосудов
- Эндосонография
- Интраоперационное УЗИ
- Лапароскопическое УЗИ
- Сцинтиграфия костей скелета
- Сцинтиграфия с Октреотидом, меченным 111 In
НЭО на поверхности клеток имеют рецепторы, обладающие высоким сродством к гормону соматостатину. В 87% случаев они присутствуют как в первичной опухоли, так и в метастазах. В связи с этим в последние годы для определения локализации опухоли и метастазов используется радиоизотопный метод с меченным 111 In Октреотидом. Введенный внутривенно Октреотид, 111 In через 24-48 ч. определяется на соматостатиновых рецепторах и позволяет визуализировать соматостатинпозитивную опухоль, а также определить возможность применения аналогов соматостатина для лечения.
Метод с применением Октреотида, 111 In обладает чувствительностью 87%, специфичностью 75% и частотой совпадения диагнозов 87%.
Лечение
Хирургическое лечение
Основной метод лечения НЭО – хирургический. Возможные варианты оперативного вмешательства определяют по локализации опухоли, наличию или отсутствию метастазов и осложнений опухолевого процесса. Однако контроль симптомов при хирургическом лечении достигается не всегда!
Немедикаментозное лечение
Контроль за проявлениями карциноидного синдрома: исключение стрессов, алкоголя, соблюдение диеты.
Биотерапия:
- синтетические аналоги соматостатина: раствор для инъекций Октреотид и лиофилизат для приготовления суспензии для внутримышечного введения пролонгированного действия Октреотид-депо.
- интерферон-?, пролонгированная форма ИНФ-? (PEG-интерферон).
- монохимиотерапия: стрептозоцин, доксирубицин, фторурацил, дактиномицин, этопозид, цисплатин, дакарбазин.
- ПХТ: сочетания стрептозоцина, фторурацила и доксирубицина, цисплатина с этопозидом.
- гипотензивные препараты
- антигистаминные препараты
- диуретики
- бронходилататоры
- антидиарейные препараты.
- Препарат оказывает симптоматический эффект, понижая секрецию гормонов и пептидов, экскретируемых при випомах в 89%, при глюкоганомах в 75%, при инсулиномах в 65%.
- После применения Октреотида-депо при разных НЭО диарея прекращается у 40-60% больных.
- При ВИПомах Октреотид-депо полностью прекращает диарею в 38%случаев, еще у 38% больных значительно её уменьшает.
- Улучшает общее состояние в 75-85% случаев.
- Октреотид-депо контролирует гипогликемию при инсулиномах, некролитические кожные повреждения при глюкоганомах, что значительно улучшает качество жизни пациентов.
При карциноидных опухолях применение Октреотида-депо может приводить к уменьшению выраженности симптомов заболевания, в первую очередь, таких как приливы и диарея. Во многих случаях клиническое улучшение сопровождается снижением концентрации серотонина в плазме и экскреции 5-гидроксииндолуксусной кислоты с мочой.
При опухолях, характеризующихся гиперпродукцией вазоактивного интестинального пептида (ВИПомы), применение Октреотида-депо приводит у большинства больных к уменьшению тяжелой секреторной диареи, которая характерна для данного состояния, что, в свою очередь, приводит к улучшению качества жизни больного. Одновременно происходит уменьшение сопутствующих нарушений электролитного баланса, например, гипокалиемии, что позволяет отменить энтеральное и парентеральное введение жидкости и электролитов. По данным компьютерной томографии у некоторых больных происходит замедление или остановка прогрессирования опухоли, и даже уменьшение ее размеров, особенно метастазов в печень. Клиническое улучшение обычно сопровождается уменьшением (вплоть до нормальных значений) концентрации вазоактивного интестинального пептида (ВИП) в плазме.
При глюкагономах применение Октреотида-депо в большинстве случаев приводит к заметному уменьшению некротизирующей мигрирующей сыпи, которая характерна для данного состояния. У больных, страдающих диареей, Октреотид-депо вызывает ее уменьшение, что сопровождается повышением массы тела. При применении Октреотида-депо часто отмечается быстрое снижение концентрации глюкагона в плазме, однако при длительном лечении этот эффект не сохраняется. В то же время симптоматическое улучшение остается стабильным длительное время.
При гастриномах/синдроме Золлингера-Эллисона Октреотид-депо, применяемый в качестве монотерапии или в комбинации с блокаторами H2-рецепторов и ингибиторами протонного насоса, может снизить образование соляной кислоты в желудке и привести к клиническому улучшению, в т.ч. и в отношении диареи. Возможно также уменьшение выраженности и других симптомов, вероятно связанных с синтезом пептидов опухолью, в т.ч. приливов. В некоторых случаях отмечается снижение концентрации гастрина в плазме.
У больных с инсулиномами Октреотид-депо уменьшает уровень иммунореактивного инсулина в крови. У больных с операбельными опухолями Октреотид-депо может обеспечить восстановление и поддержание нормогликемии в предоперационном периоде. У больных с неоперабельными доброкачественными и злокачественными опухолями контроль гликемии может улучшаться и без одновременного продолжительного снижения уровня инсулина в крови.
У больных с редко встречающимися опухолями, гиперпродуцирующими рилизинг-фактор гормона роста (соматолибериномами), Октреотид-депо уменьшает выраженность симптомов акромегалии. Это, по-видимому, связано с подавлением секреции рилизинг-фактора гормона роста и самого гормона роста. В дальнейшем возможно уменьшение размеров гипофиза, которые до начала лечения были увеличены.
Обнаружено, что применение Октреотида-депо в дозах 30 мг и выше оказывает антипролиферативный эффект, связанный с прямым цитотоксическим действием препарата на опухоль при взаимодействии с соматостатиновыми рецепторами, а также с угнетением образования сосудов, питающих опухоль.
При эндокринных опухолях ЖКТ и поджелудочной железы для больных, у которых подкожное введение Октреотида обеспечивает адекватный контроль проявлений заболевания, рекомендуемая начальная доза Октреотида-депо составляет 20 мг каждые 4 недели.
Подкожное введение Октреотида следует продолжать еще в течение 2 недель после первого введения Октреотида-депо.
Для больных, не получавших ранее Октреотид подкожно, рекомендуется начинать лечение именно с подкожного введения Октреотида в дозе 0.1 мг 3 раза/сут. в течение относительно короткого периода времени (примерно 2 недели) с целью оценки его эффективности и общей переносимости. Только после этого назначают Октреотид-депо по вышеприведенной схеме.
В случае, когда терапия Октреотидом-депо в течение 3 мес. обеспечивает адекватный контроль клинических проявлений и биологических маркеров заболевания, возможно снизить дозу Октреотида-депо до 10 мг, назначаемых каждые 4 недели.
В тех случаях, когда после 3 мес. лечения Октреотидом-депо удалось достичь лишь частичного улучшения, дозу препарата можно увеличить до 30 мг каждые 4 недели.
На фоне лечения Октреотидом-депо в отдельные дни возможно усиление клинических проявлений, характерных для эндокринных опухолей ЖКТ и поджелудочной железы. В этих случаях рекомендуется дополнительное подкожное введение Октреотида в дозе, применявшейся до начала лечения Октреотидом-депо. Это может происходить, главным образом, в первые 2 мес. лечения.
Октреотид-депо – препарат первой линии для монотерапии или комбинированной терапии высокодифференцированных нейроэндокринных опухолей ЖКТ и поджелудочной железы, эффективно купирующий гормональные синдромы за счет подавления гиперсекреции гормонов этими опухолями, повышая качество жизни и выживаемость больных.
Аналоги соматостатина (АСС) играют ключевую роль в лечении диссеминированных высокодифференцированных НЭО, как функционирующих, так и нефункционирующих. Воздействуя на рецепторы соматостатина, они ингибируют гормональную активность НЭО и оказывают прямой антипролиферативный эффект, увеличивая медиану времени до прогрессирования.
В настоящее время считается, что антипролиферативный эффект осуществляется путем связывания с рецепторами соматостатина и с системным воздействием, что приводит к угнетению таких клеточных функций, как секреция, подвижность и пролиферация.
АСС являются терапией первой линии при функционально активных НЭО, включая опухоли с проявлениями карциноидного синдрома и других функционально активных НЭО.
Препараты пролонгированного действия (ланреотид 120 мг глубоко подкожно 1 раз в 28 дней, октреотид 20-30 мг внутримышечно 1 раз в 28 дней) используются в течение длительного времени при успешном контроле симптомов, вызванных гиперсекрецией функционально активных НЭО.
АСС рекомендуются в качестве первой линии системной терапии при высокодифференцированных НЭО для контроля роста опухоли. Согласно рекомендациям ENETS 2016 года, АСС можно использовать в качестве первой линии системной терапии при НЭО G1 и G2 (Ki67
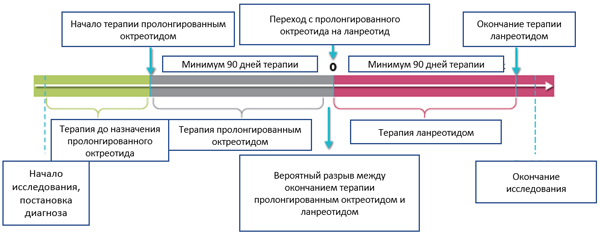
Причинами перехода были: прогрессирование (n=20; 22%), изменение формы введения препарата (n=14; 15,4%), предпочтение пациента (n=9; 9,9%), не указана причина перехода (n=33; 36,3%)
После постановки диагноза ГЭП НЭО пациенты начинали терапию октреотидом в среднем через 17 мес. и получали октреотид в среднем в течение 38,4 мес.
Клинически подтвержденное прогрессирование на момент начала терапии ланреотидом наблюдалось у 24,2% пациентов.
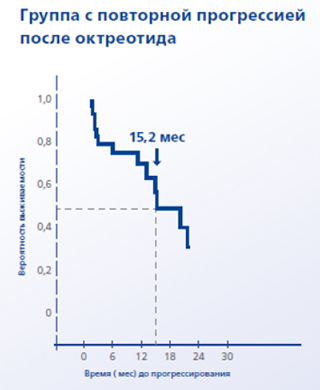
В группе с повторной прогрессией после перехода с пролонгированного октреотида на ланреотид время до повторного прогрессирования составило 15,2 мес.
Частота встречаемости ассоциированных с заболеванием симптомов и нежелательных явлений:
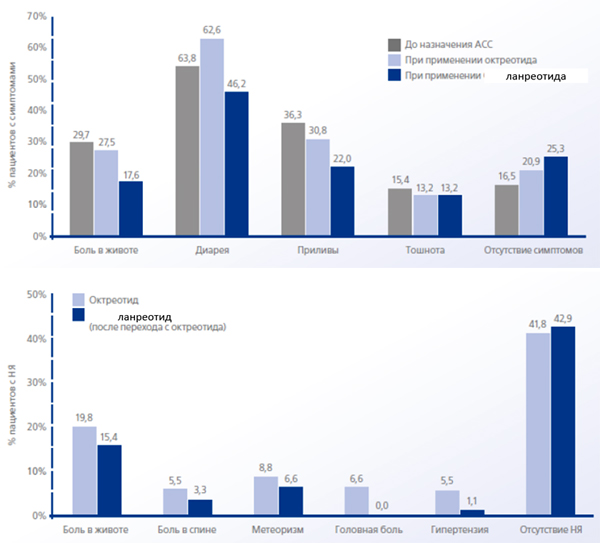
- Проведенный ретроспективный анализ показал возможность перехода с пролонгированного октреотида на ланреотид у пациентов с локально распространенными или метастатическими ГЭП НЭО.
- В группе с повторной прогрессией после перехода с пролонгированного октреотида на ланреотид время до повторного прогрессирования составило 15,2 мес.
- Пациентам с локально распространенными или метастатическими ГЭП НЭО, как непрогрессирующими, так и прогрессирующими, может быть осуществлен безопасный переход с пролонгированного октреотида на ланреотид [2].
Таким образом, выбор терапии для лечения нейроэндокринных опухолей зависит от локализации, морфологических и функциональных особенностей. Основные алгоритмы и подходы к лечению были опубликованы в клинических рекомендациях ENETS 2016 года. Аналоги соматостатина (ланреотид и октреотид) являются первой линией терапии для высокодифференцированных опухолей, тогда как химиотерапия – стандарт лечения низкодифференцированных НЭО.
- Емельянова Г.С., Орел Н.Ф. Лекарственная терапия нейроэндокринных опухолей. Фарматека, №12, 2018, С.76-80.
- Pavel M., O’Toole D., Costa F., et al. ENETS Consensus Guidelines Update for the Management of Distant Metastatic Disease of Intestinal, Pancreatic, Bronchial Neuroendocrine Neoplasms (NEN) and NEN of Unknown Primary Site. Neuroendocrinology 2016; 103: 172-185.
- Wasif M. Saif, Rohan Parikh, et al. The sequencing of lanreotide (LAN) after octreotide LAR (OCT) for the treatment of gastroenteropancreatic neuroendocrine tumors (GEP-NETs). Poster. Presented at the North American Neuroendocrine Tumor Society (NANETS), Seattle, Washington, USA, October 4-6, 2018.


Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Нейроэндокринные опухоли
Происхождение этих опухолей относится к АПУД-системе, представленной эндокринными клетками, широко распространенными в различных органах и тканях человека.
Ее клетки (апудоциты) относятся к дериватам нейроэктодермы и вырабатывают различные биогенные амины и полипептиды, обладающие функциями гормонов.
Поскольку большинство нейроэндокринных опухолей являются гормонально-активными, в клинической картине превалируют изменения, связанные с гиперпродукцией того или иного гормона либо биогенного амина. Однако имеются и негормонопродуцирующие нейроэндокринные опухоли.
К нейроэндокринным опухолям относятся также множественные эндокринные неоплазии (МЭН) — группа аутосомно-доминантных опухолевых синдромов. Различают два типа: I и II. МЭН I включает следующие поражения: аденома гипофиза, опухоли из островковых клеток, гиперплазия паращитовидных желез. МЭН II — медуллярный рак щитовидной железы, двусторонняя феохромоцитома, гиперплазия щитовидных желез, множественные ганглионевромы слизистых оболочек (губ, языка, век), иногда синдром Кушинга.
Наиболее часто встречаются нейроэндокринные опухоли, которые локализуются в колоректальной области и тонкой кишке. Доказано, что нейроэндокринные опухоли содержат большое количество серотонина, основным метаболитом которого является 5-гидроксиндолилуксусная кислота.
Клиническая картина этих гормонально-активных нейроэндокринных опухолей связана с повышением содержания серотонина и характеризуется диареей, покраснением лица, вазомоторными реакциями, гипертензией, бронхоспазмами, отеками, обмороками (карциноидный синдром). К нейроэндокринным опухолям ЖКТ относятся такие редкие опухоли, как глюкагонома, гастринома, инсулинома, ВИПомаидр. Для гастрином характерны гастриты, диарея, язвы ЖКТ, синдром Золлингера-Эллисона. При инсулиноме отмечается гипогликемия с соответствующей ей клинической картиной. Синдром Вернера-Моррисона при ВИПоме проявляется диареей (до 5 л в день), гипокалиемией, ахлоргидрией. Более редко встречаются глюкагонома, соматостатинома, опухоль, продуцирующая гормон роста.
По классификации ВОЗ (2000), нейроэндокринные опухоли по степени дифференцировки разделены на пять больших категорий:
1) высокодифференцированная нейроэндокринная опухоль;
2) высокодифференцированная эндокринная карцинома;
3) низкодифференцированная нейроэндокринная карцинома (мелкоклеточная);
4) смешанная экзокринная эндокринная опухоль;
5) редкие нейроэндокриноподобные поражения.
Для диагностики и выбора метода лечения в опухоли определяют иммуногистохимически панэндокринные маркеры — хромогранин А, синаптофизин и нейронспецифическую энолазу (NSE), а также оценивают пролиферативную активность по маркеру пролиферации Ki-67, в сыворотке крови определяют хромогранин А, в моче — уровень 5-гидроксииндолилуксусной кислоты. Уровень рецепторов октреотида оценивают с помощью сканирования с меченым октреотидом (Индий In-111 пентетреотид).
Основным методом лечения этих опухолей считается хирургический, однако большинство больных к моменту постановки диагноза имеют отдаленные метастазы. Тем не менее при наличии резектабельных метастазов в печени в первую очередь должен рассматриваться вопрос о возможности выполнения паллиативной операции.
В случае множественного поражения обеих долей обычно проводится эмболизация либо химиоэмболизация (с доксорубицином, реже — смитомицином или цисплатином) печеночной артерии. Кратковременного (3-12 мес.) значительного уменьшения проявлений карциноидного синдрома после выполнения этой процедуры обычно удается достичь у большинства больных. Циторедуктивные процедуры могут включать также высокочастотную абляцию. За рубежом изучается опухолево-направленное радиоактивное лечение на базе аналогов соматостатина.
Злокачественные нейроэндокринные опухоли в ряде случаев характеризуются относительно медленным ростом; моментом же, определяющим тяжесть состояния и представляющим непосредственную угрозу жизни, является активная продукция гормонов с соответствующими метаболическими нарушениями.
Погибает 1/3 пациентов с карциноидным синдромом от вызываемой им сердечной недостаточности. У этих больных применение аналогов соматостатина, в частности октреотида (Сандостатин ЛАР, октреотид-депо) и ланреотида, служит одним из важнейших компонентов комплексного лечения, позволяя полностью снять тягостную симптоматику в 30-75% случаев. Частичные ремиссии регистрируются у 10-20% больных, стабилизация в течение 8-16 мес. — у 50%. В последнее время появились сообщения и об антипролиферативном действии высоких доз пролонгированного октреотида. Для лечения нейроэндокринных опухолей используется также ИФН-а, позволяющий в 15% случаев добиться регрессии опухоли.
На сегодняшний день у этих больных используются пролонгированные аналоги соматостатина (Сандостатин ЛАР, октреотид-депо, ланреотид) и ИФН-а (ПЭГ-интерферон). Общая выживаемость больных со злокачественными карциноидами и карциноидным синдромом увеличилась с 2 до 9 лет и более.
Помимо симптоматического эффекта Сандостатин ЛАР также обладает противоопухолевой активностью в дозе 30 мг 1 раз в 28 дней, поэтому его можно назначить и пациентам без клинических проявлений, чтобы предотвратить рост опухоли. Согласно исследованию PROMID, Сандостатин ЛАР в 3 раза увеличивает время до прогрессирования у пациентов с высокодифференцированными НЭО кишечника (как с функционирующими, так и нефункционирующими опухолями).
Алгоритм выбора терапии при невозможности хирургического лечения у больных с высокодифференцированными нейроэндокринными опухолями представлен на схеме. При нейроэндокринных опухолях изучаются таксаны, иринотекан, темозоломид, араноза, капецитабин, а также таргетные препараты: бевацизумаб, сунитиниб, сорафениб, эверолимус и новый аналог соматостатина SOM 230.
Октреотид (Сандостатин) — 50-500 мкг п/к 3 раза в сутки (доза подбирается индивидуально). Депонированная форма октреотида (Сандостатин ЛАР, октреотид-депо, ланреотид): для больных, получавших ранее октреотид, рекомендуемая начальная доза Сандостатина ЛАР 20 мг в/м каждые 28 дней.
Лечение октреотидом продолжается в эффективной дозе еще 2 нед. после инъекции Сандостатина ЛАР; для больных, ранее не получавших октреотид, лечение начинают с Сандостатина в дозе 100 мкг 3 раза в сутки в течение 2 нед. При хорошей переносимости и клиническом эффекте переходят на Сандостатин ЛАР.
Доза Сандостатина ЛАР может регулироваться после 3 мес. лечения: при хорошем контроле симптомов и биологических маркеров доза может быть уменьшена до 10 мг каждые 4 нед, при возврате симптомов дозу повышают до 20 мг; если симптомы контролируются только частично, то доза может быть повышена до 30 мг каждые 4 нед.
Ланреотид — дозы и режимы лечения подбирают индивидуально после оценки ответной реакции. Обычно рекомендуется 60-120 мг в/м каждые 4 нед.
Октреотид-депо, так же как Сандостатин ЛАР, обычно применяют в дозе 20 мг 1 раз в месяц, при необходимости доза может быть увеличена.
Интерферон (ИФН)-а — 3-5 млн ЕД п/к 3 раза в неделю. Доза подбирается индивидуально по переносимости.
Комбинированная химиотерапия
1. Циклофосфамид — 500 мг/м2 в/в в 1-й и 8-й дни. Фторурацил — 500 мг/м2 в/в в 1-й и 8-й дни. Стрептозоцин — 500 мг/м2 в/в в 1-й и 8-й дни. Интервал между курсами 4 нед.
2. FAOS. Фторурацил — 400 мг/м2 в/в в 1-й и 8-й дни. Доксорубицин — 30 мг/м2 в/в в 1-й день. Циклофосфамид — 75 мг/м2 внутрь в 1-14-й день. Стрептозоцин — 400 мг/м2 в/в в 1-й и 8-й дни. Интервал между курсами 4 нед.
3. Цисплатин — 80 мг/м2 в/в капельно в 1-й день. Этопозид — 120 мг/м2 в/в капельно в 1-3-й день. Повторение цикла каждые 4 нед.
4. Карбоплатин — AUC 4-5. Этопозид — 100 мг/м2 в 1-3-й день. Повторение цикла каждые 4 нед.
5. Доксорубицин — 50 мг/м2 в/в в 1-й день. Стрептозоцин — 500 мг/м2 в/в в 1-4-й день. Повторение цикла каждые 4 нед.
6. Стрептозоцин — 1 г/м2 в/в в 1-й день. Фторурацил — 600 мг/м2 в/в в 1-й день или 325 мг/м2 в 1-5-й день. Повторение цикла каждые 4 нед.
7. Дакарбазин — 200 мг/м2 в/в в 1-3-й день. Эпирубицин (Фарморубицин) — 25 мг/м2 в/в в 1-3-й день. Фторурацил — 250 мг/м2 в/в в 1-3-й день. Повторение цикла каждые 3 нед.
8. Темозоломид — 150 мг/м2/сут внутрь 7 дней, перерыв 7 дней. Бевацизумаб — 5 мг/кг в/в 1 раз в 2 нед. Продолжительность курса 22 нед.
9. Темозоломид — 150 мг/м2/сут внутрь в 1-5-й день. Капецитабин (Кселода) — 2 г/м2/сут внутрь в 1-14-й день. Повторение цикла каждые 28 дней.
Алгоритм выбора лечения при метастатических нейроэндокринных опухолях

Хемодектомы (параганглиомы)
Наиболее часто встречаются хемодектомы шеи (каротидного гломуса, блуждающего нерва) и среднего уха. При хемодектомах выявляется повышенное содержание катехоламинов (норадреналина, адреналина, дофамина) в моче и в опухоли. В 54% случаев хемодектомы гормонально-активны.
Ведущий методом в лечении хемодектом — хирургический. После радикальной операции профилактическая лучевая терапия и химиотерапия (XT) не используются. XT недостаточно эффективна, объективный эффект отмечается не более чему 15-20% больных.
2. Винкристин — 1 мг/м2 в/в в 1-й и 8-й дни. Доксорубицин — 35 мг/м2 в/в в 1-й день. Циклофосфамид — 500 мг/м2 в/в в 1-й день. Блеомицин — 15 мг в/м во 2-7-й день. Преднизолон — 30 мг/м2 внутрь в 1-8-й день. Интервал между курсами 4 нед.
3. Винкристин — 1 мг/м2 в/в в 1-й и 8-й дни. Доксорубицин — 30 мг/м2 в/в в 1-й день. Циклофосфамид — 500 мг/м2 в/в в 1-й день Цисплатин — 100 мг/м2 в/в капельно во 2-й день. Интервал между курсами 4 нед.
Метастазы из невыявленного первичного очага
Метастазы из невыявленного первичного очага (НПО) имеют около 3-5% больных с зпервые установленным диагнозом злокачественной опухоли. Это гетерогенная группа заболеваний, впервые проявляющихся метастазами и имеющих плохой прогноз.
Наиболее часто таким образом манифестирует рак легкого и поджелудочной железы, несколько реже — колоректальный рак (КРР), рак молочной железы (РМЖ), рак простаты и др. У 15-25% больных первичную опухоль не удается обнаружить при последующей аутопсии.
Медиана выживаемости пациентов с метастазами из НПО, как правило, не превышает 0,5 года, составляя в среднем 3-4 мес. Хотя большинство заболеваний рефрактер-о к системной терапии, современное противоопухолевое лечение, в частности химио- и гормонотерапия, может улучшить выживаемость и некоторая часть больных живет значительно дольше. 1-летняя выживаемость при метастазах из НПО составляет 25%, 5-летняя — 10%.
Диагностический алгоритм у больных с метастазами злокачественной опухоли из НПО включает оценку общего состояния пациента, морфологическую верификацию опухоли, оценку распространенности процесса и поиск первичного очага.
Морфологическому исследованию опухоли отводится основная роль в постановке диагноза. Проводится рутинное гистологическое исследование, иммуногистохимическое исследование, при необходимости — электронная микроскопия, а также определяются гормональные рецепторы, по показаниям — HER2 и другие опухолевые маркеры.
Важное значение имеет степень дифференцировки опухоли: для умеренно и высокодифференцированных опухолей необходимо установить эпителиальную или неэпителиальную природу, в группе эпителиальных опухолей определить, аденокарцинома это или плоскоклеточный рак (ПКР). В ряде случаев морфологическое исследование может предположительно установить первичный очаг и наметить направление дальнейшего клинического поиска.
Поражение верхних и средних шейных лимфоузлов, как правило, обусловлено ПКР и опухолями головы и шеи. Значительно реже опухоли головы и шеи могут быть представлены аденокарциномами и анаплазированным раком.
Поражение нижних шейных и надключичных лимфоузлов чаще связано с аденокарциномой. У этих больных впоследствии нередко выявляется рак легкого или ЖКТ. Плоскоклеточный рак с поражением этой же группы лимфоузлов чаще исходит из легкого.
До 40% метастазов аденокарциномы из НПО составляет рак легкого и поджелудочной железы. По 10% аденокарцином приходятся на рак желудка, толстой кишки, печени и желчных путей. Аденокарциномы и недифференцированные карциномы с метастазами в печени и левых надключичных лимфоузлах, как правило, исходят из ЖКТ.
Лечебная тактика при метастазах злокачественной опухоли из НПО зависит от ее морфологического строения, степени распространенности и предполагаемой локализации первичного очага. Основная задача морфологического исследования заключается в выявлении опухолей, лечение или эффективный контроль которых реально возможны (лимфомы, герминогенные, трофобластические и нейроэндокринные опухоли, РМЖ, рак простаты, яичников и др.). Химиотерапия проводится по стандартным схемам в зависимости от гистологии и предполагаемой нозологии.
Плоскоклеточный рак. Если выявлены метастазы ПКР только в одной группе лимфоузлов, возможна длительная выживаемость при адекватной лечебной тактике. Метастазы ПКР в лимфоузлах шеи требуют тщательного исследования верхних дыхательных путей, т.к. у 2-5% больных с опухолями этой локализации заболевание впервые проявляется таким образом. У 10% больных этой группы выявляется билатеральное поражение лимфоузлов.
Пациенты с вовлечением шейных лимфоузлов выше надключичной области должны получать полный курс лучевой терапии на область от основания черепа до ключиц. Как альтернативный вариант можно применять радикальную лимфодиссекцию с последующей лучевой терапией. Лучевая терапия необходима для воздействия на возможные скрытые очаги в области головы и шеи. Выживаемость в этой группе такая же, как у больных с выявленным первичным очагом в области головы и шеи (от 35 до 59%).
Изолированное поражение подмышечных лимфоузлов — это, как правило, рак легкого. Изолированное поражение паховых лимфоузлов встречается редко. Больным этих двух групп показана регионарная лимфодиссекция с последующей лучевой терапией.
При диссеминированном ПКР проводится системная XT по схемам, разработанным для рака головы и шеи и немелкоклеточный рак легкого (НМРЛ).
ПКР с генерализованным вовлечением лимфоузлов, как правило, сочетается с поражением внутренних органов и практически не поддается лечению.
Аденокарцинома и низкодифференцированная карцинома
У женщин с метастазами аденокарциномы или низкодифференцированного рака обязательна маммография и исследование органов малого таза, а также определение рецепторов гормонов и НЕR2-статуса. Если в результате обследования предполагается первичная опухоль в молочной железе и имеет место поражение подмышечных лимфоузлов, проводят лечение, как при РМЖ II-III стадии: иссечение лимфоузлов с последующей лучевой терапией на молочную железу и подмышечную область; радикальная мастэктомия с последующей лучевой терапией; адъювантная химио- и гормонотерапия.
Женщинам с метастазами аденокарциномы в брюшной полости проводится XT, как при раке яичников (комбинации на основе цисплатина), с включением на определенном этапе адекватной хирургической циторедукции.
У мужчин с метастазами аденокарциномы или низкодифференцированного рака обязательно определение сывороточной фосфатазы, простатспецифического антигена (ПСА), хорионического гонадотропина (ХГ), а-фетопротеина (АФП) и лактатдегидрогеназы (ЛДГ) для исключения рака простаты и герминогенных опухолей. При повышении уровня ПСА проводится гормонотерапия, как при раке простаты. При положительных реакциях на АФП и ХГ проводится лечение, как при герминогенных опухолях.
Если выявлены метастазы низкодифференцированной карциномы в верхних и средних лимфоузлах шеи, проводится лечение, как при опухолях головы и шеи.
При метастазах аденокарциномы и низкодифференцированного рака из НПО применяют химиотерапию на основе цисплатина: ВЕР (блеомицин, этопозид, цисплатин), ЕР (этопозид, цисплатин). Эти комбинации дают до 60 % объективных эффектов и до 20 % полных ремиссий. Длительная выживаемость около 13%. Комбинации на основе паклитаксела дают до 45 % объективных эффектов, а комбинации доксорубицина с митомицином С — до 30%.
У 5% больных с метастазами меланомы не удается обнаружить первичную опухоль. При поражении одной группы лимфоузлов заболевание расценивается как II стадия и основным методом лечения служит радикальная лимфаденэктомия. При диссеминированном процессе проводится стандартная системная XT: дакарбазин и комбинации на его основе, производные нитрозомочевины и комбинации с цисплатином.
Нейроэндокринная карцинома
Плоскоклеточный рак CF
Цисплатин — 100 мг/м2 в/в капельно в 1-й день.
Фторурацил — 1000 мг/м2 в/в капельно 24-часовая инфузия в 1-4-й день.
Повторение цикла каждые 3 нед.
Метотрексат — 40 мг/м2 в/м в 1-й и 15-й дни.
Блеомицин — 10 мг в/м в 1,8 и 15-й дни.
Цисплатин — 50 мг/м2 в/в капельно в 4-й день.
Повторение цикла каждые 3 нед.
Аденокарцинома, низкодифференцированный рак
Блеомицин — 30 мг в/в или в/м 1 раз в неделю в течение 12 нед.
Этопозид — 100 мг/м2 в/в капельно ежедневно в 1-5-й день.
Цисплатин — 20 мг/м2 в/в капельно ежедневно в 1-5-й день.
Повторение цикла каждые 3 нед.
Цисплатин — 20 мг/м2 в/в капельно ежедневно в 1-5-й день.
Этопозид — 100 мг/м2 в/в капельно ежедневно в 1-5-й день. Повторение цикла каждые 3 нед. или Этопозид — 120 мг/м2 в/в капельно в 1,3 и 5-й дни.
Цисплатин — 80 мг/м2 в/в капельно в 1-й день.
Повторение цикла каждые 3 нед.
Паклитаксел — 175 мг/м2 в/в 3-часовая инфузия в 1-й день.
Карбоплатин — AUC 6 в/в капельно 30-60-минутная инфузия в 1-й день.
Этопозид — 50 и 100 мг/сут внутрь чередовать с 1-го по 10-й день.
Повторение цикла каждые 3 нед.
Доксорубицин — 50 мг/м2 в/в в 1-й и 22-й дни.
Митомицин — 10 мг/м2 в/в в 1-й день.
Повторение цикла каждые 42 дня.
Гемцитабин — 1000 мг/м2 в/в капельно 30-минутная инфузия в 1-й и 8-й дни.
Иринотекан — 100 мг/м2 в/в капельно 90-минутная инфузия в 1-й и 8-й дни.
Повторение цикла каждые 3 нед.
Доцетаксел — 75 мг/м2 в/в капельно в 1-й день с пре- и постмедикацией.
Карбоплатин — AUC 5-6 или Цисплатин — 75 мг/м2 в/в капельно в 1-й день.
Повторение цикла каждые 3 нед.
Н.Ф. Орел, Л.В. Манзюк, Е.В. Артамонова
Читайте также:

