С каким заболеванием можно спутать лейкоз
Врач-гематолог, доктор медицинских наук Сергей Семочкин про острый лимфобластный лейкоз

Врач-гематолог, профессор кафедры онкологии, гематологии и лучевой терапии РНИМУ им. Н. И. Пирогова Минздрава России, доктор медицинских наук Сергей Семочкин рассказал: можно ли распознать острый лимфобластный лейкоз (ОЛЛ) на ранней стадии и поставить диагноз по анализу крови; объяснил, как лечат ОЛЛ и кому показана трансплантация костного мозга (ТКМ).
Как правило, в анализе крови есть ярко выраженные показатели: изменены ростки кроветворения, количество лейкоцитов выходит за пределы нормы - может упасть ниже нормальных значений, а может стать запредельно огромным. Мне встречались пациенты, у которых количество лейкоцитов при норме от 4 до 9 тысяч повышалось до 200 тысяч на мкл. Тромбоциты тоже в ряде случаев очень сильно снижены, но главное – изменение количества лейкоцитов. Очень важным маркером является выход опухолевых клеток в кровь, когда в крови появляются незрелые ранние клетки, которые называют бластными. Если в анализе крови выявили бластные клетки, то это, скорее всего, либо острый лейкоз, либо миелодиспластический синдром.
Анализ крови с характерными изменениями - повод для немедленного вызова скорой помощи и госпитализации пациента в профильный стационар. При лечении детей и подростков у онкогематолога, как правило, есть один-два дня ни диагностику, лечение необходимо начинать, как можно раньше. В диагностику входит повторный анализ крови, затем – верификация диагноза, для которой проводят биопсию костного мозга. У маленьких детей ее проводят под общей анестезией, у взрослых - под местной. С помощь небольшой иглы делаю прокол грудины или подвздошной кости. У детей пункцию грудины не делают. Полученный образец костного мозга, который выглядит как обычная пробирка с кровью, отправят в лабораторию, где для подтверждения диагноза проведут целый спектр исследований. Главный критерий – увеличение количества бластных клеток. Только по внешнему виду и по количеству бластных клеток определить вариант лейкоза – невозможно. Еще в 1913 году установили, что есть лимфоидный, а есть миелоидный вариант лейкоза. Для верификации применяются специальные лабораторные методы: иммунологические и химические. Существует специальный прибор – проточный цитометр, с помощью которого определяют маркеры, характеризующие данный тип клеток. Для определения подвида острого лейкоза, применяют целый спектр генетических исследований, чтобы выйти на более целевую терапию у этих пациентов.
Истинную причину возникновения лейкоза у взрослых можно выявить только в 5% случаев, в 95% совершенно непонятно, что там к чему привело. У детей все несколько интересней.
Как возникает лейкоз? В генетическом материале клетки возникает некая первичная мутация, которая сама по себе далеко не всегда приводит к лейкозу. В дальнейшем к этой мутации присоединяются другие, и когда болезнь все же возникает, в клетке накоплено уже много молекулярных событий, сочетание которых привело возникновению заболевания. Пик острого лимфобластного лейкоза приходится на детей от двух до четырех лет, потом заболеваемость падает. Следующий пик приходится на 18-29 лет, потом снова спад. После 60 лет - опять небольшой рост.
У части детей раннего возраста прослеживается некая врожденная составляющая этой проблемы. Встречаются случаи ОЛЛ у плода или новорожденного, когда ребенок рождается уже с заболеванием, либо заболевает в течение первого года жизни. Исследования пуповинной крови показали, что у новорожденных встречаются лейкемические поломки, врожденные мутации, которые могут привести к возникновению лейкоза. И мутацию эту вызывает наследственный фактор, сработавший во время внутриутробного развития. По разным данным, общее количество таких младенцев составляет от 1 до 5%. Дальше многое зависит от инфекционной обстановки, сложившейся вокруг ребенка. Многочисленные инфекции, перенесенные в детстве, способствуют формированию нормальной иммунной системы, которая нейтрализует наследственный фактор.
Если говорить про экологические проблемы, то с ними четкой связи не выявлено.
В Хиросиме и Нагасаки повышенная заболеваемость держалась около 12 лет. После Чернобыля у многих пострадала щитовидная железа, но заболеваемость лейкозами не выросла. Все зависит от типа изотопов попавших в окружающую среду. В Фукусиме тоже этого не случилось, потому что концентрация радиоактивных веществ сильно разбавилась морской водой.
Вред ультрафиолета научно доказан только в отношении меланомы. Четкой связи с ОЛЛ нет. Своим бывшим пациентам мы не разрешаем посещать солярий и не рекомендуем загорать, потому что хотя связь и не доказана, совсем исключать этот фактор тоже нельзя.
Если говорить об СВЧ-излучении, домашние микроволновые печи абсолютно безопасны.
В отличие от острого миелоидного лейкоза, показаний к аллогенной (от донора) ТКМ меньше. Ее назначают пациентам, которые не достигли ремиссии в указанные протоколом сроки или имеют неблагоприятный цитогенетический вариант заболевания. В детской практике выздоравливают более 90% детей, и примерно 15-20% являются кандидатами для аллогенной ТКМ. У взрослых процент пациентов нуждающихся в трансплантации несколько выше, за счет того, что генетических операций высокого риска становится намного больше и ответ на стандартное лечение хуже. Когда мы обсуждали хронический миелолейкоз, там фигурировала филадельфийская хромосома - транслокация (9;22). При ОЛЛ это абсолютно негативный фактор прогноза. У детей такая мутация встречается меньше чем в 5% случаев, у людей старше 50-60 лет примерно половина В-линейных ОЛЛ будет с филадельфийской хромосомой. В отличие от хронического миелолейкоза, применение ингибиторов тирозинкиназы при остром лимфобластном лейкозе не столь успешно. Вот поэтому во взрослой практике ТКМ необходимо проводить примерно 30% пациентов. Возрастной порог для аллогенной ТКМ - в районе 55 лет, это разумно.
Если мы говорим про взрослых людей, то рецидивы случаются почти в 40% случаев. Бывают ранние рецидивы, которые случаются прямо на терапии. В таком случае необходимо менять лечение, делать его более интенсивным и тяжелым. В таких случаях, как правило, показана ТКМ. Поздний рецидив может случиться и через 20 лет. К сожалению мы не можем убрать причину, которая вызывает это заболевание - оно может вернуться.
Длительная химиотерапия нарушает фертильность, поэтому лучше провести криоконсервацию спермы/яйцеклетки, а еще лучше эмбриона - это более надежный способ. У мужчин, как правило, серьезно нарушается сперматогенез, но у женщин дело обстоит несколько лучше. Вероятность забеременеть и выносить здорового ребенка высока. Если прошло не менее пяти лет в ремиссии, никаких ограничений нет.
Скорее, нет. Это не такое частое явление, как при некоторых других заболеваниях, где беременность действительно может стать провоцирующим фактором.
Лимфобластный лейкоз – редкое заболевание, поэтому вероятность того, что он случится у ребенка, рожденного от родителей после ОЛЛ, крайне мала.
Представляется, что в основе лечения онкологических заболеваний в будущем станет активация собственного иммунитета. Нам необходимо настроить иммунную систему таким образом, чтобы она распознавала и убирала раковые клетки. Сейчас мы находимся на раннем этапе развития CAR-T-терапии, но через какое-то время технологии настолько усовершенствуются, что, скорее всего, она станет одним из основных методов терапии при целом ряде онкогематологических заболеваний. Суть метода заключается в том, что у пациента собирают его собственные Т-лимфоциты и отправляют в специальную лабораторию. Эта лаборатория может быть в другом городе, стране - не важно. В лаборатории эти Т-лимфоциты перепрограммируются: в них появляется информация об опухолевых клетках, присутствующих в организме пациента. После перепрограммирования Т-лимфоциты вводят обратно пациенту, она находят раковые клетки и возникает ремиссия. Основные проблемы – создать качественный процесс распознавания и разработать стандартные протоколы лечения.
Много вопросов возникает в понимания биологии заболевания, потому как каждый конкретный случай весьма индивидуален. Мы знакомы только с грубыми поломками, но каждая отдельная поломка провоцирует различное течение болезни. Мы уже сейчас можем полностью секвенировать геном опухолевой клетки и главное научиться понимать, что в патогенезе является ключевым и как на это можно воздействовать, тогда мы ближе подойдем к полному излечению болезни. За этим будущее.

Лейкоз (син. – лейкемия) – это онкологическое заболевание, возникающее в костном мозге вследствие мутаций стволовых клеток. Результатом подобных мутаций является потеря способности клеток крови развиваться до зрелых форм. Как любое злокачественное заболевание лейкозы имеют морфологический субстрат – бластные клетки. Неконтролируемый рост бластных клеток, их неспособность полноценно выполнять свои функции и вытеснение центров нормального кроветворения, обуславливают симптомы заболевания.
Выделяют острые лейкозы и хронические. Важно отметить, что острый лейкоз не может перейти в хронический, а хронический обостриться. Терминами острый и хронический обозначают не характер течения процесса, а абсолютно разные болезни. В зависимости от того, какие клетки костного мозга поражены, лейкозы подразделяют на лимфобластные и миелоидные формы. В свою очередь лимфоидный лейкоз может быть Т и В клеточным. В первом случае бластные клетки являются незрелыми предшественниками Т лимфоцитов, во втором – В лимфоцитов. Острый миелоидный лейкоз может быть нескольких видов: из предшественников эритроцитов, тромбоцитов, нейтрофилов и пр. В отличие от острого миелоидного лейкоза, при хронической форме, превалируют более зрелые клетки крови. Самым распространенным и благоприятным является острый лимфобластный лейкоз. Хронический лимфобластный лейкоз у детей не встречается.
Среди детских онкологических болезней лейкозы занимают первое место, что составляет около 35%. Наиболее часто болеют дети в возрасте от 2 до 5 лет. Риск развития лейкоза по статистике незначительно выше у мальчиков.
Причины лейкозов у детей.
На сегодняшний день ученым еще не удалось окончательно установить причину возникновения лейкозов у детей, однако разработан ряд убедительных теорий, подтверждаемых современными научными исследованиями. Одной из наиболее распространенных теорий является генетическая . Согласно ей, в результате случайных изменений хромосом, возникающих внутриутробно у плода, формируются аномальные гены. Они запускают производство аномальных веществ, блокирующих нормальное созревание клеток крови.
Второй, не менее распространенной теорией является вирусная . Очень часто в практической деятельности врач сталкивается с ситуацией, когда лейкоз у ребенка развивается на фоне недавно перенесенной вирусной инфекции. Как правило, это инфекционный мононуклеоз, ветряная оспа, аденовирусная инфекция. Вероятнее всего вирусы приводят к возникновению лейкоза путем встраивания в клеточный геном и вызывая в нем различные поломки. Помимо этого, вирусная инфекция приводит к чрезмерно активному делению иммунных клеток, что так же можно отнести к фактору риска. Во многих лейкозных клетках можно обнаружить геном того или иного вируса, что является убедительным подтверждением данной теории.
Теория иммунодефицита . Всем известно, что иммунная система человека выполняет одну из важнейших функций – уничтожение чужеродных микроорганизмов и веществ, попавших к нам в организм. Однако помимо борьбы с агентами, попавшими извне, иммунная система направлена на уничтожение наших собственных патологически измененных клеток, в том числе и злокачественных. При снижении иммунитета эта функция не осуществляется в полном объеме, что создает благоприятную почву для неконтролируемого роста бластных клеток.
Вторичное развитие лейкозов . Современные схемы лучевой и химиотерапии позволили добиться значительных успехов в излечении детей от онкологических заболеваний. Но на обратной стороне медали скрываются отдаленные последствия подобного лечения. Речь идет о развитии вторичных опухолей, в том числе и лейкозов.
Облучение матери во время беременности (рентген, компьютерная томографя), употребление алкоголя, наркотических веществ и курение, так же является фактором риска в развитии лейкозов у детей. Также повышен риск развития лейкозов у детей уже с имеющимися генетическими заболеваниями, такими как синдром Дауна.
Симптомы лейкоза.
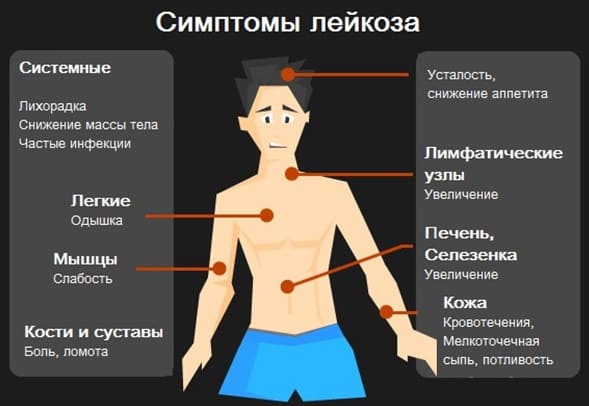
В течении лейкоза выделяют несколько стадий. Каждая имеет свои особенности.
1. Предлейкозный период . Этот период характеризуется отсутствием ярких, специфических симптомов. Этот факт и является причиной поздней диагностики. Основными признаками болезни, которые могут отметить родители в предлейкозном периоде, являются: слабость, утомляемость ребенка в школе или детском саду. Сниженный аппетит, пониженное настроение. Ребенок предпочитает сон и отдых подвижным играм. Так же возможны разнообразные нарушения стула, от запоров до диарейного синдрома. Часто удается зафиксировать повышение температуры тела до 37-37,5 С. Как правило, такие неспецифические симптомы трактуются родителями и врачами, как начало ОРВИ.
2. Острый период отличается яркими симптомами. Температура тела может повышаться до 38 градусов и выше. Ребенок теряет вес даже при калорийном питании. Общее самочувствие ухудшается. Одним из характерных симптомов при лейкозах является анемия (малокровие), которая проявляется бледностью кожи. Из-за снижения количества тромбоцитов в крови часто развивается кровоточивость. Как правило, это мелкоточечная сыпь на коже и слизистой оболочек полости рта. Возможны носовые кровотечения, а так же более грозные симптомы, такие как почечные и желудочно-кишечные кровотечения. Ребенок может жаловаться на боли в костях и суставах, потливость по ночам, кожный зуд. Очень часто увеличиваются лимфатические узлы в области шеи, над ключицами, в паху. В отличии от воспалительного увеличения лимфатических узлов, при лейкозах они безболезненные, кожа над ними не изменена. Больше чем у половины маленьких пациентов увеличивается в размерах печень и селезенка. Достоверно определить это может только врач, но в случае значительного увеличения этих органов у ребенка будет увеличен и деформирован живот, что сразу отметят внимательные родители.
3. После начала лечения острый период сменяет фаза ремиссии . Состояние ребенка стабилизируется, печень, селезенка и лимфатические узлы уменьшаются в размерах. Костный мозг начинает вырабатывать достаточное количество полноценных клеток, что обуславливает нормальное самочувствие ребенка.
4. После завершения всего курса лечения, как правило, ребенка можно считать полностью здоровым, но в ряде случаев возможен рецидив. Данная фаза проявляется схожими симптомами с острым периодом.
Болезни, с которыми можно спутать лейкоз.
На ранних этапах болезни представляет большую трудность отличить лейкоз от вирусных инфекций, таких как инфекционный мононуклеоз, аденовирусная инфекция и банальная ОРВИ. Все они могут протекать с увеличением лимфатических узлов, слабостью, повышением температуры тела. Бледность кожи, может возникать при анемиях другой природы: железодефицитная, В12 дефицитная, апластическая. Кровоточивость часто бывает при таких заболеваниях, как гемофилия, тромбоцитопеническая пурпура. Болевой синдром в костях и суставах может развиваться при ревматологических болезнях – ювенильный ревматоидный артрит, системная красная волчанка. Учитывая тот факт, что лейкозы могут маскироваться под разнообразные заболевания, необходимо сразу обращаться за медицинской помощью и не заниматься самолечением.
При наличии подобных жалоб у ребенка, необходимо обратится к участковому педиатру. Врач в свою очередь определит, есть ли необходимость консультации более узкого специалиста – детского онколога/гематолога.
Диагностика лейкоза.

В случае, когда есть подозрение на лейкоз, ребенка обязательно госпитализируют в онкогематологический стационар. Пребывание дома при подобном заболевании или подозрении – строго противопоказано! В течении нескольких дней специалисты возьмут все необходимые анализы и выполнят все инструментальные исследования.
Первым делом берут общий и биохимический анализ крови . В общем анализе при лейкозах часто отмечается анемия (сниженное количество эритроцитов и гемоглобина), тромбоцитопения (снижение количества тромбоцитов), количество лейкоцитов может быть как снижено, так и повышено. Иногда в крови можно обнаружить бластные клетки.
Обязательно берут костный мозг и спинно-мозговую жидкость . Анализ костного мозга является самым важным, именно на его основании устанавливают или снимают диагноз лейкоза. Спинно-мозговая жидкость является зеркалом состояния центральной нервной системы. При обнаружении в ней бластных клеток применяются более интенсивные схемы лечения.
Все остальные исследования, такие как УЗИ, компьютерная томография, рентгенография являются дополнительными и необходимы для оценки распространенности процесса.
В отличие от других злокачественных заболеваний, лейкозы не имеют стадий. В данном случае оперируют понятием группа риска. От того, в какую группу попадет ребенок, будет зависеть интенсивность лечения. Например, при остром лимфобластном лейкозе их выделяют три: стандартная, средняя и высокая группа риска. Распределение осуществляется на основании возраста пациента и исследования костного мозга. Если возраст пациента от 1 до 6 лет, количество лейкоцитов на момент постановки диагноза составляет менее 20 тысяч и отсутствуют наиболее значимые хромосомные мутации в бластных клетках, то ребенка относят и лечат по протоколу для стандартного риска. В случае обнаружения генетических мутаций, так называемой филадельфийской хромосомы, ребенок автоматически попадет в группу высокого риска и получает более интенсивную химиотерапию не зависимо от возраста и других показателей. Если возраст до 1 года или старше 6 лет и/или количество лейкоцитов составляет более 20 тысяч – пациент относится к группе среднего риска. В зависимости от группы риска врач выбирает ту или иную схему лечения. В зависимости от ответа на проводимое лечение, группа риска может изменяться, но только в худшую сторону. При хороших результатах на начальных этапах лечения, пациент все равно остается в своей первоначальной группе.
Лечение лейкоза у детй.
За последние несколько десятилетий детская онкология значительно продвинулась вперед. Если в середине прошлого столетия от лейкозов умирало более 90% пациентов, то на сегодняшний день выживаемость составляет около 80%. Другими словами 8 из 10 детей можно считать полностью излеченными при своевременных возможностях терапии.
В отличие от других областей медицины, где врач, полагаясь на свой богатый опыт, может корректировать тактику лечения и заменять один препарат на другой, в детской онкологии дело обстоит иначе. Существуют утвержденные протоколы лечения каждого злокачественного заболевания, в частности и лейкозов, от которых врач не имеет права отступать за исключением случаев непереносимости медикаментов или устойчивости опухоли.
В схеме терапии лейкозов выделяют несколько фаз: индукционная, консолидирующая, реиндуцирующая и поддерживающая. В течении всех периодов используют гормональные и противоопухолевые препараты. Часть препаратов дают в виде таблеток, но большую часть вводят внутривенно при помощи специальных устройств, инфузоматов. Данные аппараты позволяют с высокой точностью устанавливать скорость внутривенных инфузий, что является важным условием терапии лейкозов у детей.
Для пациентов из группы высокого риска, а так же у пациентов с поражением головного мозга применяют лучевую терапию.
Как правило, весь период лечения в стационаре занимает до 3-4 месяцев. Препараты поддерживающей терапии принимаются амбулаторно. При тяжелом течении заболевания, ранних рецидивах, нечувствительности опухоли к проводимому лечению, ребенок направляется на трансплантацию стволовых клеток от родственных доноров. Данный метод позволяет в большинстве случаев добиться стойкой ремиссии.
Важным компонентом является сопроводительная терапия. Она включает в себя антибактериальные, противогрибковые препараты, так как в период лечения иммунитет ребенка значительно снижен, препараты крови, такие как эритроцитная и тромбоцитная взвеси, используемые с целью замещения. Постоянная инфузия раствора глюкозы, физиологического раствора, растворов ионов калия, поддерживают ионный баланс и способствуют дезинтоксикации.
Лечение лейкозов у детей относится к высокотехнологической помощи, полис ОМС покрывает не все затраты, какую то часть покрывают благотворительные фонды. Так же возможно получить квоты на лечение в департаменте здравоохранения. Для этого необходимы документы, подтверждающие наличие заболевания (выписной эпикриз из истории болезни, результаты анализов). Данным вопросом с родителями занимается и лечащий врач.
Инвалидность. При установленном диагнозе острый лейкоз ребенок направляется на медико-социальную экспертизу. 1 группа инвалидности определяется при первично установленном диагнозе, а так же в случае обострения лейкоза. 2 группа определяется при стойкой ремиссии не менее года при продолжении специфической терапии. 3 группа определяется при полной стойкой ремиссии после окончания специфического лечения.
Прогноз.
Без лечения прогноз крайне неблагоприятный. Более чем в 90% случаев больной умирает.
При раннем распознавании и своевременно начатом лечении шанс добиться стойкой полной ремиссии достигает 80%! По статистическим данным наиболее благоприятный прогноз отмечается у детей от 1 до 6 лет с острым В-клеточным и лимфобластным лейкозом. Промежуточный прогноз при острых миелоидных лейкозах и менее благоприятный при хроническом миелоидном лейкозе. Так же неблагоприятным фактором является возраст ребенка до 1 года и старше 6 лет. Однако эта статистика достаточно условна, порой хороший ответ на лечение встречается при острых и хронических миелолейкозах.
Сказать достоверно, что влияет на прогноз и исход заболевания очень трудно. Вероятнее всего это зависит не только от вида опухоли и возраста ребенка, но и от характера изменений в геноме бластной клетки.
Врач педиатр Журавель Е.А.
Новости по теме:
Исследовательская группа из Массачусетской многопрофильной больницы совместно с Гарвардским институтом стволовых клеток выяснили, что справиться с прогрессированием острого миелоидного лейкоза поможет ингибирование одного из ферментов, участвующих в дифференцировке опухолевых клеток. Исследователям удалось обнаружить, что у 70% людей, страдающих различными формами острого миелоидного лейкоза, нарушена экспрессия транскрипционного фактора HoxA9. Ингибиторов этого белка до последнего времени обнаружено не было.
Авторы во главе с Дэвидом Сайкесом предложили новый подход к скринингу потенциальных соединений. Они изучили более трехсот тысяч веществ, что позволило им отобрать 12 веществ, предположительно обладающих необходимыми свойствами. Одиннадцать из них подавляли дифференцировку опухолевых клеток, ингибируя работу фермента DHODH. Ранее не было известно, что этот белок участвует в процессе дифференцировки миелоидных клеток.
Ученые протестировали работу ингибитора DHODHна мышах с острым миелоидным лейкозом – препарат снижал число опухолевых клеток, увеличивал продолжительность жизни животных и, что немаловажно, не вызывал побочных эффектов, характерных для большинства химиотерапевтических препаратов. Шестинедельное лечение не смогло предотвратить рецидив, а вот десятинедельный курс привел к длительной ремиссии.
После того, как будет подробно изучен механизм действия ингибитора DHODH, ученые планируют начать проводить эксперименты с участием пациентов.
Отвечаем на самые важные вопросы про лейкоз
" title="Показать лейкоз может исследование периферической крови
" itemprop="contentUrl">
Показать лейкоз может исследование периферической крови
Фото: Сергей Яковлев
В сентябре мы познакомились с архангелогородкой Вероникой Рожновской, жизнь которой изменилась, когда у её дочери Даши диагностировали лейкоз. Девочка в тот момент училась в пятом классе, а на недомогания врачи не обращали должного внимания. Специалисты отмечают, что рак крови действует тем агрессивнее, чем моложе организм, который поражает болезнь. На другие важные вопросы об этом раке отвечают профессор кафедры онкологии и медицинской радиологии Уральского государственного медицинского университета Сергей Берзин и гематолог из Уфы Нэлли Янтурина.
Лейкоз — опухолевое заболевание клеток крови. При лейкозе происходит патологическая трансформация лейкоцитов и их бесконтрольное деление. В итоге они замещают собой нормальные клетки костного мозга, из которых образуются циркулирующие в крови лейкоциты, эритроциты и тромбоциты.
При хронических лейкозах деление клеток идёт медленнее, и клиника тоже развивается с меньшей скоростью. Лейкозный клон током крови разносится по всей кроветворной ткани. Органами-мишенями, где откладываются метастазы, становятся почки и кости. Оседая в костной ткани, эти клетки, по-другому они называются миеломные, нарушают ее структуру. Это может проявляться частыми переломами, болью в позвоночнике, ребрах. Хронические лейкозы могут годами протекать без каких-либо явных отклонений в самочувствии, тогда выявить их можно только при исследовании крови.
Начало заболевания нередко протекает без выраженных симптомов. Больные отмечают общую слабость, утомляемость, неопределенную боль в костях, непостоянную температуру по вечерам в пределах 37,1–38 градусов. Но уже в этот период у некоторых больных можно обнаружить небольшое увеличение лимфатических узлов, селезенки. В анализе крови тоже будут изменения — повышение или снижение количества лейкоцитов, анемия.
Лейкоз может проявляться разнообразными симптомами. При острой форме пациенты могут жаловаться, что стали часто простывать, у них возникли инфекционные осложнения или синяки на теле, а кого-то будет беспокоить резкая потеря веса, появление шишек на теле или увеличение лимфоузлов.
Симптомы лейкоза неспецифичны, они таковы:
- слабость;
- головокружения;
- высокая температура без явных на то причин;
- боли в руках и ногах;
- кровотечения.
При замещении патологически размножающимися лейкоцитами других клеток крови на первое место выходят анемии и кровотечения из-за уменьшения числа других клеток крови — эритроцитов и тромбоцитов. Из-за накопления лейкоцитов в лимфоузлах, печени или селезёнке эти органы могут увеличиться, но обнаружить эти симптомы уже может только врач.
При лейкозе субстратом опухоли является костный мозг, который находится во всех трубчатых и плоских костях. Здесь же развиваются предшественники крови: эритроциты, лейкоциты и тромбоциты. Когда в ткани начинают развиваться опухолевые клетки, места для нормальных здоровых клеток крови просто не остается. Если в случае с раком желудка пораженный участок можно удалить, вовремя провести химиотерапию и добиться длительной ремиссии, то при раке крови такая тактика не приемлема.
Есть формы острого лейкоза, которые могут развиваться с первых дней жизни человека. Хроническим формам лейкоза подвержены люди старшего возраста. Чем моложе возраст, тем агрессивнее протекает болезнь, но при современных методиках лечения больной может жить до 5–7 лет. На течение хронического миелолейкоза (и это научно доказано) большое влияние оказывает состояние нервной системы больного — если есть стрессы, депрессии, люди сгорают буквально на глазах.
Лечение лейкоза — это достаточно длительный процесс. В среднем на достижение ремиссии при острых лейкозах уходит от 3 месяцев до 2–3 лет.
Первый и самый сложный этап в лечении острого лейкоза — это интенсивная химиотерапия, с помощью которой мы должны убить опухолевые клетки. Пациенты должны находиться в специальном асептическом блоке, в котором созданы стерильные условия, чтобы исключить их контакт с любой инфекцией. Больные в этот момент не имеют никаких собственных факторов защиты, потому что кроветворение у них пострадало от самой болезни и применяемых химиопрепаратов. Для закрепления результатов терапии после этапа восстановления (или поддержки ремиссии) принимается решение о необходимости трансплантации костного мозга.
Пересадку можно делать, если пациента ввели в ремиссию. Она бывает двух видов: аутотрансплантация, когда пересаживается костный мозг самого больного, и аллотрансплантация, в этом случае ткани забирают у донора.
В первом случае у пациента из вены берется периферическая кровь, из нее при помощи сепаратора извлекают стволовые клетки, консервируют и передают на хранение в банк. Затем пациенту проводят сильнейшую химиотерапию, а следом проводят пересадку — так же, через вену, вводят стволовые клетки, и они начинают творить новое потомство. Технически это выглядит как переливание крови. Пересадка может быть сделана и при хроническом лейкозе.
Аллотрансплантация дает хорошие результаты, если доноры — родные сестра или брат, у них самый близкий фенотип. Пересадка даже от двоюродных родственников не всегда бывает столь успешна, но все равно это шанс на то, что человек будет жить.
Лучшие доноры костного мозга — это мужчины в возрасте 30–40 лет, семейные, имеющие постоянное место работы. Желательно — на промышленном производстве, на заводах. Практика показывает, что именно такие люди относятся к донорству с наибольшей ответственностью.
Женщина тоже может стать донором костного мозга. Но здесь важно учесть, что после родов и беременностей в крови у женщин циркулируют антитела, и их лейкоциты уже настроены бороться с чужеродными антигенами. Поэтому результат пересадки может оказаться хуже.
Читайте также:

