С хлором сульфатом меди и гидроксидом натрия может реагировать
Задание 6.1
Из предложенного перечня выберите два вещества, с каждым из которых железо реагирует без нагревания.
1) хлорид кальция (р-р)
2) сульфат меди (II) (р-р)
3) концентрированная азотная кислота
4) разбавленная соляная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Источник - Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Железо будет реагировать с раствором сульфата меди (II). Данная реакция обусловлена тем, что железо в ряду активностей металлов (в электрохимическом ряду напряжений) стоит левее меди (следовательно, железо активнее меди). В связи с этим железо способно вытеснять медь из ее соли:
Fe + CuSO4 = FeSO4 + Cu
В случае хлорида кальция железо реагировать не будет, так как кальций находится в указанном ряду левее железа, следовательно, является более активным металлом.
Также железо реагирует без нагревания с разбавленной соляной кислотой с образованием хлорида железа (II):
Fe + 2HCl = FeCl2 + H2↑ (без доступа воздуха).
Также напомним, что в концентрированной азотной кислоте железо пассивируется.
Ответ: 24
Задание 6.2
Из предложенного перечня выберите два вещества, с каждым из которых реагирует углерод.
1) оксид свинца (IV)
2) сульфат меди (II) (р-р)
3) разбавленная соляная кислота
4) концентрированная серная кислота
5) хлорид хрома (III) (р-р)
Запишите в поле ответа номера выбранных веществ.
Углерод будет восстанавливать оксид свинца (IV):
2C + PbO2 = Pb + 2CO
Углерод будет взаимодействовать с концентрированной серной кислотой при нагревании:
C + 2H2SO4 (конц.) = CO2↑ + 2SO2↑ + 2H2O
Ответ: 14
Задание 6.3
Из предложенного перечня выберите два вещества, с каждым из которых реагирует медь.
1) гидроксид калия (р-р)
2) хлор
3) сульфат цинка (р-р)
4) хлорид натрия (р-р)
5) нитрат серебра (р-р)
Запишите в поле ответа номера выбранных веществ.
Медь будет реагировать с хлором:
Cu + Cl2 = CuCl2
Медь будет реагировать с раствором нитрата серебра, так как медь находится в ряду активности металлов левее серебра, следовательно, является более активным металлом:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Ответ: 25
Задание 6.4
Из предложенного перечня выберите два вещества, с каждым из которых алюминий реагирует без нагревания.
1) сера
2) нитрат меди (II) (р-р)
3) хлорид калия (р-р)
4) концентрированная серная кислота
5) разбавленная соляная кислота
Запишите в поле ответа номера выбранных веществ.
Алюминий будет реагировать с раствором нитрата меди (II), так как алюминий находится в ряду активностей металлов (в электрохимическом ряду напряжений) левее меди, следовательно, является более активным металлом и способен вытеснять медь из ее соли:
2Al + 3Cu(NO3)2 = 2Al(NO3)3 + 3Cu
Алюминий также реагирует без нагревания с разбавленной соляной кислотой с образованием хлорида алюминия:
2Al + 6HCl = 2AlCl3 + 3H2↑.
Для реакций с серой и концентрированной серной кислотой требуется нагревание.
С хлоридом калия алюминий реагировать не будет.
Ответ: 25
Задание 6.5
Из предложенного перечня выберите два вещества, с каждым из которых реагирует кремний.
1) бром
2) хлорид калия (р-р)
3) оксид магния
4) концентрированная азотная кислота
5) сульфат меди (II) (р-р)
Запишите в поле ответа номера выбранных веществ.
Кремний, проявляя восстановительные свойства, реагирует с бромом:
Si + 2Br2 = SiBr4
Кремний, являясь восстановителем, также взаимодействует с оксидом магния:
Si + 2MgO = SiO2 + 2Mg
Ответ: 13
Задание 6.6
Из предложенного перечня выберите два вещества, с каждым из которых реагирует хлор.
1) вода
2) концентрированная серная кислота
3) кислород
4) иодид натрия
5) фторид калия
Запишите в поле ответа номера выбранных веществ.
Хлор взаимодействует с водой:
Cl2 + H2O ⇔ HCl + HClO
Хлор реагирует с иодидом натрия, так как окислительная способность хлора выше окислительной способности иода:
Cl2 + 2NaI = 2NaCl + I2
Ответ: 14
Задание 6.7
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует кальций.
1) гидроксид калия
2) серная кислота
3) вода
4) хлорид калия
5) карбонат кальция
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Кальций реагирует с серной кислотой:
Ca + H2SO4 = CaSO4 + H2↑
Кальций взаимодействует с водой:
Ca + 2H2O = Ca(OH)2↓ + H2↑
Ответ: 23
Задание 6.8
Из предложенного перечня выберите два вещества, которые реагируют с оксидом цинка.
1) вода
2) оксид азота (II)
3) гидроксид натрия
4) оксид серы (VI)
5) сульфат калия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Оксид цинка ZnO взаимодействует с гидроксидом натрия:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Оксид цинка ZnO реагирует с оксидом серы (VI):
ZnO + SO3 = ZnSO4
Ответ: 34
Задание 6.9
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует водород.
1) оксид железа (III)
2) серная кислота
3) хлорид кальция
4) азот
5) гидроксид натрия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Водород взаимодействует с оксидом железа (III):
3H2 + Fe2O3 = 2Fe + 3H2O
Водород реагирует с азотом:
3H2 + N2 = 2NH3
Ответ: 14
Задание 6.10
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует кальций.
1) метан
2) вода
3) оксид калия
4) сера
5) сульфат натрия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Кальций взаимодействует с водой:
Ca + 2H2O = Ca(OH)2↓ + H2↑
Кальций реагирует с серой:
Ca + S = CaS
Ответ: 24
Задание 6.11
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует азот.
1) литий
2) водород
3) вода
4) соляная кислота
5) хлорид калия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Азот взаимодействует с литием с образованием нитрида лития:
N2 + 6Li = 2Li3N
Азот реагирует с водородом:
N2 + 3H2 = 2NH3
Итоговое тестирование 9 класс
Вариант 1
- В атоме кремния распределение электронов по энергетическим уровням соответствует ряду чисел
1) 2;8;2 2) 2;4 3) 4;8;2 4) 2;8;4
- В каком ряду химические элементы расположены в порядке увеличения числа валентных электронов?
1) Ве, В, С 2) К, Nа, Li 3) S, P, C 4) C, Si, Ge
- Ионная связь характерна для каждого из двух веществ
1) оксид натрия и аммиак 2) сульфид калия и оксид серы (IV)
3) оксид лития и хлор 4) фторид кальция и сульфид натрия
- Выберите уравнения реакций, в которых фосфор является окислителем.
- Степень окисления хлора в соединении КCl О3 равна
1) -1 2) +3 3) +5 4) +7
- К основным оксидам относится
1) оксид магния 2) оксид хлора (VII) 3) оксид алюминия 4) оксид фосфора (V)
- Сумма коэффициентов в уравнении реакции между алюминием и соляной кислотой равна
1) 13 2) 11 3) 12 4) 10
- В ряду химических элементов Al – Mg – Na
1) усиливаются металлические свойства
2) уменьшаются заряды ядер атомов
3) увеличивается число электронов на внешнем электронном слое
4) увеличивается число заполненных электронных слоёв в атоме
5) уменьшается радиус атомов
- Взаимодействие раствора гидроксида калия с фосфорной кислотой относится к реакциям
1) замещения 2) разложения 3) соединения 4) обмена
- К неэлектролитам относится
1) сульфат меди (II) 2) гидроксид бария 3) оксид серебра (I) 4) карбонат лития
- Веществом, при диссоциации которого образуются катионы водорода и анионы кислотного остатка является
1) сульфат меди (II) 2) гидроксид бария 3) азотная кислота 4) карбонат лития
- C раствором серной кислоты реагируют:
1) серебро 2) оксид кремния (IV) 3) гидроксид меди (II) 4) вода 5) хлорид бария
- Осадок не образуется при смешивании растворов
1) хлорида магния и нитрата меди (II) 2) гидроксида натрия и сульфата цинка
3) хлорида калия и нитрата серебра (I) 4) карбоната калия и хлорида кальция
- Какой из указанных металлов проявляет наибольшую химическую активность в реакции с водой?
1) кальций 2) алюминий 3) свинец 4) железо
- Массовая доля кислорода в силикате кальция равна
1) 52,9 % 2) 65,7 % 3) 32,5 % 4) 41,4
16. Объём газа (при н. у. ), выделившийся при взаимодействии 20 г карбоната кальция
соляной кислотой равен
1) 1,12 л 2) 22,4 л 3) 4,48 л 4) 44,8 л
Вариант 2
- В атоме фосфора число электронов на внешнем энергетическом уровне равно
1) 5 2) 2 3) 3 4) 4
- В каком ряду химические элементы расположены в порядке усиления неметаллических свойств?
1) N, P, As 2) С, Si, P 3) S, О, Se 4) C, N, О
- Одинаковый вид химической связи имеют оксид калия и
1) сероводород 2) сульфид натрия 3) натрий 4) оксид серы (IV)
- Выберите уравнения реакций, в которых углерод является окислителем.
- Значения высшей и низшей степеней окисления углерода соответственно равны:
1) +2 и -4 2) +4 и -2 3) +2 и -4 4) +4 и -4
- Какое из перечисленных веществ является простым?
1) ртуть 2) карбонат натрия 3) оксид цинка 4) вода
- Признаком химической реакции карбоната калия с серной кислотой является
1) выделение газа 2) выделение света
3) образование осадка 4) появление запаха
- В ряду химических элементов Li – Be – B
1) уменьшаются металлические свойства
2) уменьшаются заряды ядер атомов
3) уменьшается число электронов на внешнем электронном слое атомов
4) увеличивается электроотрицательность
5) увеличивается число заполненных электронных слоёв в атомах
- Взаимодействие раствора гидроксида натрия с оксидом фосфора (V)относится к реакциям
1) замещения 2) разложения 3) соединения 4) обмена
- К хорошо растворимым электролитам относится
1) хлорид калия 2) гидроксидом алюминии 3) гидроксид цинка 4) карбонат кальция
- Веществом, при диссоциации которого образуются катионы металла и гидроксид-анионы, является
1) кислота 2) щёлочь 3) средняя соль 4) кислая соль
- C раствором гидроксида кальция реагируют:
1) азот 2) оксид серы (IV) 3) железо 4) азотная кислота 5) оксид железа (II)
- Необратимо протекает реакция ионного обмена между растворами
1) сульфата калия и нитрата цинка 2) гидроксида натрия и хлорида алюминия
3) хлорида калия и фосфорной кислоты 4) гидроксида калия и нитрата бария
- Кальций при обычных условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и хлором 2) серой и углеродом
3) оксидом углерода (IV) и оксидом меди (II) 4) хлоридом натрия и нитратом цинка
- Массовая доля кислорода в гидроксиде алюминия равна
1) 22,6 % 2) 61,5 % 3) 48,2 % 4) 32,8%
- Объём водорода (при н. у. ), выделившийся при взаимодействии 2,7 г алюминия с избытком раствора соляной кислоты равен
Ответом к заданиям 1–26 является последовательность цифр. Цифры в ответах на задания 5, 10–12, 18, 19, 22–26 могут повторяться.
Электронную конфигурацию 1s 2 2s 2 2p 6 имеют частицы:
Расположите в порядке увеличения атомного радиуса химические элементы:
1) S 2) Zn 3)O 4) Ва 5)Se
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +4. Запишите в поле ответа номера выбранных элементов.
Из предложенного перечня выберите два соединения, между молекулами которых образуется водородная связь.
Установите соответствие между формулой вещества и классом, к которому это вещество принадлежит: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
1) оксид основный
2) оксид кислотный
3) оксид несолеобразующий
4) оксид амфотерный
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует хлор.
2. оксид углерода(II)
3. хлорид цинка(II)
4. концентрированная серная кислота
5. хлорид железа(II)
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует оксид азота(IV).
1. гидроксид натрия
3. углекислый газ
4. фосфорная кислота
5. оксид железа(III)
Концентрированная серная кислота при обычных условиях взаимодействует с:
4. оксидом кремния(IV)
5. гидроксидом меди(II)
В заданной схеме превращений
[math]Al\xrightarrow XAl(OH)_3\xrightarrow YAl(NO_3)_3[/math]
веществами X и Y соответственно являются:
Установите соответствие между схемой реакции и названием восстановителя в ней.
Установите соответствие между простыми веществами и формулами реагентов, с которыми они могут взаимодействовать.
Установите соответствие между тривиальным и систематическим названиями соединений.
Одинаковые функциональные группы содержат:
1. метанол и стирол
2. нитробензол и нитроглицерин
3. анилин и этиламин
4. глицерин и этин
5. пропанол-2 и фенол
Перманганат калия в кислой среде реагирует с каждым из двух углеводородов:
1. гексаном и гексеном-1
2. пропином и толуолом
3. этилбензолом и бутеном-2
4. бензолом и этиленом
5. бензолом и бутином-2
Пропанол-2 образуется в результате взаимодействия
1. пропана с раствором щелочи
2. пропена с водой
3. пропаналя с водородом
4. изопропилацетата с раствором щелочи
5. пропина с водой
Из предложенного перечня выберите два вещества, с которыми реагирует глюкоза.
2. Ag2O (аммиачный раствор)
В заданной схеме превращений
этан [math]\xrightarrow X\dots\xrightarrow Y[/math] этанол
веществами X и Y соответственно являются:
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
А) циклопропан и бром
Б) циклогексан и бром
В) изобутан и бром
Г) бензоат натрия и NaOH
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
А) пропанол-1 и СuО
Б) пропанол-2 и СuО
В) пропанол-1 и Na
5) пропилат натрия
6) пропановая кислота
Взаимодействие сульфата натрия и хлорида бария относится к реакциям:
3. практически необратимым
Увеличение давления в системе в наибольшей степени скажется на скорости химической реакции между
1. пропеном и водородом
2. магнием и хлором
3. сульфатом железа(III) и хлоридом бария
4. оксидом меди(II) и серной кислотой
5. алюминием и раствором щёлочи
Установите соответствие между названием металла и промышленным электролитическим способом его получения.
1) электролиз водного раствора хлорида
2) электролиз водного раствора нитрата
3) электролиз расплавленного нитрата
4) электролиз расплавленного хлорида
Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое.
А) сульфат натрия
Б) хлорид алюминия
В) ортофосфат цезия
Г) ацетат аммония
1) сульфид калия
2) сульфид алюминия
3) сульфат железа (II)
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Катализатор никель используется в технологических процессах:
1. окисление спиртов
2. восстановление альдегидов
3. дегидратация первичных спиртов
4. гидрирование алкенов
5. образование сложных эфиров
К 250 г 20%-ной серной кислоты добавили 50 мл 60%-ной кислоты (плотностью 1,6 г/мл). Какова массовая доля кислоты в полученном растворе? (Запишите число с точностью до целых.)
В результате реакции, термохимическое уравнение которой
выделилось 28,5 кДж теплоты. Какая масса азотной кислоты была нейтрализована гидроксидом калия? (Запишите число с точностью до десятых.)
Литий массой 3,5 г сожгли в кислороде. Рассчитайте массу оксида лития, образовавшегося при этом. (Запишите число с точностью до десятых.)
Запишите сначала номер задания (30, 31 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
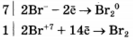
Бром в степени окисления -1 является восстановителем, а бром +7 (или бромная кислота) - окислителем.
Магний растворили в разбавленной азотной кислоте, причём выделение газа не наблюдалось. Получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде.
Запишите уравнения описанных реакций.
3) NH4NO3 + KOH 
KNO3 + NH3 ↑ + H2O
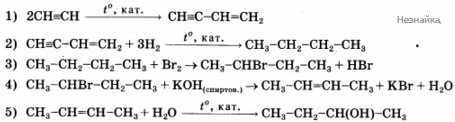
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
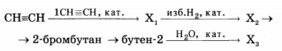
При написании уравнений реакций используйте структурные формулы органических соединений.
Газ, выделившийся при взаимодействии 3,2 г меди с 100 мл 60%-ной азотной кислоты (плотностью 1,4 г/мл), растворили в 100 г 15%-ного раствора гидроксида натрия. Рассчитайте суммарную массовую долю солей в полученном растворе.
При сгорании 2,9 г органического вещества образуется 3,36 л углекислого газа и 2,7 г воды. Плотность паров этого вещества по водороду 29. Установлено, что это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором дихромата калия до карбоновой кислоты. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с аммиачным раствором оксида серебра.
2) молекулярная формула C3H6O
3) структурная формула 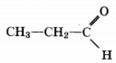
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.

1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:


3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O

4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:


5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:

6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2

9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0

10. Соли образуются при взаимодействии щелочей с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr +Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорид кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:

2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:

4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:

5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:

6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!

При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
2AgNO3 → 2Ag +2NO2 + O2
- Галогениды серебра (кроме AgF):
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3 + HCl
(NH4)2CO3 → 2NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3

7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
2KI — + 2Cu +2 Cl2 → 2KCl + 2Cu + Cl + I2 0

8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Читайте также:

