Русаков рак предстательной железы
Рак предстательной железы — это проблема, с которой может столкнуться, пожалуй, каждый мужчина. К настоящему моменту не существует ни надежных методов профилактики этого заболевания, ни достоверных способов заранее узнать, каков риск столкнуться с бедой в каждом конкретном случае. Однако медики уже научились распознавать рак простаты на самых ранних стадиях, а также успешно лечить опухоли. Поэтому если онколог предполагает наличие рака простаты — не спешите впадать в отчаяние, ведь шансы на выздоровление высоки.
Стадии и особенности протекания рака предстательной железы
Предстательная железа — небольшой орган (размером с шарик для пинг-понга), расположенный у основания мочевого пузыря. Ее основная функция — синтез секрета, входящего в состав спермы, и участие в процессе семяизвержения.
Рак предстательной железы подразумевает появление и увеличение в размерах опухоли, способной к быстрому росту и метастазированию (переносу злокачественных клеток в другие органы и ткани). Это заболевание может возникнуть в любом возрасте, но в подавляющем большинстве случаев диагностируется у мужчин старше 60 лет.
Рак простаты — третье по распространенности онкологическое заболевание у представителей сильного пола в России после рака легких и рака желудка. Он обнаруживается у одного из пятнадцати мужчин старше 40 лет. Каждый год в мире злокачественные опухоли предстательной железы диагностируют у миллиона человек, и примерно каждый третий из них умирает вследствие данной патологии.
Почему развивается рак предстательной железы? Известно, что это сопряжено с изменениями гормонального фона, генетической предрасположенностью, неправильным питанием и воздействием некоторых других факторов, роль которых до сих пор окончательно не установлена.
От момента появления первой раковой клетки до развития симптомов, которые приводят мужчину на консультацию к врачу, обычно проходит несколько лет. По этой причине часто пациент оказывается на приеме у онколога с запущенной, разросшейся опухолью, которую сложно вылечить.
Всего принято выделять четыре стадии рака простаты:
- 1 стадия характеризуется маленькими размерами опухоли, отсутствием вовлечения в патологический процесс лимфатических узлов (туда раковые клетки могут попасть с током лимфы) и хорошим самочувствием больного. Как правило, на этой стадии рак простаты выявляется случайно — в ходе лечения другого заболевания железы. Прогноз для жизни пациента — благоприятный, терапия не занимает много времени.
- 2 стадия рака простаты означает, что новообразование увеличилось в размерах. Его можно прощупать — в ходе ректального осмотра (простата прилегает к передней стенке прямой кишки, поэтому врач способен дотянуться до нее пальцем). При этом симптомы заболевания зачастую по-прежнему не проявляются. Поэтому так важно регулярно проходить профилактическое обследование у уролога. Около 80% больных, у которых рак простаты был диагностирован на 2 стадии, выздоравливают.
- 3 стадия заболевания характеризуется разрастанием опухоли за пределы оболочки простаты. Раковые клетки обнаруживаются в лимфоузлах малого таза и в некоторых соседних органах. К этому моменту больной обычно ощущает дискомфорт: из-за деформации железы нарушается мочеиспускание, появляется боль в промежности. Чтобы победить опухоль, уже недостаточно сделать операцию, поэтому часто онкологи используют комбинированную тактику, сочетая различные подходы к уничтожению раковых клеток. Выживаемость на этой стадии рака простаты составляет менее 40%.
- 4 стадия подразумевает, что, помимо простаты, рак затронул отдаленные органы или лимфоузлы. Метастазы могут обнаруживаться в костях, легких, печени и т. д. Если пациент — пожилой человек с тяжелыми хроническими заболеваниями, врачи примут решение отказаться от операции в пользу щадящих методов терапии, которые продлят жизнь и облегчат страдания больного, хотя и не помогут победить рак.
Как будет проходить лечение рака простаты, зависит не только от стадии болезни. Важное значение имеет тип опухоли — его определяют при биопсии, взяв несколько образцов ткани и изучив их под микроскопом. Некоторые разновидности рака — например полиморфноклеточный рак предстательной железы — склонны к быстрому агрессивному росту, развитие других подвержено влиянию гормонов. Опытный онколог учитывает все эти обстоятельства, а также мнение самого больного, прежде чем принять решение о лечебной тактике.
Немаловажную роль играет и техническая оснащенность клиники. Не секрет, что многие современные технологии и лекарства попросту не доступны в отечественных онкологических центрах или находятся на стадии внедрения. И даже такие классические подходы, как хирургическое удаление простаты, могут значительно отличаться, что сказывается не только на успехе лечения, но и на качестве жизни пациента.
Предстательная железа — орган важный, но взрослый мужчина вполне способен прожить и без него. Поэтому, если рак не перекинулся на соседние органы и ткани, а состояние больного допускает проведение операции, онколог порекомендует мужчине радикальную простатэктомию — удаление простаты. На начальных стадиях болезни такой подход позволяет полностью вылечиться в короткий срок (пребывание в больнице занимает около 7 дней).
Между тем важно помнить, что речь идет о серьезном вмешательстве в работу организма, которое сопряжено с риском для жизни, а также приводит к некоторым неприятным последствиям. Так, больные нередко испытывают проблемы с мочеиспусканием на протяжении многих месяцев после операции, более половины мужчин — жалуются на исчезновение эрекции.
Щадящим вариантом хирургического лечения рака простаты является лапароскопическое вмешательство, при котором удаление простаты осуществляется через небольшие разрезы — всего несколько миллиметров длиной. В результате снижается риск послеоперационных осложнений, а сама процедура переносится пациентом гораздо легче.
Альтернативой традиционному хирургическому вмешательству может стать криохирургия опухоли простаты. Данный метод применим на ранних стадиях заболевания, когда рак еще не вышел за пределы органа. В ходе манипуляции пациенту в простату вводятся специальные иглы, через которые поступает жидкие аргон или азот. Низкие температуры разрушают ткани железы, а врач при помощи УЗИ контролирует, чтобы воздействие не повредило соседние органы. Как результат — железу не приходится удалять (хотя функции ее необратимо нарушаются). В последние годы криохирургию все чаще предлагают в качестве основного способа лечения рака простаты, который подходит больным всех возрастов.
Лучевая терапия назначается как отдельный метод лечения, так и в качестве дополнения к операции: до вмешательства или после него. Речь может идти как о внешней радиотерапии (когда пациент лежит под излучателем), так и о внутренней лучевой терапии, когда в тело больного вводят особые радиоактивные гранулы.
Внешняя лучевая терапия также имеет свои разновидности. Онкологи стремятся минимизировать губительное воздействие радиации на ткани тела, поэтому стараются как можно точнее направить пучок радиации на опухоль. В этом им помогают такие методы, как 3D-конформная лучевая терапия, лучевая терапия модулированной интенсивности (IMRT), стереотоксичечская лучевая терапия (SBRT) и протонная лучевая терапия. Каждый из этих подходов имеет достоинства и недостатки. Часто радиотерапия приводит к устойчивым расстройствам мочеиспускания и к эректильной дисфункции.
Внутренняя лучевая терапия (брахитерапия) значительно увеличивает эффект радиации за счет сокращения расстояния от ее источника до раковых клеток. Радиоактивные гранулы, используемые для процедуры, содержат радиоактивный йод, палладий и другие химические вещества, способные в течение длительного времени воздействовать на окружающие ткани. В зависимости от метода, эти гранулы могут находиться в организме многие месяцы (постоянная брахитерапия) или только во время лечебных сеансов (временная брахитерапия).
Химиотерапия применяется, как правило, в ситуациях, когда рак распространился по организму, поэтому воздействовать на болезнь нужно глобально. Препараты, используемые для лечения злокачественных опухолей простаты, назначают курсами, следя за результатами терапии и развитием побочных эффектов. Химиотерапевтические средства плохо влияют не только на рак, но и на здоровые ткани. Поэтому больные, проходящие такое лечение, часто страдают от расстройств пищеварения, слабости, потери волос и инфекционных заболеваний.
Данный вид лечения направлен на активацию иммунитета пациента. Раковые клетки чужеродны нашему телу, однако благодаря особым приспособительным механизмам они способны уклоняться от иммунного ответа.
Поскольку зачастую рост опухоли провоцируется действием мужских половых гормонов, на поздних стадиях рака простаты врачи могут назначать пациенту препараты, блокирующие синтез этих веществ. Обычно речь идет о пожизненном приеме фармацевтических средств. Такое лечение означает медикаментозную кастрацию: на его фоне затухает сексуальная функция. В сочетании с другими методами — например радиотерапией — прием гормонов способен привести к полному излечению пациентов, которым противопоказана радикальная простатэктомия. При этом медикаментозная кастрация обратима — после отмены лекарств.
Методы лечения рака простаты разнообразны, и каждый год появляется информация о новых эффективных подходах. Другими словами, безнадежных случаев, когда медицина оказывается бессильна помочь пациенту, уже почти не осталось. Важно найти врача, который подберет эффективную лечебную тактику. Не стоит отчаиваться — победа над раком во многом зависит от вас.
Для цитирования: Русаков И.Г., Алексеев Б.Я. Монотерапия Касодексом в дозе 150 мг в лечении больных раком предстательной железы // РМЖ. 2005. №15. С. 1042
Рак предстательной железы (РПЖ) является в настоящее время одной из наиболее распространенных злокачественных опухолей у мужчин. Заболеваемость РПЖ в России составляет 15 чел. на 100 тыс. мужского населения, а в структуре всей онкологической заболеваемости опухоли предстательной железы занимают 3 место, не считая опухоли кожи (6,1% всех злокачественных новообразований у мужчин). По темпам роста заболеваемости РПЖ опережает опухоли других локализаций, в 1993–2002 гг. прирост составил 73,5% [1]. У большого числа больных РПЖ диагностируют на стадии местно–распространенного (39%) и генерализованного (22%) опухолевого процесса, когда проведение радикального лечения, как правило, невозможно [2]. Основным методом лечения больных опухолями предстательной железы на стадиях местно–распространенного и метастатического процесса является гормональная терапия, направленная на подавление стимуляции андрогенами чувствительных к ним опухолевых клеток. Эндокринные воздействия при РПЖ могут быть реализованы двумя механизмами: подавлением продукции андрогенов (андрогенная депривация) или блокированием действия андрогенов на уровне клеток опухоли предстательной железы путем конкурентного ингибирования с андрогенными рецепторами. Хирургическая или медикаментозная (агонисты ЛГРГ) кастрация вызывает депривацию тестикулярных андрогенов и в качестве монотерапии или в комбинации с антиандрогенами (комбинированная или максимальная андрогенная блокада) является в настоящее время стандартным методом лечения диссеминированного РПЖ. Учитывая, что гормональная терапия распространенных форм РПЖ носит паллиативный характер, улучшение качества жизни больных должно рассматриваться наряду с увеличением продолжительности жизни важнейшей целью проводимого лечения. Однако снижение тестостерона до посткастрационных значений приводит к развитию ряда выраженных побочных эффектов, в значительной степени ухудшающих качество жизни больных: импотенция, снижение либидо, приливы, остеопороз, мышечная атрофия, дислипидемия, нервно–психические расстройства. Снижение сексуальной и физической активности у больных, которым проводится депривация андрогенов, является серьезным отрицательным аспектом лечения, особенно учитывая возрастание числа больных относительно более молодого возраста [3]. В ряде исследований, основанных на опросах больных, показано, что некоторые пациенты готовы предпочесть сохранение сексуального влечения и эректильной функции даже ценой снижения продолжительности жизни. В работе, опубликованной Центром клинической медицинской этики Университета Чикаго (США), показано, что из 50 больных РПЖ (возраст 45–79 лет, средний – 58 лет) 68% отказались от 10% преимущества в 5–летней выживаемости в пользу сохранения сексуальной активности [4]. В другом исследовании из 230 опрошенных больных РПЖ (средний возраст – 65 лет) 67% предпочли сохранить потенцию за счет снижения ожидаемой продолжительности жизни на 14% [5].
Альтернативой кастрации или комбинированной андрогенной блокады является монотерапия нестероидными антиандрогенами. Данный метод гормонотерапии позволяет блокировать на уровне андрогенных рецепторов внутри опухолевых клеток действие тестостерона и андрогенов надпочечников. При этом концентрация тестостерона в плазме не падает, а по механизму обратной тестикулярно–гипофизарно–гипоталамической связи даже несколько возрастает по сравнению с исходным уровнем. В связи с этим монотерапия нестероидными антиандрогенами позволяет сохранить сексуальную функцию у большинства больных РПЖ, обладающих потенцией и либидо до начала лечения. Другими преимуществами использования антиандрогенов являются удобство применения препаратов, психологическая приемлемость данного вида лечения для больных, обратимость лечебного эффекта и побочных реакций проводимой терапии. Но при проведении монотерапии антиандрогенами всегда возникает вопрос о сопоставимости эффективности данного вида лечения со стандартными вариантами эндокринных воздействий – кастрацией и комбинированной андрогенной блокадой.
В качестве агента для проведения монотерапии применяли как стероидные, так и нестероидные антиандрогены. Стероидный антиандроген ципротерона ацетат в режиме монотерапии применяется в дозах 100–300 мг в сутки и по данным рандомизированных исследований уступает по эффективности кастрации или терапии агонистами ЛГРГ. В проспективном рандомизированном исследовании, проведенном в Великобритании и включавшем 525 больных метастатическим РПЖ, монотерапия ципротероном сравнивалась с терапией Золадексом. При сроках наблюдения до 48 мес. медиана времени до прогрессирования в группе больных, получавших ципротерон, составила 225 дней, в группе больных, получавших Золадекс – 346 дней (р=0,016) [6]. В другом исследовании отмечено снижение выживаемости больных, получавших монотерапию ципротероном, по сравнению с пациентами, которым проводили терапию агонистами ЛГРГ [7]. В двух других работах время до прогрессирования и выживаемость больных, получавших монотерапию ципротероном и медикаментозную или хирургическую кастрацию [8,9], существенно не различались, но необходимо отметить, что данные исследования включали очень небольшие группы больных и не могут считаться репрезентативными. Ципротерона ацетат, обладая центральным прогестивным действием, ингибирует выработку тестостерона. В связи с этим до 70% больных, получающих монотерапию ципротероном, теряют в процессе лечения потенцию и сексуальное влечение [10]. В исследовании EORTC 30892 потенцию сохранял каждый третий больной, получавший монотерапию ципротероном в дозе 300 мг в сутки, такие же функциональные результаты отмечены и в группе больных, получавших монотерапию флутамидом [11]. Обладая стероидной активностью, ципротерона ацетат вызывает те же побочные эффекты, что и эстрогены, хотя и в меньшей степени. Кардиоваскулярная токсичность препарата наблюдается у 8% пациентов.
Флутамид также применяли в режиме монотерапии для лечения распространенных форм РПЖ. Некоторые исследования III фазы, включающие незначительное количество больных, сообщают об одинаковой эффективности флутамида в дозе 250 мг х 3 раза в сутки и стандартных методов гормонотерапии [12,13]. Наиболее крупное исследование по сравнению эффективности монотерапии флутамидом и хирургической кастрации проведено Boccon–Gibod и соавт. В исследование включено 104 больных, результаты прослежены у 86 из них. При минимальном сроке наблюдения 36 мес. время до прогрессирования и выживаемость пациентов в обеих группах оказались одинаковыми. Частота развития побочных эффектов в группе больных, получавших флутамид, оказалась выше, 10% пациентов прекратили принимать препарат в связи с развитием токсичности. Влияние терапии на сексуальную функцию не оценивалось, так как средний возраст больных составлял 74 года [14]. В другом рандомизированном двойном слепом исследовании ECOG, включающем 92 больных метастатическим РПЖ, эффективность монотерапии флутамидом в дозе 250 мг х 3 раза в сутки сравнивалась с терапией диэтилстилбестролом (ДЭС) в дозе 1 мг х 3 раза в сутки. Время до прогрессирования в группе больных, получавших ДЭС, оказалось достоверно больше, чем в группе пациентов, принимавших флутамид (26,4 и 9,7 месяцев соответственно, р=0,016). Выживаемость больных, получавших эстрогенотерапию, составила 43,2 месяца, тогда как выживаемость больных в группе монотерапии флутамидом только 28,5 месяцев (р=0,04) [15].
Другой нестероидный антиандроген нилутамид применялся в режиме монотерапии только в одном исследовании II фазы, включающем 26 больных, в связи с чем судить о его эффективности не представляется возможным [16].
Таким образом, в настоящее время монотерапия такими антиандрогенами, как ципротерон, флутамид и нилутамид не может являться стандартным методом гормонотерапии распространенных форм РПЖ, так как данные об эффективности этих препаратов крайне немногочисленны и противоречивы. Кроме того, сексуальная функция сохраняется только у 30% больных, получающих данные варианты лечения. Единственным антиандрогеном, применение которого в режиме монотерапии позволило добиться высокой эффективности и хороших функциональных результатов, является бикалутамид (Касодекс) в дозе 150 мг.
В первоначальных исследованиях изучалась возможность монотерапии бикалутамидом в дозе 50 мг (дозировка, которая применятся при использовании режима комбинированной андрогенной блокады). В работе Chodak и соавт. терапия Касодексом в дозе 50 мг (243 больных) сравнивалась с хирургической или медикаментозной (Золадекс) кастрацией (243 больных). Средняя продолжительность терапии составила около 10 месяцев, при этом прогрессирование процесса отмечено у 53% больных в группе монотерапии Касодексом и у 42% в группе кастрации. При анализе выживаемости выявлено, что через 1 год после начала лечения оставались живы 61% больных (Касодекс 50 мг) и 65% (кастрация). После 86 недель наблюдения средняя выживаемость оказалась одинаковой в обеих группах. Авторы отмечают более высокое качество жизни больных, получавших Касодекс [17]. В обзоре 3 рандомизированных исследований, включающих более 1000 больных метастатическим РПЖ, также сравнивается эффективность терапии бикалутамидом в дозе 50 мг и кастрации. Время до прогрессирования и выживаемость оказались достоверно выше в группе больных, которым выполнялась кастрация по сравнению с пациентами, получавшими Касодекс в дозе 50 мг (р В связи с тем, что в дозе 50 мг бикалутамид несколько уступает кастрации по эффективности, но превосходит ее по качеству жизни, дальнейшие исследования были связаны с эскалацией дозы. В настоящее время наиболее приемлемой для применения в качестве монотерапии считается более высокая доза препарата – 150 мг [19]. В рандомизированном исследовании Boccardo, включающем 220 больных распространенным РПЖ, эффективность монотерапии Касодексом в дозе 150 мг сравнивалась с эффективностью лечения по схеме максимальной андрогенной блокады (МАБ) (Золадекс и флуцином). Средний период наблюдения составил 38 месяцев, за это время не выявлено статистически значимого различия в безрецидивной и общей выживаемости между группами. Сексуальный интерес (либидо) сохранили 40% больных в группе Касодекса 150 мг и 15% больных в группе МАБ (р=0,01), потенцию – соотвественно 31% и 7% пациентов (р=0,002) [20]. В исследовании французских авторов (270 больных РПЖ) применение бикалутамида 150 мг в монорежиме также показало одинаковую эффективность с МАБ (хирургическая или медикаментозная кастрация и нилутамид) по таким показателям, как объективный ответ на лечение в течение 6 месяцев, длительность периода до прогрессирования и общая выживаемость. При этом также отмечено преимущество бикалутамида по сравнению с МАБ в сохранении сексульной функции в течение 24 месяцев [21]. При анализе качества жизни и сексуального интереса больных в двух данных исследованиях выявлено преимущество лечения Касодексом. Авторы делают вывод о том, что монотерапия Касодексом в дозе 150 мг может являться альтернативой комбинированной андрогенной блокаде для больных, желающих сохранить сексуальную активность [9,10].
Наиболее представительное и хорошо документирование исследование по изучению эффективности и влияния на сексуальную активность больных РПЖ монотерапии Касодексом в дозе 150 мг проведено Iversen и соавт. [22,23]. В исследование включено 1453 больных, из них у 480 диагностирован местно–распространенный (Т3/Т4) опухолевый процесс, у остальных больных – метастатический РПЖ. Больные были рандомизированы на 2 группы: в 1 группе пациенты получали монотерапию Касодексом 150 мг, во 2 группе проводилась билатеральная орхидэктомия или лечение Золадексом. Сроки наблюдения для больных с неметастатическим РПЖ составили 6,3 года. За этот период умерли 56% больных. Общая выживаемость больных в группе монотерапии Касодексом 150 мг и в группе кастрации оказалась одинаковой (рис. 1). Также не было получено статистически достоверных различий во времени до прогрессирования в обеих исследуемых группах. При анализе качества жизни больных отмечено преимущество монотерапии Касодексом в отношении сексуального интереса и физической активности пациентов (рис. 2). Через 12 месяцев после начала лечения снижение сексуальной активности по сравнению с исходным уровнем отметили 47% больных в группе хирургической и медикаментозной кастрации и только 23% больных, получавших Касодекс 150 мг. При анализе побочных эффектов лечения выявлено значительное преобладание приливов у больных в группе кастрации (50,0%) по сравнению с больными, получавшими Касодекс (13,1%). В группе монотерапии Касодексом 150 мг более часто наблюдалась гинекомастия и болезненность грудных желез (соответственно 49,4% и 40,1%) по сравнению со стандартной терапией (4,4% и 1,9%). В подгруппе больных с метастатическим РПЖ продолжительность жизни больных, которым выполнялась кастрация, оказалась выше, чем у больных, получавших Касодекс 150 мг, однако преимущество в выживаемости составило 6 недель. Кроме того, при анализе результатов лечения больных генерализованным РПЖ с благоприятным прогнозом не выявлено достоверных различий в выживаемости пациентов в обеих группах. Таким образом, данное крупное рандомизированное исследование показало, что монотерапия Касодексом в дозе 150 мг является равноэффективным кастрации методом гормонального лечения больных местно–распространенным РПЖ, позволяющим существенно повысить качество жизни пациентов за счет сохранения сексуальной и физической активности. У больных метастатическим РПЖ с минимальными проявлениями болезни лечение Касодексом 150 мг незначительно уступает кастрации по эффективности и может быть рекомендовано молодым пациентам, желающим сохранить потенцию, при условии информированности больного о возможном снижении продолжительности жизни.
Большое многоцентровое исследование проведено с целью изучения эффективности применения Касодекса в дозе 150 мг при раннем РПЖ в качестве адъювантного лечения после стандартной терапии: радикальная простатэктомия, лучевая терапия, тщательное наблюдение (исследования 23, 24, 25 в рамках программы Early Prostate Cancer – EPC). В исследование включено 8113 больных РПЖ стадии T1–4 Nx M0, которые были рандомизированы на 2 группы: больным в одной группе (4042 чел) в дополнение к основному лечению проводили гормональную терапию Касодексом в дозе 150 мг, в другой группе (4061 человек) пациенты после основного лечения получали плацебо. За 5,4 лет наблюдения (при минимальном периоде наблюдения 4,5 года), в течение которого прогрессирование заболевания было выявлено у 21,6% больных, отмечено значительное улучшение безрецидивной выживаемости – на 27% у больных, получавших Касодекс 150 мг по сравнению с группой плацебо (отношение шансов – 0,73, 95% доверительные интервалы – 0,66–0,8, р Таким образом, в настоящее время монотерапия Касодексом в дозе 150 мг является эффективным методом лечения больных РПЖ, позволяющим обеспечить пациентам более высокое качество жизни, чем при проведении других вариантов гормональной терапии. При лечении больных местно–распространенным РПЖ общая, специфичная выживаемость больных и длительность ремиссии при проведении терапии Касодексом 150 мг не отличаются от аналогичных показателей при проведении кастрации или комбинированной андрогенной блокады. Выживаемость пациентов с метастатическим РПЖ только на 6 недель меньше, чем при выполнении кастрации. Преимущество в качестве жизни больных, получающих Касодекс в дозе 150 мг, обеспечивается в основном за счет более высокой сексуальной и физической активности. Адъювантная терапия Касодексом в дозе 150 мг после выполнения радикальной простатэктомии или проведения лучевой терапии, а также при сравнении с тщательным наблюдением, улучшает безрецидивную выживаемость и снижает риск прогрессирования местно–распространенного РПЖ.
Рак простаты — одно из наиболее частых онкологических заболеваний у мужчин. Обычно он не слишком агрессивен. Большинство опухолей растут очень медленно и хорошо поддаются лечению.

Симптомы
На ранних стадиях заболевания никаких симптомов нет. Только когда опухоль достигает крупных размеров, появляются признаки:
- кровь в эякуляте или моче;
- ночные мочеиспускания более 2 раз за ночь;
- затрудненное мочеиспускание и вялая струя мочи;
- проблемы с эрекцией;
- тазовые боли;
- слабость, онемение в ногах, снижение контроля над кишечником и мочевым пузырём.
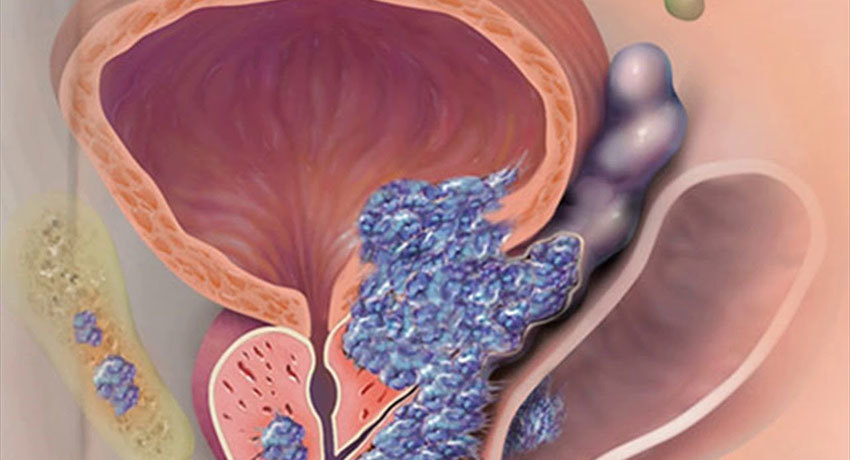
Диагностика
Диагностика начинается после того как пациент обращается с симптомами рака предстательной железы или сдает анализ крови на ПСА. Часто болезнь диагностируется после скрининга. Его проходят мужчины после 50 лет.
Стандартный диагностический алгоритм:
- Анализ крови на ПСА и пальцевое ректальное исследование простаты. Риск рака считается высоким при уровне простатспецифического антигена более 4 нг/мл. Если он ниже, вероятность наличия злокачественной опухоли составляет 15%. Если ПСА составляет от 4 до 10 нг/мл, риск увеличивается до 25%, если он больше 10 нг/мл, то до 50%.
- При уровне ПСА более 4 нг/мл, либо при меньшей концентрации простатспецифического антигена, но выявлении увеличенной простаты при пальцевом ректальном исследовании, требуются дополнительные диагностические тесты: обычно это трансректальное УЗИ, реже МРТ.
- По результатам УЗИ или МРТ могут быть определены показания для проведения биопсии предстательной железы. Она выполняется трансректальным (через прямую кишку) или трансперинеальным (через промежность) способом. При помощи специальной иглы с пружиной берется фрагмент ткани из простаты. Обычно врач делает это 12 раз. Введение иглы и её извлечение занимает доли секунды, поэтому процедура не очень болезненна для пациента.
Биопсия помогает понять, есть рак или нет. В ходе гистологического исследования определяется степень злокачественности опухоли. Она оценивается в баллах по шкале Глисона. Большинство случаев рака простаты имеют низкую степень злокачественности.
Оставьте свой номер телефона
Лечение по стадиям
Стадия 1. При ожидаемой продолжительности жизни пациента менее 10 лет заболевание можно не лечить. Оно прогрессирует очень медленно, поэтому вряд ли успеет вызвать симптомы у пациента на протяжении его жизни. Для молодых здоровых мужчин применяется тактика активного наблюдения, либо лечение при помощи одного из методов:
- брахитерапия;
- дистанционное облучение;
- простатэктомия (хирургическое удаление простаты).
Стадия 2. Варианты лечения для пожилых пациентов: активное наблюдение, либо лучевая терапия, которая может дополняться гормональной терапией. Варианты лечения для молодых мужчин с высокой ожидаемой продолжительностью жизни:
- радикальная простатэктомия с удалением лимфоузлов, а при положительных краях резекции (наличие раковых клеток на границе удаленной ткани) проводится облучение;
- дистанционное облучение как единственный метод лечения;
- брахитерапия (контактная лучевая терапия).
Стадия 3. Рак распространяется на соседние органы. Но ещё нет метастазов в лимфоузлах. Такие новообразования чаще рецидивируют после лечения. Варианты терапевтической тактики для таких пациентов:
- сочетание дистанционного облучения и гормональной терапии;
- два вида облучения (дистанционное и контактное) вместе с гормональной терапией;
- радикальная простатэктомия, которая может быть дополнена облучением, гормональной терапией или сочетанием этих методов.
В пожилом возрасте возможно только облучение, только гормональная терапия, а в редких случаях — активное наблюдение.
Стадия 4. Радикальная простатэктомия не проводится, так как появляются отдаленные метастазы. Применяются методы, позволяющие держать заболевание под контролем как можно дольше: гормональная терапия, облучение, химиотерапия, радионуклидные методы, трансуретральная резекция простаты для уменьшения симптомов.
Читайте также:





