Ронц отделение опухолей поджелудочной железы
Пока опухоль маленьких размеров, она никак себя не проявляет и пациента не беспокоит. Часто рак поджелудочной железы диагностируется только тогда, когда появляется боль в эпигастральной области. Проявлением опухоли поджелудочной железы, локализованной в её головке, является возникновение механической желтухи. В этой ситуации механическая желтуха безболевая, в отличие от желтухи при камнях в желчных протоках, которая болью сопровождается. При раке головки поджелудочной железы механическая желтуха возникает постепенно, и чаще всего такую желтуху у пациента замечают его родственники. Сам пациент редко замечает, что он начал желтеть.
- Ранняя диагностика
Ранней диагностики опухоли поджелудочной железы как таковой не существует – нет чек-апов, которые были бы направлены непосредственно на раннюю диагностику рака поджелудочной железы. Неинвазивный метод, который может сказать о том, что у пациента есть какое-то образование в железе – скрининговое УЗИ брюшной полости. Но УЗИ – это исследование, результаты которого во многом зависят от оператора и от качества оборудования, на котором оно выполняется. Чтобы получить достоверный результат, необходима аппаратура экспертного класса и диагност высочайшей квалификации, а это доступно далеко не во всех медицинских учреждениях.
- Обследование при подозрении на опухоль поджелудочной железы
Онкомаркеры. Если есть подозрение на опухоль поджелудочной железы, то пациенту рекомендуют сдать анализ крови на наличие специфичных онкомаркеров. По его результатам можно судить, есть ли какое-то заболевание в области гепатопанкреатобилиарной зоны.
КТ органов брюшной полости с внутривенным контрастированием. По результатам этого исследования врач может установить, в каком именно месте поджелудочной железы находится опухоль.
Эндоскопическая ультрасонография. В Ильинской больнице для диагностики опухоли поджелудочной железы выполняется эндоскопическая ультрасонография (эндо-УЗИ). В желудок и двенадцатиперстную кишку пациента проводится эндоскоп, на конце которого есть не только камера, но и ультразвуковой датчик. С помощью ультразвука органы, прилегающие к желудку и двенадцатиперстной кишке, можно очень подробно рассмотреть. Врач может изучить кровоток в новообразовании. По типу кровотока и по характеру опухоли – какое она имеет строение, какую плотность, имеет ли капсулу – врач может с большей долей вероятности, чем по КТ, судить о морфологии этой опухоли.
Пункция. При подозрении на опухоль поджелудочной железы её нужно верифицировать морфологически. Эндо-УЗИ дает возможность сделать пункцию и изучить полученные ткани в гистологической лаборатории. Результат точно укажет - опухоль это или какое-то локальное воспаление, которое при инструментальных исследованиях имитирует злокачественное образование. Если это воспаление, то пациента будут консервативно лечить гастроэнтерологи. А если это всё-таки опухоль, верифицированная по результатам гистологического исследования, то такому пациенту будет предложена операция.
В Ильинской больнице проводятся все современные методы диагностики рака поджелудочной железы, в том числе и эндо-УЗИ с возможностью выполнения пункции.
- Локализация и виды опухолей поджелудочной железы
Опухоли в поджелудочной железе могут иметь разную природу. Это может быть аденокарцинома. Часто встречаются муцинозные опухоли: внутрипротоковые муцинозно-папиллярные опухоли, муцинозные цистоденомы и т.д. Опухоль может располагается в головке поджелудочной железы, в её теле или в хвосте. От локализации опухоли зависит тип резекции. Если опухоль располагается в головке поджелудочной железы, то выполняется панкреатодуоденальная резекция. Если опухоль располагается в теле поджелудочной железы, то можно удалять часть поджелудочной железы, делая так называемую центральную резекцию. Это очень сложная хирургия, и только специалисты в этой узкой области могут выполнять подобные операции успешно. Одна из наименее сложных операций на железе по сравнению с остальными – это когда опухоль располагается в хвосте железы. В этом случае выполняется дистальная резекция поджелудочной железы. Она может быть со спленэктомией – с удалением селезёнки, может быть с сохранением селезёнки, и, естественно, с лимфодиссекцией.
- Онкологический консилиум (Tumor-board)
Постановка онкологического диагноза в Ильинской больнице основывается на всестороннем обследовании пациента, включающем методы лучевой диагностики, эндоскопические исследования, гистологический анализ пункционного материала и др. Каждый клинический случай разбирается на онкологическом консилиуме (Tumor-board), в котором участвуют семейный врач пациента, онкохирурги, клинические онкологи, лучевые диагносты, морфологи, анестезиологи, кардиологи, эндокринологи и другие специалисты. Такой мультидисциплинарный подход позволяет выработать наиболее эффективную персонализированную тактику лечения пациента, учесть все индивидуальные нюансы его биологии, принять решение о виде и объеме хирургического вмешательства.
- Сложности хирургии поджелудочной железы
В хирургическом сообществе считается, что операция на поджелудочной железе – это операция экстра-уровня. Такие операции при подтверждённом раке должны выполняться у тех хирургов, которые имеют максимальный опыт. Область поджелудочной железы – очень сложная анатомическая зона. Делая операцию на головке поджелудочной железы, врач выполняет так называемую панкреатодуоденальную резекцию. Нужно правильно сформировать доступ к поджелудочной железе, сделать резекцию – удалить часть поджелудочной железы. Удаляется часть желчных протоков, которые проходят в головке поджелудочной железы, удаляется часть двенадцатиперстной кишки, куда впадают протоки поджелудочной железы и желчный проток. Обязательно выполняется удаление лимфоузлов (лимфодиссекция). Т.е. во время операции удаляется большой органокомплекс, который играет серьёзную роль в человеческом организме. А после этого хирургу нужно выполнить правильную реконструкцию: правильно вшить в кишку отсечённый проток, правильно пришить оставшуюся часть поджелудочной железы – создать новое соединение (анастомоз) между поджелудочной железой и тонкой кишкой или желудком, правильно сопоставить тонкую кишку. Поэтому операция по поводу рака поджелудочной железы должна проводиться экспертом.
При раке поджелудочной железы бывают ситуации, когда есть возможность выполнить операцию в том или ином объёме резекции, а бывает, что такой возможности уже нет. Бывают и пограничные ситуации, когда опухоль в поджелудочной железе прорастает в магистральные сосуды. В команде Ильинской больницы есть уникальный хирург - профессор Вячеслав Иванович Егоров, всемирно признанный лидер в области гепатопанкреатобилиарной хирургии, в области хирургии поджелудочной железы. Профессор Егоров обладает максимальным опытом выполнения вмешательств на поджелудочной железе. Он проводит уникальные операции при местнораспространённом раке с резекцией артерий, реконструкцией и протезированием этих артерий.
В Ильинской больнице операции на поджелудочной железе могут быть выполнены из лапароскопического доступа, в том числе с применением роботического комплекса Da Vinci. Хирург управляет инструментами робота с помощью специальных джойстиков, 3D-видеокамера передает хирургу объемное изображение. Инструменты робота движутся предельно точно и имеют больше степеней свободы, чем руки человека. Робот позволяет провести наиболее тщательное удаление лимфоузлов, минимизирует развитие интра- и послеоперационных осложнений, сроки реабилитации сокращаются.
- Послеоперационный период
Первые дни после операции пациент проводит в отделении реанимации. Корректируются его жизненные показатели, с помощью прикроватного УЗИ контролируется состоятельность анастомозов, при подозрении на внтурипросветное кровотечение проводится экстренное эндоскопическое исследование и лечение. На 7-9 сутки после операции пациента выписывают. После этого пациент продолжает наблюдаться у онколога, при необходимости получает послеоперационную химиотерапию. Оперировавший хирург также наблюдает пациента длительное время. Общую координацию осуществляет семейный врач. Пациент точно знает, когда и какие обследования и осмотры ему предстоит пройти.
- Качество жизни после операции
Если хирургам удалось сохранить хотя бы часть поджелудочной железы, то её эндокринной функции абсолютно достаточно, чтобы пациент в дальнейшем не принимал никаких препаратов. В редких случаях хирурги вынуждены удалять поджелудочную железу полностью. В этом случае пациенту придётся постоянно принимать ферменты, обеспечивающие нормальное расщепление питательных веществ в ЖКТ. Кроме того, эти пациенты становятся инсулинозависимыми – у них развивается так называемый послеоперационный диабет.












Использование сунитиниба при нейроэндокринных опухолях поджелудочной железы: опыт отделения химиотерапии ФГБУ РОНЦ им. Н.Н. Блохина МЗ РФ
С целью оценки эффективности и токсичности сунитиниба для 19 больных нейроэндокринными опухолями (НЭО) поджелудочной железы, ранее получавших лечение, была проведена оценка профиля безопасности с НЭО поджелудочной железы G1, G2. Стабилизация отмечена у большинства (78,6%) больных, прогрессирование у 1 (7,1%) пациента. Длительность стабилизации (медиана) равна 395 дням (162–518 дней, 95% ДИ). Полученные результаты показали, что эффективность лечения сунитинибом соответствует результатам, представленным в мировой литературе. Выявленные нежелательные явления коррелируют с известным токсическим профилем препарата.
Нейроэндокринные опухоли (НЭО) поджелудочной железы составляют 12% в структуре НЭО желудочно-кишечного тракта и 2% от всех злокачественных новообразований поджелудочной железы. Частота их возникновения увеличивается [14]. В эту группу входят инсулиномы, гастриномы, редко функционирующие и нефункционирующие НЭО. Для пациентов с НЭО поджелудочной железы хирургическое лечение – основной и единственный радикальный метод, позволяющий их излечивать. Показания к хирургическому лечению и объем операции определяются в зависимости от наличия клинических симптомов опухоли, местной расспространенности, злокачественого потенциала, наличия метастазов в печени, включая оценку резектабельности поражения печени и функциональное состояние организма. Хирургическое лечение НЭО заключается в выполнении панкреатодуоденальной резекции, дистальной резекции поджелудочной железы со спленэктомией или без нее, энуклеации опухоли самостоятельно либо совмещенно с дистальной резекцией поджелудочной железы в зависимости от наличия сопутствующего наследственного синдрома МЭН1. НЭО поджелудочной железы, как правило, имеют высокий злокачественный потенциал, следовательно, необходима регионарная лимфодиссекция. По мнению абсолютного большинства авторов, не следует оперировать больных низкодифференцированными НЭО (G3) поджелудочной железы, т.к. эти опухоли на момент диагностики обычно местнораспространенные, имеют метастазы в печень и другие органы [8, 11–13].
При диссеминированной болезни и нерезектабельных опухолях показано проведение консервативной терапии (химиотерапия, таргетная терапия, аналоги соматостатина). Ключевую роль в процессе ангиогенеза НЭО поджелудочной железы играет сосудистый эндотелиальный фактор роста (VEGFR). Кроме этого опухолевые клетки поджелудочной железы широко экспрессируют тромбоцитарный фактор роста (PDGFR). К настоящему времени большую роль в лечении НЭО поджелудочной железы приобретает использование таргетных препаратов. К одним их таких средств относится сунитиниб. Сунитиниб (Сутент, SU 11248 ) – мультитаргетный препарат, антиангиогенный, низкомолекулярный ингибитор VEGFR и тромбоцитарного фактора роста (PDGFR). Мишенью Сутента служат рецепторы VEGF 1-го (flt) и 2-го (flk) типов, KIT, PDGFR-альфа и -бета (рецепторы тромбоцитарного фактора роста). Результаты использования Сутента при светлоклеточном раке почки и резистентных к Гливеку гастроинтестинальных стромальных опухолях позволяют рекомендовать его при этих заболеваниях. Получены положительные результаты использования Сутента при НЭО. В качестве средства, применяемого при терапии почечно-клеточного рака и гастроинтестинальных стромальных опухолей, сунитиниб был зарегистрирован в США в январе 2006 г. В России сунитиниб был одобрен для лечения больных раком почки в августе 2007 г., а в 2012 г. включен в Перечень жизненно необходимых и важнейших лекарственных препаратов.
Сунитиниб был зарегистрирован в Европе с 2010 г., в США – с 2011-го, в РФ – с 2013 г. в качестве препарата для лечения НЭО поджелудочной железы. В исследовании I фазы [2] было установлено, что время полувыведения препарата составляет 40 часов, а его активных метаболитов – около 80 часов. Сунитиниб метаболизируется в печени изоферментом CYP3A4 системы цитохрома-Р450. В качестве средства лечения почечно-клеточного рака и гастроинтестинальных стромальных опухолей установлена лечебная доза препарата – 50 мг в день перорально независимо от приема пищи в течение 4 недель с интервалом в 2 недели.
К основным проявлениям дозолимитирующей токсичности относятся астения и артериальная гипертензия. Также отмечена кожная токсичность, выраженная в развитии сухости кожи, отека и ладонно-подошвенного синдрома, наблюдавшаяся преимущественно при применении Сутента в дозах ≥75 мг/день. Другими проявлениями кожной токсичности были окрашивание кожи в желтый цвет, ассоциирующееся с интенсивным окрашиванием мочи вследствие выведения препарата и его метаболитов, а также депигментация волос. Эти эффекты обычно развивались при применении Сутента в дозах ≥50 мг/день и купировались после отмены препарата.
Из 22 больных раком почки в исследовании I фазы частичный эффект Сутента в дозе ≥ 50 мг/день был отмечен у троих. Стабилизация продолжительностью более 6 месяцев отмечена у пятерых больных с почечно-клеточным раком почки. Дополнительно у шестерых больных произошел некроз опухоли с образованием свищей, развитием вторичной инфекции в местах некроза метастазов в легких, летальным внутрибрюшным кровотечением у одного больного. Эти осложнения были связаны с быстрым (в течение недели после начала лечения) исчезновением сосудов внутри опухоли и высокой дозой препарата. На основании результатов I–II фаз испытаний были проведены расширенные исследования Сутента на больных Гливек-резистентными гастроинтестинальными стромальными опухолями, почечно-клеточным раком и другими опухолями.
Использование Сутента при светлоклеточном раке почки основано на том, что значительное число больных светлоклеточным раком почки имеют синдром Гиппеля–Линдау, характеризующийся повышенным неоангиогенезом, обусловленным гиперпродукцией VEGF. Это позволяет ожидать высокой эффективности при применении антиангиогенных препаратов.
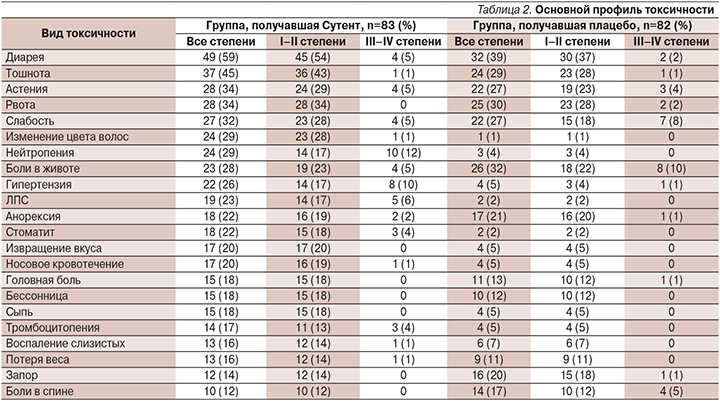
Во II фазе испытаний 63 больным светлоклеточным раком почки с прогрессированием на фоне терапии цитокинами назначали Сутент по 50 мг/сут в режиме 4/2 [3]. При оценке эффективности частичный эффект отмечен у 25 (40%) больных, стабилизация более 3 меяцев – у 17 (27%). Время до прогрессирования у больных с частичным эффектом составило от 21 до 24+месяц, медиана времени до прогрессирования у всех больных – 8,7 месяца. Медиана ОВ – 16,4 месяца. Из токсичности III–IV степеней чаще всего отмечались слабость (11%), лимфопения (32%), повышение уровня липазы (21%) без признаков развития панкреатита. Также имели место нейтропения (13%), анемия (10%), повышение уровня амилазы (8%), диарея (3%), тошнота (3%), стоматит (2%), рвота (2%), снижение фракции выброса левого желудочка (2%), дерматит (2%), артериальная гипертензия (2%).
Также были проведены исследования по изучению эффективности бевацизумаба при светлоклеточном раке почки, составившей около 10%. В.I. Rini и соавт. [5] исследовали эффективность Сутента на 32 больных с прогрессированием рака почки на фоне терапии бевацизумабом. Уменьшение опухоли отмечено у большинства (81%) пациентов, а у 13% больных наблюдался частичный эффект, что подтверждает оправданность последовательного проведения антиангиогенной терапии препаратами с различными механизмами действия и разными мишенями. Таким образом, можно смело утверждать, что Сутент улучшает результаты лечения распространенного светлоклеточного рака почки.
Сутент изучали и при резистентных к Гливеку гастроинтестинальных стромальных опухолях. Известно, что Гливек (ингибитор тирозинкиназы c-kit) – единственный препарат с доказанной высокой эффективностью при этом виде опухолей. В среднем через 1–2 года на фоне приема Гливека развивается резистентность, связанная с вторичной мутацией KIT или PDGFR-альфа [6], а около 20% больных имеют первичную резистентность к препарату.
В исследование J.А. Morgan и соавт. [7] были включены 97 больных Гливек-резистентными GIST. Пациенты принимали Сутент в дозе 50 мг/сут в течение 4 недель с 2-недельным перерывом. Частичный эффект был зарегистрирован у 8% больных, стабилизация болезни более 6 месяцев – у 37%, а от 6 недель до 6 месяцев – у 32%. Медиана времени до прогрессирования составила 7,8 месяца, общая выживаемость – 19,8. Активно изучается эффективность сунитиниба при НЭО. Обнадеживающие результаты в отношении объективного эффекта для больных НЭО различной локализации послужили причиной проведения мультицентрового исследования I фазы. Препарат назначали в дозе 50 мг/день с интервалом между курсами 2 недели. Объективный эффект для 66 больных распространенной НЭО поджелудочной железы составил 16,7%, и 56,1% пациентов была достигнута длительная стабилизация (более 6 месяцев). Медиана времени до прогрессирования составила 7,7 месяца 13].
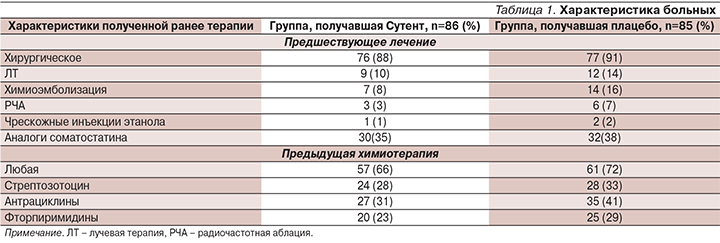
Beaumont и соавт. представлены результаты II фазы по изучению препарата на 106 больных НЭО поджелудочной железы, получавших ранее лечение. Частичный эффект достигнут 10% пациентов, стабилизация заболевания – 80%. Медиана времени до прогрессирования составила 40 недель, годичная выживаемость – 82,8% [9]. В дальнейшем Raymond и соавт. [11, 12] выполнили мультицентровое рандомизированное двойное слепое плацебо-контролируемое исследование III фазы по изучению сунитиниба на больных высокодифференцированными НЭО поджелудочной железы, которым невозможно выполнить радикальное оперативное вмешательство и у которых отмечено прогрессирование болезни за последние 12 месяцев. Первичной целью была оценка выживаемости без прогрессирования, вторичной – уровня объективного ответа, общей выживаемости и токсичности. Основная характеристика больных представлена в табл. 1.
Больные принимали Сутент/плацебо в дозе 37,5 мг/сут в ежедневном непрерывном режиме. По данным проведенного исследования, медиана времени до прогрессирования в группе сунитиниба составила 11,4 месяца (95% ДИ: 7,4–19,8; р 0
- Отделение хирургическое N7 опухолей печени и поджелудочной железы
Опухоли органов желчевыводящей системы, поджелудочной железы и двенадцатиперстной кишки, или опухоли органов билиопанкреатодуоденальной зоны, составляют значительную по частоте встречаемости и наиболее сложную для лечения группу опухолей человека.
Наиболее часто развивающейся опухолью в указанных органах является рак. Кроме рака, в них могут развиться так называемые нейроэндокринные опухоли, которые характеризуются в подавляющем большинстве случаев менее агрессивным течением и лучшим прогнозом по сравнению с раковой опухолью. Кроме того, крайне редко в рассматриваемых органах могут развиться саркомы – опухоли неэпителиального, мезенхимального происхождения. Наконец, такой орган, как поджелудочная железа, может быть мишенью для метастазов рака толстой кишки, лёгкого, почки, молочной железы и меланомы различной локализации.
По частоте поражения опухолями рассматриваемые органы следует расположить в следующей последовательности. На поджелудочную железу приходится не менее 65 % всех опухолей органов билиопанкреатодуоденальной зоны, на внепечёночные желчные протоки и желчный пузырь – до 20 %, на большой сосочек двенадцатиперстной кишки – до 10 %, на двенадцатиперстную кишку – до 5 %.
Среди всех опухолей поджелудочной железы, наиболее часто поражаемого опухолевой патологией органа, абсолютно превалирующей формой является аденокарцинома. На неё приходится до 95 % всех форм экзокринного рака этого органа. Эта опухоль обладает максимально выраженными проявлениями злокачественности: местным разрушающим ростом, ранним метастазированием, осложнённым течением. Характерные для этой опухоли поджелудочной железы тупые нарастающие боли в животе и спине носят изнурительный характер, лишают больного сна, требуют для своего купирования всё больших доз обезболивающих, в том числе наркотических препаратов. Указанная опухоль прорастает двенадцатиперстную кишку, приводит к сужению просвета кишки, вызывая её непроходимость. При распаде этой опухоли отмечается кровотечение в просвет двенадцатиперстной кишки. Поскольку опухоль головки поджелудочной железы исключает орган из пищеварения, в силу нарушения поступления сока поджелудочной железы в двенадцатиперстную кишку, помимо общего воздействия на весь организм, это быстро приводит больного к истощению.
Среди других первичных экзокринных опухолей поджелудочной железы сравнительно редко встречаются разнообразные кистозные опухоли, каждая из которых обладает в разной степени выраженности признаками злокачественности, а некоторые из них являются предшественниками протокового рака поджелудочной железы.
К сожалению, современная медицина не располагает методами ранней диагностики рака поджелудочной железы и других органов билиопанкреатодуоденальной зоны. Поводом обратиться к врачу должны быть следующие проявления болезни: постоянные нарастающие боли вверху живота, нередко сопряжённые с такими же болями в спине; стойкое снижение аппетита, отвращение к пище, особенно мясной, тошнота; похудание; появление желтухи; стойкие симптомы сахарного диабета. Важно учесть: возникновение тупых постоянных, нарастающих болей вверху живота и спине, равно как и других вышеназванных симптомов, если они обусловлены раком поджелудочной железы и реже желчевыводящей системы, не является ранним проявлением заболевания.
При подозрении на опухоль органов желчевыводящей системы и поджелудочной железы на основе осмотра больного, обычных лабораторных исследований, УЗИ, эзофагогастродуоденоскопии, как правило, предлагается РКТ или МРТ, а часто оба метода уточняющей диагностики. Важно понимать, что РКТ и МРТ, наряду с одинаково эффективным решением ряда диагностических задач, в решении некоторых задач обладают разной диагностической эффективностью, то есть они не дублируют друг друга. Так, при определении природы изменений в поджелудочной железе, когда диагноз опухоль поджелудочной железы вызывает сомнения, когда необходимо различить воспалительные и опухолевые изменения, выполнение МРТ предпочтительнее. Также МРТ более информативна в определении уровня, локализации опухолевого блока желчевыводящей системы, протяжённости опухолевого поражения желчных протоков, в выявлении мелких метастазов в печени. РКТ, в свою очередь, более информативна в решении диагностических задач, связанных с таким принципиальным понятием, как резектабельность опухоли, то есть возможностью полного хирургического удаления опухоли. Это обусловлено тем, что РКТ более точно, чем МРТ, отражает распространение опухоли на прилежащие крупные сосуды. Ведь именно значительное вовлечение прилежащих к опухоли сосудов, в отсутствие отдалённых метастазов, определяет невозможность хирургической операции. Кроме того, РКТ обладает несколько более высокой информативностью в диагностике метастазов в забрюшинных лимфоузлах и по брюшине.
При подозрении на рак органов желчевыведения и поджелудочной железы необходимо исследование крови на следующие маркёры опухоли: СА 19-9 и РЭА (раковоэмбриональный антиген) – вещества белковой природы, которые вырабатываются опухолевыми клетками. Повышенные показатели заставляют с большей уверенностью подозревать опухолевую природу выявленных изменений и косвенно отражают объём опухоли, опухолевую массу, поскольку чем выше уровень этих маркёров, тем больше масса опухоли и её метастазов. В интерпретации повышенных показателей опухолевых маркёров в крови важно понимать, что их повышение может быть обусловлено не только опухолью, но и воспалительными и другими изменениями и состояниями человека. Так, повышенный уровень указанных маркёров может быть обусловлен хроническим панкреатитом, холангитом, то есть воспалительными изменениями, или повышенным давлением в желчевыделительной системе вообще вне зависимости от причины, вызвавшей нарушение желчеоттока в двенадцатиперстную кишку. Наконец, эти вещества белковой природы не всегда вырабатываются опухолевыми клетками одной и той же опухоли. Всё это означает, что специфичность опухолевых маркёров очень ограничена.
Пункционная биопсия, осуществляемая под УЗИ или РКТ наведением, – рутинная методика на амбулаторном этапе - позволяет точно судить о морфологии и гистогенезе опухоли. Необходимость в ней возникает при нерезектабельной опухоли поджелудочной железы, когда больному на первом этапе предстоит нехирургическое лечение: химиотерапия, радиотерапия. Метод также необходим при подозрении на нерезектабельную нейроэндокринную опухоль поджелудочной железы, например, в силу одновременно выявленных метастазов в печени. В этом случае при нейроэндокринной природе опухоли, в отличие от протокового рака, допустимо комбинированное лечение с выполнением так называемой циторедуктивной, то есть неполной, сокращающей объём опухоли операции на первом этапе. Биопсийный материал, полученный в результате пункции, может быть подвергнут обычной световой микроскопии или иммуноморфологическому исследованию, что повышает диагностическую ценность исследования.
К методам уточняющей диагностики относятся следующие: эндоскопическое - УЗИ, ультразвуковое исследование, сочетаемое с эндоскопическим исследованием. Чаще осуществляется гастроскопия или дуоденоскопия с одновременным ультразвуковым исследованием желудка, двенадцатиперстной кишки, поджелудочной железы. Метод позволяет выявить небольшие образования, расположенные в подслизистом слое двенадцатиперстной кишки, опухоли размерами менее 2 см в поджелудочной железе, распространение опухоли большого дуоденального сосочка на стенку двенадцатиперстной кишки и поджелудочную железу, оценить вовлечение в опухолевый процесс прилежащих магистральных сосудов, довольно точно судить о природе изменений в поджелудочной железе. Наконец, метод обеспечивает проведение пункционной биопсии подозрительного участка.
Ангиграфия – рентгенологическое исследование сосудов в той или иной области человеческого организма. Ангиография сосудов в области органов желчевыведения и поджелудочной железы позволяет предельно точно судить об особенностях сосудистой анатомии, выраженности так называемого коллатерального кровообращения, о вовлечении в опухоль магистральных сосудов. Этот метод уточняющей диагностики особенно актуален при протоковом раке поджелудочной железы, когда вероятность распространения опухоли на магистральные прилежащие сосуды высока, предстоит операция с резекцией поражённых опухолью сосудов.
Лапароскопия – эндоскопическое исследование органов брюшной полости позволяет выявить мелкие метастазы по брюшине, на поверхности печени, осуществить их биопсию. Метод также может сочетаться с ультразвуковым исследованием печени. Диагностическая роль лапароскопии при опухолях поджелудочной железы и органов желчевыводящей системы в целом небольшая.
- антеградное чрескожное дренирование желчных путей;
- эндоскопическое ретроградное транспапиллярное дренирование желчных путей;
- хирургическое и эндохирургическое формирование анастомозов между желчным пузырём или внепечёночными желчными протоками и пищеварительным трактом.
Колоссальный опыт применения всех видов желчеотведения по поводу синдрома механической желтухи, обусловленной опухолью органов билиопанкреатодуоденальной зоны, позволяет констатировать: наиболее универсальным по диагностическим и лечебным возможностям, вне зависимости от уровня блока желчевыводящих путей, и наиболее приемлемым по онкологическим показаниям и безопасности методом желчеотведения является антеградное чрескожное дренирование протоков печени.
- правосторонняя расширенная гемигепаэктомия с резекцией внепечёночных желчных протоков, холецистэктомией, с удалением I сегмента печени;
- левосторонняя гемигепатэктомия с резекцией внепечёночных желчных протоков, холецистэктомией, удалением I сегмента печени.
Типичной операцией по поводу рака тела и хвоста поджелудочной железы является дистальная субтотальная резекция поджелудочной железы со спленэктомией. При поражении опухолью головки, тела и хвоста поджелудочной железы выполняется панкреатэктомия, то есть удаляется вся поджелудочная железа с селезёнкой, двенадцатиперстной кишкой.
Важно понимать: операция под одним и тем же названием по поводу рака органов желчевыведения и поджелудочной железы, но выполняемая с учётом онкологических принципов, например, в высокоспециализированном онкологическом учреждении, обеспечивает лучшую профилактику местного рецидива рака по сравнению с аналогичной операцией, выполняемой без соблюдения указанных принципов. При этом дооперационное и послеоперационное противоопухолевое лекарственное и/или лучевое лечение, то есть то, что делает лечение комбинированным, направлено на улучшение показателей отдалённой выживаемости. Вопрос о назначении комбинированного лечения решается на совместном консилиуме хирурга-онколога, химиотерапевта, радиотерапевта.
После завершения лечения больной подлежит ежеквартальным контрольным обследованиям, включающим как инструментальное обследование (УЗИ, РКТ, МРТ, эндоскопическое исследование желудочно-кишечного тракта), так и исследование опухолевых маркёров в крови, если таковые были повышены до лечения.
Читайте также:

