Результаты цитохимического исследования характеризующие острый миелобластный лейкоз
Лекция.
(Ст. Преподаватель Свирина В.И.)
В дифференциальной диагностике гемобластозов цитохимические исследования занимают важное место. Помимо глубокого теоретического значения, неоспорима их роль в уточнении различных форм лейкозов. Разработка эффективных методов дифференцированной терапии острых лейкозов, особенно острого лимфобластного лейкоза детей, стала возможной только после применения в клинической практике цитохимических методов диагностики.
Ниже представлено краткое описание некоторых цитохимических методик. Они ограничены исследованиями, используемыми для идентификации различных форм острых лейкозов. К ним относятся реакции: на миелопероксидазу, полисахариды, хлорацетатэстеразу, альфа-ацетатнафтилэстеразу, кислую фосфатазу, липиды и кислые сульфатированные мукополисахариды.
Реакция на пероксидазу.Пероксидаза является ферментом, разрушающим перекись водорода, образующуюся в клетке в процессе жизнедеятельности. Токсичная для клеток перекись водорода обезвреживается, освобождающийся при участии пероксидазы кислород вновь используется клеткой.
Пероксидаза обнаруживается не во всех клетках, этот фермент отсутствует в лимфоидных клетках и постоянен для всех элементов миелоидного ряда. Ввиду его специфичности для нейтрофилов с ранних фаз созревания фермент получил обозначение миелопероксидазы. Уровень активности пероксидазы подвержен большим колебаниям.
 |
Рис. 1. Положительная реакция на миелопероксидазу в клетках миелоидного ряда.
Х о д р е а к ц и и. Фиксированные мазки крови или костного мозга заливают бесцветным раствором бензидина или ортотолидина.
К раствору, перед тем как его наливают на мазок, добавляют каплю 3% перекиси водорода. Если в клетке содержится пероксидаза, то перекись водорода превращается в воду с выделением кислорода. Высвободившийся кислород окисляет бензидин или ортотолидин и переводит их в окрашенное соединение. При использовании бензидина цитоплазма клеток, содержащих пероксидазу, окрашивается в желтый цвет.
Все клеточные элементы нейтрофильного ряда костного мозга, начиная с ранних фаз созревания, дают резко положительную реакцию. В препарате цитоплазма клеток окрашена в желтый цвет.
Цитохимическая реакция на полисахариды (гликоген). Энергетические потребности клетки обеспечиваются гликогеном. Сложные метаболические процессы, связанные с расщеплением и ресинтезом гликогена под воздействием различных патологических процессов, могут извращаться. При цитохимическом анализе используется определение этих отклонений. Для обнаружения гликогена в клетках применяется ШИК – реакция.
Х о д р е а к ц и и. Под воздействием реактива Шиффа, в состав которого входит фуксин, появление в цитоплазме клеток красных или фиолетово-красных зерен указывает на присутствие полисахаридов (гликогена). После проведения ШИК – реакции и докраски гематоксилином все клеточные элементы хорошо дифференцируются. Ядра нейтрофилов окрашиваются в синий цвет, цитоплазма заполняется мелкой красной зернистостью гликогена, как бы сплошной окраской. Существует различная степень окраски цитоплазмы.
 |
Рис. 2. Положительная реакция на гликоген в гранулоцитах (диффузное окрашивание цитоплазмы)
Моноциты содержат гликоген, выявляемый в виде мелких пылевидных красных гранул на фоне неокрашенной или розоватой цитоплазмы. В эозинофилах при ШИК – реакции неокрашивающихся из-за обилия эозинофильной зернистости, судить о содержании гликогена невозможно. Определение ШИК – реакции в эозинофилах, так же как в базофилах, практического значения не имеет. Наиболее ценно ее значение для исследования зрелых нейтрофилов и лимфоцитов.
В лимфоцитах гликоген определяется в виде сравнительно крупных красных, не сливающихся между собой, зерен. Количество их находится в зависимости от ширины пояса, образованного цитоплазмой вокруг ядра. Для уточнения характера малых лимфоцитов с тонким ободком цитоплазмы необходимо внимательное изучение препарата под микроскопом. Только наличие крупных, хотя и единичных, красных зерен указывает на положительную ШИК – реакцию лимфоцитов.
 |
Рис. 3. Положительная реакция на гликоген в лимфоцитах (в виде гранул вокруг ядра)
Хлорацетатэстераза.Хлорацетатэстераза относится к неспецифическим эстеразам и наряду с реакцией на миелопероксидазу является биохимическим маркером клеток нейтрофильного ряда. Активность хлорацетатэстеразы, выявляемая в миелобластах, возрастает у промиелоцитов и миелоцитов. Активность фермента при остром миеломонобластном лейкозе низкая, а при остром монобластном лейкозе она совсем не обнаруживается.
Положительная реакция на хлорацетатэстеразу с использованием метода Яма позволила наряду с реакцией на миелопероксидазу дифференцировать по бластным клеткам острый миелобластный лейкоз. Положительная реакция определяется по мелкой синей зернистости, выпадающей в цитоплазме клеток.
 |
Рис. 4. Положительная реакция на хлорацетатэстеразу в миелобастах и созревающих гранулоцитах
Альфа - ацетатнафтилэстераза (неспецифическая эстераза). Этот фермент также содержится в клетках нейтрофильного ряда, начиная с миелобласта. Реакция на альфа-ацетатнафтилэстеразу особенно ярко выражена у клеток моноцитарного ряда и их молодых форм. Она приобретает важное диагностическое значение при остром монобластном лейкозе. Характерна следующая важная отличительная особенность: при остром монобластном лейкозе неспецифическая эстераза подавляется фтористым натрием в концентрации среды 1,5 мг/мл. Этот признак позволяет отличить клетки монобластного ряда от клеток других ростков, также обладающих активностью неспецифической эстеразы. При положительной реакции на альфа - ацетатнафтилэстеразу цитоплазма клеток заполнена мелкой темно-бурой зернистостью.
 |
Рис. 5. Положительная реакция на альфа-нафтил-ацетатэстеразу в миелобластах и созревающих гранулоцитах
Щелочная и кислая фосфатаза.Активность фосфатаз в нейтрофилах выявляется гистохимическим методом Гомори и методом азосочетания. Активность щ е л о ч н о й ф о с ф а т а з ы характерна для зрелых форм нейтрофилов, при различных заболеваниях она подвержена закономерным изменениям. В частности, для хронического миелолейкоза характерно резкое снижение щелочной фосфатазы, что является важным диагностическим признаком.
К и с л а я ф о с ф а т а з а в клетках связана с процессами клеточной дифференцировки. В клетках миелоидного ряда она выявляется уже в молодых предстадиях нейтрофилов, по мере вызревания клеток этого ряда ее активность снижается. Зрелые нейтрофилы лишены этой активности. Положительная реакция на кислую фосфатазу отмечается при остром миелобластном лейкозе. Резко положительна эта реакция при остром монобластном лейкозе.
 |
Рис. 6. Положительная реакция на кислую фосфатазу в миелобластах и созревающих гранулоцитах
Реакция на липиды. Липиды содержатся в клетках различных тканей. Клетки костного мозга и периферической крови содержат так называемые простые липиды в виде нейтральных жиров, свободных жирных кислот и др., а также сложных липидов - фосфолипидов. Особенно много их обнаруживают в зрелых нейтрофилах. Для выявления липидов в клетках крови применяют окраску суданом черным Б. В клетках лимфатического ряда липиды не выявляются. В клетках нейтрофильного ряда липиды могут быть определены уже в бластных элементах и по мере созревания клеток этого ряда количество суданофильных веществ в гранулоцитах увеличивается. Моноциты также содержат липиды, но в меньшем количестве, чем нейтрофилы.
 |
Рис. 7. Положительная реакция на липиды в гранулоцитах
Реакция на кислые мукополисахариды. Зернистость клеток гранулоцитарного ростка содержит кислые мукополисахариды; основным компонентом последних является хондроитин - 4 - сульфат. Наибольшее количество кислых мукополисахаридов синтезируют незрелые клетки зернистого ряда.
Реакция на сульфатированные кислые мукополисахариды специфична при промиелоцитарном остром лейкозе и характеризуется появлением в цитоплазме богатой сравнительно крупной розово-вишневой зернистости. Ядра клеток окрашиваются в светлый серо-голубой цвет.
 |
Рис. 8. Положительная реакция на мукополисахариды в созревающих гранулоцитах
Фактором прогноза, наиболее четко отражающим биологические свойства лейкоза, является цитогенетическая характеристика опухолевых клеток. В течение последних 20 лет было проведено большое число исследований с целью доказать принципиальную роль хромосомных аберраций. В настоящее время ни одно клиническое исследование не проводят без оценки цитогенетических маркеров лейкемических клеток.
В зависимости от долгосрочных показателей у больных с различными хромосомными аберрациями были определены три группы прогноза: благоприятного, среднего, неблагоприятного. Как уже отмечалось ранее, в разных клинических исследованиях критерии отнесения хромосомных аберраций к той или иной группе прогноза различаются. Эти расхождения касаются ряда хромосомных аберраций, таких как inv16, t(10; 11), делеция длинного плеча хромосомы 7 (-7q), трисомия 8 (+8), которые достаточно часто определяют у больных острым миелоидным лейкозом. Несмотря на различия в интерпретации значимости некоторых хромосомных аномалий, долгосрочные результаты в соответствующих цитогенетических группах во многом совпадают.
Это объясняется тем, что небольшое число больных с той или иной хромосомной аберрацией в любой группе прогноза не может оказать существенного влияния на общие результаты лечения.
В таблице сравниваются результаты лечения больных в немецком исследовании AMLCG и британском MRC-10 исследованиях в зависимости от группы прогноза.
Данные, представленные в таблице, убедительно показывают, насколько различаются результаты индукционной терапии и долгосрочные показатели у больных острым миелоидным лейкозом (ОМЛ) из разных групп прогноза, определяемых по цитогенетическим аберрациям.
Ученые из MD Anderson Центра по изучению рака (США) провели оценку эффективности лечения больных острым миелоидным лейкозом (ОМЛ) в зависимости от аномалий кариотипа, разделенных на четыре группы:
1) invl6, t(8;21), t(15;17);
2) нормальный кариотип и отсутствие митозов;
3) аномалии 5-й и 7-й хромосом;
4) все остальные аберрации.
И в этом случае установлена четкая зависимость между определенной цитогенетической аномалией и выживаемостью больных.

Следует отметить, что показатели выживаемости больных во всех группах невысокие и отличаются от показателей, полученных в современных европейских исследованиях. По-видимому, это объясняется тем, что в данном исследовании в анализ были включены данные, полученные ранее (1980—1992), когда применяли менее интенсивную терапию. Интересен установленный авторами факт: цитогенетические поломки теряют свою прогностическую значимость в том случае, если продолжительность первой полной ремиссии достигает 9 мес и более.
Ученые из другой американской исследовательской группы CALGB аномалии кариотипа у больных острым миелоидным лейкозом (ОМЛ) классифицируют по другому принципу. Они выделяют следующие группы:
1) аномалии генов, связанных с синтезом белка CBF — inv16, t(16;16), dell6, t(8;21);
2) нормальный кариотип;
3) другие аномалии.
В таблице представлены данные о 5-летней выживаемости больных с различными аномалиями кариотипа в зависимости от дозы цитарабина, используемой в курсах консолидации.
Дизайн исследования CALGB состоит в том, что всем больным проводят 1—2 курса 7 + 3 (даунорубицин по 45 мг/м2), затем больных, у которых достигнута полная ремиссия, рандомизируют на три группы в зависимости от варианта лечения:
1) цитарабин по 3 г/м2 2 раза в день в 1, 3, 5-й день; всего 4 курса;
2) цитарабин по 400 мг/м2 2 раза в день в 1, 3, 5-й день; всего 4 курса;
3) цитарабин по 100 мг/м2 2 раза в день в 1, 3, 5-й день; всего 4 курса.
Затем больным во всех группах проводят поддерживающую терапию (4 курса 5+2). В данном исследовании установлен факт принципиального улучшения долгосрочных результатов у больных из группы цитогенетически благоприятного прогноза (CBF-группа) и больных с нормальным кариотипом на фоне применения цитарабина в высоких дозах.
Дальнейшие исследования CALGB показали, что 5-летняя безрецидивная выживаемость 29 больных с t(8;21) после проведения 3—4 курсов цитарабина в высоких дозах существенно выше, чем у 21 больного после одного курса: 71 и 37 % соответственно. Таким образом, авторы делают заключение, что цитарабин в высоких дозах, используемый в период консолидации ремиссии, не улучшает прогноз у больных с неблагоприятным кариотипом, но значительно повышает выживаемость больных с благоприятными хромосомными аберрациями. На основании этих данных исследователи из группы CALGB предложили стратифицировать лечение: цитарабин в высоких дозах рекомендуют больным из группы благоприятного прогноза и не рекомендуют пациентам из группы неблагоприятного прогноза. Число включенных в анализ больных стало самым главным предметом критики этих выводов.
Многие исследователи считают, что, опираясь лишь на анализ результатов лечения 50 больных, рано проводить дифференцированную терапию острого миелоидного лейкоза (ОМЛ).
Несколько иное заключение об эффективности цитарабина в высоких дозах у больных с разными аномалиями кариотипа делают ученые, участвовавшие в исследовании AMLCG.
В этом исследовании в отличие от CALGB цитарабин в высоких дозах, использованный во втором курсе двойной индукции, улучшал результаты лечения больных из группы неблагоприятного прогноза. Частота достижения ремиссии у больных, у которых выявляются неблагоприятные хромосомные аномалии, повысилась в 2 раза при использовании цитарабина в высоких дозах.
Как уже отмечалось, все приводимые противоречия по интерпретации прогноза у больных с различными цитогенетически ми аномалиями могут быть обусловлены, во-первых, различиями в терапевтических стратегиях, применяемых в исследованиях, во-вторых, небольшим числом больных с определенными хромосомными аберрациями, включаемых в анализ. Так, в исследовании MRC (Великобритания) invl6 была выявлена у 57 больных, в AMLCG (Германия) - у 20, в AML-HDSG (Германия) — у 24. Как и многие другие исследователи, ученые, принимающие участие в исследованиях MRC и AMLCG, расценивают обнаружение inv16 как фактор благоприятного прогноза.
Так, в британском исследовании общая выживаемость больных с invl6 составила 63 % при 34 % рецидивов, а в общегерманском исследовании безрецидивная 5-летняя выживаемость достигала 55 %. Нужно отметить, что обе исследовательские группы используют унифицированное лечение для всех больных независимо от аномалий кариотипа. Данные же, полученные в исследовании AML-HDSG, свидетельствуют о не столь благоприятном прогнозе у больных с invl6: безрецидивная 2-летняя выживаемость составила 40 %. При этом в исследовании используют очень интенсивные программы лечения, включающие цитарабин в высоких дозах. Эти заключения совпадают с результатами другого немецкого исследования — AML SHG. В настоящее время ученые, принимающие участие в обоих этих исследованиях, относят invl6 к группе среднего прогноза и больным с данной аномалией кариотипа проводят иную постремиссионную терапию. Этот подход определяют как кариотипспецифический.
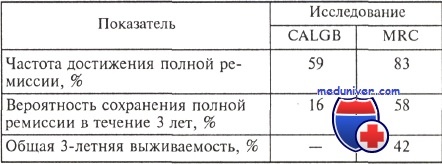
В анализ включено столь же небольшое число больных, например, с трисомией 8: в исследовании CALGB — 42 больных, в исследовании MRC — 48. Результаты лечения больных с трисомией 8 в этих двух исследованиях представлены в таблице.
Очевидно, что результаты лечения больных принципиально различаются. Согласно заключению исследователей из США, трисомия 8 является прогностически неблагоприятным фактором, а ученые из Великобритании относят больных с трисомией 8 к группе среднего прогноза. Таким образом, на основании результатов лечения всего 42 и 48 больных с трисомией 8 сделаны противоречащие друг другу выводы.
Все приводимые противоречия и различия в результатах позволяют сделать заключение, что кариотипспецифическая терапия и стратификация больных в соответствии с кариотипом представляют собой несовершенную терапевтическую стратегию (острый промиелоцитарный лейкоз не обсуждается). Приведенные данные свидетельствуют, что каждая цитогенетическая аномалия может быть расценена в качестве того или иного прогностического признака абсолютно по-разному. Все зависит от терапии и числа больных, включенных в анализ. В последние годы появляется все больше информации о молекулярных механизмах опухолевой трансформации при ОЛ, которая может в корне изменить представление о группе прогноза. Так, выявление тандемных повторов гена MLL расценивают как признак неблагоприятного прогноза независимо от того, выявлены ли хромосомные аберрации или кариотип нормальный.
Аналогичное влияние на прогноз заболевания оказывает выявление тандемных повторов гена FLT3. Так, при их обнаружении риск развития рецидива в течение 5 лет составляет 74 %, при их отсутствии — 48 %. В связи с этим наиболее целесообразным представляется проведение всем больным однотипного и адекватного по современным меркам лечения с целью выделения новых прогностических критериев и ассоциаций в соответствии с новыми знаниями в области молекулярной биологии лейкозов.
В настоящее время в мире проводят огромное количество кооперированных рандомизированных исследований, которые значительно различаются по индукционной и постремиссионной тактике, по принципу рандомизации (до начала лечения, после индукции), что определяет отбор больных. Это означает только одно — невозможно сравнивать результаты лечения и делать общие выводы. Для того чтобы избежать неадекватного отбора больных и получить объективные данные об эффективности лечения больных всех групп прогноза, общегерманская исследовательская группа, возглавляемая Т. Бюхнером, предложила провести международное исследование. Основными его принципами должны стать рандомизация больных до начала терапии и проведение одинаковой химиотерапии больным всех групп прогноза.
Предполагается, что лишь 10 % больных, регистрируемых в национальных исследованиях, будут включены в международное исследование, в котором планируется использовать следующую программу терапии острого миелоидного лейкоза (ОМЛ). Индукционное лечение будет состоять из 2 курсов 7 + 3 (цитарабин в дозе 100 мг/м2 в день в виде постоянной инфузии, в 1—7-й день, даунорубицин в дозе 60 мг/ м2 в 3, 4, 5-й день курса), проводимых по принципу двойной индукции (второй курс начинается на 22-й день от начала первого, т. е. на 15-й день перерыва). Консолидация будет осуществляться тремя курсами цитарабина в высоких дозах (3 г/м2 2 раза в день 1, 3, 5-й день) без использования антрациклиновых антибиотиков. Такое исследование уже проводят в Германии, в нем участвует 5 кооперированных групп.
ОСТРЫЙ ЛЕЙКОЗ
Острый лейкоз
Острый лейкоз ( лейкемия) - злокачественная пролиферация кроветворных клеток, возникающая вследствие соматической мутации в одной стволовой клетке, потомки которой формируют лейкемический клон. Необходимым условием развития лейкемического клона является расстройство процессов клеточной дифференцировки и пролиферации с накоплением незрелых форм кроветворных клеток.
Это гетерогенная группа состояний, которые различаются по этиологии, патогенезу, клинической манифестации, ответу на терапию и прогнозу
Эпидемиология:Взрослые – 3-5 случаев на 100 тыс населения в год.
Два пика заболеваемости – 5-15 лет, 55-70 лет.
Особенности патогенеза острых лейкозов
1. Бластная инфильтрация кроветворных и других органов.
Ø Первая манифестация острого лейкоза наблюдается при накоплении бластных клеток более 1012 (1,5 кг опухоли). Обусловлена способностью лейкозных клеток к большему числу митозов, чем здоровые клетки, так как они не созревают и в них не накапливаются вещества, прекращающие синтез ДНК. Утрачивается способность к апоптозу.
2. Угнетение нормальных ростков кроветворения
Ø лейкозные клетки выделяют ингибиторы, действующие на сохранившиеся нормальные клетки
Ø выделяют положительные стимуляторы, воздействующие на лейкозные клетки
Ø торможение по принципу обратной связи
Ø механическое вытеснение
Клинические проявления острых лейкозов
Клиника разнообразна и неспецифична. Наиболее часто первым проявлением является кровоточивость.
Клиника определяется тремя группами факторов:
1. степень угнетения нормальных ростков кроветворения: анемия, грануло- и тромбоцитопения.
2. локализация лейкозных инфильтратов
3. интоксикация, часто параллельно связана с уровнем мочевой кислоты.
Лабораторные показатели при острых лейкозах
Периферическая кровь:
Ø Анемия нормо- или макроцитарная (реже)
Ø Лейкоциты в большинстве случаев (50-79%) увеличены в разной степени – 10-500х109/л. В формуле – бласты. По морфологии в ряде случаев лейкозные бласты могут не отличаться от нормальных бластов КМ, но в большинстве случаев характеризуются полиморфизмом, атипией (уродливая форма ядер, отсутствие и увеличение ядрышек, наличие зернистости, вакуолизация). Бластные клетки хорошо видны только в тонких мазках.
Ø Лейкемическое зияние (бласты встречаются параллельно со зрелыми клетками.
Острый лейкоз с лейкоцитозом и бластами в периферической крови называется лейкемическим.
В 30-50% случаев количество лейкоцитов в норме или снижено и бласты в формуле отсутствуют или единичны – это алейкемическая стадия. Считают, что ее проходят практически все больные, но не у всех выявляем.
Ø Тромбоцитопения различной степени
Ø Ретикулоциты снижены или в норме( реже).
Биохимия увеличено содержание мочевой кислоты в сыворотке и моче.
Особенности КМ у больных острым лейкозом
Костный мозг: тотальная бластная гиперплазия. Если присутствуют клетки эритроидного и/или гранулоцитарного рядов, то они обычно с дегенеративными изменениями. Часто видна мегалобластоидность нормобластов или типичные мегалобласты (за счет дефицита потребления фолиевой кислоты и потери клетками способности к усвоению ФВ). Мегакариоциты снижены.
Международный порог диагностики ОЛ – 30% и более бластов в КМ.
Пунктаты КМ должны храниться в течение 5 лет после смерти больного ОЛ.
Клинические стадии – периоды острого лейкоза
ª Развернутая (первая атака)
ª Полная ремиссия
ª Частичная ремиссия
Особенности различных клинических стадий ОЛ
1. Развернутая стадия - время от установления д-за до эффекта лечения.
2. Полная ремиссия. Основные критерии – нормализация самочувствия, отсутствие признаков роста опухоли. Кровь: Нв ≥ 110 г/л, тромбоциты ≥ 100х109 /л, бластов нет, КМ – бластов не более 5%, бласты+лимфоидные клетки не более 30%.
3. Выздоровление - полная ремиссия, длящаяся более 5 лет.
4. Частичная ремиссия - разные состояния клинического и гематологического улучшения.
5. Рецидив: ухудшение клинического состояния и гематологических показателей – снижение Нв, тромбоцитов, увеличение лейкоцитов за счет бластов, образование экстрамедуллярных очагов кроветворения (нейролейкоз, гепатит, орхит и др.)
6. Терминальная стадия - тяжелое состояние, инфекции, кровоточивость, ↓↓тромбоцитов, эритроцитов на фоне активного лечения.
Дифференциальная диагностика ОЛ
1. Агранулоцитоз в начале выздоровления
2. Апластическая анемия (с алейкемической стадией острого лейкоза).
3. Инфекционный мононуклеоз.
Международная классификация острых лейкозов (ФАБ).
Основной принцип— характеристика доминирующей популяции лейкемических клеток на основании морфоцитохимических критериев.
I. Острые нелимфобластные лейкозы
II. Острые лимфобластные лейкозы
III. Миелодиспластический синдром.
М1 – острый миелолейкоз без вызревания
М2 – ОМЛ с вызреванием
М3 – Острый промиелолейкоз
М4 – острый миеломонолейкоз
М5 – острый монобластный лейкоз
М6 – острый эритромиелоз
М7 – острый мегакариолейкоз (редкий(
М0 – острый недифференцированноклеточный лейкоз.
Варианты II: L1-, L2, L3
Современная диагностика острых лейкозов
Это определение направленности и степени дифференцировки лейкемических клеток
Ø Морфологические исследования крови и костного мозга
Ø Цитохимические исследования
Ø Цитогенетические исследования
Ø Молекулярно-биологические исследования
Обязательные цитохимические реакции в диагностике лейкозов
1. Выявление миелопероксидазы (положительна в виде золотисто-желтых гранул в цитоплазме гранулоцитов, начиная с миелобластов и части моноцитов, отрицательна – у лимфоидных клеток)
2. Реакция на липиды с черным суданом В (положительна – черные или серые гранулы в цитоплазме гранулоцитов и моноцитов, отрицательна – у лимфоидных клеток)
3. Реакция на неспецифическую эстеразу (положительна в виде серовато-коричневых гранул в цитоплазме моноцитов, начиная с монобластов).
4. Реакция на гликоген с реактивом ШИФ (PAS, ШИК) (положительна – в виде диффузного малиново-сиреневого окрашивания в цитоплазме гранулоцитов и моноцитов, положительна в виде красновато-фиолетовых и синефиолетовых крупных гранул в цитоплазме лимфоцитов)
Особенности различных вариантов ОНЛЛ
М1 и М2 – наиболее частая форма у взрослых (60% от всех острых лейкозов взрослых). Бласты крупные и средние, ядерно:цитоплазматическое соотношение 1:1 (или высокое). Структура хроматина нежно-сетчатая, могут быть мелкие ядрышки, цитоплазма голубая без гранул (у М1) или с зернистостью и в 30% палочки Ауэра (у М2). При ОМЛ могут встречаться единичные созревающие гранулоциты (миело, метамиело), то есть нет абсолютного зияния (чаще при М2). Цитохимия – пероксидаза+, липиды+, гликоген + в диффузной форме, эстераза-.
Г л а в а 2
ЦИТОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ
Цитохимическое исследование клеток крови и пунктатов костного мозга основано на способности некоторых веществ и ферментов, участвующих в клеточном метаболизме, всту пать в реакцию с определенными красителями и давать специфическое окрашивание. Нали чие или отсутствие в клетке исследуемого вещества, степень активности того или иного фермента позволяют сделать определенные диагностические выводы о принадлежности клеток к тому или иному ростку. Наиболее широкое применение цитохимические исследования кле ток крови находят в гематологической практике, и прежде всего для дифференциации раз личных форм острого лейкоза.
Цитохимическая характеристика клеток крови и костного мозга в норме
Цитохимическая характеристика элементов гемопоэза может быть проведена начиная со стадии морфологически распознаваемых пролиферирующих клеток (эритробласта, миелоб- ласта , монобласта, лимфобласта). При этом, при описании химических и энзимо-химичес- ких особенностей этого и других классов кроветворных клеток, предпочтение должно быть отдано реакциям, которые могут иметь диагностическое или дифференциально-диагностическое значение.
Уже в первой морфологически распознаваемой клетке гранулопоэза — миелобласте об наруживаются все цитохимические признаки, свойственные этому ряду. В цитоплазме мие- лобластов выявляется положительная реакция при определении активности пероксидазы и хлорацетатэстеразы. При проведении PAS -реакции наблюдается диффузное окрашивание цитоплазмы, а при окраске Суданом черным В — умеренная суданофилия. В этих же клетках отмечается активность кислой фосфатазы, при выявлении которой интенсивность диффуз ной окраски цитоплазмы колеблется от слабой до умеренной. Как и во всех пролиферирующих клетках гранулоцитарного ряда, в миелобластах не выявляется активность щелочной фосфатазы. Реакция при определении активности неспецифической эстеразы — слабо поло жительная, не ингибируется фторидом натрия.
Как правило, активность разных ферментных систем, содержание гликогена и липидов увеличиваются по мере созревания клеточных элементов гранулоцитопоэза.
Нейтрофильные, эозинофильные и базофильные гранулоциты отличаются по ряду ци тохимических признаков. В нейтрофильных палочко- и сегментоядерных лейкоцитах гликоген выявляется в виде отдельных гранул вишневого цвета, выполняющих цитоплазму, или диффузной интенсивной окраски. В эозинофильных лейкоцитах гликоген располагается между специфическими гранулами, которые остаются неокрашенными. В базофильных гра-нулоцитах положительная PAS -реакция после предварительной обработки мазков амилазой сохраняется. Гранулы нейтрофильных лейкоцитов окрашиваются Суданом черным В в темно-серый или черный цвет. В зрелых эозинофильных гранулоцитах центральная часть су-данотрицательная, она окрашивается в желто-коричневый цвет, а периферия — суданополо-жительная. В эозинофильных миелоцитах, метамиелоцитах, палочко- и сегментоядерных лейкоцитах активность пероксидазы и кислой фосфатазы выше, чем в соответствующих ней трофильных клетках, но зато совершенно не выявляется активность хлорацетатэстеразы и щелочной фосфатазы, которая в норме обнаруживается в 18—54 % зрелых нейтрофильных лейкоцитов периферической крови и костного мозга. В базофильных лейкоцитах также не выявляется активность этих ферментов и пероксидазы. Нейтрофильные, эозинофильные и
базофильные гранулоциты проявляют слабую или умеренную эстеразную активность при ис пользовании в качестве субстрата а-нафтилацетата и нафтол-АБ-ацетата.
В клетках мегакариоцитарного ряда с помощью PAS -реакции выявляются многочислен ные гранулы, окрашенные в вишнево-фиолетовый цвет. Столь же выраженную реакцию дают и тромбоциты. Контрольный тест с амилазой указывает на то, что определяемое веще ство является гликогеном. При окраске Суданом черным В липиды в мегакариоцитах не обнаруживаются. Реакции на пероксидазу, хлорацетатэстеразу и щелочную фосфатазу дают отрицательные результаты. Активность кислой фосфатазы, определяемая методом одновремен ного азосочетания, в клетках мегакариоцитарного ряда и тромбоцитах умеренная; она полностью подавляется при добавлении в инкубационную среду 0,05 М виннокислого калия-натрия. Приблизительно такой же уровень активности в мегакариоцитах неспецифической эс- теразы , чувствительной к действию натрия фторида.
Наиболее характерным признаком моноцитов, как и всех клеток системы мононуклеар-ных фагоцитов, отличающим их от клеток остальных ростков кроветворения, является высо кая активность неспецифической эстеразы, которая эффективно ингибируется при добавле нии в инкубационную среду натрия фторида в концентрации 1,5 мг/мл (0,03М). В то же время этот ингибитор не оказывает влияния на более слабую активность этого фермента в других кроветворных клетках. В моноцитах крови умеренная и выраженная активность кис лой фосфатазы, которая ингибируется ионами тартрата (виннокислого калия-натрия). По своей значимости в идентификации клеток системы мононуклеарных фагоцитов методика определения активности кислой фосфатазы приближается к маркерной реакции на неспеци фическую эстеразу. В большей части моноцитов периферической крови выявляют актив ность пероксидазы, уровень которой значительно ниже, чем в наиболее молодых клетках гранулоцитарного ряда. Для большей надежности можно использовать реакцию на выявле ние нафтол-АБ-О-хлорацетатэстеразы. При этом в молодых и незрелых клетках нейтрофиль- ного ряда всегда фиксируют окрашивание цитоплазмы разной степени, а в моноцитах реак ция всегда отрицательная [Глузман Д.Ф., 1978]. В моноцитах также незначительное количе ство липидов и гликогена. По степени суданофилии моноциты значительно уступают клет кам гранулоцитарного ряда. При PAS -реакции в цитоплазме моноцитов наблюдают диффуз ное окрашивание или отложение мелких гранул по периферии клетки. Интенсивность ок раски ниже, чем в зрелых гранулоцитах. Многие авторы указывают на выраженную цитохи мическую гетерогенность этой группы клеток периферической крови [Глузман Д.Ф., 1978; Jansa , Papousek , 1971; Kaplow , 1975].
При цитохимическом исследовании чаще пользуются полуколичественной оценкой результатов, используя принцип Астальди, основанный на выявлении различной степени ин тенсивности специфической окраски. В зависимости от нее исследуемые клетки делят на 4 группы: с отрицательной реакцией (-), слабоположительной (+), положительной (++) и резко положительной (+++). Для количественного выражения результатов подсчитывают 100 клеток определенного вида, дифференцируя их по степени интенсивности окраски, затем число клеток с одинаковой интенсивностью окраски суммируют и вычитают количество клеток без окраски, результат выражают в процентах. Например, при исследовании активности миелопероксидазы в нейтрофилах из 100 просмотренных клеток: в 2 — активность фермента не выявлена (—); в 3 — специфическая окраска была слабой (+); в 20 — более ин тенсивной (++) и в 75 — резко положительной (+++). Результат определения активности миелопероксидазы в нейтрофилах в таком случае составит: (3 + 20 + 75) — 2 = 98 %.
Результат можно выразить в виде среднего цитохимического коэффициента (СЦК) по L . Kaplow (1955). Для количественного выражения результатов подсчитывают 100 клеток оп ределенного вида, дифференцируя их по степени интенсивности окраски, затем число клеток с одинаковой интенсивностью окраски умножают на соответствующее данной группе число плюсов, сумму этих произведений делят на 100, что и составляет СЦК. Например, при исследовании активности миелопероксидазы в нейтрофилах из 100 просмотренных клеток: в 2 активность фермента не выявлена (-); в 3 специфическая окраска была слабой (+); в 20 более интенсивной (++) и в 75 резко положительной (+++). СЦК для одной клетки в таком случае составит:
(2 ■ 0) + (3 • 1) + (20 • 2) + (75 • 3) : 100 = 2,68.
Нормы для всех цитохимических показателей клеток необходимо разрабатывать каждой ла боратории отдельно. Это обусловлено наличием различных реактивов и степенью их чистоты.
Активность миелопероксидазы
Активность миелопероксидазы выявляют в клетках гранулоцитарного ряда, нейтрофи- лах и эозинофилах, начиная с некоторых миелобластов до сегментоядерных клеток, в виде гранул, заполняющих цитоплазму (табл. 2.1).
Таблица 2.1. Активность миелопероксидазы в норме [Меньшиков В.В., 1982]
Читайте также:

