Репарация в раковых клетках
Существует ряд механизмов для устранения повреждений, вызванных внутренними и внешними мутагенными факторами. К ним относятся система эксцизионной репарации и система устранения некорректно спаренных оснований. Клеточная система репарации ДНК устраняет ошибки, допущенные в процессе нормального деления клетки. Такие мутации особенно часто происходят в областях множественных повторов ДНК, т. к. именно в нихДНК особенно склонна к потерям.
Пример такой ситуации приведен на рисунке ниже. Существует 6 генов, необходимых для работы клеточной системы репарации ДНК. Предполагаемый механизм их работы приведен на рисунке ниже.
Парадокс процесса канцерогенеза в том, что скорость мутаций в нормальных клетках слишком низка, чтобы вызвать злокачественную трансформацию. Первым доказательством существования так называемого нестабильного фенотипа стала нестабильность генома некоторых опухолей толстой кишки. Если клетка не может устранять повреждения, происходящие в процессе нормального деления, мутации накапливаются, достигая критического уровня в генах, осуществляющих контроль над ростом клетки, и развивается злокачественная опухоль.
Таким образом, нарушение системы репарации ДНК ведет к злокачественной трансформации. Многочисленные исследования выявили эти нарушения в опухолях, обладающих микросателлитной недостаточностью. Ключевые гены, ответственные за метаболизм клетки, обычно не имеют микросателлитных повторов, которые были бы наиболее подвержены повреждениям. Тем не менее в клетках с дефектами системы репарации частота мутаций в неповторяющихся последовательностях повышена в 100 — 10 000 раз по сравнению с клетками, в которых эта система функционирует нормально.
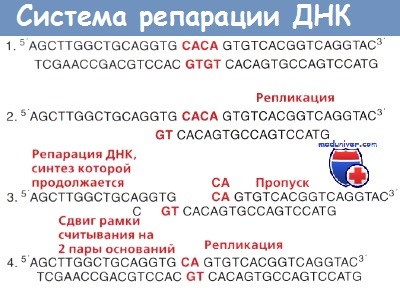
Пропуск СА в пределах повторяющихся оснований СА, в результате чего возникает делеция СА.
Система репарации ДНК специально приспособлена к устранению этого нарушения.
Если система репарации не срабатывает, возможно накопление мутаций.
Хотя микросателлитные последовательности в функциональных генах обычно отсутствуют, мононуклеотидные повторы в некоторых основных генах могут приводить к их инактивации. К таким генам относятся, например, TGF-BR2H(A10), bMSH3 (А8), bMSH6/GTBP (С8), IGF2R (G8) и ВАХ (G8). Парадоксально, но нестабильность числа хромосом часто наблюдается в опухолях без нарушений системы репарации, а опухоли с такими нарушениями часто имеют стабильное число хромосом. Наследственные мутации системы репарации нередко выявляют у лиц, страдающих семейными формами злокачественных опухолей. К таким заболеваниями относятся некоторые опухоли толстой кишки (ННПКРР), рак эндометрия (РЭ) и синдром Линча типа II.
Также с нарушениями системы репарации связано развитие синдромов Торре и Тюрко. ННПКРР составляет около 5 % всех случаев рака толстой кишки; его диагностируют на основании следующих критериев:
1) должно быть по меньшей мере три родственника, из них двое первой степени родства, имевших рак толстой кишки;
2) опухоли толстой кишки по крайней мере в двух поколениях;
3) хотя бы у одного из родственников рак толстой кишки был выявлен в возрасте моложе 50 лет.
У 70 % больных ННПКРР выявляют мутации в генах клеточной системы репарации ДНК — bMLH1 (49 %), bMLH2 (45 %) и bPMS2 (6 %). Нарушения системы репарации обнаруживают в 25 % случаев рака эндометрия (РЭ), примерно 1/4 из них наследственные, остальные — результат инактивации гена MLH1, вызванной гиперметилированием промоторного региона.
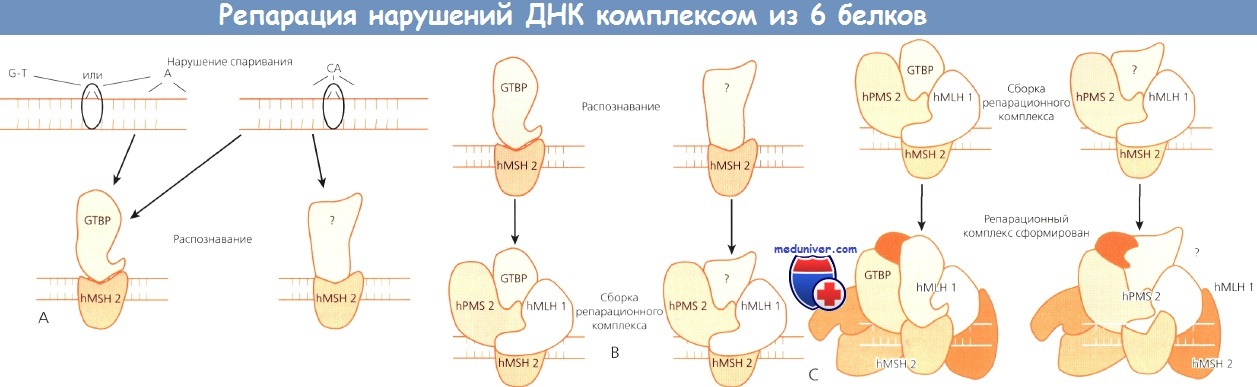
Репарация нарушений ДНК комплексом из 6 белков.
Необходимые условия: (А) распознавание пропуска,
(В) сборка репарационного комплекса и, наконец,
(С) собственно репарация
Целью данного реферата является сравнение двух процессов - процесса злокачественного перерождения ткани и процесса репаративной регенерации. На первый взгляд в них нет ничего общего, хотя наверняка это не так.
Мой реферат будет состоять из трех частей - в первой и второй частях я опишу сущность процессов репарации и онкогенеза, влияющие на эти процессы факторы, некоторые основные понятия связанные с этими явлениями. В последней, третьей части я попытаюсь сравнить некоторые явления и процессы, имеющие место быть в том или другом случае.
Начать следует с основных понятий:
«РЕГЕНЕРАЦИЯ (позднелатинское regeneratio – возрождение, восстановление) – обновление структур организма в процессе жизнедеятельности и восстановление структур, утраченных в результате патологических процессов. Различают физиологическую и репаративную регенерацию.
Физиологическая регенерация – непрерывное обновление структур на клеточном (смена клеток крови, эпидермиса, печени и д.р.) и внутриклеточном (обновление клеточных органелл) уровнях, благодаря чему обеспечивается функционирование органов и тканей.
Репаративная регенерация – процесс ликвидации структурных повреждений после действия патогенных факторов. В ее основе лежат такие же механизмы, как и при физиологической регенерации, она отличается лишь большей интенсивностью проявлений. Репаративную регенерацию, в процессе которой восстанавливается ткань, идентичная погибшей, называется полной, или реституцией. В ряде случаев в результате репаративной регенерации в зоне повреждения образуется не специфическая для данного органа ткань, а рубец – неполная регенерация или субституция. При некоторых состояниях организма (гиповитаминозе, истощении и д.р.) течение репаративной регенерации бывает затяжным, качественно извращенным (сопровождается образованием длительно незаживающих язв, формирование ложного сустава и д.р.), то есть наблюдается патологическая регенерация.
Процесс регенерации происходит на всех уровнях – органном, тканевом, клеточном, внутриклеточном. Осуществляется он путем деления клеток, обновления внутриклеточных структур и их размножения.
ОНКОГЕНЕЗ представляет собой длительный и многостадийный процесс, состоящий из совокупности событий, которые в экспериментальных моделях разделяют на стадии инициации, промоции и прогрессии. Хотя концепция многостадийности онкогенеза была разработана исходя из результатов опытов с использованием лабораторных животных, считается, что у человека опухолевый процесс развивается подобным образом. Согласно существующим представлениям, неопластическое перерождение ткани может происходить в результате генетических изменений в одной клетке , которая в результате митотического деления дает начало клону клеток, имеющих трансформированный фенотип. Эти клетки претерпевают множественные изменения, прежде чем стать опухолевыми, и каждая из стадий онкогенеза характеризуется определенными фенотипическими, генотипическими и биохимическими особенностями.
РАКОВОЕ ПЕРЕРОЖДЕНИЕ.
ОНКОГЕНЫ, ПРОТООНКОГЕНЫ, АНТИОНКОГЕНЫ.
Итак, общим звеном в возникновении опухолей является онкоген, внесенный в клетку вирусом, или возникший из протоонкогена, а результате мутации, или выведенной из-под контроля сдерживающих генов хромосомной транслокации. Но в последние годы найдено еще одно звено, по-видимому, наиболее общее звЕно канцерогенеза – гены-супрессоры опухолей, подавляющие активность онкогенов. Главный представитель антионкогенов - р53 , названный по продукту от р-protein, и 53 – тк вес 53000 дальтон.
Было показано, что накопление продуктов нормального гена р53 останавливает прохождение клеткой митотического цикла на границе G1 и S . в результате поврежденная клетка не может удвоить поврежденную ДНК и передать геном своим клеткам-потомкам при делении. У клетки есть спец ферменты, ремонтирующие испорченную ДНК. Если через какое-то время повреждение исправлено, то вызванный р53 блок деления снимается, и клетка может вновь размножаться. Если повреждение ДНК не исправлено, тор53 включает программу апоптоза.
ОПУХОЛЕВЫХ КЛЕТОК.
Самой характерной биологической особенностью опухолевых клеток является их автономность – независимость темпа размножения и других проявлений их жизнедеятельности от внешних воздействий (по отношению к клеткам), изменяющих и регулирующих жизнь нормальных клеток. Неправильно считать автономность абсолютной, понимать ее как полную независимость опухоли - любое новообразование сохраняет ту или иную степень зависимости от воздействующих на него факторов.
Также признаком многих, особенно злокачественных, опухолей я является анаплазия ткани, возвращение ее к более примитивному типу.
Для морфологической анаплазии характерна утрата опухолевой тканью особенностей, характерных для исходных дифференцированных тканей. Степень анаплазии может нарастать в ходе развития опухолей.
Наряду с морфологической анаплазией можно говорить о функциональной анаплазии – частичной или полной утрате опухолевой тканью способности выполнять специфические функции, характерные для соответствующей нормальной ткани: секреторные, сократительные и т.д..
Биохимическая анаплазия проявляется в исчезновении из опухолевых клеток части, или всех специфических ферментов, характерных для исходных клеток. Так , в клетках анаплазированных гепатом не выявляются многие ферменты, специфические для нормальной печеночной клетки.
Наряду с исчезновением белков, характерных для ткани взрослого животного, в некоторых типах опухолей возобновляется синтез белков, специфичных для эмбриона. Наиболее ярким примером является возобновление синтеза эмбрионального альфа-фетопротеина клетками гепатом человека и животных.
Иммунологическая анаплазия проявляется в исчезновении из опухолевых клеток ряда антигенов, типичных для нормальных клеток того же типа (антигенное упрощение).
Инвазивный рост – способность опухолевой ткани врастать в окружающие ткани и, разрушая, замещать их. Это – характерная черта злокачественности.
Метастазирование также принадлежит к числу наиболее характерных отличительных особенностей злокачественных опухолей. Основными этапами процесса можно считать отделение опухолевых клеток от основного узла и попадание их в кровеносный или лимфатический сосуд, циркуляцию этих клеток в крои, или лимфе, прилипание клеток к сосудистой стенке и образование опухолевого эмбола, выход клеток из сосуда и пролиферацию их с образованием метастатического узла.
Инициация онкогенеза — это процесс, в ходе которого химические, физические и биологические агенты изменяют определенные элементы генома клетки-мишени. Для того чтобы изменения, произошедшие во время инициации онкогенеза, закрепились, необходимо, чтобы осуществилась репликация ДНК клетки. Мутации определенных генов могут изменить свойства клеток. Изменения генома в первую очередь затрагивают гены, ответственные за основные жизненно важные функции клеток. Для возникновения рака недостаточно единичной мутации, а необходимы изменения в нескольких (не менее двух) генах, один из которых обеспечивает иммортализацию (бессмертие) клеток, а другой — развитие злокачественного фенотипа.
Промоция онкогенеза — это стадия, которая характеризуется увеличением популяции инициированных клеток и дальнейшими изменениями в их геноме под влиянием промоторов канцерогенеза, причем последние могут быть как генотоксическими канцерогенами, так и эндогенными факторами (например, стимуляция гормонами). Так формируется и увеличивается популяция клеток с геномными повреждениями, предшествующими их злокачественному перерождению. При этом возрастает вероятность вторичной мутации в какой-нибудь из клеток в этой популяции, поскольку делящиеся клетки более чувствительны к действию мутагенов. Главная особенность стадии промоции - ее обратимость и наличие концентрационного порога в действии промоторов .
Прогрессия онкогенеза — это активная стадия опухолевого процесса, когда пролиферация клона трансформированных клеток приводит к образованию опухоли. Характерные признаки:усиление скорости роста клеток на фоне снижения дифференцировочного потенциала этих клеток, проявление инвазивных свойств и способности к метастазированию, нестабильность генома и хромосомные абберации (изменение числа наборов хромосом или числа отдельных хромосом, перестройки хромосом). Опухолевые клетки обладают преимуществами перед нормальными клетками для роста и выживаемости в одинаковых условиях. Для стадии прогрессии характерны глубинные нарушения уже между опухолью и организмом.
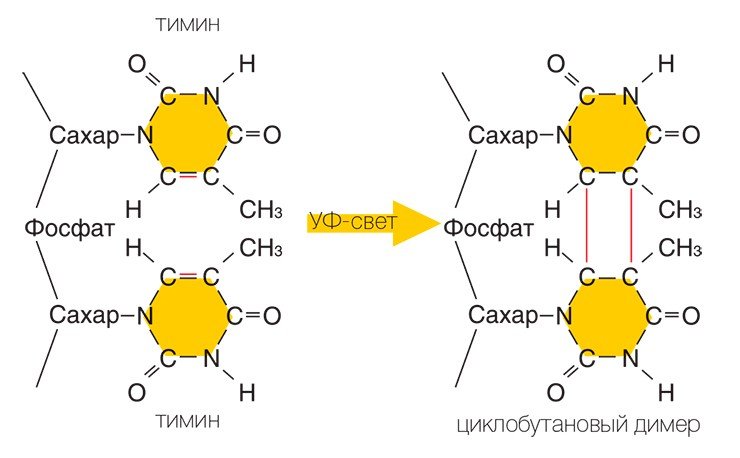
Удивительно, что, несмотря на ключевую роль, которую играет нить ДНК в работе клеток, она является очень нежным образованием, и повредить ее ничего не стоит. Даже обычный солнечный свет представляет для ДНК серьезную угрозу. Чаще всего это происходит следующим образом: квант света — фотон, — столкнувшись с ДНК, может передать свою энергию одному из ее структурных элементов — азотистому основанию, — который при этом переходит в возбужденное состояние. Дальше все зависит от того, с каким конкретно основанием это произошло. Если это аденин или гуанин, то энергия возбуждения быстро переходит в тепловую — и структура ДНК не меняется. Если же порцию дополнительной энергии получили тимин или цитозин, то последствия могут быть весьма серьезными.
Довольно жестким ударом для любого организма является радиационное облучение, в несколько раз превышающее фоновый уровень радиации, необходимый для существования всех живых существ. Действие ионизирующей радиации вызывает различные повреждения ДНК, включая разрывы обеих цепей, что наиболее опасно для клетки, поскольку репарация таких повреждений особенно сложна. Этот принцип, собственно, положен в основу радиотерапии, когда с помощью ионизирующей радиации уничтожаются раковые клетки; сходным действием обладают и некоторые лекарственные препараты, также используемые при лечении рака. Следует заметить, что даже единственный неисправленный разрыв обеих цепей ДНК может вызвать гибель клетки.
Повреждения ДНК могут быть вызваны и некоторыми антропогенными загрязнениями окружающей среды, такими как продукты сгорания бензина, табачный дым. Однако самые многочисленные, но в то же время и наиболее легко исправляемые повреждения, вызваны агентами, которые возникают в процессе нормальной жизнедеятельности самой клетки: при дыхании, окислении липидов (жиров), а также при воспалительных реакциях. Сейчас известно всего более ста типов подобных окислительных повреждений ДНК.
Заплатки короткие и длинные
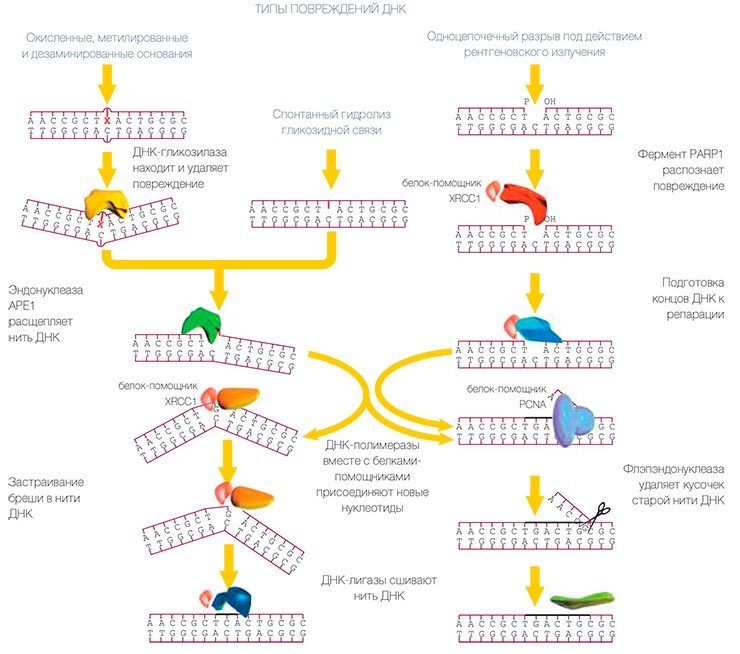
Плохо — когда очень мало или очень много
Считается, что за опознавание повреждения ответственность несет белок, который обозначается буквами XPC-HR23B. (Характерно, что многие из белков этого ансамбля имеют обозначения, начинающиеся буквами XP. Происхождение этих обозначений связано с пигментной ксеродермой (xeroderma pigmentosum), которая проявляется в повышенной чувствительности к действию солнечного света, что связано с отсутствием одного из белков ЭРН.)
Работы еще двух систем, специализирующихся на репарации двуцепочных разрывов в ДНК, мы не будем касаться — это тема другого разговора.
Для правильной и своевременной репарации ДНК важно не только наличие в клетке всех белков, участвующих в этих процессах, но и их количество: опасны как недостаток (или отсутствие) белков, так и их избыток. Чем же грозят человеку дефекты в системах репарации ДНК? Подобные заболевания протекают, как правило, тяжело (самое известное из них — вышеупомянутая пигментная ксеродерма), но встречаются они достаточно редко.
Заболевания человека, однозначно связанные с функциональной неактивностью какого-либо из белков системы ЭРО, на сегодня вообще не известны. Это может быть обусловлено высокой значимостью описанного пути репарации, выражающейся в нежизнеспособности организмов с подобными дефектами.
Пришиваем этикетку к белку
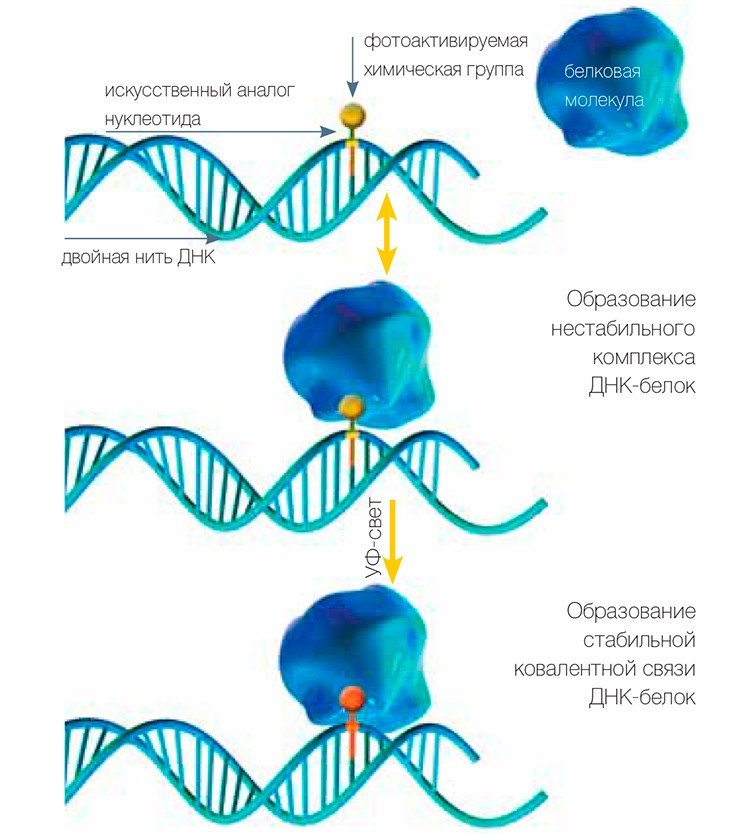
В результате исследователи убивают сразу двух зайцев. Во-первых, поскольку в состав ДНК входят атомы фосфора, мы можем ввести в ее состав радиоактивную метку (обычно это изотоп фосфора 32 Р), что дает возможность легко следить за этой меткой при последующем анализе. Радиоизотопные метки регистрируются с высокой чувствительностью, что позволяет работать с очень маленькими количествами белков. Во-вторых, присутствие этикетки на белке свидетельствует о том, что этот белок способен взаимодействовать с определенными структурными образованиями ДНК, характерными для того или иного этапа процесса репарации.
*См. в: НАУКА из первых рук. — 2006. — № 6 (12). — С. 24—35.
**См. в: НАУКА из первых рук. — 2006. — № 6 (12). — С. 46—53.

Рис. 1. Под действием канцерогена, ионизирующего излучения или спонтанной мутации протоонкоген может активироваться и превратиться в онкоген, индуцирующий рак. Рисунок с сайта en.wikipedia.org
В настоящее время рак занимает второе место среди причин смерти человека, уступая лишь сердечно-сосудистым заболеваниям (ежегодно в мире от рака умирает примерно 8 миллионов человек), а в некоторых развитых странах, например в Дании, рак уже вышел на первое место.
Детальные сведения об аномалиях, связанных с возникновением и развитием раковых опухолей, требуются для диагностики и результативного лечения рака, для определения оптимальной терапии, а также для разработки новых противораковых средств. Объектами исследований являются аномалии молекулярной структуры ДНК, РНК, белков и эпигенетических аномалий (в частности, метилирования). Именно такой подход принят как генеральная стратегия, реализуемая несколькими национальными и международными консорциумами, которые объединяют десятки институтов, университетов и клиник. В работах участвуют сотни исследователей. Наибольшие успехи и наиболее ценные данные получены в результате поиска генов, связанных с инициацией, развитием и поддержанием злокачественной трансформации клеток.
В организме должен поддерживаться тонкий баланс между активностью генов и их продуктов, которые, с одной стороны, обеспечивают рост и деление клеток, а с другой стороны — предотвращают неограниченные рост и деление. Излишняя активность первых или подавление функции вторых приводят к неконтролируемому росту клеток, возникновению и развитию злокачественных неоплазий — раковых опухолей.
Связанные с раком гены можно разделить на два типа — онкогены и антионкогены (супрессоры опухолей), продукты которых могут, соответственно, стимулировать или подавлять образование и развитие опухолей. Особое место занимают микроРНК (miRNA) — короткие (в среднем
22 нуклеотида) некодирующие РНК. К настоящему времени идентифицировано примерно 2000 различных микроРНК. Они способны подавлять трансляцию мРНК, считываемую с 30–60% генов человека. Некоторые микроРНК (oncomiR) способствуют злокачественной трансформации клеток, другие могут работать как антионкогены. В онкоген может превратиться нормальный ген — протоонкоген (рис. 1), который стимулирует рост клеток постоянно или на определенных стадиях развития организма. Трансформация протоонкогена в онкоген происходит в результате относительно незначительной модификации его естественной функции. Существуют следующие основные пути активации протоонкогена:
1) Мутация внутри протоонкогена или в его регуляторных элементах, которая меняет структуру белка и повышает активность кодируемого им белка (фермента) или усиливает экспрессию соответствующего гена.
2) Повышение концентрации белка из-за повышения его стабильности в клетке, увеличения периода полужизни и, соответственно, повышения активности.
3) Дупликация гена (увеличение количества копий), в результате чего повышается концентрация белка в клетке.
4) Транслокация гена, которая вызывает усиление его экспрессии или возникновение агрессивного гибридного гена.
Онкогенами являются, например, гены семейства Ras (сокр. от ‘Rat sarcoma’) — ГТФазы, участвующие в передаче сигналов, стимулирующих деление клеток.
Функция антионкогенов противоположна функции протоонкогенов. Антионкогены контролируют различные процессы, препятствующие злокачественной трансформации клеток:
1) Подавление избыточной экспрессии генов, обеспечивающих пролиферацию клеток.
2) Осуществление репарации ДНК (повреждения ДНК при подавлении репарации усиливают мутагенез и, как следствие, активацию протоонкогенов и инактивацию антионкогенов).
3) Координация пролиферации клеток с репарацией ДНК. Если репарация ДНК подавлена, они тормозят деление клетки и иницииируют апоптоз.
4) Контроль адгезии и механизмов контактного торможения делящихся клеток.
1) Активация системы репарации ДНК.
2) Если ДНК повреждена, ТР53 задерживает митоз делящихся клеток, блокируя переход из G1-фазы в S-фазу и предоставляя системе репарации время устранить повреждения.
3) Если устранить повреждения ДНК не удается, ТР53 включает программу гибели клеток — апоптоз.

Рис. 2. В нормальных клетках р53 инактивирован негативным регулятором mdm2. При повреждениях ДНК или других стрессах комплекс р53-mdm2 распадается. Активированный р53 тормозит деление клетки до тех пор, пока поврежения не будут исправлены, или индуцирует программу апоптоза. Рисунок с сайта en.wikipedia.org
В случае, если рак вызван протоонкогеном, обычно достаточно активации этого протоонкогена на одной из двух парных клеточных хромосом. А вот если рак возник из-за утраты эффекта антионкогена, то, как правило, требуются мутации или потеря обеих его копий.
К настоящему времени идентифицировано примерно 300 онкогенов и супрессоров опухолей. Раковые гены ищут с помощью сравнительного секвенирования — то есть сравнивают последовательности нуклеотидов в ДНК опухолей и нормальных тканей и затем идентифицируют отсутствующие в ДНК нормальной ткани соматические мутации, которые встречаются чаще, чем просто случайные события.
Эта стратегия реализуется в несколько этапов. Во-первых, требуется получить образцы опухолевой ткани от пациентов с достоверно поставленным диагнозом и детально описанной картиной течения заболевания. При этом образцы должны быть, по возможности, свободны от нормальных клеток. Для сравнения используются пробы нормальной ткани или крови пациента. Из ткани опухоли и нормальной ткани выделяют ДНК и иссследуют их с помощью секвенирования. В последнее время секвенирование проводится с помощью платформ нового поколения, позволяющих быстро и сравнительно недорого полностью секвенировать геном человека. Результаты сравнительного секвенирования затем анализируются с помощью специально разработанных весьма сложных математических и биоинформатических методик (рис. 3).


Рис. 3. На целостность генома воздействуют внешние факторы, такие как ультрафиолетовое излучение, сигаретный дым или вирусные инфекции. Разные участки генома мутируют с различной частотой при различных формах рака. Результаты сравнения последовательности нуклеотидов в ДНК опухолей и нормальных тканей анализируются с помощью математических и биоинформатических методик, которые учитывают частоты и спектр мутаций, порядок, в котором происходит репликация сегментов ДНК по всей длине хромосомы, а также уровень экспрессии генов, — это позволяет найти гены, достоверно мутирующие при раке. Рисунок из статьи L. Ding и M. Wendl, 2013. Differences that matter in cancer genomics
Генеральной целью этих проектов является создание детального каталога аномалий структуры генома, связанных с инициацией, прогрессией и поддержанием онкологических новообразований. Такой каталог позволит не только получить много новых данных по молекулярной биологии рака, но и усовершенствовать методы диагностики, лечения и профилактики рака, определять новые мишени для разработки противораковых средств. Систематические исследования в этом направлении уже позволили идентифицировать много новых раковых генов и даже целые классы раковых генов.
5% всех случаев рака в мире.
Некоторые связанные с раком гены мутируют довольно часто — при многих или, по крайней мере, при нескольких типах рака. Поэтому неудивительно, что именно они (в частности, TP53) были охарактеризованы первыми. Но большинство раковых генов обнаруживаются с умеренной частотой (2–20%) или реже. Основные проблемы возникают при идентификации редких раковых генов. Так, недавнее исследование 183 аденокарцином легких показало, что у 15% пациентов не обнаруживается ни одной мутации в 10 известных для этого заболевания классах генов, а в 38% случаев идентифицировано три или менее мутаций (M. Imielinski et al., 2012. Mapping the Hallmarks of Lung Adenocarcinoma with Massively Parallel Sequencing).
Гарвардская группа под руководством Г. Гетца (G. Getz) разработала программный пакет MutSig (сокр. от ‘Mutation Significance’), анализирующий частоты и спектр мутаций в различных областях генома при различных формах рака, а также ряд других факторов, и позволяющий вычленить гены, достоверно мутирующие при раке.


Мутации, достоверно связанные с раком, обнаруживались в 224 различных генах. Для различных типов рака число мутантных генов сильно варьировало (от 1 до 58). Для 7 типов оно было меньше 10, а для двух (раки молочной железы и эндометрия матки) — более 30. Только 22 гена оказались достоверно связанными с более чем тремя типами рака. Анализ позволил идентифицировать практически все ранее известные гены, связанные с канцерогенезом. Найдено также 33 гена, мутации в которых ранее не были проассоциированны с раком. Эти гены связаны с делением клеток, апоптозом, стабильностью генома, регуляцией активности хроматина, иммунным ответом, превращениями РНК и гомеостазом белков. Среди еще 81 гена также должны быть гены, связанные с раком.
0,5 на миллион пар оснований ДНК (как при нейробластоме). Или даже около 5300 пар, если частота
12,9 на миллион (как при меланоме). Всего же, чтобы для
В общем, создание детального каталога раковых генов — важная задача, выполнение которой позволит подбирать оптимальную терапию онкологического заболевания для каждого пациента: воздействия на определенные сигнальные пути или иные процессы, поврежденные в каждом конкретном случае. Такой каталог нужен также для выбора мишеней при разработке противораковых средств, создания новых экспериментальных моделей животных и линий клеток для исследования рака, испытания новых средств и методов лечения.
Источник: Cancer Genome Atlas Network. Collaborators (348). Comprehensive genomic characterization of head and neck squamous cell carcinomas // Nature. 2015. V. 517. P. 576–582.
См. также:
1) Marcin Imielinski et al. Mapping the hallmarks of lung adenocarcinoma with massively parallel sequencing // Cell. 2012. V. 150. P. 1107–1120.
2) Michael S. Lawrence et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes // Nature. 2013. V. 499. P. 214–218.
3) Li Ding & Michael C. Wendl. Differences that matter in cancer genomics // Nat Biotechnol. 2013. V. 31. P. 892–893.
4) Michael S. Lawrence et al. Discovery and saturation analysis of cancer genes across 21 tumour types // Nature. 2014. V. 505. P. 495–501.
"этим утверждением вы отбрасываете трансформацию клеток из-за мутации, хотя бы. ваше утверждение не верно."
- то есть, предположение не верно, поскольку не поддерживает офицальную точку зрения?:)
"Пожалуйста, цитируйте проверенные источники, а не сайты типа "лечебные травы", если хотите обсудить проблему рака серьезно. Старайтесь найти ЦИТИРУЕМЫЕ публикации."
- это общие сведения, поэтому достаточно, на мой взгляд, и таких данных.
"И обратите внимание, трансформированная клетка - это клетка с нормально функционирующими системами, благодаря чему она и выживает при повреждении некоторых частей этих систем, которые и привели к трансформации"
- я разве говорю о какой-либо не нормально функционирующей системе?!
Если предположить, что накопление АТФ впринципе возможно, то. что самое затратное по АТФ для клетки? - Деление клетки! Поэтому клетка и делится от избытка не использованных АТФ (иначе куда еще деть АТФ?). Все очень просто. И происходят нарушения в клетке и поехало. Но изначально - наличие большого скопления АТФ провоцирует клетку на самое затратное для нее на деление.
Интересна теория не правдали? - рак - это убегание от АТФ:).
рак - недостаток положительных ионов натрия.:) стакан слабого раствора соли. )
"Разжиженные мембраны" и тп - это все описания каких угодно клеток, но не живых. - не цепляйтесь к словам, прошу Вас ведь можно же пропустить мимо и выделить главное?:) Ведь понятно же, что подразумевается. А если не понятно, то пропустите мимо ушей, поскольку это далеко не самое важное в тексте.
И еще.
Можно был бы утверждать, что нехваток ионов металов в раковых клеток (нехваток натрия) связан именно с отрицательным зарядом, с большим количеством отрицательно заряженных частиц (происходит нейтрализация).
Если человек действительно вырабатывает электроны во время бодрствования, если он работает сутками, мало спит и отдыхает, возможно, во время нервного напряжения, выделяемые электроны, накапливаются в теле.
И поэтому возникает рак. Возможно, стоит пить слабый солевой раствор тем кто много работает, мало спит, при нервных нагрузках, чтобы восполнить натрий, ионы которого нейтрализуются под действием электронов.. тогда рак не возникнет, так как недостатка натрия не будет. или к нему добовлять раствор других металов.
И стараться высыпаться, чтобы снять избыточный заряд.
Не надо мне говорть о том что раствр соли вреден, что мы употребляем много больше соли, чем нам нужно.Что при чрезмерном употреблении соли происходят заболевания. Что соль выходит с водой. Что наличие соли зависит от наличия жидкости в организме. Что употребление соли вредно. Я сама знаю. Но слабый раствор соли 3-5 гр является нормой и думаю полезен (при раке??). но как угадать, что существует нехватка натрия в некоторых клетках, например, где операционный шов? Ведь нехватка натрия в организме и нехватка натрия в определенном органе - это две разные вещи.
Ха, вот забавно будет, если раковым больным для лечения нужен только водянной слабый раствор соли. Прикол.
(а ведь у всех раковых больных слабый алкалоз, разве нет? А он не является ли признаком нехватки натрия, еще раз повторю я свой вопрос?)
Читайте также:

