Рецепторы прогестерона в опухолях яичников
Фундаментальным открытием, внесшим новое содержание в проблему гормонозависимости и гормоночувствительности опухолей, явилось обнаружение Jensen (1971) рецепторов эстрадиола во фрагментах ткани РМЖ. В дальнейшем в опухолях молочной железы, эндометрия и яичников с высоким постоянством были отмечены рецепторы эстрадиола и прогестерона, определение которых стало объективным тестом чувствительности к гормонотерапии эстрогенами, прогестагенами и антиэстрогенами.
McGuiere (1975) одним из первых показал, что чувствительность РМЖ к эстрогенам и антиэстрогенам коррелирует с наличием в опухоли рецепторов эстрадиола (ER+). Но около 30% больных с ЕR+ не были чувствительны к гормонотерапии. Ноrwitz и соавт. (1975) установили, что ремиссии у больных с метастазами РМЖ после овариэктомии или гормонотерапии достигаются в 80— 100% случаев, если опухоль содержит и ER и PR (рецепторы прогестерона). В то же время опухоли с отсутствием рецепторов эстрадиола и прогестерона (ER— и PR—) в 90% случаев не реагируют на гормонотерапию или овариэктомию.
Полученные данные позволили пересмотреть показания к овариэктомии, которые ранее определялись эмпирически. Она неэффективна у больных в постменопаузе. У больных до 50 лет профилактическая овариэктомия оказалась полезной у больных с ER+ и метастазами не более чем в трех подмышечных лимфатических узлах.
При нормальном двухфазном менструальном цикле эстрогены повышают содержание рецепторов прогестерона в цитоплазме эндометриальных клеток. Прогестерон уменьшает пролиферативный эффект эстрогенов с помощью следующих механизмов: подобно антиэстрогенам он ингибирует синтез рецепторов эстрадиола; уменьшает время нахождения эстрадиола в ядре клетки; уменьшает содержание собственных рецепторов (PR), связываясь с ними; стимулирует синтез ферментов, которые способствуют конверсии эстрадиола в менее активный метаболит эстрон.
Уровень содержания стероидных рецепторов в опухолях эндометрия варьирует в широких пределах: от 10 до 1000 фмоль/мг для эстрадиола и от 20 до 2600 фмоль/мг — для прогестерона. Опухоль считается ER+ при содержании рецепторов эстрадиола более 1.0 фмоль/мг и PR (+)—более 20 фмоль/мг. Richardson, McLaughlin (1983) суммировали данные 10 авторов, касающиеся определения ER+ и PR+ у 353 больных аденокарциномой эндометрия. ЕК+ установлены в 75% случаев, причем в 80% из них были также и PR+.
Ведущий фактор, влияющий на частоту ER (+)-опухолей, — степепь дифференцировки. При высокодифференцированной аденокарциноме частота ER (+)-опухолей составила 83%, при умереннодифференцированной — 75 %, низкодифференцированной — 55%.
Рецепторы прогестерона определены у 258 больных аденокарциномой эндометрия. PR+ выявлены в 62% случаев: при высокодифференцированном раке —в 81%, умереннодифференцированном — в 56 %, низкодифференцированном — в 33%. Сходные закономерности отмечены при использовании методик определения связанных с ядром рецепторов эстрадиола и особенно прогестерона в аденокарциноме эндометрия. По нашим наблюдениям, ER+ и особенно PR+ чаще всего отмечаются при благоприятном наборе прогностических факторов: высокой дифференцировке аденокарциномы с поверхностной инвазией в миометрий, отсутствии метастазов в регионарных лимфатических узлах.
Высокий уровень содержания рецепторов прогестерона — надежный критерий чувствительности РЭ к лечению прогестагенами. В работах Benraad (1980) и Ehrlich (1981) показано, что характерные для прогестинотерапии явления гормонального патоморфоза установлены в 91% случаев при PR (+)-опухолях и лишь в 6% — при PR—. По данным нашой клиники, наиболее четко можно предсказать высокую чувствительность опухоли к прогестагенам при следующих условиях: PR+ и ER+ содержание PR более 100 фмоль/мг, а отношение PR/ER>2. Это совпадает с результатами исследований Gurpide (1981) и Greasman и соавт. (1985).
Назначение перед прогестинотерапией эстрадиола или антиэстрогенов повышает содержание PR и увеличивает чувствительность опухоли к гестагенам. При PR(—)-аденокарциномах результаты химиотерапии оказались значительно лучше, чем при PR (+)-опухолях. Удовлетворительного объяснения этому факту не существует, но аналогичная ситуация была ранее замечена у больных РМЖ.
По данным нашей клиники, полученным совместно с А.С. Вишневским, PR( + )- и ER(+)-опухоли и высокий уровень стероидных рецепторов чаще определяются при высоко- и умереннодифференцированной аденокарциноме по сравнению с железисто-солидной и низкодифференцированной. Под влиянием прогестагенов (ОПК) и антиэстрогенов (тамоксифен) происходит снижение содержания рецепторов эстрадиола. Терапия 0ПК также снижает уровень рецепторов прогестерона (в среднем с 143,3 до 57,8 фмоль/мг), в то время как назначение тамоксифена способствует синтезу рецепторов прогестерона. Эти данные позволили индивидуализировать адъювантную гормонотерапию РЭ.
В неизмененных яичниках у женщин репродуктивного возраста тканью-мишенью действия эстрогенов являются гранулезные клетки фолликулов. В них находят рецепторы эстрадиола и реже — прогестерона. Кроме того, в них находятся мембранные рецепторы ФСГ, который стимулирует секрецию эстрогенов. Рецепторы андрогенов определяются в ткани атрезированных фолликулов. Большой интерес вызывают последние данные о нахождении стероидных цитоплазматических рецепторов в зародышевом однослойном целомическом эпителии на поверхности яичников.
Указанный эпителий, по современным представлениям, является мультипотентным, он дифференцируется в мюллеровский эпителий, причем из него возникают 3 основных вида рака яичников: серозные, эндометриоидные и муцинозные цистаденокарциномы. По сводным данным 10 клиник, суммированным Richardson, McLaughlin (1983), среди 135 больных эпителиальным и злокачественными опухолями яичников рецепторы эстрадиола были обнаружены в 60%, прогестерона — в 39%, оба — в 29% случаев. Эти данные обосновывают клинические испытания прогестинов и антиэстрогенов при раке яичников, особенно при эндометриодной цистаденокарциноме.
Обнаруживаемые с высоким постоянством рецепторы стероидных гормонов в тканях-мишенях подтверждают роль гиперэстрогении в сложном патогенезе гормонозависимых опухолей органов репродуктивной системы. Рассмотрим интересный пример коканцерогенного действия эстрогенов.
Исследование проводится в целях диагностики патологии репродуктивной функции, а также для оценки тяжести гиперпластического процесса. Определение уровня рецепторов эстрогена и рецепторов прогестерона в среднюю стадию фазы секреции позволяет оценить степень эндометриальной дисфункции. Ki-67 – индекс пролиферативной активности – белок, который синтезируется в ядрах клеток, находящихся в процессе деления. Является одним из специфических маркеров хронического эндометрита. Исследование экспрессии Ki-67 маркера позволяет подтвердить наличие диспластических процессов, выявить поражения шейки матки с высоким риском дальнейшей прогрессии.
Определение рецепторов эстрогена, прогестерона и Ki -67 в эндометрии.
Immunocytochemical analysis ofsteroid-receptor and Ki-67 , immunocytochemistry of progesterone, estrogen receptors and Ki-67.
Метод исследования
Жидкостная цитология + иммуноцитохимическое исследование.
Какой биоматериал можно использовать для исследования?
Аспират из полости матки.
Общая информация об исследовании
Стандартное морфологическое исследование эндометрия включает определение клеточного состава, соотношения клеток, фазы менструального цикла, патологических изменений – признаков атипии, инфильтрации воспалительными клетками при световой микроскопии. Материалом для исследования является эндометрий, полученный методом аспирационной биопсии эндометрия или при гистероскопии с биопсией эндометрия, после выскабливания (кюретаж полости матки).
Иммуноцитохимия – это метод исследования клеток, основанный на обнаружении специфических антигенов с помощью присоединения к ним антител, меченных флюорохромом или ферментом. Антигены – молекулы белков или углеводов, имеющие уникальную трёхмерную структуру, способные индуцировать образование антител. Антитела – иммуноглобулины, распознающие антигены и присоединяющиеся к ним во время реакции "антиген-антитело". Антигены и антитела неразличимы при исследовании методом световой и электронной микроскопии. Для обнаружения специфических антигенов к образцу клеток добавляют реагент, содержащий меченные флюорохромом или ферментом антитела, в результате чего образуется иммунный комплекс "антиген-антитело". Комплексы формируют специфическое окрашивание клеток и их внутренних структур, обеспечивая детекцию патологических изменений на молекулярном уровне. Иммуноцитохимическое исследование позволяет верифицировать онкологические заболевания, метастатические поражения, определить их гистологическую принадлежность, оценить экспрессию маркеров, влияющих на прогноз заболевания и подбор схемы эффективной химиотерапии.
Эндометрий – слизистая оболочка, выстилающая полость матки изнутри, необходимая для имплантации оплодотворенной яйцеклетки и развития плаценты во время беременности. Он подвергается динамическим структурным и функциональным изменениям во время менструального цикла под действием женских половых гормонов - эстрогена и прогестерона, последовательно секретируемых яичником. Нарушение экспрессии рецепторов эстрогена и прогестерона в эндометрии нарушает нормальное циклическое функционирование эндометрия у женщин репродуктивного возраста и вызывает ряд патологических состояний, включающих аномальные маточные кровотечения, бесплодие.
Иммуноцитохимическое исследование образца, содержащего клетки эндометрия, позволяет определить выраженность экспрессии рецепторов к эстрогену и прогестерону и определить их соотношение. В нормальном эндометрии происходит циклическое изменение баланса рецепторов женских половых гормонов в зависимости от фазы менструального цикла.
В стадию ранней пролиферации после пятого дня цикла начинается прогрессивное увеличение рецепторов к эстрогену (ER) в строме и эпителии желёз, продолжающееся в позднюю пролиферативную фазу с максимальным пиком экспрессии в предовуляторном периоде и во время овуляции. После овуляции отмечается постепенное снижение уровня рецепторов к эстрогену, обусловленное действием прогестерона.
Увеличение рецепторов к прогестерону начинается в позднюю пролифертивную фазу, достигая максимальной экспрессии в предовуляторном период, во время овуляции. В секреторную фазу железистый эпителий постепенно уменьшает экспрессию рецепторов к прогестерону, в то время как экспрессия рецепторов на стромальных клетках продолжает увеличиваться.
Максимальное количество клеток эндометрия, экспрессирующих рецепторы к женским половым гормонам, отмечается в конце поздней пролиферативной фазы и предовуляторный период, со смещением соотношения в сторону рецепторов к эстрогену (референтный интервал ER/PR составляет от 2-4:1). В секреторную фазу соотношение ER/PR смещается в сторону рецепторов к прогестерону и составляет 1:2, в стромальных клетках до 1:3 к концу менструального цикла.
К концу менструального цикла количество рецепторов к женским половым гормонам снижается до минимальных значений.
Одной из причин бесплодия может быть повышение экспрессии эстрогеновых рецепторов с одновременным снижением экспрессии прогестиновых рецепторов в клетках эндометрия в раннюю секреторную фазу, что нарушает способность эндометрия к имплантации оплодотворенной яйцеклетки.
При хроническом эндометрите отмечается смещение максимального пика экспрессии рецепторов эстрогена и прогестерона в сторону пролиферативной фазы, уменьшение количества клеток, экспрессирующих рецепторы, более раннее истощение рецепторного аппарата с резким снижением эстрогеновых рецепторов в раннюю секреторную фазу. Аналогичные изменения характерны и для рецепторов к прогестерону в клетках эпителия желез.
Для неопластической трансформации эндометрия характерно снижение рецепторов к эстрогену и прогестерону. До 80% опухолей эндометрия экспрессируют рецепторы к эстрогену. Высокая экспрессия рецепторов женских половых гормонов с сохранением соотношения ER/PR свидетельствует о высокой дифференцировке клеток опухоли, что связано с более благоприятным прогнозом в отношении выживаемости. Низкое содержание рецепторов прогестерона позволяет прогнозировать лучший ответ на химиотерапию гормональными препаратами (прогестинами).
Ki-67 – это ДНК-связывающий ядерный белок, экспрессирующийся в пролиферирующих клетках, который предотвращает разрушение хромосом во время деления. Он используется как маркер пролиферации при опухолевых процессах, в некоторых случаях позволяет определить злокачественность процесса, склонность опухоли к метастазированию, прогнозировать ответ на химиотерапию с включением гормональных препаратов. Ki-67 присутствует в нормальных клетках эндометрия в пролиферативную фазу и в очень малом количестве в секреторную. В большем количестве белок содержится в стромальных клетках функционального слоя эндометрия.
Определение экспрессии Ki-67 проводится методом иммуноцитохимии. К образцу, содержащему клетки эндометрия, добавляют меченый антиген к белку Ki-67. В результате реакции "антиген-антитело" формируется специфическое окрашивание ядер клеток. Для анализа выполняется подсчет позитивно меченных клеток, оценка интенсивности окрашивания ядра.
Экспрессия Ki-67 значительно повышается при атипической гиперплазии, раке эндометрия.
При всех типах гиперплазии эндометрия отмечается снижение экспрессии ER, PR и Ki-67 по сравнению с нормальным эндометрием в фазу пролиферации. При сравнении результата иммуноцитохимии с нормальным эндометрием в секреторную фазу наблюдается обратная картина: экспрессия ER, PR и Ki-67 значительно выше при гиперплазии эндометрия.
При раке эндометрия экспрессия ER и PR снижается с одновременным увеличением Ki-67. Чем выше экспрессия Ki-67, тем более низкая дифференцировка клеток опухоли, что свидетельствует о менее благоприятном прогнозе для жизни.
Когда назначается исследование?
- При необходимости подтверждения или исключения хронического эндометрита;
- при оценке тяжести и контроле течения гиперплазии миометрия;
- при обследовании женщин с миомой матки, кистами яичников, эндометриозом;
- при определении гормонально-рецепторного статуса при эндометриальной карциноме;
- при первичном и вторичном бесплодии;
- при невынашивании или ранней потере беременности в анамнезе;
- при подготовке к ВРТ и/или неудачных попытках ЭКО;
- при утолщении эндометрия, выявленном на УЗИ у женщин, принимающих ЗГТ, тамоксифен;
- пациенткам со злокачественной опухолью молочной железы;
- при уточнении диагноза при сомнительных результатах морфологического заключения.
Что означают результаты?
Соотношение рецепторов эстрогена к рецепторам прогестерона (ЕR/PR) в строме составляет 4:1.
При хроническом эндометрите отмечается смещение пика уровня экспрессии рецепторов эстрогенов и прогестерона в сторону средней и поздней стадий фазы пролиферации, в то время как в нормальном эндометрии пик экспрессии приходится на овуляцию.
Нарушение экспрессии рецепторов половых гормонов связано с формированием гиперплазии эндометрия и определяет форму и тяжесть гиперпластического процесса.
При простой железистой гиперплазии без атипии наблюдается повышение рецепторов ER и PR в эпителии желез и стромальных элементах с одновременно высокими показателями экспрессии маркера пролиферации Ki-67.
При неопластической трансформации клетки эндометрия частично или полностью утрачивают рецепторы к эстрогенам и прогестерону. Соотношение рецепторов ER/PR в клетках различных аденокарцином различается и связано со степенью морфологической дифференцировки опухоли.
Степень экспрессии белка Ki-67 увеличивается по мере нарастания неопластических изменений эпителия шейки матки и достигает максимума при цервикальной плоскоклеточной карциноме. Его величина прямо коррелирует со степенью гистологической злокачественности.
Степень экспрессии Ki-67 выражается в процентах.
73 Диагностика хронического эндометрита: CD20+, CD56+, CD138+, HLA-DR
25 Гистологическое исследование биопсийного материала
24 Антиген плоскоклеточной карциномы (SCCA)
Кто назначает исследование?
Гинеколог, эмбриолог, онколог, эндокринолог, цитолог.
Литература
1) Techniques of immunohistochemistry: principles, pitfalls, and standardization. Richard W. Cartun, Clive R. Taylor and David J. Dabbs. Diagnostic Immunohistochemistry, Chapter 1, 1-46.
2) Benign Endometrium. David W Kindelberger and Marisa R Nucci. Gynecologic Pathology: A Volume in the Series: Foundations in Diagnostic Pathology, Chapter 6, 197-232.
3) The Female Genital Tract. Lora Hedrick Ellenson and Edyta C. PirogRobbins and Cotran Pathologic Basis of Disease, Chapter 22, 991-1042.
Молочная железа у женщин является гормонозависимым органом. Основными гормонами, которые влияют на ее работу, считаются прогестерон, эстроген и пролактин. В норме эти вещества всегда присутствуют в организме. Когда развивается РМЖ (рак молочных желез), метод лечения определяет то, сохранились ли в груди рецепторы к гормонам. Если да, то действовать на опухоль, угнетая ее рост, можно соответствующими препаратами.
Гормоны – это биологически активные вещества, которые отвечают за деление клеток, нормализацию других жизненно важных процессов. Практически все процессы жизнедеятельности зависят от нормальной выработки этих веществ.
Значение рецепторов эстрогена, прогестерона и НЕR-2 белка в клетках рака молочной железы, и методы их определения

В кровотоке женского организма все время присутствуют:
- Эстрогены – 3 вида
- Прогестероны – 5 видов
Сколько их содержится в данный момент, зависит от того, какой сейчас период менструального цикла. Эти гормоны взаимодействуют со специальными структурами на поверхности клеток молочных желез.
Развитие онкологии подразумевает рост опухоли, клетки которой мутировали – изменились. Некоторые из них полностью преобразовались, в других же остались рецепторы гормонов. Когда к таким клеткам попадает эстроген и прогестерон, они делятся особенно интенсивно, затем проникают в кровь и лимфу. При онкологии это означает появление метастазов.
Как рецепторы прогестерона и эстрогена влияют на гормональную терапию
Рецепторы прогестерона при раке молочной железы, как и эстрогена, являются основанием для назначения гормональной терапии. Цель этого метода лечения – максимально уменьшить действие гормонов на опухоль, тем самым остановив ее рост и деление патогенных клеток.
Чаще всего гормональная терапия назначается после проведения операции по удалению раковой опухоли. Ее цель заключается в перестраховке, чтобы предотвратить губительное действие раковых клеток, которые могли остаться в организме.
Расположение и функции рецепторов эстрогена и прогестерона

Располагаются эти чувствительные частицы во многих частях тела – жировой ткани, лимфоузлах, молочных железах. Все эти ткани имеют подходящую для жизнедеятельности гормонов структуру. Основными функциями эстрогена и прогестерона являются:
Методы определения
В таблице ниже приведены допустимые показатели нормы прогестерона и эстрогена в разные периоды менструального цикла женщины:
Чтобы определить количество прогестерона и эстрогена, назначается анализ крови. А чтобы определить наличие рецепторов эстрогена и прогестерона при раке молочной железы, требуется иммуногистохимическое исследование. Для его проведения берут кусочек опухоли, заливают в парафин. Затем в лаборатории происходит изучение взятого материала.
Что означает результат исследования
Если иммуногистохимическое исследование подтвердило наличие рецепторов половых гормонов на участке груди, пораженном злокачественными процессами, это означает, что необходимо выбирать средства гормонотерапии. В противном случае рост ракового образования будет увеличиваться, появятся метастазы, затрагивающие другие органы.
Однако положительные данные исследования являются не единственным основанием для прогноза на выздоровление. Если стадия рака вторая и выше, появились метастазы, поражены лимфоузлы, успех терапии уменьшается.
Химические и физические характеристики

Эстроген-рецепторы относятся к группе ядерных, делятся на две формы: α и β. Рецепторы к нему, как и к прогестерону, играют важную роль в формировании злокачественной опухоли. Они представляют собой белковые структуры, которые размещаются по поверхности новообразования.
При естественном выделении новых половых гормонов происходит их соединение и взаимодействием с рецепторами, которые расположены возле раковой опухоли. Последствием становится интенсивное развитие и прогрессирование роста онкологии. По статистике, рецепторы к половым гормонам встречаются в такой частоте:
- 75% — эстроген-позитивные
- 65% — эстроген-позитивные, восприимчивы также к прогестерону
- 10% — эстроген-позитивные, но абсолютно прогестерон-негативные (эстрогенозависимые)
- 5% — прогестерон-позитивные, но абсолютно эстроген-негативные (прогестеронзависимые)
- 25% — не содержат рецепторы, восприимчивые к гормонам
Эстроген-рецептор – механизм действия
Две формы эстроген-рецептора α и β исследованы по-разному. Функция эстрогена типа β научно полностью не определена. Тип α исследован подробно, относится к группе лиганд-активированных ядерных структур. Принцип действия эстрогена такой:
- проникает в молочную железу и другие ткани
- транспортируется в ядро
- соединяется с эстрогеновыми рецепторами
- взаимодействует с ДНК и клеточными белками
- осуществляет синтез белков
Прогестерон-рецептор – механизм действия

Промотор гена прогестерона содержит в составе частицы, зависимые от эстрогена, поэтому считается, что роль последнего при формировании злокачественных опухолей больше. В связи с этим эстрогенозависимый рак молочной железы встречается чаще, чем прогестеронозависимый. Принцип действия прогестерон-рецепторов аналогичен эстрогеновым. Соединяясь с гормоном, они взаимодействуют, результатом чего оказывается модуляция экспрессии и синтез белков.
Использование в клинических целях
Результаты исследований применяются лечащим врачом-онкологом для подбора терапии рака. В основном прогноз на выздоровление положительный, если опухоль оказалась гормонозависимой, определена на ранней стадии, метастазов нет.
Если принимается решение о назначении гормональной терапии, на основании показателей количества рецепторов, определяется ее вид. Выделяют такие основные виды:
- адъювантная – ее продолжительность составляет 5-10 лет, иногда назначается пожизненно
- неоадъювантная – длится 3-6 месяцев, чаще всего применяется перед хирургическим вмешательством
- лечебная – назначается на ранних стадиях онкологии, вместо операции
Как остановить выработку гормонов

Чтобы остановить выработку эстрогена и прогестерона и прекратить их соединение с соответствующими рецепторами, назначаются препараты, которые:
- снижают уровень эстрогена
- останавливают взаимодействие с уже имеющимися в организме гормонами
Основными группами таких лекарственных средств являются:
- Модуляторы рецепторов. Изначально применялся Тамоксифен – лекарственный препарат, компоненты которого привязывались к эстрогену, блокируя проникновение к ним самого гормона. Сегодня применяются такие аналоги Тамиксифена, как Ралоксифен, Торемифен.
- Блокаторы рецепторов. Эта группа препаратов направляет свое действие на разрушение рецепторов опухоли. В результате в них не просто не проникает гормон, а они вовсе перестают функционировать. Эффективное средство этой группы – Фаслодекс.
- Ингибиторы ароматазы. Признаны наиболее эффективной группой средств гормонотерапии, которые способствуют не только угнетению рецепторов, но и разрушению раковой опухоли. Одним из наиболее эффективным ингибиторов ароматазы признан Летрозол.
- Прогестины. Обычно назначаются, если препараты предыдущих групп оказались неэффективными. Оказывают мощное действие на выработку гормонов, блокируют рецепторы, но вызывают ряд побочных действий.
Таким образом, определение рецепторов прогестерона и эстрогена является основанием для назначения гормонотерапии. Рак молочной железы – опасное для жизни женщины заболевание, поэтому затягивать с выбором лечения нельзя. После проведения специальных исследований, лечащий врач решает, как будет применяться гормонотерапия – вместо операции или в дополнение к ней.
Как и в случае с эстрогеновыми рецепторами (ЭР), описаны две основные формы прогестероновых рецепторов (ПР) — ПР-А и ПР-В. Кодируются они одним и тем же геном. Они имеют идентичное строение, за исключением дополнительной N-терминальной 164-аминокислотной последовательности у ПР-В, именуемой В-апстрим-сегментом (BUS). ПР-А имеет молекулярную массу 94 кДа и содержит 768 аминокислот; ПР-В — молекулярную массу 114 кДа и 933 аминокислоты. Эти две формы происходят от двух отдельных эстрогенрегулируемых промоторов.
Домен функции транскрипции (TAF-1) прогестероновый рецептор (ПР) расположен на 91-аминокислотном сегменте регуляторного региона, a TAF-2 — на гормонсвязывающем домене. У ПР-В BUS содержит третий домен активации — TAF-3, который может либо усиливать действие TAF-1 и TAF-2, либо самостоятельно активировать транскрипцию. TAF-3 рекрутирует отдельный набор коактиваторов, которые не обладают способностью эффективно взаимодействовать с ПР-А, и инициирует их связывание с ПР-В.
Таким образом, прогестероновый рецептор-А (ПР-А) и прогестероновый рецептор-В (ПР-В) обладают разными трансактивационными свойствами, которые являются специфичными как по отношению к клетке, так и по отношению к промотору гена-мишени. Изоформы ПР-А и ПР-В в отсутствие связывания с лигандом четко локализованы в клетке: ПР-А — преимущественно в ядре, а ПР-В — в цитоплазме.
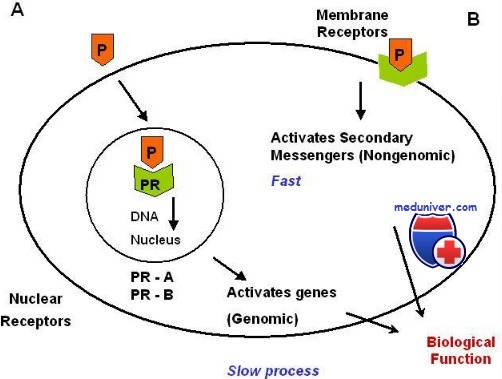
Значение изоформ прогестероновых рецепторов (ПР) до сих пор неясно. Селективное выключение экспрессии ПР-А у мышей вызвало грубые нарушения функции яичников и матки, приведшие к бесплодию, но не повлияло на чувствительность к прогестерону молочных желез и тимуса. Выключение же экспрессии ПР-В не влияет на чувствительность яичника, матки и тимуса к прогестерону, но проявляется недоразвитием млечных протоков.
Таким образом, прогестероновые рецепторы-А (ПР-А) необходимы для обеспечения фертильности женщин; в отсутствие прогестеронового рецептора-А (ПР-А) прогестеронового рецептора-B (ПР-B) функционируют тканеспецифично, опосредуя некоторые эффекты прогестерона в тканях молочных желез. Однако трансгенные мыши — носители избыточной копии гена ПР-А — демонстрировали патологию развития молочных желез, что свидетельствует о возможном физиологическом значении гиперэкспрессии ПР-А.
Относительные уровни двух изоформ в эндометрии различны в разные фазы менструального цикла. В матке прогестерон угнетает действие белков остановки клеточного цикла, стимулируя при этом факторы роста и рецепторы к ним, а также другие регуляторы; кроме того, он необходим для возникновения и сохранения беременности. Антагонист прогестерона RU-486 (мифепристон) первоначально был синтезирован как антагонист глюкокортикоидных рецепторов, но впоследствии выяснилось, что он оказывает выраженное антипрогестероновое действие.
Аффинность его связывания с глюкокортикоидным рецептором в 3 раза превышает аффинность дексаметазона, а связывания с прогестероновым рецептором — в 5 раз превышает аффинность эндогенного прогестерона. В противоположность прогестерону комплекс RU-486-ПР ингибирует транскрипцию благодаря тому, что у него имеются несколько иные конформационные изменения в домене TAF-2. При возникновении имплантации он негативно регулирует активируемые прогестероном гены, что приводит к некрозу децидуальной оболочки и отделению продуктов зачатия.


Что большинство людей знает о раке молочной железы (РМЖ)?
- Опухоли бывают злокачественными и доброкачественными.
- Для лечения используется химиотерапия и хирургическое вмешательство.
- Рак пугает нас до чертиков.
Что знают о раке молочной железы врачи?
Очень, очень и очень много. И будьте уверены, вышеперечисленными фактами медицинские знания и близко не ограничиваются.
Не существует некого универсального рака, который поражает разные органы нашего тела.
Онкология разнообразна, типов опухлевой активности множество — это относится и к раку молочной железы.
Для того, чтобы успешно бороться с раком и снизить риски рецидивов, онкологи изучают опухоль различными способами, определяя ее особенности, вплоть до молекулярного строения.
Важным аспектом терапии РМЖ является определение, является ли опухоль гормонозависимой или гормоно-негативной.
Это первоочередная задача после биопсии или операции. В зависимости от полученных результатов врачи определятся со стратегией лечения.
Какое отношение к раку имеют гормоны?
Если речь идет о раке молочной железы (и некоторых других органов), то отношение самое прямое. Наша грудь — орган гормонозависимый, на ее работу влияют прогестерон, эстроген и пролактин (и некоторые другие, но о них в другой раз).
Гормоны — активные вещества, они отвечают за эффективную работу различных систем организма, в том числе, за клеточное деление.
В тех случаях, когда опухоль восприимчива к гормонам, ее рост может ускориться или усилиться. Подавление выработки эстрогена и прогестерона позволяет контролировать опухоль и снизить риски ее возвращения после химиотерапии или операции.
Как это работает на клеточном уровне?
Можно представить себе рецепторы как крошечных котят, лапки которых цепко хватают только любимые игрушки, игнорируя все остальные.
Некоторые рецепторы восприимчивы только к эстрогену, другие — только к прогестерону, третьи воспринимают оба гормона, и так далее.
Как это связано с раком молочной железы?
Онкологический процесс подразумевает мутацию клеток.
Когда мы говорим о РМЖ, нужно помнить, что клетки многих опухолей сохраняют рецепторы к половым гормонам, а значит, такой рак более склонен к клеточному делению и формированию метастазов.
Как узнать, есть ли в опухоли рецепторы к эстрогену и прогестерону?
Для этого необходимо иммуногистохимическое исследование.
Кусочек опухоли, полученный при операции или биопсии, тщательно изучают в лаборатории под микроскопом на наличие биомаркеров рецепторов.
Считается, что около 70% опухолей молочной железы являются гормонозависимыми.
Если рецепторы обнаружили, что происходит дальше?
Этого можно достичь двумя способами:
Некоторые опухоли гормонозависимы или гормон-негативны и к эстрогену, и к прогестерону. Другие реагируют только на эстроген.
Логика терапии будет одинаковой в обоих случаях.
Какую терапию используют, и как она работает?
Для лечения гормонозависимого рака молочной железы используется четыре типа препаратов.
Что такое ингибиторы ароматазы? Звучит перспективно
Ароматаза — это фермент, трансформирующий андрогены в эстрогены. Ингибиторы ароматазы можно назвать антиэстрогенами.
Использование ингибиторов имеет свои побочные эффекты. Часть из них относится к искусственной менопаузе, в которую, по сути, препарат погружает организм.
Другие несут осложнения иного рода.
- Приливы жара
- Боли в суставах
- Мышечная боль
- Головная боль
- Ночная потливость
- Потеря волос
- Бессонница
- Тошнота
- Расстройство желудка
- Диарея
- Усталость
- Депрессия
- Отеки
К долговременным побочным эффектам можно отнести повышение риска остеопороза.
Поэтому при гормональной терапии такого плана врачи обычно следят за состоянием костной ткани.
Терапию ингибиторами ароматазы связывают с повышенным риском сердечно-сосудистых заболеваний и диабета.
Существует также крошечная вероятность развития рака эндометрия во время терапии ингибиторами ароматазы.
Побочные эффекты гормональной терапии могут быть очень неприятными, но они но она несопоставимо менее значимы, чем риски рецидива рака молочной железы.
Ингибиторы ароматазы могут взаимодействовать с определенными лекарствам, что снижает их концентрацию и требует корректировки дозы.
Среди таких препаратов некоторые гормональные контрацептивы, антибиотики, антидепрессанты, противогрибковые препараты, антипсихотики, сердечные препараты и препараты для лечения ВИЧ, а также БАДы, содержащие зверобой.
Читайте также:

