Рецепторы к соматостатину в опухолях



- На заглавную
- О журнале
Поиск
Экспрессия рецепторов к соматостатину 1, 2, 3 и 5 типов в нейроэндокринных опухолях поджелудочной железы
It was examined the expression of somatostatin receptors 1, 2, 3 and 5 types in 56 pancreatic neuroendocrine tumors: 48 function (45 insulinomas and 3 gastrinomas) and 18 non-function tumors. Twenty of 56 tumors were malignant (6 insulinomas, 9 non-function tumors, 3 gastrinomas). In function tumors dominated expression of receptor of 3 type (48%), and in non-function tumors — type 2 (63.2%). In tumors with metastases the number of cells expressing the receptor type 2 and 3 increased, and receptor type 1 — decreased.
Нейроэндокринные опухоли (НЭО) поджелудочной железы считаются относительно редкими новообразованиями. Вместе с тем, за последние годы отмечается тенденция к увеличению частоты их обнаружения как в связи с внедрением в клиническую практику различных методов лучевой диагностики, так и с совершенствованием морфологической верификации. Единственным методом радикального лечения локализованных НЭО поджелудочной железы является хирургический [1, 2]. Нерезектабельные и диссеминированные НЭО требуют индивидуального подхода к лечению, при этом рекомендации по выбору оптимального метода (химио- либо биотерапия) основываются на морфологических особенностях опухоли [3].
В настоящее время в первой линии лекарственной терапии НЭО (особенно функционирующих) поджелудочной железы наиболее часто применяют синтетические аналоги соматостатина [4, 5, 6, 7]. Противоопухолевая активность этих препаратов обусловлена подавлением пролиферации опухолевых клеток, стимуляцией их апоптоза, подавлением продукции ими факторов роста и основана на связывании специфических мишеней на опухолевых клетках – рецепторов к соматостатину (РС) [8].
В этой связи определение профиля экспрессии РС в опухолевых клетках является важнейшим фактором прогноза эффективноcти данного метода лечения. К настоящему времени известны 5 типов РС. Впервые экспрессия клетками НЭО поджелудочной железы (ПЖ) всех пяти типов этих рецепторов была продемонстрирована в исследованиях J.C. Reubi и соавт. [9], однако, данные литературы последних лет, касающиеся иммуно-гистохимического (ИГХ) определения РС разных типов в НЭО поджелудочной железы, противоречивы, что и послужило основанием для проведения данного исследования.
Цель исследования: изучить особенности экспрессии соматостатиновых рецепторов 1, 2, 3 и 5 типов в НЭО поджелудочной железы различной степени злокачественности.
Материалы и методы
Результаты и их обсуждение
Экспрессия РС 1, 2, 3 и 5 типов обнаружена во всех исследованных НЭО поджелудочной железы. При сравнительном анализе экспрессии РС 1, 2, 3 и 5 типов установлено, что в гормонально-активных и в нефункционирующих НЭО поджелудочной железы экспрессия РС-1 наблюдалась в 17,9% и 21,4%, РС-2 – в 41,9% и 63,2%, РС-3 – в 48% и 25%, РС-5 – в 15,4% и 11%, соответственно (табл. 1).
Экспрессия РС в НЭО поджелудочной железы в зависимости от их функциональной активности
Типы РС
Гормонально-активные НЭО, %
![]()
Локализация НЭО крайне разнообразна, но чаще всего они обнаруживаются в органах пищеварительной системы (более 50 %): прямая (17,2 %) и тонкая кишка (13,4 %), желудок (6,0 %), поджелудочная железа (6–7 %). НЭО занимают второе место в общей структуре онкологической патологии ЖКТ, уступая лидерские позиции лишь колоректальному раку. Около 27 % случаев НЭО возникают в легких (согласно базе данных Surveillance, Epidemiology, and End Results (SEER) 1975-2016) [1].
Еще недавно обсуждались вопросы включения НЭО в список орфанных заболеваний. Но в настоящее время отмечается увеличение частоты встречаемости этой патологии, в том числе из-за улучшения диагностических возможностей (в частности, распространение гастроскопии, колоноскопии, капсульной эндоскопии).
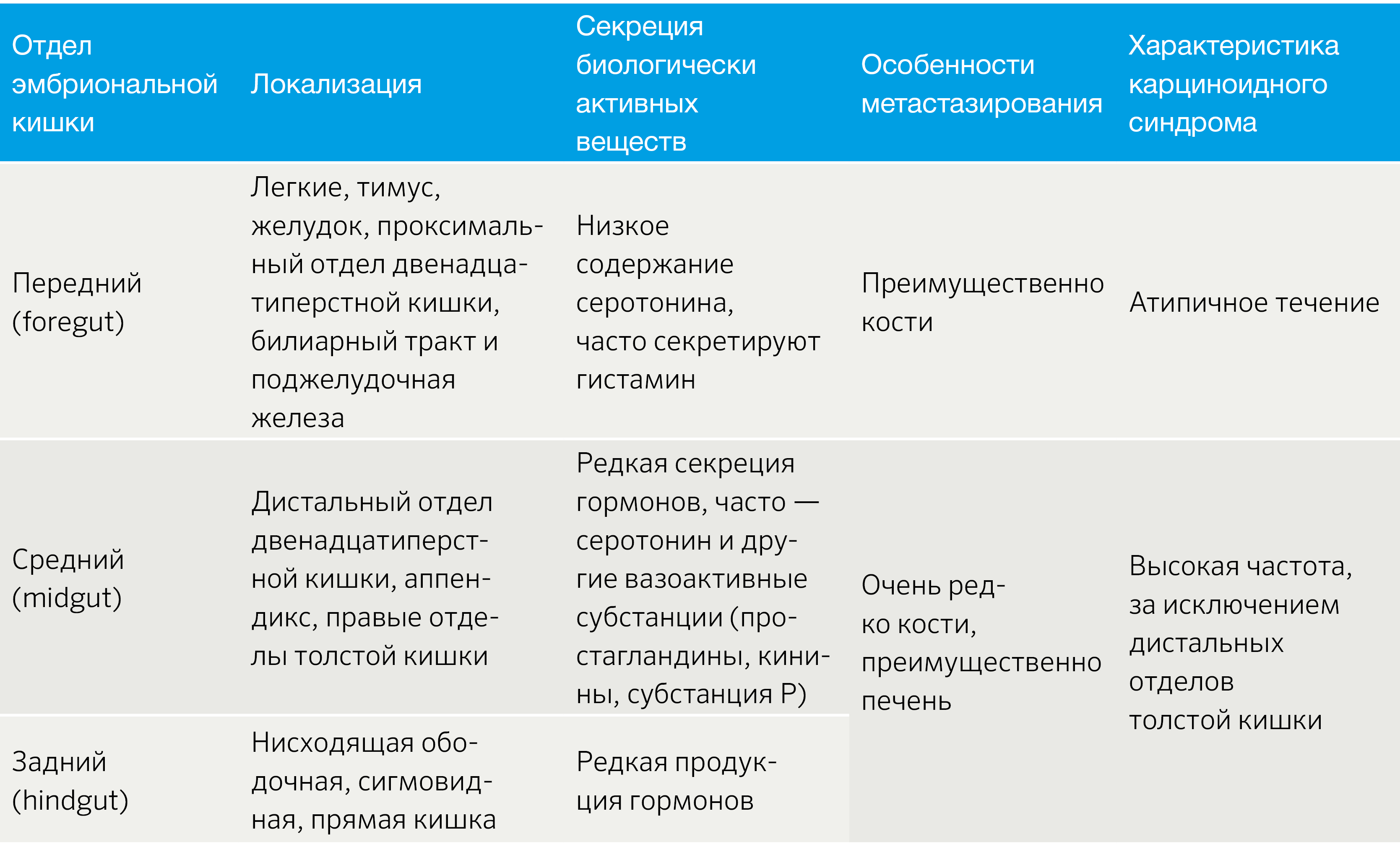
НЭО классифицируют в зависимости от отдела эмбриональной кишечной трубки: из передней, средней и задней кишки (табл. 1) [2].
Табл.1 | Классификация НЭО по эмбриогенезу [2].
![]()
Карциноидный синдром — важный клинический признак. В основном, он обусловлен эффектами серотонина, а также брадикинина, гистамина, дофамина и в меньшей степени других биологически активных веществ (БАВ).
Клинические проявления карциноидного синдрома разнообразны. Наиболее часто у пациентов отмечается гиперемия кожи лица, приливы, диарея, боль в животе. У 60 % пациентов отмечают формирование карциноидной болезни сердца, с нарушением работы преимущественно клапанного аппарата правых отделов (стеноз и/или недостаточность легочного и трехстворчатого клапанов). Серьезным осложнением является декомпенсация нарастающей сердечной недостаточности. Морфологическим субстратом служит выраженный диффузный фиброэластоз эндокарда. Возможны появления телеангиоэктазий, одышки, пеллагры, бронхоспазма. Усиливается продукция соединительнотканных компонентов, в частности, коллагена. Это ведет к фиброзированию и стенозу брыжеечных артерий, фиброзирующему стенозу уретры. Ввиду склонности к развитию спаечного процесса в брюшной полости нарастает риск формирования кишечной непроходимости.
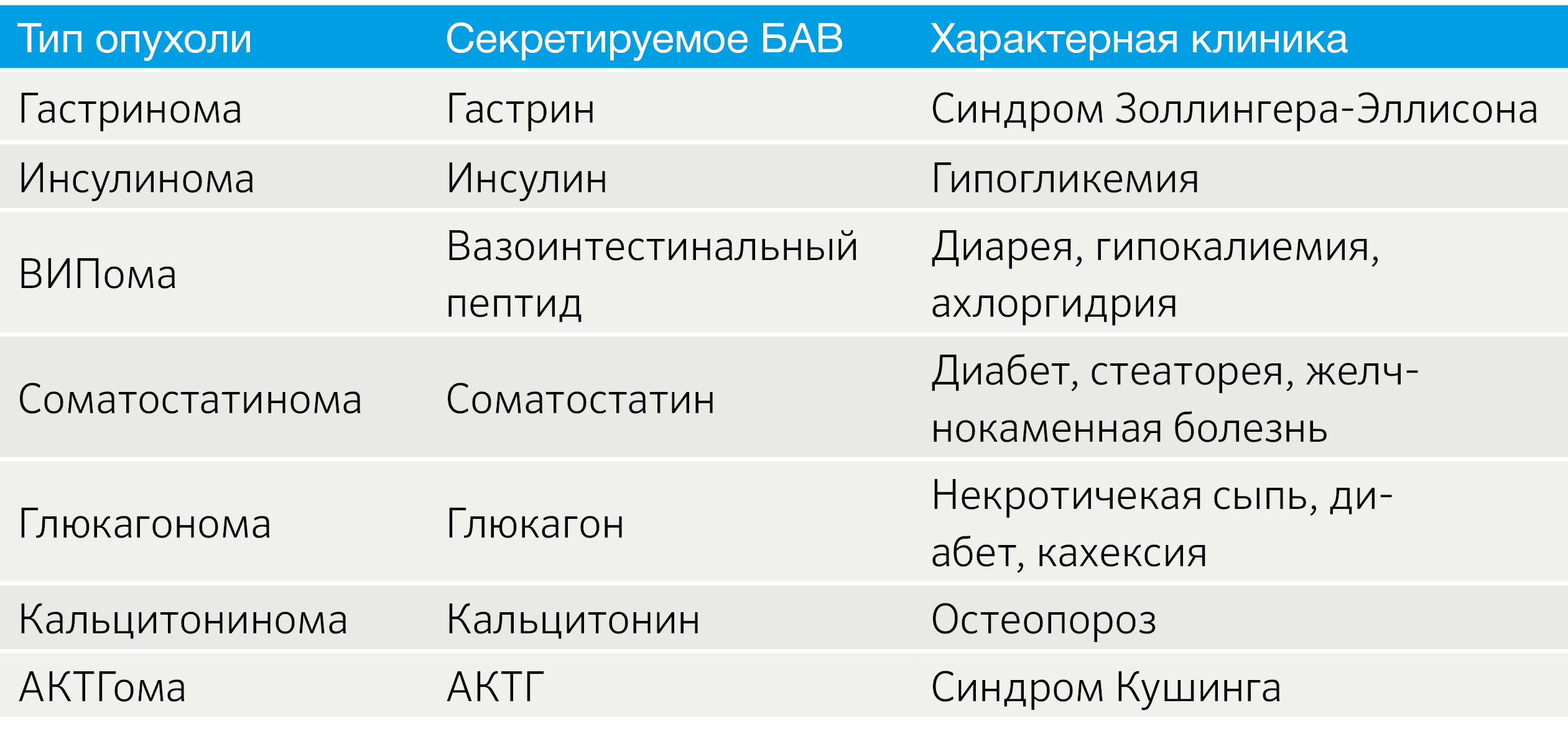
Важным аспектом является функциональный статус опухоли. В зависимости от наличия продукции БАВ выделяют функционирующие (табл. 2) и нефункционирующие новообразования [3].
Табл.2 | Функционирующие НЭО [3].
![]()
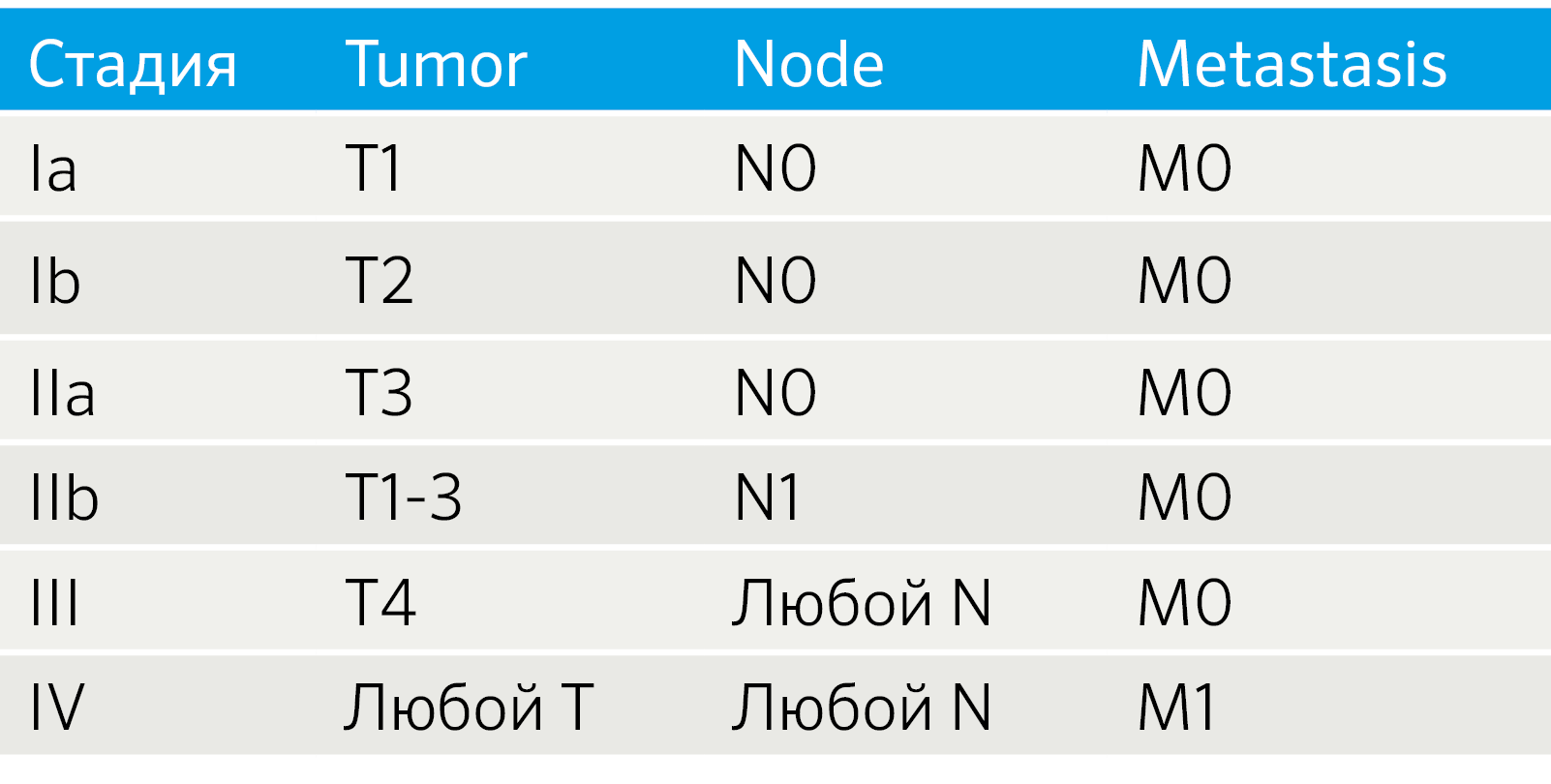
Особенности TNM-классификации определяются локализацией НЭО. НЭО легких стадируются как немелкоклеточный рак легких, для НЭО ЖКТ и поджелудочной железы разработаны рекомендации Европейского общества по изучению НЭО (ENETS) [4]. Также установление стадии TNM для всех анатомических локализаций регламентируется руководством, созданным Американским объединенным комитетом по раковым заболеваниям (the American Joint Committee on Cancer, AJCC) [5, 6]. Так как эти системы не идентичны, возникают вопросы унификации подходов к стадированию. Например, была создана модифицированная система ENETS (mENETS), для диагностики НЭО поджелудочной железы (pNET) (табл. 3) [7].
Табл.3 | Стадирование НЭО поджелудочной железы согласно модифицированной системе ENETS (mENETS) [7].
![]()
И вот мы подходим к той черепахе, на которой стоят киты онкологической диагностики. Это, несомненно, гистологическая верификация диагноза. Как и многие опухолевые заболевания, морфологические градации НЭО подвергались различным модификациям, уточнениям, дополнениям. Дискуссии в этой области в итоге привели к созданию 4-ой редакции классификации ВОЗ (2017 год) [8]. Именно она является актуальной на настоящий момент и заключение при проведении патологоанатомическом исследовании должно отвечать введенным в ней понятиям и требованиям.
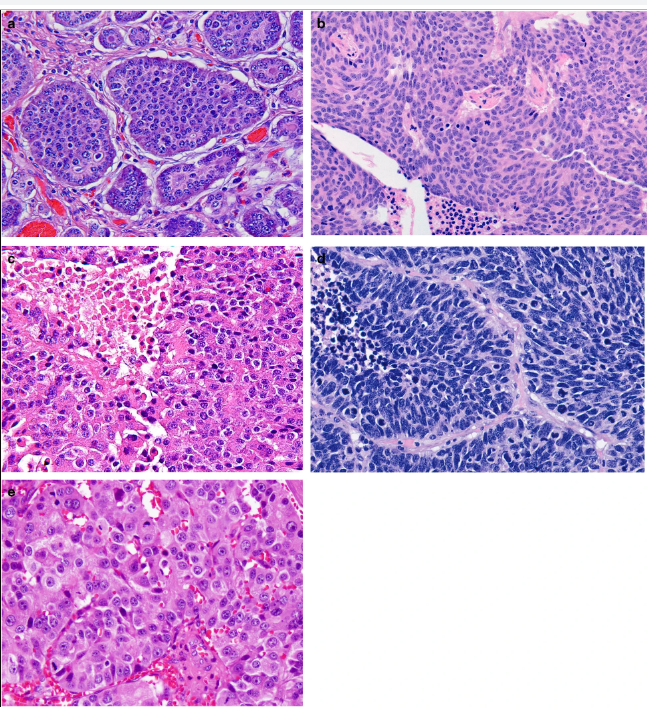
Параметрами морфологической оценки нейроэндокринных новообразований являются: гистологическое строение опухоли, определение сосудистой и периневральной инвазии, митотический индекс. Несмотря на многообразия источников НЭО, морфологическая картина является сходной (рис. 1) [9].
![]()
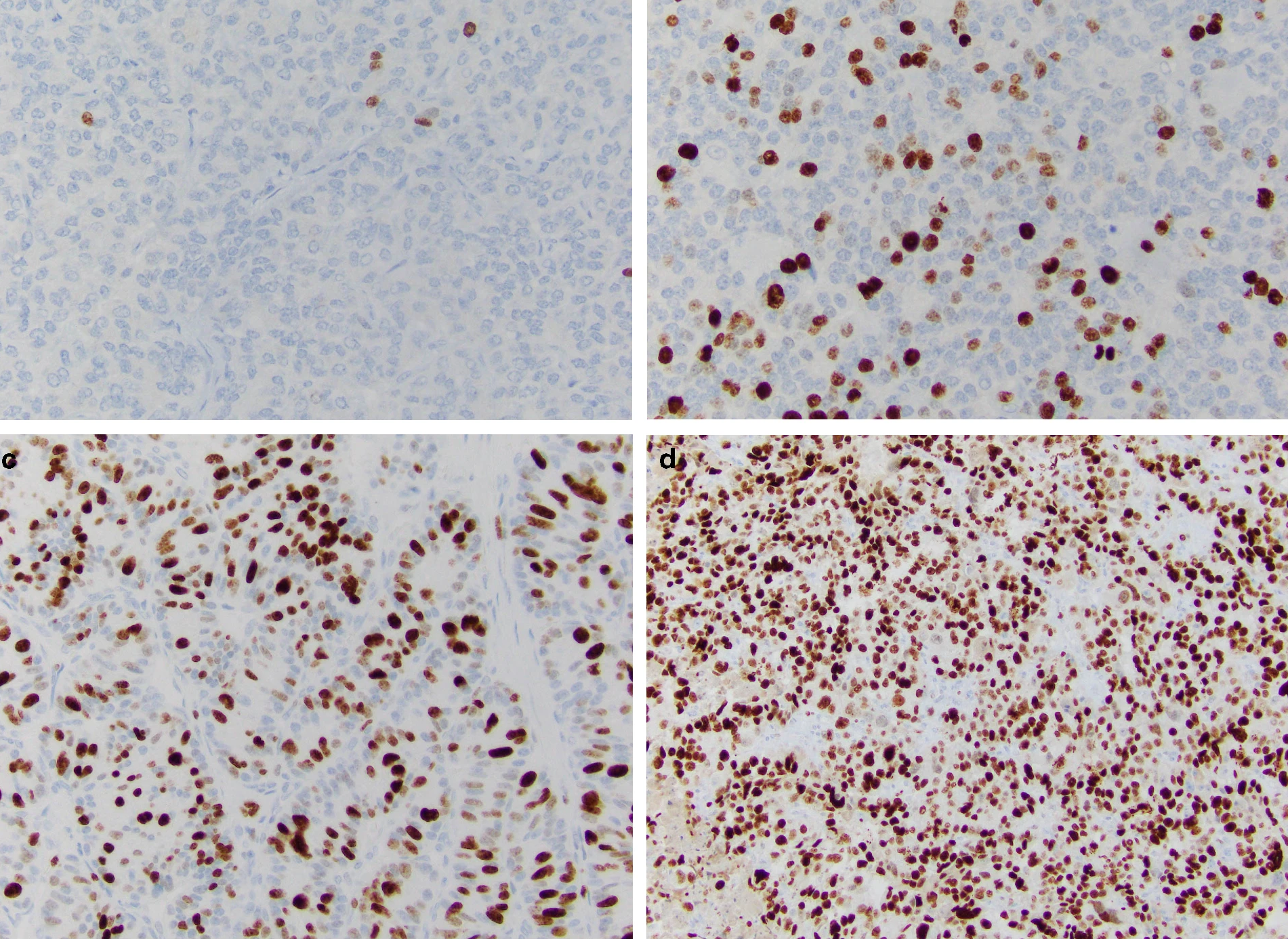
Нейроэндокринное происхождение атипичных клеток доказывает положительная экспрессия так называемых общих нейроэндокринных маркеров. Основные из них это хромогранин А, окрашивающий компоненты нейросекреторных гранул, и пептид синаптофизин, накапливающийся в мелких синаптических везикулах. Также применяется дополнительно установление экспрессии рецепторов соматостатина 2 и 5 типов (SSTR2 и SSTR5). В этом случае возможно определить чувствительность опухолевых клеток к аналогам соматостатина.
Степень злокачественности НЭО определяют на основании двух основных критериев: уровня дифференцированности опухолевых клеток и их пролиферативной активности. Традиционно выделяют три степени злокачественности (grade): G1, G2, G3. Для НЭО ЖКТ и поджелудочной железы введены понятия высокодифференцированных и низкодифференцированных новообразований (или нейроэндокринного рака (карциномы), НЭР). Высокодифференцированные НЭО объединяют G1 (менее 2 митозов на 10 репрезентативных полей зрения (РПЗ) при большом увеличении микроскопа (х400) и индекс Ki-67 ≤ 2%), G2 (2–20 митозов на 10 РПЗ и индекс Ki-67 3–20 %), G3 (> 20 митозов на 10 РПЗ и индекс Ki-67 > 20 %). Grade 3 опухоли разделяют на мелко- и крупноклеточный рак. Опухоли мелкоклеточного типа построены из однотипных клеток округлой, овальной или вытянутой формы, мелкого размера, со скудной цитоплазмой и нечеткими границами. Ядра имеют характерный вид за счет нежного хроматина и невизуализирующихся ядрышек. Определяются массивные некрозы. Крупноклеточные НЭР образованы, соответственно, клетками крупного или среднего размера, с низким ядерно-цитоплазматическим соотношением, выраженной атипией ядер, содержащих гранулярный хроматин и четкие ядрышки. В опухолевой ткани выявляются мультифокальные некрозы, значительное число митозов [8, 9].
Индекс Ki-67 определяют как средний процент окрашенных ядер при учете 500–2000 злокачественно трансформированных клеток (рис. 2) [9].
![]()
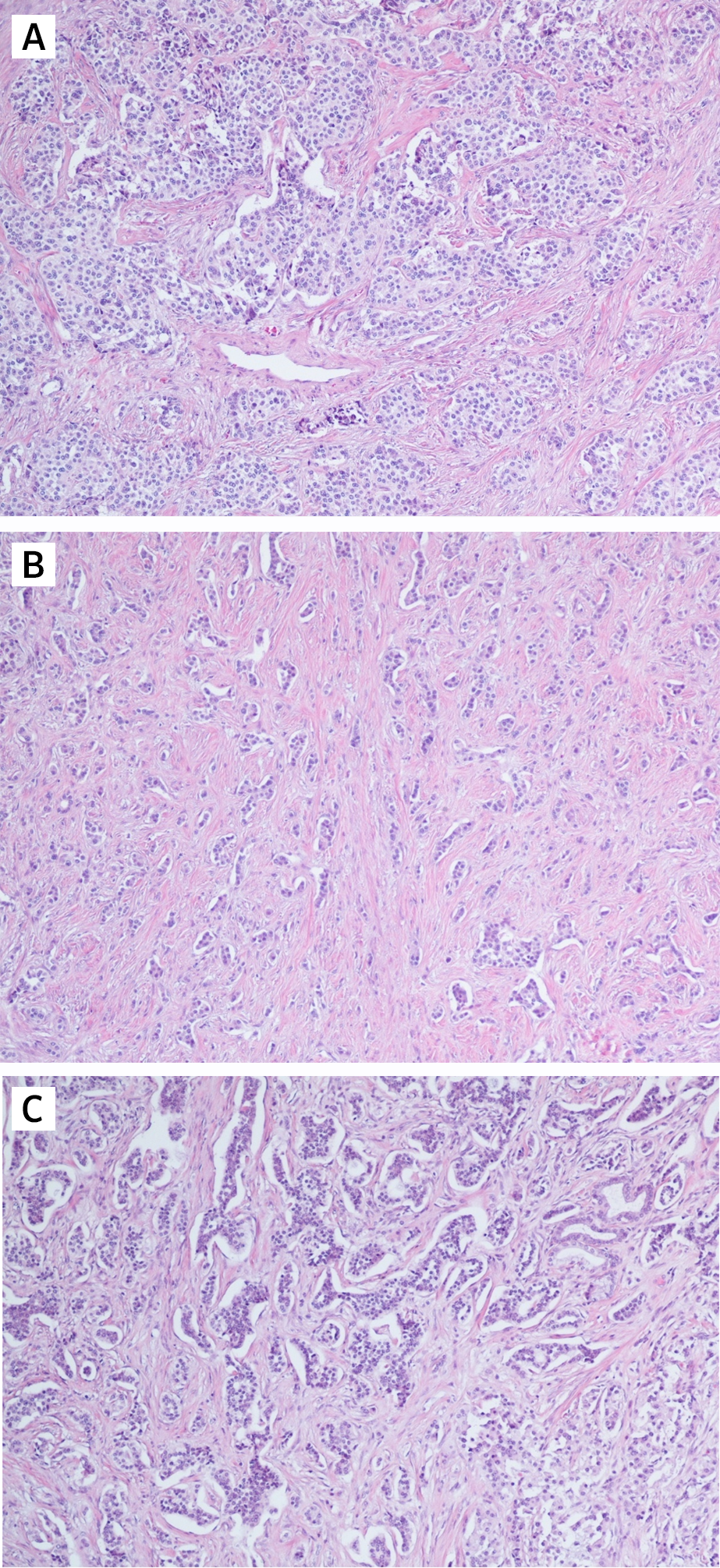
Рассмотрим различия понятий НЭО G3 и НЭР при локализации в поджелудочной железе. Несмотря на высокую степень злокачественности НЭО G3 гистологически имеют органоидную модель строения (рис. 3), отсутствие некрозов [10]. При иммуногистохимическом исследовании опухолевая ткань сохраняет экспрессию общих маркеров нейроэндокринной дифференцировки (диффузно и интенсивно определяется экспрессия синаптофизина, зачастую хромогранина А), а также панкреатические экзокринные или эктопические гормоны. Кроме того, в них отсутствует выраженная экспрессия p53 и утрата экспрессии RB (также определяются иммуногистохимически).
![]()
НЭР поджелудочной железы — это опухоли низкой степени дифференцировки и соответственно высокой степени злокачественности. Экспрессия общих маркеров нейроэндокринной дифференцировки атипичными клетками снижается: синаптофизин определяется слабо или диффузно, хромогранин А также слабо или фокально. Экзокринные гормоны отрицательны в таких опухолях [9]. Часто определяется экспрессия р53, белков ремоделирования хроматина DAXX (death-associated protein 6) и ATRX (АТФ-зависимая хеликаза), потеря экспрессии RB (белок ретинобластомы) и ISL1 (энхансер гена инсулина 1) [11].
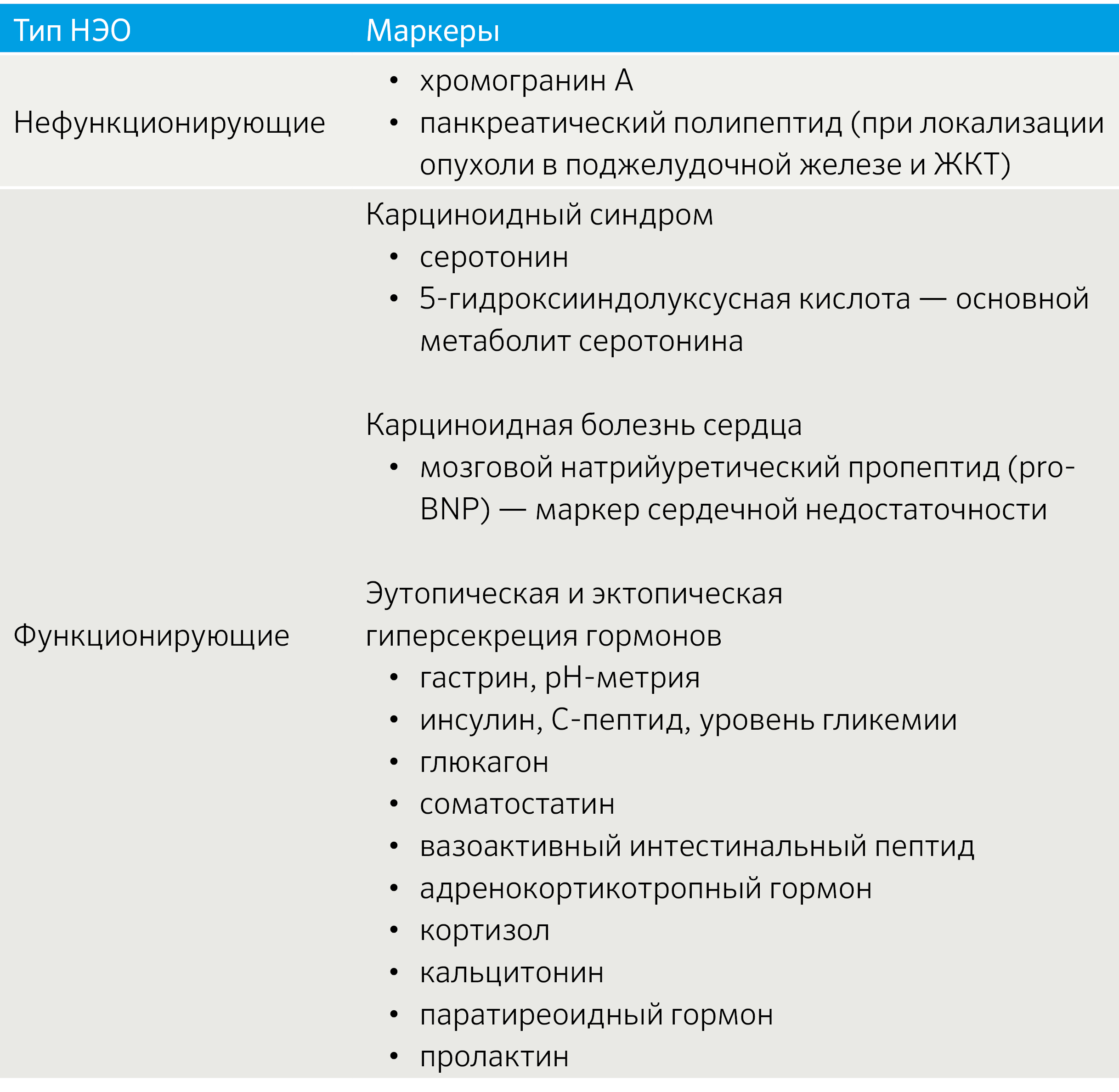
Ввиду многообразия секретирующего профиля НЭО биохимическая диагностика включает различные маркеры, комбинируемые с учетом клинической картины (табл. 4).
Табл. 4 | Спектр биохимических маркеров НЭО [2].
![]()
Радионуклидная диагностика играет важную роль в топической характеристике НЭО. Она включает методы специфической метаболической визуализации ( 123 I-MIBG), рецепторной визуализации ( 111 In-октреотид, 68 Ga-DOTA-TOС/DOTA-NOC/DOTA-TATE) и неспецифической метаболической визуализации ( 18 F-FDG, 18 F-DOPA).
123 I-метайодбензилгуанидин (MIBG) является аналогом норадреналина (норэпинефрина). Он накапливается в адренергических тканях и опухолях, происходящих из них. Сцинтиграфия с 123 I-MIBG используется для диагностики нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки [12].
Для рецепторной визуализации применяют 111 In (индий)-октеотид. Он выявляет высокодифференцированные нейроэндокринные опухоли, опухоли из клеток островкового аппарата поджелудочной железы (гастринома, глюкагонома, инсулинома). Также для верификации НЭО ЖКТ применяется соматостатин-рецепторная сцинтиграфия, так как большинство из них имеют рецепторы к соматостатину (SSTR) на поверхности опухолевых клеток (чаще 2 и 5 типа).
Выбор радионуклидного метода связан со степенью дифференцировки опухолевых клеток. Первичная диагностика НЭО Grade 1 и 2 проводится путем ПЭТ/КТ с радиофармпрепаратами (РФП), мечеными галлием 68 (является ПЭТ-радионуклидом). Сродство (аффинитет) РФП к конкретному подтипу трансмембранных рецепторов соматостатина определяет выбор диагностического индикатора (ПЭТ-лиганда, представленного различными модификациями DOTA). Например, для визуализации НЭО, экспрессирующих рецепторы подтипов SSTR2a и SSTR2b, применяют 68 Ga-DOTA-TATE (DOTA-Tyr3-октреотад). 68 Ga-DOTA-NOC (DOTA-1-Nal3-октреотид) выявляет подтипы SSTR3 и SSTR5, 68 Ga-DOTA-ТOC (DOTA-Tyr3-октреотид) — рецепторы SSTR5 [13].
При отсутствии возможности проведения данного исследования следует выполнить однофотонную эмиссионную компьютерную томографию (ОФЭКТ)/КТ (гибридный метод визуализации) с соматостатин-рецепторным радиофармпрепаратом.
Для недифференцированных НЭО Grade 3 и НЭР при отрицательных результатах соматостатин-рецепторной сцинтиграфии рекомендуется ПЭТ неспецифическая метаболическая визуализация с использованием других РФП. В частности, ПЭТ/КТ c 18F-фтордезоксиглюкозой (18F-ФДГ), которая неэффективна при высокодифференцированных НЭО [14]. Также рассматривают применение 18F-L–DOPA (дигидроксифенил-аланин) — меченого предшественника допамина, который эффективен для обнаружения медуллярного рака щитовидной железы, НЭО, параганглиомы и феохромоцитомы [15].
Предметы
Аннотация
Соматостатин был идентифицирован как обладающий антипролиферативным, антиангиогенным и проапоптотическим действием во многих опухолевых системах, и эти эффекты опосредованы семью из пяти трансмембранных рецепторов SRIF, связанных с G-белком. Рак яичников является наиболее распространенным гинекологическим злокачественным новообразованием в Великобритании, и срочно требуется поддерживающая терапия. Экспрессия нативного соматостатина и его рецепторов sst 1, 2, 3 и 5 была изучена с помощью иммуногистохимии в 63 злокачественных и 35 доброкачественных опухолях яичников различных гистологических типов. Пятьдесят семь из 63 (90%) злокачественных и 26/35 (74%) доброкачественных опухолей экспрессировали соматостатин. Рецепторы sst 1, 2, 3 и 5 были выражены по-разному в эпителиальных, сосудистых и стромальных компартментах как для доброкачественных, так и для злокачественных опухолей. Обнаружено, что соматостатин значительно коррелирует с стромальным сст 1 ( р = 0, 008), эпителиальным сст 1 ( р 2 использовался для различий в окрашивании между доброкачественными и злокачественными группами, и вероятность P
![]()
Серозная цистаденокарцинома, демонстрирующая сильную экспрессию SRIF злокачественным эпителием. S = строма, E = злокачественный эпителий, F = жидкость в кистозной опухоли (увеличение × 200).
Изображение в полном размере
Экспрессия рецептора SRIF
Эпителиальное окрашивание рецепторов SRIF было однородным, если оно присутствует. Эндометриоидная аденокарцинома, демонстрирующая эпителиальную экспрессию sst 5, показана на фиг.2. Окрашивание сосудов было в основном обнаружено в гладких мышцах сред оболочек артерий и вен и было довольно однородным, хотя также наблюдалось некоторое окрашивание эндотелия (фиг.3). Стромальное окрашивание было более очаговым и пятнистым (рис. 4).
![]()
Эндометриоидная аденокарцинома яичника, демонстрирующая равномерное связанное с мембраной эпителиальное окрашивание для sst 5 . Е = Эпителий; S = строма (магнификатоин × 200).
Изображение в полном размере
![]()
Эндотелиальная экспрессия sst 1 в небольших опухолевых венулах. V = венула, R = эритроциты в просвете сосуда, S = строма, E = злокачественный эпителий (увеличение × 400).
Изображение в полном размере
![]()
Аденокарцинома яичника, демонстрирующая очаговую экспрессию sst 1 на незлокачественных стромальных клетках. Существует как мембранно-связанное, так и внутриклеточное окрашивание. E = эпителий, S = строма (увеличение × 400).
Изображение в полном размере
У сорока восьми из 63 (76%) злокачественных и 30 из 35 (86%) доброкачественных опухолей выражена sst 1 . Выявлена значительно более частая экспрессия sst 1 в эпителии (60%) доброкачественных опухолей по сравнению со злокачественными (50, 8%) опухолями ( P = 0, 034), хотя не было различий между окрашиванием сосудов и стромой (таблица 1).
Существенно более частая экспрессия sst 2 в злокачественных опухолях наблюдалась как в эпителии (30, 2 против 14, 3%; р = 0, 044), так и в строме (57, 1 против 40%; р = 0, 018) (таблица 1). Не было никакой разницы в окрашивании сосудов. Интересно, что пять из восьми (62, 5%) недифференцированных карцином экспрессировали сосудистые рецепторы sst 2 . В целом 46 из 63 (77%) злокачественных опухолей и 21 из 35 (60%) доброкачественных опухолей экспрессировали sst 2 по крайней мере в одном из отсеков ткани.
sst 3 был наименее выраженным из изученных рецепторов, в целом только 18 из 63 (29%) злокачественных и 16 из 35 (45%) доброкачественных опухолей, выражающих его. Как шесть из восьми (75%) муцинозных цистаденокарцином, так и шесть из 10 (60%) муцинозных цистаденом продемонстрировали эпителиальную систолу 3 (таблица 1). Три опухоли продемонстрировали сосудистую экспрессию sst 3 .
Сорок пять из 63 (71%) злокачественных и 25 из 35 (71%) доброкачественных опухолей продемонстрировали экспрессию sst 5 . Не было значимых различий в эпителиальной или стромальной экспрессии между доброкачественными и злокачественными опухолями, но доброкачественные опухоли выражали значительно более высокие количества сосудистых сист 5 (40 против 4, 8%; P
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Дополнительные файлы
- Cited By
Актуальность. У пациентов с нейроэндокринными опухолями (НЭО) очень важно еще до начала лечения аналогами соматостатина прогнозировать его клинический эффект. Данных по иммуногистохимическому исследованию экспрессии рецепторов к соматостатину (ССР) разных типов, полученных на больших выборках НЭО различной локализации, функциональной активности и степени злокачественности, накоплено недостаточно, что и определило цель настоящего исследования.
Материал и методы. Проводили иммуногистохимическое исследование с антителами к ССР 1, 2А, 3 и 5-го типов. Материалом исследования послужили тканевые образцы диагностических и операционных биопсий 399 НЭО: 168 поджелудочной железы, 120 желудочно-кишечного тракта (желудка – 48, тонкой кишки – 39, из которых опухолей двенадцатиперстной кишки – 14, аппендикса – 6, толстой и прямой кишки – 15 и 12), 84 легких, 6 тимуса / средостения и 21 метастазов НЭО с неизвестной первичной локализацией.
Результаты. Очень высокий уровень экспрессии ССР 2А, которые преимущественно связывают аналоги соматостатина, используемые сегодня в клинической практике, выявлен в НЭО тонкой кишки (22/25, 88%), аппендикса (5/6, 83,3%), толстой кишки (10/15, 66,7%), тимуса (4/6, 66,7%), атипичных карциноидах легкого (10/15, 66,7%), желудка (27/41, 65,8%) и поджелудочной железы (105/165, 63,6%), а самый низкий – в НЭО прямой кишки (5/12, 41,7%) и мелкоклеточных и крупноклеточных нейроэндокринных карциномах легких (20 и 11,1%). Из всех функционирующих НЭО самый высокий уровень ССР 2А обнаружен в гастриномах (18/19, 94,7%), глю- кагономах (15/16, 93,8%), синдромальных карциноидах желудочно-кишечного тракта (31/35, 88,6%), соматостатиномах (2/3, 66,7%), а самый низкий – в опухолях, секретирующих адренокортикотропный гормон, с синдромом Кушинга (11/12, 50%) и инсулиномах (34/69, 49,3%). В нефункционирующих НЭО поджелудочной железы уровень экспрессии ССР 2А был значительно выше, чем в инсулиномах (57/82, 69,5% и 34/69, 49,3% соответственно). Показано, что уровень экспрессии ССР 2А зависит от степени злокачественности и увеличивается в НЭО поджелудочной железы Grade 2A (Ki67 до 10%), Grade 2B (Ki67 от 10 до 19%) и нейроэндокринных карциномах Grade 3 по сравнению с Grade 1 – 16/50 (32%), 37/61 (60,6%), 8/12 (66,7%) и 20/24 (83,3%) соответственно. Высокий уровень экспрессии второго по клиническому значению рецептора ССР 5 наблюдался в НЭО двенадцатиперстной кишки (7/10, 70%) и аппендикса (2/5, 60%), из функционирующих НЭО – в глюкагономах (12/15, 80%) и гастриномах (12/15, 80%). Рецепторы ССР 3 встречались реже, чем ССР 2А и 5, чаще всего в НЭО желудка (6/11, 54,5%) и инсулиномах (16/37, 43,2%), НЭО поджелудочной железы Grade 3 (4/9, 44,7%), типичных карциноидах легкого (7/16, 41,2%). ССР 1 во всех опухолях выявлялись редко, максимальный уровень их экспрессии наблюдался в карциноидах тонкой кишки (9/21, 42,9%).
Заключение. В зависимости от типа и степени злокачественности нейроэндокринные опухоли различаются по интенсивности экспрессии ССР того или иного типа. В этой связи необходимо определять профиль данных рецепторов в каждой опухоли до начала применения аналогов соматостатина.
д-р биол. наук, профессор, вед. науч. сотр. патологоанатомического отделения,
129110, г. Москва, ул. Щепкина, 61/2,
125284, г. Москва, ул. Беговая, 6/2–12
канд. мед. наук, врач лаборатории фундаментальной патоморфологии,
117036, г. Москва, ул. Дмитрия Ульянова, 11
д-р мед. наук, профессор, заведующий онкологическим хирургическим отделением,
119991, г. Москва, ул. Трубецкая, 8/2
канд. мед. наук, врач-хирург хирургического отделения,
119991, г. Москва, ул. Трубецкая, 8/2
1. Pert CB, Snyder SH. Opiate receptor: demonstration in nervous tissue. Science. 1973;179(4077):1011–4. doi: 10.1126/science.179.4077.1011.
2. Reubi JC, Kappeler A, Waser B, Laissue JR, Hipkin W, Schonbrunn A. Immunohistochemical localization of somatostatin receptors sst2A in human tumors. Am J Pathol. 1998;153(1):233–45. doi: 10.1016/S0002-9440(10)65564-2.
3. Susini C, Buscail L. Rationale for the use of somatostatin analogs as antitumor agents. Ann Oncol. 2006;17(12):1733–42. doi: 10.1093/annonc/mdl105.
4. Guillermet-Guibert J, Lahlou H, Pyronnet S, Bousquet C, Susini C. Somatostatin receptors as tools for diagnosis and therapy: Molecular aspects. Best Pract Res Clin Gastroenterol. 2005;19(4):535–51. doi: 10.1016/j.bpg.2005.03.007.
5. Strosberg J, Kvols L. Antiproliferative effect of somatostatin analogs in gastroenteropancreatic neuroendocrine tumors. World J Gastroenterol. 2010;16(24):2963–70. doi: 10.3748/WJG.v16.i24.2963.
6. Gugger M, Waser B, Kappeler A, Schonbrunn A, Reubi JC. Cellular detection of sst2A receptors in human gastrointestinal tissue. Gut. 2004;53(10):1431–6. doi: 10.1136/gut.2004.042002.
7. Fischer T, Doll C, Jacobs S, Kolodziej A, Stumm R, Schulz S. Reassessment of sst2 somatostatin receptor expression in human normal and neoplastic tissues using the novel rabbit monoclonal antibody UMB-1. J Clin Endocrinol Metab. 2008;93(11):4519–24. doi: 10.1210/jc.2008-1063.
8. Öberg K, Kvols L, Caplin M, Delle Fave G, de Herder W, Rindi G, Ruszniewsk P, Woltering EA, Wiedenmann B. Consensus report on the use of somatostatin analogs for the management of neuroendocrine tumors of the gastroenteropancreatic system. Ann Oncol. 2004;15(6):966–73. doi: 10.1093/annonc/mdh216.
9. Горбунова ВА, Орел НФ, Кузьминов АЕ. Современные направления лечения нейроэндокринных опухолей. Современная онкология. 2010;(1):30–5.
10. Гуревич ЛЕ, Пантелеева ЕИ, Корсакова НА, Казанцева ИА, Егоров АВ, Бритвин ТА, Васильев ИА, Устинова ЕИ. Экспрессия рецепторов к соматостатину 1, 2, 3 и 5 типов в нейроэндокринных опухолях поджелудочной железы. Практическая медицина. 2012;(9):117–9.
11. Дедов ИИ, Марова ЕИ, Абросимов АЮ, Лапшина АМ, Григорьев АЮ, Аблицов ЮА, Кузнецов НС, Гончаров НП, Арапова СД, Рожинская ЛЯ. Экспрессия рецепторов соматостатина и дофамина в АКТГ-продуцирующих опухолях. Проблемы эндокринологии. 2010;56(1):14–8.
12. Егоров АВ, Кондрашин СА, Фоминых ЕВ, Мусаев ГХ, Гитель ЕП, Гуревич ЛЕ, Парнова ВА, Васильев ИА, Рабинович ЭЗ, Волков РЮ. Аналоги соматостатина в диагностике и лечении нейроэндокринных опухолей. Анналы хирургической гепатологии. 2009;14(4): 71–8.
13. Volante M, Brizzi MP, Faggiano A, La Rosa S, Rapa I, Ferrero A, Mansueto G, Righi L, Garancini S, Capella C, De Rosa G, Dogliotti L, Colao A, Papotti M. Somatostatin receptor type 2A immunohistochemistry in neuroendocrine tumors: a proposal of scoring system correlated with somatostatin receptor scintigraphy. Mod Pathol. 2007;20(11):1172–82. doi: 10.1038/modpathol.3800954.
14. Zamora V, Cabanne A, Salanova R, Bestani C, Domenichini E, Marmissolle F, Giacomi N, O'Connor J, Mendez G, Roca E. Immunohistochemical expression of somatostatin receptors in digestive endocrine tumours. Dig Liver Dis. 2010;24(3):220–5. doi: 10.1016/j.dld.2009.07.018.
15. Bertherat J, Tenenbaum F, Perlemoine K, Videau C, Albertini JL, Richard B, Dousset B, Bertagna AX, Epelbaum J. Somatostatin Receptos 2 and 5 A are the major somatostatin receptors in insulinomas: an in vivo and in vitro study. J Clin Endocrinol Metab. 2003;88(11):5353–60. doi: 10.1210/jc.2002-021895.
16. Papotti M, Bongiovanni M, Volante M, Allìa E, Landolfi S, Helboe L, Schindler M, Cole SL, Bussolati G. Expression of somatostatin receptor types 1–5 in 81 cases of gastrointestinal and pancreatic endocrine tumors. A correlative immunohistochemical and reverse-transcriptase polymerase chain reaction analysis. Virchows Arch. 2002;440(5):461–75. doi: 10.1007/s00428-002-0609-x.
17. De Sa SV, Correa-Giannella ML, Machado MC, de Souza JJ, Pereira MA, Patzina RA, Siqueira SA, Machado MC, Giannella-Neto D. Somatostatin receptor subtype 5 (SSTR5) mRNA expression is related to histopathological features of cell proliferation in insulinomas. Endocr Relat Cancer. 2006;13(1):69–78. doi: 10.1677/erc.1.00962.
18. O'Toole D, Saveanu A, Couvelard A, Gunz G, Enjalbert A, Jaquet P, Ruszniewski P, Barlier A. The analysis of quantitative expression of somatostatin and dopamine receptors in gastro-entero-pancreatic tumours opens new therapeutic strategies. Eur J Endocrinol. 2006;(6):849–57. doi: 10.1530/eje.1.02307.
19. Schmid HA, Lambertini C, van Vugt HH, Barzaghi-Rinaudo P, Schäfer J, Hillenbrand R, Sailer AW, Kaufmann M, Nuciforo P. Monoclonal antibodies against the human somatostatin receptor subtypes 1–5: development and immunohistochemical application in neuroendocrine tumors. Neuroendocrinology. 2012;95(3):232–47. doi: 10.1159/000330616.
20. Kanakis G, Grimelius L, Spathis A, Tringidou R, Rassidakis GZ, Oberg K, Kaltass G, Tsolakis AV. Expression of somatostatin receptors 1–5 and dopamine receptor 2 in lung carcinoids: implication for a therapeutic role. Neuroendocrinology. 2015;101(3):211–22. doi: 10.1159/000381061.
21. Righi L, Volante M, Tavaglione V, Billè A, Daniele L, Angusti T, Inzani F, Pelosi G, Rindi G, Papotti M. Somatostatin receptor tissue distrution in lung neuroendocrine tumors: a clinicopathologic and immunohistochemical study of 218 'clinically aggressive' cases. Ann Oncol. 2010;21(3):548–55. doi: 10.1093/annonc/mdp334.
22. Kaemmerer D, Specht E, Sanger J, Witz RM, Sayeg M, Schulz S, Lupp A. Somatostatin receptors in bronchpulmonary neuroendocrine neoplasms: new diagnostic, prognostic, and therapeutic markers. J Clin Endocrinol Metab. 2015;100(3):831–40. doi: 10.1210/jc.2014-2699.
23. Tsuta K, Wistuba II, Moran CA. Differential expression of somatostatin receptors 1–5 in neuroendocrine carcinoma of the lung. Pathol Res Pract. 2012;208(8):470–4. doi: 10.1016/j.prp.2012.05.014.
24. Hofland LJ, Liu Q, Van Koetsveld PM, Zuijderwijk J, Van der Ham F, De Krijger RR, Schonbrunn A, Lamberts SW. Immunohistochemical detection of somatostatin receptor subtypes sst1 and sst2A in human somatostatin receptor positive tumors. J Clin Endocrinol Metab. 1999;84(2):775–80. doi: 10.1210/jcem.84.2.5497.
25. Kulaksiz H, Eissele R, Rössler D, Schulz S, Höllt V, Cetin Y, Arnold R. Identification of somatostatin receptor subtypes 1, 2A, 3,and 5 in neuroendocrine tumours with subtype specific antibodies. Gut. 2002;50(1):52–60. doi: 10.1136/gut.50.1.52.
26. Janson ET, Stridsberg M, Gobl A, Westlin JE, Oberg K. Determination of somatostatin receptor subtype 2 in carcinoid tumors by immunohistochemical investigation with somatostatin receptor subtype 2 antibodies. Cancer Res. 1998;58(11):2375–8.
27. Korner M, Waser B, Schonbrunn A, Perren A, Reubi JC. Somatostatin receptor subtype 2A immunohistochemistry using a new monoclonal antibody selects tumors suitable for in vivo somatostatin receptor targeting. Am J Surg Pathol. 2012;36(2):242–52. doi: 10.1097/PAS.0b013e31823d07f3.
28. Reubi JC, Waser B, Cescato R, Gloor B, Stettler C, Chest E. Internalized somatostatin receptor subtype 2 in neuroendocrine tumors of octreotide-treated patients. J Clin Endocrinol Metab. 2010;95(5):2343–50. doi: 10.1210/jc.2009-2487.
29. Ferone D, Saveanu A, Culler MD, Arvigo M, Rebora A, Gatto F, Minuto F, Jaquet P. Novel chimeric somatostatin analogs: facts and perspectives. Eur J Endocrinol. 2007;156 Suppl 1:S23–8. doi: 10.1530/eje.1.02356.
30. Hofland LJ, van der Hoek J, Feelders R, van Aken MO, van Koetsveld PM, Waaijers M, Sprij-Mooij D, Bruns C, Weckbecker G, de Herder WW, Beckers A, Lamberts SW. The multi-ligand somatostatin analogue SOM230 inhibits ACTH secretion by cultured human corticotroph adenomas via somatostatin receptor type 5. Eur J Endocrinol. 2005;152(4):645–54. doi: 10.1530/eje.1.01876.
31. Ono K, Suzuki T, Miki Y, Taniyama Y, Nakamura Y, Noda Y, Watanabe M, Sasano H. Somatostatin receptor subtypes in human non-functioning neuroendocrine tumors and effects of somatostatin analogue SOM230 on cell proliferation in cell line NCI-H727. Anticancer Res. 2007;27(4B):2231–9.
32. Modlin IM, Pavel M, Kidd M, Gustafsson BI. Review article: somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine (carcinoid) tumours. Aliment Pharmacol Ther. 2010;31(2):169–88. doi: 10.1111/j.1365-2036.2009.04174.x.
33. Mundschenk J, Unger N, Schulz S, Hollt V, Schulz S, Steinke R, Lehnert H. Somatostatin receptor subtypes in human pheochromocytoma: subcellular expression pattern and functional relevance for octreotide scintigraphy. J Clin Endocrinol Metab. 2003;88(11):5150–7. doi: 10.1210/jc.2003-030262.
Читайте также: