Раковая клетка делится бесконечно
- ДОБАВИТЬ В ДРУЗЬЯ
- RSS
Научно-популярный блог о медицине
С тех пор как в 2009 году Нобелевскую премию вручили за открытие механизма защиты хромосом теломерами, лаборатории по всему миру стали предлагать услугу исследования длины теломер с целью определения "биологического возраста". Например, в одном из учреждений Москвы данный анализ обойдется клиенту в 18 000 рублей. В чем суть этого открытия, влияет ли длина теломер на продолжительность жизни человека и стоит ли тратиться на данное обследование - об этом моя сегодняшняя статья.
Предел Хейфлика
В 1961 году Леонард Хейфлик, наблюдая за культивированием фибробластов человека, обнаружил гибель культуры после 50 делений. Клетки можно было переносить из среды в среду, замораживать на любой срок, но и после размораживания они каким-то образом "помнили" сколько уже произошло делений и делились столько раз сколько осталась до 50. Названное в честь ученого явление - предел Хейфлика - годами оставалось необъяснимым, но уже тогда заговорили про запрограммированную в генах продолжительность жизни человека.
Лишь в 1971 году Алексей Оловников обратил внимание, что предел Хейфлика характерен для клеток с незамкнутой в кольцо ДНК, в то время как бактерии с кольцевой ДНК размножаются без ограничений. Ученый выдвинул гипотезу маргинотомии, которая предполагала, что лимит деления клеток с линейной ДНК обусловлен неполным копированием концевых участков хромосомы в момент деления клетки. Идея Оловникова гениальна и одновременно проста, ее легко объяснить даже школьнику. Попробую рассказать об этом в контексте эволюционной теории.
Когда клетка готовится к делению, фермент ДНК-полимераза проходит вдоль хромосомы с целью создания ее копии. Если хромосома имеет кольцевое строение, фермент благополучно завершает полный круг, а концы копии слипаются с образованием хромосомы для новой клетки.
В эпоху одноклеточных организмов хромосомы имели кольцевое строение. Но иногда в результате мутаций случалось так, что концы новой хромосомы не слипались с образованием кольца, и нить ДНК оставалась незамкнутой. Примерно так появились бактерии с линейными хромосомами. Получившая такую хромосому бактерия сталкивалась с проблемой копирования, когда приходил черед ее собственного деления. Полимераза, добежав до конца линейной хромосомы, останавливается и не может скопировать концевой участок, примерно равный собственной длине фермента.
Данная идея озарила Оловникова, когда он спустился в метро после лекции об экспериментах Хейфлика в МГУ. Он рассуждал: "происходящее с полимеразой на линейных хромосомах аналогично тому, как второй вагон поезда никогда не доедет до тупика и остановится на расстоянии равное длине локомотива". Но вернемся к эволюционной теории, чтобы понять, как природа решила проблему бактерий с линейными хромосомами.
Склонность к образованию линейных хромосом могла передаваться по наследству дочерним клеткам, и с каждым поколением геном дочерних бактерий укорачивался. Как только недокопированным оказывался жизненно важный для бактерии ген - колония прекращала рост и погибала. Поэтому первое время бактерии с линейными хромосомами быстро отсеивались в результате естественного отбора.
Однако некоторые из таких бактерий в результате случайных вирусных вставок получили дополнительные концы на хромосомах, которые служили своеобразным резервом - данные концевые участки хромосомы могли укорачиваться с каждым делением без угрозы для важных генов. Оловников, предполагая наличие данных участков на концах линейных хромосом человека, назвал их телогенами (совр. назв. - теломеры).
Ок, но ведь и теломеры рано или поздно через 50-100-200 делений израсходуются, и гибель колонии бактерий с линейными хромосомами кажется неизбежной. Более того, линейные хромосомы - единственный вариант организации ДНК и для всех существующих многоклеточных включая человека. Почему на первый взгляд дефектные линейные хромосомы достались высокоразвитым организмам? Предположительно, для первых многоклеточных способность к неограниченному делению оказалось вредна. Только представьте, что ваши клетки беспрепятственно удваиваются, превращая ваше красивое тело в эмбриональную биомассу. А ведь у первых многоклеточных не было иммунной и гормональной систем и других механизмов регулирующих деление клеток. Возможно, поэтому естественный отбор благоприятствовал многоклеточным, которые возникли из одноклеточных с линейными хромосомами.
Итак, теломеры конечны, а природа требует продолжения рода. Как объяснить образование организма человека в триллионы клеток из одной зиготы без укорочения теломер? Для разрешения данного противоречия гениальный Оловников предсказал, что теломеры способны наращиваться специальным ферментом, которому дал название тандем-полимераза (совр. назв. - теломераза). Спустя много лет американские ученые экспериментально подтвердили догадки Оловникова и доказали, что теломераза способна прикрепляться к концу хромосомы и, выступая в роли матрицы, наращивать теломеры, за что в 2009 году получили Нобелевскую премию.
Предел Хейфлика в организме человека
В современных организмах животных и человека проблема предела Хейфлика не так актуальна - до сих пор не удалось установить связь длинны теломер с продолжительностью жизни. Поэтому не стоит спешить платить деньги за исследование длинны теломер. Кроме того данный механизм ограничения деления клеток вряд ли способен остановить рак. Как стволовые, так и раковые клетки легко наращивают теломеры своих хромосом повышая активность теломеразы. Наглядным примером может служить культура клеток, полученная 60 лет назад из опухоли шейки матки американки Генриетты Лакс. Ее клетки до сих пор используют в лабораториях всего мира, они летали в космос и их взрывали атомной бомбой, с их помощью разработаны вакцины и лекарства от рака, а в этом году про них даже сняли художественный фильм. Знаменитые клетки HeLa (от Henrietta Lacks) пережили саму женщину и ее детей, а по своей биомассе многократно переросли массу всех их вместе взятых. Таким образом теломераза легко решает проблему предела Хейфлика. 
Кроме того способность стволовых клеток к ассиметричному делению не только решает проблему предела Хейфлика без участия теломеразы, но и проблему накопления мутаций, частота которых увеличивается с каждым делением клетки. Новые данные о делении стволовых клеток создают предпосылки к потенциальному бессмертию не только отдельных клеток, но и всего организма.
Ассиметричное деление - потенциал к бессмертию
Логично, что деление одной клетки заканчивается образованием двух дочерних, одна из которых содержит исходную хромосому, а второй достается ее копия. Даже если речь идет о делении клетки с кольцевой хромосомой, то дочерние клетки не эквивалентны друг другу, так как в процессе копирования ДНК неизбежно происходят ошибки, которые достаются дочерней клетке, получившей копию хромосомы. Если же говорить о делении клеток с линейной хромосомой, то дочерняя клетка получившая копию не только содержит больше мутаций, но и получит укороченные теломеры. Таким образом можно предположить, что через много циклов делений стволовой клетки в организме будет существовать одна клетка с исходной хромосомой, а все остальные будут содержать укороченые копии с мутациями.
Учитывая, что через несколько циклов делений происходит постепенное созревание (дифференцировка) клеток, то рано или поздно клетка с исходной хромосомой, как и все клетки ее поколения, выполнив свою функцию, погибнет, как ежедневно гибнут миллиарды клеток крови, кожи или эпителия кишечника. При таком раскладе мы вынуждены признать, что все исходные стволовые клетки, запасенные в нашем теле еще в утробе матери, расходуются и с возрастом неизбежно накапливаются мутации, а теломеры неизбежно укорачиваются. Именно так долгое время объяснялось неизбежное дряхление и смертность нашего тела.
Однако в 1975 году была выдвинута гипотеза ассиметричного деления, предполагающая, что деление стволовой клетки заканчивается образованием не двух дочерних клеток, а одной, вторая клетка при этом остается стволовой. В 2010 году экспериментально было подтверждено, что процесс распределения исходной хромосомы и ее копии ассиметричен. Оказалось, что исходные хромосомы остаются в стволовой клетке, которая сохраняет свою стволовость, а копии оказываются в дочерней клетке, которая образует колонию постепенно дифференцирующихся клеток с ограниченным сроком службы.
При таком раскладе стволовые клетки обладают буквально неисчерпаемым потенциалом к самоподдержанию:
1. Сохраняют исходное ДНК не накапливая мутации и не рискуя остаться без теломер;
2. Редко делятся, мало синтезируют белков и метаболически слабоактивны, а значит легче других клеток переживают недостаток кислорода и питания, интоксикацию и радиацию;
3. Не дифференцируются в зрелые клетки и не расходуются в течении жизни.
В своей лаборатории я выращиваю вот такие гигантские колонии клеток крови всего за 10 дней. Каждое красное пятно - это тысячи молодых эритроцитов, образованных из одной-единственной стволовой клетки. Не исключено, что родоначальница колонии где-то среди них и готова образовать еще не одну такую колонию - достаточно изменить концентрацию гормоноподобных стимуляторов деления.
Примерно так это происходит и в костном мозге у каждого из нас в течении жизни. Большинство зрелых клеток крови живут от нескольких минут до нескольких месяцев, поэтому ежедневно требуется возобновление миллиардов клеток крови.
Но почему с возрастом процессы возобновления крови и других тканей организма замедляются? Я придерживаюсь версии, что стволовые клетки остаются жизнеспособными всю нашу жизнь. А замедление процессов регенерации обусловлено "замуровыванием" стволовых клеток соединительными тканями, в результате чего они перестают получать сигналы от макроорганизма о необходимости в обновлении.
О том почему так происходит - расскажу как-нибудь в следующий раз. Чтобы не пропустить обновления - подписывайтесь на самый популярный блог о медицине! А если у вас нет аккаунта в ЖЖ, подписывайтесь на обновления в Фэйсбук, Вконтакте, Телеграм и Твиттер.
Поделитесь интересной информацией с друзьями в соцсетях:
- Чем раковые клетки отличаются от нормальных?
- Каковы причины появления раковых клеток?
- Какие бывают типы генов рака?
- Основные характеристики и строение раковых клеток
- Как выглядят раковые клетки под микроскопом?
- Как развиваются раковые клетки, какие этапы проходят в своем развитии?
- Ликвидация раковых клеток: что помогает их уничтожить?

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
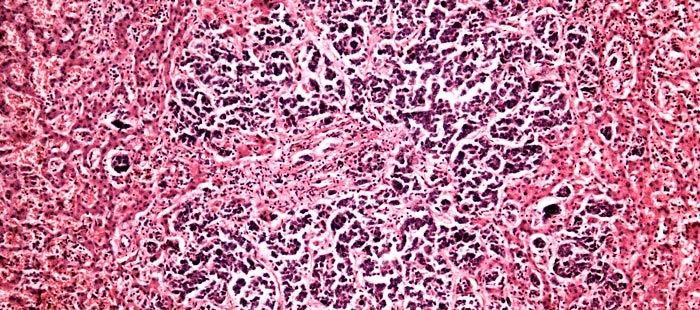
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Раковые клетки не бессмертны , как и все остальные. Образование обычной клетки в раковую происходит на самых ранних этапах развития этой клетки , когда способность к размножению превышает таковую у других клеток в сотни раз. Это по сути те же стволовые клетки. Отсюда такая " живучесть" , но не бессмертность. Клетки иммунной системы не сразу могут распознать онкологическую клетку , потому что генетически она "родная" для организма. И к тому моменту , когда клетки - киллеры начинают уничтожать раковые клетки , их становится слишком много - останется хоть одна и процесс начнется заново. Кроме того, новые технологии лечения онкологических заболеваний связаны с фактором некроза опухоли , который синтезируется организмом постоянно . Поэтому бессмертия им точно не видать. А вот омоложение с помощью стволовых клеток давно используется . Но это очень противоречивая тема.
Хороший пример бессмертия раковых клеток — это клетки HeLa, изначально полученные из опухоли шейки матки Генриетты Лекс в 1951 г. Эта культура по сей день используется в лабораторных исследованиях. Клетки Hela в самом деле бессмертны: по оценкам, ежедневно производится несколько тонн этих клеток, причём все они являются потомками нескольких клеток, извлечённых из опухоли Г. Лекс.
Чтобы клетка стала раковой (запустив механизм своего размножения и деления в организме человека), она проходит несколько этапов мутаций (трансформируется). Не любых мутаций, а именно критичных для превращения в канцерогенную клетку. Их должно быть не менее пяти (8-10), их комбинации - самые разные. Нет абсолютно одинаковых опухолей, как и одинаковых причин их возникновения.
У каждой нашей клетки (их около 100 триллионов) - своя продолжительность жизни, у каждого органа - свои клетки. И программа клеточной гибели срабатывает только после многократного "сигнала смерти". Сигнал может прийти из окружающей клетку среды или собственных внутриклеточных "датчиков неблагополучия".
В здоровом и нормально функционирующем организме ежесекундно(!) погибает огромное количество клеток и столько же образуется вновь. Опухоль возникает, когда этот процесс иногда выходит из-под контроля. И появляются мутантные клетки, которых ежедневно(!) в организме возникает до сотни тысяч. Их постоянно отслеживают и уничтожают две системы контроля нашего организма: система клеточного генетического самоконтроля и система противоопухолевого иммунитета.
Сложность в том, что если клетка в результате мутации не поддастся действию одной из этих двух систем контроля, то она будет неуязвима и для другой. И потомки этой клетки положат начало формированию мутантного клона - они приобретают способность ускользать от системы генетического самоконтроля и в дальнейшем избегать гибели при тиражировании вновь появившихся мутаций.
Таким образом, опухолевая клетка постоянно эволюционирует, порождая новые клеточные клоны, наиболее злокачественные из которых начинают вытеснять менее злокачественные. Остановить это возможно, лишь удалив опухоль, ограничивая их рост.
Сейчас ученые работают над тем, чтобы раковая клетка совершила самоубийство, поедая саму себя.
Будущее приближается, и от него никуда не деться: если еще 100 лет назад средняя продолжительность жизни была 40–46 лет, то сегодня, если верить статистике, в развитых странах она составляет около 80 лет. Универсального рецепта долгой жизни сегодня нет ни у кого, но вполне вероятно, что современные технологии смогут нам его подсказать. И случиться это может даже раньше, чем вы думаете.
Первая технология, открывающая дверь в бессмертие, уже стала притчей во языцех. Где только ее ни эксплуатировали и как только ни издевались над ней, особенно после появления овечки Долли. Вы уже, наверное, догадались, о чем пойдет речь.
Клонирование
Само по себе клонирование не предполагает продление жизни отдельно взятой особи.

Вот только выращивать такие тела запрещено с 1998 года. И этот запрет будет сохраняться до тех пор, пока мы сами для себя не решим этическую дилемму: считать ли убийством пересадку своей личности в другое тело? Ведь мы должны будем удалить у клона мозг и заменить его своим.
Отрасль создания искусственных органов сегодня переживает свой расцвет: ученые научились выращивать не только кожу, но и внутренние органы (печень и сердце), работают над созданием искусственного пениса и мозговой ткани.
Да, из вашей печени можно взять клетки и вырастить новую практически такую же (хотя, подозреваем, что делать этого не стоит). Можно даже пересадить вам эту печень, если родная откажет.
Но когда дело доходит до объединения искусственных органов в систему, возникают серьезные проблемы. Ведь для этого нужно учесть целую кучу факторов: особенности биохимических процессов, биосовместимость клеток, стабильность нового организма во времени. Это не просто пересадка одного органа взамен другого, это создание всей системы с чистого листа — каждого сосуда и нерва, каждой складки кожи и волоска на голове. Кроме того, очень сложно создать какую-то конкретную искусственную часть тела и поддерживать ее существование для остальных систем организма. Например, сердце не сможет работать, если к его тканям не будут поступать кровь и электрические сигналы по нервным окончаниям.
Следующая технология, о которой пойдет речь, существует уже сегодня и даже применяется несколькими компаниями, хотя ученые и сомневаются в том, что она может обеспечить бессмертие.
Крионирование
Технология крионирования, впервые описанная в научно-фантастических романах, плавно перешла в реальный мир благодаря трансгуманистам и ученым. Тело человека или только его мозг замораживают, чтобы сохранить до момента, когда наука научится лечить все болезни на свете, пересаживать людей в новые тела или загружать сознание в компьютер.

Чтобы такой способ продления жизни был законным с точки зрения юристов, тело нужно замораживать сразу после зафиксированной биологической смерти, иначе это будет считаться убийством. То есть, по сути, крионирование — это что-то вроде бальзамирования на современный лад.
Почему же заморозка считается вариантом утилизации трупа, а не способом продлить нашу жизнь на тысячу лет? Одна из сложностей, как ни странно, состоит в том, что человеческие клетки содержат в себе много воды. Охлаждаясь до температуры замерзания (для содержимого клеток она немного ниже −40 °C), цитоплазма клеток превращается в кристаллики льда. Но этот лед занимает бóльший объем, чем вода, из которой он образовался, и, расширяясь, повреждает стенки клеток. Если в дальнейшем эти клетки разморозить, они уже не смогут функционировать: их мембрана будет необратимо разрушена.
От столь холодной материи мы переходим к, пожалуй, самому желаемому многими способу продления жизни.
Перенос сознания в компьютер
Информация переносится по проводам в компьютере намного быстрее, чем по нервной системе в человеческом теле. Но у компьютеров, как мы знаем, есть один недостаток: они не умеют мыслить, как люди. Научившись перемещать сознание человека в электронные устройства, мы создадим симбиоз с огромным потенциалом.
Этап моделирования и составления карт мозга уже идет вовсю. В 2005 году был запущен проект Blue Brain Project, цель которого — создать полную карту человеческого мозга к 2023 году. В 2011-му его участники смогли полностью картографировать мозг крысы (это около 100 млн нейронов). По словам ученых, мозг человека по объему равен примерно 1000 крысиным мозгам, поэтому для его картографирования потребуется не 6, а 12 лет. Учтем, однако, что данные этих экспериментов обрабатывал суперкомпьютер Blue Gene, скорость вычислений которого в 6 раз меньше скорости лучших современных машин, поэтому процесс в перспективе можно значительно ускорить.
Второй проект — Human Brain Project, основанный в 2013 году в Швейцарии и в значительной мере финансируемый Европейским союзом, — можно считать прямым продолжением Blue Brain (у них одни и те же создатели). Однако цели у них всё же немного различаются. Если Blue Brain хочет лишь картографировать человеческий мозг и приблизиться к пониманию того, что такое память и сознание, то Human Brain планирует полностью смоделировать работу мозга в компьютере. Вместе оба этих проекта открывают путь к созданию цифрового аналога человеческого разума.
К сожалению, и тут не всё так радужно и хорошо. Если картографировать мозг и заставить его работать в виртуальном мире еще потенциально возможно, то когда дело доходит до загрузки сознания, всё становится ой как непонятно. Ведь мы даже не знаем, что такое сознание и чем оно определяется. Хотя взглядов на этот счет столько же, сколько ученых на планете, ни одна из теорий сознания не подкреплена экспериментальными фактами, а значит — это всего лишь гипотезы.
Соединить себя с компьютером — это, конечно, круто, но не все готовы сделать такой шаг. Не каждый готов и клонировать себя или заморозить в криокамере. Поэтому сейчас мы расскажем о тех способах достижения вечной жизни, которые никак не отразятся на вашем внешнем виде, не потребуют сложного морального выбора и не будут столь неопределенными.

Рак
Да-да, вы не ослышались. Рак — это не просто болезнь, это изменения клеток, которые мы не можем контролировать.
Но если это станет возможным, мы убьем двух зайцев: избавимся от страшных болезней и сможем продлить жизнь многих людей на годы, а то и десятилетия. Кроме того, научившись программировать рост раковых клеток, мы откроем новый способ выращивания биологических тканей для пересадки больным.
Как сделать раковые клетки нашими союзниками? Для этого надо понять, почему они вообще могут бесконечно делиться. Мы уже выяснили, что они избегают апоптоза — ну а кто умирать-то хочет?
Научившись контролировать процессы внутри раковых клеток, мы сможем управлять ими по своему желанию и жить столько, сколько нам вздумается.
Но тут возникает немало проблем. Во-первых, раковые клетки перестали умирать не от хорошей жизни. Они похожи на обреченных на смерть людей, которые готовы продать душу дьяволу, лишь бы остаться в живых.
Исследований по этому вопросу пока мало, но внушают надежду HeLa — культура раковых клеток, извлеченная в 1951 году из опухоли шейки матки женщины по имени Генриетта Лакс (Henrietta Lacks). С тех пор получены триллионы этих клеток, и они по-настоящему бессмертны.
Да, с раковыми клетками не всё так просто, но согласитесь — способ очень соблазнительный. От превращения болезни в лекарство вечной жизни мы переходим к еще одной безумной идее, которая тем не менее в перспективе может обеспечить нам вечную жизнь без потери личности и тела.
Симбиоз
Внутри человека живет масса разных видов бактерий. Каждая из них эгоистична и действует только в своих интересах. Интересы ряда бактерий совпадают с нашими, поэтому они нам помогают — например, перерабатывают в кишечнике непереваренные остатки еды. Другие бактерии, которые мы называем вредными, тоже питаются веществами в нашем организме, но при этом выделяют в него токсины. С первыми видами у нас завязываются взаимовыгодные отношения — симбиоз: мы даем им пищу для жизни, а они избавляют нас от непереваренных остатков еды, которые иначе гниют и приносят вред.
Идея использования бактерий для лечения возникла относительно недавно.
Так, вирус гриппа постоянно мутирует, приспосабливаясь к лекарствам, которые его убивают. Производство каждого нового средства требует всё больше ресурсов и денег, и в конце концов зайдет в тупик, чего не скажешь о бактериях. Их геном легко изменить и настроить на уничтожение конкретного типа вируса, к тому же бактерии при необходимости могут сами мутировать.

Если рассматривать наш симбиоз с бактериями в качестве средства для бессмертия, тут тоже возникают некоторые проблемы с реализацией. Использование модифицированной микрофлоры может не дать возникнуть некоторым болезням и излечивать существующие, но исключить запрограммированную смерть клеток оно не способно. Однако эти бактериальные помощники позволят продлить нашу жизнь не на один десяток лет, и, согласитесь, это уже немаловажный шаг на пути к истинному бессмертию.
Интерес к этой теме подогревают результаты исследований, опубликованные российскими учеными в 2015 году: обнаруженная ими в Мамонтовой пещере бактерия Bacillus F оказалась способна продлевать жизнь подопытных мышей на 20–30 %. Возможно, когда наука изучит механизмы, дающие такой эффект, мы сможем модифицировать этот вид бактерий и увеличить этот процент до 100–150.
Мы рассмотрели пять перспективных методов увеличения продолжительности жизни до бесконечности, но так и не разобрались, что значит эта бесконечность. В научном понимании это то время, которое осталось нашей Вселенной до ее смерти, если она вообще возможна. Но на практике сможем ли мы жить так долго?
Информация, которая накапливается в нашем мозге, может в конце концов повредить его: есть риск просто сойти с ума — хотя пока что встречаются менее страшные симптомы переизбытка информации. Они входят в так называемый синдром информационной усталости — психологическую болезнь XXI века, проявление которой в обществе будет от года к году только возрастать, если мы не научимся эффективно распределять информационные потоки и выносить из каждого прочитанного материала пользу.
К тому же, по теории вероятности, с каждым годом нашей жизни растет вероятность несчастного случая: сегодня человек может доехать до работы спокойно, а завтра в него влетит фура. Если вы летаете самолетом, есть небольшой шанс, что он упадет и вы погибнете. Это очень маленькие риски, но чем дольше вы живете, тем больше они начинают сказываться на вашей жизни.
Вы возразите, что уже, может быть, через 50 лет все автомобили будут оснащены автопилотом или мы будем летать на аэротакси, и тогда жить станет менее рискованно. Но это не так.
Взамен устраненных нами рисков приходят другие, и каждый невозможно предсказать. Поэтому бессмертие — это, скорее, состояние возможности выбора между жизнью и смертью. Если вы вольны выбирать, когда хотите уйти из жизни без принуждения, можно считать, что цель науки достигнута.
Читайте также:

