Рак желудка с метастазами в брыжейку

Метастазы в брюшине могут развиться при всех злокачественных процессах, но при раке яичников и желудка — это типичная и самая частая локализация. В большинстве случаев метастазирование в брюшной полости отсекает возможность радикального хирургического лечения, только больные раком яичников находятся в выигрышном положении — их активно и результативно оперируют.
- Механизм формирования метастазов
- Пути распространения метастазов
- Способы диагностики метастазов
- Какой рак может дать метастазы в брюшину?
- Симптомы возникновения метастаз в брюшине
- Что делать, если пошли метастазы в брюшной полости?
- Лечение метастаз в брюшине
- Прогноз при метастазах в брюшине
Механизм формирования метастазов
Механизм образования метастазов — одна из основополагающих характеристик злокачественного процесса. Метастатический узел образуется из одной злокачественной клетки, получившей способность жить без помощи материнской опухоли и выживать на удалении от неё. К путешествию по организму злокачественную клетку понуждают образующиеся в ней и в её окружении специфические белковые комплексы — факторы роста опухоли.
В кровеносном и лимфатическом русле больного раком циркулирует огромное число злокачественных клеток, 99.9% которых погибает. Мизерное число злокачественных клеток находит приют в небольших сосудах разных органов, образуя там фиксированный раковый эмбол. По какому-то сигналу начинается размножение раковых клеток, образующих микроскопическое злокачественное сообщество, разъедающее стенку сосуда своими ферментами. Дальше клеточная группа внедряется в здоровую ткань, чтобы сначала стать микрометастазом, а после и клинически определяемым метастатическим узлом.
Пути распространения метастазов
Серозные листки организма, к которым относятся брюшина, плевра и сердечная сумка — перикард восприимчивы к опухолевым клеткам, которые попадают на них несколькими путями:
- в разветвленную сеть кровеносных сосудов внутренних органов раковые эмболы приносятся с кровотоком — гематогенное метастазирование;
- лимфатическая сеть брюшины вырабатывает влагу для исключения трения внутренних органов при дыхательных движениях, создавая отличные условия для приживления заносимых лимфой злокачественные клеток — лимфогенное метастазирование;
- лимфогематогенный путь предполагает сочетанное действие двух описанных патогенетических механизмов;
- клетки отрываются от ракового конгломерата внутреннего органа и путешествуют вместе с внутрибрюшной жидкостью, контактно внедряясь в подходящий по условиям участок серозной оболочки — это имплантационный вид распространения.
В большинстве случаев действуют все механизмы метастазирования.
Способы диагностики метастазов
Диагностика зависит от анатомической области:
- метастатические образования в коже и мягких тканях определяются на ощупь — при пальпации, их границы хорошо видны при УЗИ;
- в легких метастазы находят при рентгене, КТ и МРТ, также и в костях, но совсем крошечные очаги обнаруживают только при сцинтиграфии;
- в органах брюшной полости метастазы обнаружат УЗИ, КТ и МРТ, в желудочно-кишечном тракте большую пользу приносят эндоскопические методы обследования;
- очаговые метастатические образования в головном мозге выявляет МРТ и КТ;
- в любом месте опухолевый очаг найдет изотопное исследование — ПЭТ.
Какой рак может дать метастазы в брюшину?
Любой рак может осложниться метастазами в брюшину, но самый высокий процент отмечается при карциномах яичников, желудка, толстой кишки и поджелудочной железы.
Уже на 1-2 стадиях карциномы яичников в брюшной полости находят свободно циркулирующие раковые клетки, при 3 стадии на листках брюшины развиваются видимые метастазы разных размеров.
При карциномах всех других органов метастазы переводят процесс в неоперабельный и констатируется 4 стадия, радикальное лечение невозможно, но при случае и с пользой для пациента может выполнятся циторедукция — удаление всех видимых опухолевых образований.
Симптомы возникновения метастаз в брюшине
Клинические проявления внутрибрюшинного метастазирования часто протекают скрытно — где-то кольнуло, что-то потянуло, какая-то непонятная слабость. Симптомы появляются при значительном увеличении живота в размере за счёт образования в полости избыточного количества жидкости — асцита. Опухолевые узлы на листках брюшины находят только при УЗИ, КТ или МРТ.
Нередко прогрессирующее опухолевое поражение брюшины так и остается бессимптомным, на первый план выходят признаки накопления внутрибрюшной жидкости и вызываемые асцитом симптомы сердечно-легочной недостаточности: одышка, отеки нижней половины тела, застой в легких, кашель, нарушение сердечной деятельности, слабость. Болевой синдром, как правило, очень слабый.
Что делать, если пошли метастазы в брюшной полости?
При раке яичников с сохраненной подвижностью опухолевого конгломерата в малом тазу обязательно предложат циторедуктивную операцию, при которой убирается всё опухолевое, что можно удалить, и метастатические узелки буквально срезаются с брюшины. Цель циторедукции — удалить всю злокачественную ткань по максимуму, узелки меньше сантиметра эффективно уничтожаются лекарствами. Далее больной предстоит длительная химиотерапия с производными платины и таксанами.
При других нозологических формах рака метастазирование отрезает путь к радикальной операции, только паллиативные вмешательства по поводу осложнений и создания обходящих опухоль путей для беспрепятственного движения пищевых или каловых масс, больному предстоит системная и локальная — внутрь брюшной полости химиотерапия.
Лечение метастаз в брюшине
Системная химиотерапия помогает при чувствительных к цитостатикам злокачественных процессах: раке молочной железы, лимфомах. Карциномы органов желудочно-кишечного тракта неактивно отзываются на лекарственное лечение, но нельзя не использовать возможность их уменьшения, особенно при агрессивных быстро прогрессирующих процессах.
При раке желудка предлагается 18 недель химиотерапии, при опухоли толстой кишки — не менее 4 месяцев, при панкреатической карциноме — до прогрессирования заболевания. Схема определяется состоянием пациента, тяжелым больным проводится симптоматическое лечение при необходимости с эвакуацией асцита.
Повысить противоопухолевый эффект химиотерапии удается при локальном введении цитостатика — внутрибрюшинно. При необходимости частых введений цитостатика внутрь полости устанавливается порт-система, исключающая тягостные симптомы классического лапароцентеза. Сложности неизбежны, поскольку постоянная выработка асцитической жидкости снижает концентрацию химиопрепарата, а тяжесть состояния ограничивает спектр цитостатиков.
Прогноз при метастазах в брюшине
Прогноз определяется чувствительностью злокачественных клеток к лекарствам, но в любом случае метастазирование по брюшине относится к самым неблагоприятным, исключая рак яичников. При карциномах кишки, когда удаётся провести паллиативную операцию и максимально удалить метастатические новообразования, трёхлетняя выживаемость приближается к 20%, 2 года переживает только каждый третий. Проведение химиотерапии улучшает выживаемость, но она хуже, чем при метастазах другой локализации.
В нашей клинике никогда не отступают перед раком, предлагая пациенту оптимальные и все известные онкологии методики противоопухолевого воздействия. Мы не ограничиваемся одним оружием, используя комбинацию лекарств, паллиативных вмешательств и неинвазивных методик. Наша цель — сохранить и улучшить жизнь наших пациентов, и нам это удается.
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
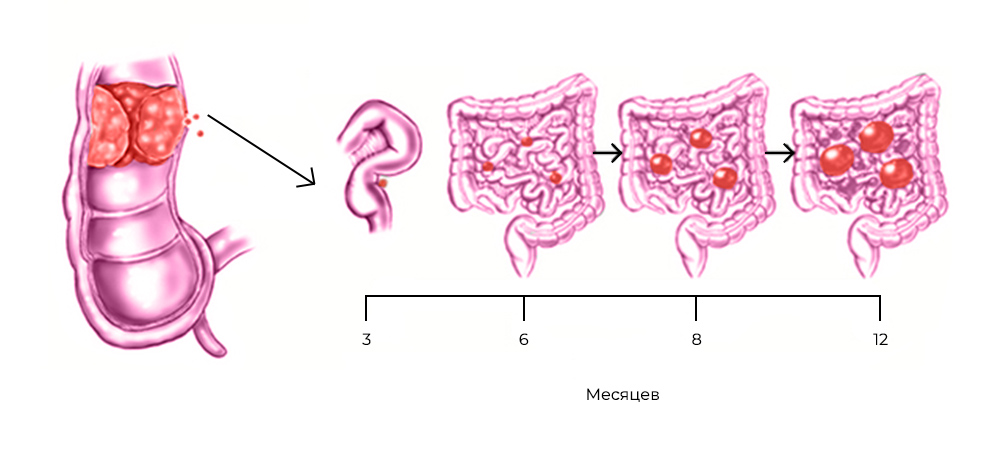
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
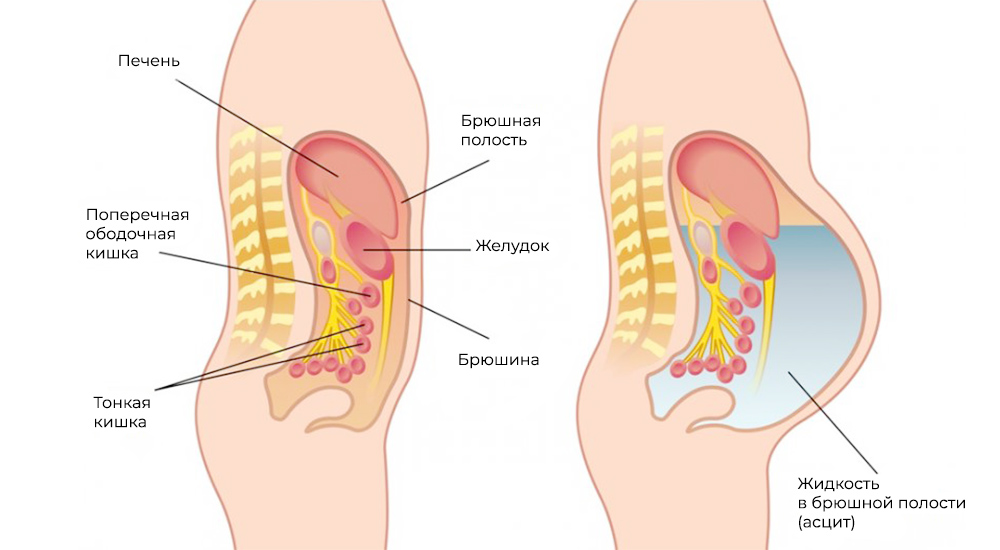
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
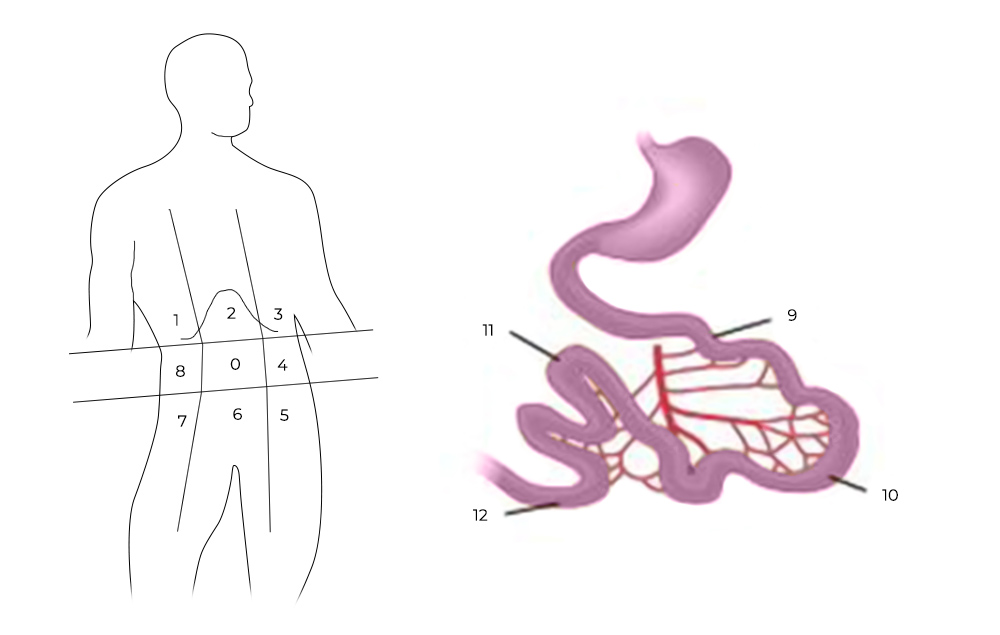
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
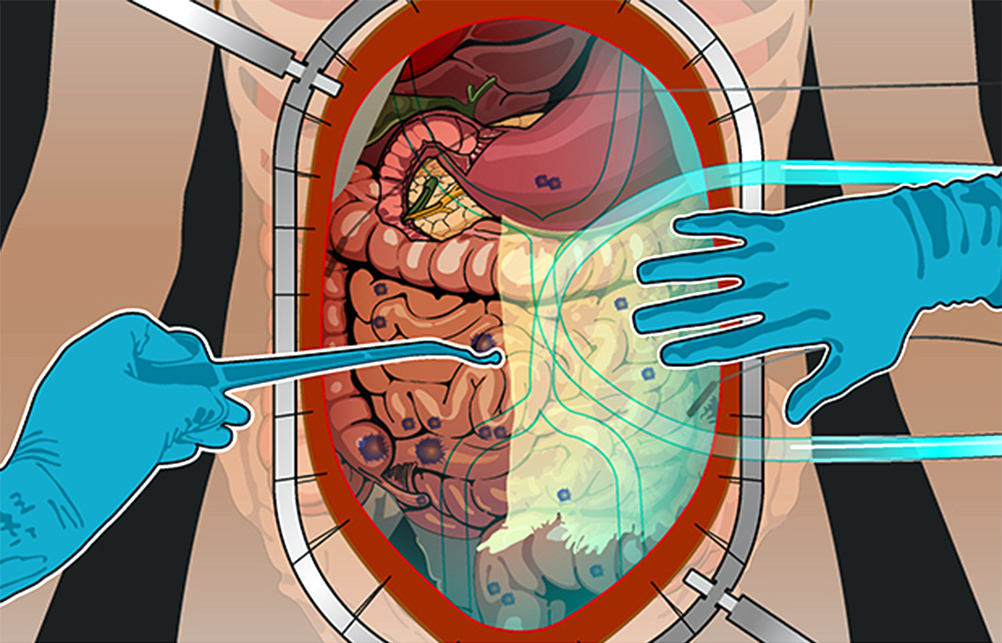
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
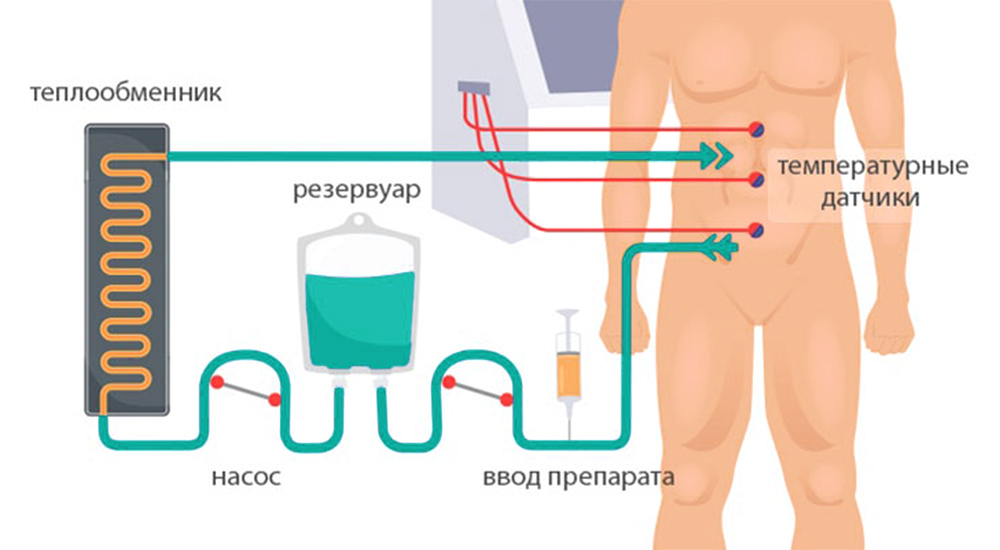
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Отрываясь от первичной опухоли, раковые клетки перемещаются по организму и образовывают вторичные очаги. Их называют метастазами.
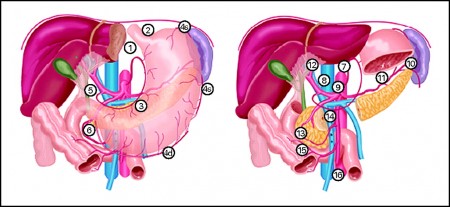
Поражение лимфатических узлов при раке желудка
В зависимости от вида пути метастазов к своему новому месту локализации выделяют следующие типы метастазирования:
- Лимфогенный. Характеризуется движением атипичных клеток вместе с лимфой по лимфатическим сосудам. Лимфоузлы для них становятся преградой, мешая продолжить свой путь в другие органы, тем самым принимая удар на себя, сами подвергаются поражению вторичной опухолью.
- Гематогенный (клетки движутся по кровеносным сосудам).
- Имплантационный. При увеличении первичной опухоли и выхода её за пределы поражённого органа, она начинает прорастать в соседние ткани.
Каждое образование имеет свой тип и путь метастазирования. Лимфогенный путь метастазирования наиболее характерный при раке желудка, но встречаются и комбинации перечисленных путей.
Метастазы злокачественной опухоли считаются самым опасным осложнением рака. Они намного опаснее, чем само первичное новообразование. Ранняя диагностика и своевременное специализированное лечение является основным методом борьбы с раком желудка и отвечает за продолжительность жизни таких пациентов.
Лимфатическая система желудка
Лимфатическая система желудка представлена капиллярами и сосудами, пронизывающими все слои его стенки.
Топографически выделяют четыре бассейна, по которым происходит диссеминация опухоли:
- первый лимфатический бассейн – отток лимфы из пилорического отдела, который захватывает большую кривизну, примыкающие к ней передние и задние стенки органа. Подвергаются поражению желудочно-ободочная связка, ретропилорические узлы, начальная часть тонкой кишки, парааортальные ЛУ;
- второй бассейн переносит лимфу из малой кривизны и прилегающих стенок. Подвергаются опасности заражения ворота печени и сама печень, а также правая желудочная артерия;
- третий бассейн – отток лимфы из тела желудка, кардиального отдела и медиальной части свода желудка. Лимфа течет в забрюшинные лимфатические узлы, малый сальник, желудочно-поджелудочную связку, средостение;
- четвёртый отдел собирает лимфу из свода желудка, вертикальной части большой кривизны желудка и примыкающих к ней стенок. При данном пути метастазирования подвергается поражению селезёнка, желудочно-ободочная связка. Исходя из этих особенностей можно установить путь диссеминации рака из того или иного отдела желудка.
Интересный факт! Отдалённые вторичные очаги могут возникать, как по току лимфы (ортоградный путь), так и против неё (ретроградный).
Как и куда метастазирует рак желудка?
Процесс метастазирования по лимфатической системе может начаться уже на первой стадии рака желудка.
Как правило, распространение происходит по такой схеме:
- раковые клетки заражают ближайшие сосуды;
- затем происходит распространение на лимфатические узлы, вдоль которых проходят крупные артерии желудка;
- в конце метастазы проникают в забрюшинные ЛУ и органы, которые находятся в брюшной полости (печень, селезенка, брюшина, тонкая кишка).
Интересно знать! Карциноматоз брюшины практически всегда возникает на поздних стадиях рака желудка. Метастазы поражают брюшину, усеивая её новыми злокачественными узлами разного размера. Проникают атипичные клетки на брюшину лимфогенным и имплантационным путём. Частым спутником вторичных очагов становится канкрозный перитонит.
Существуют также специфические формы метастазирования:
Диагностирование у пациента хотя бы одного из этих узлов, свидетельствует о поздней стадии заболевания.
Факторы, влияющие на возникновение метастаз
Возникновение метастаз характерно для поздней стадии рака. Но часто отмечаются случаи и более раннего их прогрессирования.
Всё зависит от таких факторов:
- формы опухоли желудка. Экзофитные новообразования считаются менее злокачественными, они не так подвержены возникновению вторичных очагов болезни, как эндофитные. Инфильтративная форма опухоли отличается быстрым и ранним распространением раковых клеток по организму;
- ее размера. Частота поражения лимфоузлов при раке желудка напрямую зависит от размера первичного новообразования. Например, если опухоль имеет размер до двух сантиметров, метастазы выявляют у 11% больных, а при габаритах больше чем в четыре сантиметра – у 33% пациентов;
- локализации онкоочага. Немаловажным фактором для возникновения вторичных злокачественных образований в лимфатических узлах становится локализация первичного очага. Если раковыми клетками поражена нижняя часть желудка, метастазы в лимфоузлах наблюдаются у 12% больных. У 31% больных наблюдается метастазирование такого типа при опухолях в верхней или средней доли желудка. Больше всего вероятность наличия вторичных очагов в лимфатических узлах возникает при тотальном раке желудка (половина от всех заболевших).
Диагностика метастаз в лимфоузлах
Вероятность наличия метастазов у пациентов с карциномой желудка очень велика. Задачей онколога является провести качественную диагностику, чтобы установить степень распространенности процесса. От этого зависит тактика дальнейшего лечения.
Во время диагностики обнаружить метастазы в лимфоузлах при раке желудка помогают:
- Жалобы пациента. Поражение нескольких лимфатических узлов может никак не выражать себя, кроме увеличения их размера. А вот при проникновении в печень развивается печеночная недостаточность, при метастазах в кишечнике – кишечная непроходимость и свищи. Общими симптомами, которые говорят о далеко зашедшем раке, являются анемия, потеря аппетита, желудочный дискомфорт, беспричинное похудение, слабость и потеря работоспособности. Возможно повышение температуры тела, покраснение кожи, головная боль. Симптомами метастазов в забрюшинных лимфоузлах является боль в спине.
- Пальпация живота (лимфатические узлы увеличиваются в размерах).
- Лабораторное исследование крови. Обычно у больных с диссеминированными новообразованиями наблюдается выраженный лейкоцитоз, диспротеинемия.
- Компьютерная томография. Этот метод широко применяется на ранней стадии предоперационной диагностики рака желудка. КТ является доступной и неинвазивной. Она подходит для общей оценки метастазирования рака желудка в печени и отдаленный ЛУ, а также для установления асцита. Однако КТ не всегда дает правильные результаты, касающиеся мелких лимфатических узлов Читайте здесь: Рак простаты у мужчин симптомы, лечение
После обнаружения метастазов необходимо взять образец для микроскопического исследования, чтобы подтвердить их принадлежность к первичной опухоли желудка. Делают это с помощью пункционной или открытой биопсии. Первая проводится с помощью иглы, а вторая представляет собой мини хирургическую операцию, во время которой вырезают часть лимфоузла.
Лечение метастаз в лимфоузлах
Метастазы в лимфоузлах при раке желудка необходимо удалять хирургическим путем. Объем лимфаденэктомии устанавливают на основании типа хирургической операции. При стандартных резекциях подвергают удалению лимфатические узлы первого порядка N1 (смотрите таблицу ниже).
Радикальная операция при раке желудка подразумевает удаление части органа или его целиком, а также лимфоузлов первого и второго порядка (N1 и N2). Расширенная гастрэктомия включает резекцию ЛУ первого, второго и третьего порядка (N1, N2, N3), причем поражение последней группы считается отдаленными метастазами.
Лимфоузлы первого порядка:
- паракардиальные (правые и левые);
- малой и большой кривизны;
- надпривратниковые;
- подпривратниковые.
ЛУ второго порядка:
- вдоль левой желудочной артерии;
- вдоль общей печеночной артерии;
- вокруг чревного ствола;
- ворот селезенки;
- вдоль селезеночной артерии.
ЛУ третьего порядка:
- печеночно-двенадцатиперстной связки;
- ретропанкреатические;
- узлы корня брыжейки;
- вокруг средней ободочной артерии;
- парааортальные;
- нижние параэзофагеальн;
- диафрагмальные.
Такая классификация отражает последовательность поражения лимфоузлов, но опыт показывает, что метастазирование не всегда идет по одинаковой схеме, поэтому многие врачи для пациентов с инфильтративными формами рака считают оправданной расширенную лимфаденэктомию (лимфодиссекцию), в особенности при поражении тела желудка или кардиального отдела.
Лимфодиссекция подразумевает резекцию лимфатического аппарата в пределах фасциального футляра. Такой подход позволяет увеличить 5-летнюю выживаемость больных на 15-25% и значительно уменьшить вероятность локорегиональных рецидивов.
Полезно знать! Локальное удаление опухоли без резекции желудка и лифоузлов может проводиться только при дифференцированных, экзофитных формах менее 2 см, которые находятся в слизистой оболочке. Во всех других случаях показана гастрэктомия с лимфоденэктомией, так как существует большая вероятность метастазирования.
Другими методами лечения метастазов являются лучевая и химиотерапия. Они угнетают рост опухоли и микроскопических метастазов, которые невозможно обнаружить и удалить. Химию и лучевую терапию могут применять в комбинации с операцией (до и после нее). Схему выбирает врач по индивидуальным показаниям и возможностям.
Химиотерапия при раке желудка назначается с целью остановить рост метастазов и облегчить последующую хирургию, или с паллиативной целью для неоперабельных больных. Чаще всего используют препараты 5-фторурацил и Фторафур. При метастазах в печени применяют внутриартериальную химиотерапию.
Дооперационная лучевая терапия при раке желудка подразумевает облучение опухоли, включая минимум 5 см окружающей ткани и зоны возможного метастазирования. Такой подход позволяет остановить процесс диссеминации и на 10-20% увеличить резектабельность новообразований.
Перспективным методом считается интраоперационная лучевая терапия, при которой производят однократное облучение ложа удаленной опухоли в дозе 15-20 Гр. После операции обычно используют контактные методики: внутривенное или внутрибрюшинное введение радиоактивных веществ.
Комбинирование хирургического вмешательства с облучениями и химиотерапией повышает выживаемость на 15-25%.
Лучевая терапия может быть использована в качестве самостоятельного метода лечения в случае невозможности проведения операции. Для таких пациентов назначают облучения на высоко-энергетических установках с суммарной дозой 35-45 Гр. Паллиативную ЛТ комбинируют с химиотерапией и иммунотерапией.
Противопоказания к лучевой терапии:
- распад опухоли;
- стеноз выходного отдела желудка;
- сопутствующие патологии.
Иммунотерапия – это лечение с помощью препаратов, стимулирующих иммунитет. Например: Левамизон, Интерлейкин-2, Интерферон и др.
Альтернативой хирургии является радиохирургия Гамма-нож и Кибер-нож. Она действует по принципу лучевой терапии, только мощность излучения намного выше. При этом аппараты оснащены датчиками, которые направляют луч на само новообразование, не задевая здоровые ткани. После 1-3 сеансов происходит гибель онкоклеток и опухоль постепенно разрушается.
Прогноз жизни при поражении лимфоузлов метастазами
Прогноз выживаемости, при существовании метастаз в регионарных лимфатических узлах по данным разных авторов составляет 64-81%. Эти цифры зависят от количества пораженных лимфатических узлов. При вовлечении от 1 до 6 ЛУ — 5-летняя выживаемость составляет 45%, от 7 до 15 – 30%, при поражении более 15 штук – всего 10%.
Информативное видео:
Читайте также:

